(Od Redakcji: Autor w wielu miejscach odwołuje się do statusu embrionu, o którym pisał w artykule "Status embrionu - stanowisko personalizmu ontologicznego". Zachęcamy do przeczytania tamtego artykułu.)
Sposoby pozyskiwania komórek macierzystych
Komórki macierzyste ze względu na wszechstronność w wytwarzaniu różnorodnych komórek potomnych dzieli się na totipotencjalne, pluripotencjalne, multipotencjalne i unipotencjalne. Totipotencjaną komórką jest zawsze zygota. Pluripotencjalne komórki mogą się różnicować w komórki pochodzące z różnych listków zarodkowych. Multipotencjalne komórki mogą dać początek komórkom pochodzącym z jednego listka zarodkowego i mają mniejszy zakres różnicowania się (na przykład z ektodermy powstają neurony, nabłonki, komórki gruczołowe, a z mezodermy - komórki mięśniowe). Komórki unipotencjalne to takie, które mogą wytworzyć tylko jeden typ komórek.[1] Wiedza o nich ciągle się rozwija. Zdobywana jest poprzez obserwację komórek macierzystych w ludzkim ustroju, czyli in vivo, jak też w różnorodnie prowadzonych hodowlach in vitro.
Ze względu na pochodzenie wyróżnia się komórki macierzyste: a) embrionalne, b) płodowe i c) dorosłe. Ludzkie komórki macierzyste można otrzymywać:
a) z embrionów ludzkich uzyskiwanych metodą zapłodnienia in vitro,
b) z embrionów uzyskiwanych metodą klonowania,
c) z tkanki płodu po poronieniu czy aborcji,
d) z krwi pępowinowej podczas porodu oraz
e) z organizmu ludzkiego, w którym występują komórki macierzyste dorosłe.[2]
Pojawiają się też doniesienia o możliwości pobierania komórek macierzystych ze zwłok.[3]
Tak wielkie zainteresowanie komórkami pochodzącymi z wczesnych embrionów ludzkich (stadium blastocysty) spowodowane jest tym, że komórki te są liczne, łatwo dostępne, posiadają cechę toti- lub pluripotencjalności, a w przypadku klonowania są immunologicznie zgodne z dawcą jądra, dzięki czemu można je u dawcy jądra zastosować w celach terapeutycznych. "Komórki macierzyste organizmów dorosłych są obecne (...) w znacznie mniejszej (do kilku stopni skali logarytmicznej) liczbie i są monopotencjalne lub jeżeli multipotencjalne, to ograniczone do wytwarzania niewielu linii komórkowych".[4] Rozwijająca się wiedza o tych komórkach podważyła panujące dotychczas poglądy. "Uprzednio zakładano, że w organizmie dorosłego występują tylko te populacje komórek macierzystych, które dają początek komórkom wytwarzanym na tym etapie życia. Obowiązywała również zasada nieodwracalności zróżnicowania tych komórek - raz ukierunkowana komórka nie była w stanie tego zdeterminowania zmienić, stąd z komórek macierzystych krwiotworzenia musiał powstać jedynie układ krwiotwórczy, a np. z komórek macierzystych mięśni tylko tkanka mięśniowa".[5] Doktryny te zostały jednak odrzucone. Odrzucono pogląd kwestionujący występowanie w organizmie dorosłym różnorodnych komórek macierzystych, nie tylko tego rodzaju, które utworzyły dany narząd. Odrzucono też pogląd o nieodwracalności ich różnicowania i ukierunkowania.[6] Głosi się również tezę o krążeniu różnorodnych komórek macierzystych w ludzkim ustroju.[7] Mimo różnych opinii na temat możliwości formowania plastyczności komórek macierzystych dorosłego organizmu (przekierunkowania z jednej linii komórkowej na inną lub odróżnicowania, czyli powrotu do komórki wcześniejszej) nie ulega wątpliwości, że wiedza o tych procesach przyniesie nowe odkrycia i praktyczne rozwiązania.
Łatwo dostępnym źródłem komórek macierzystych jest krew pępowinowa, pozostająca po porodzie w naczyniach łożyska i łożyskowej części pępowiny. "Ostatnio wykazano, że zawiera ona, oprócz komórek krwiotwórczych, komórki macierzyste dające początek innym liniom komórkowym, np. komórkom kościotwórczym, komórkom układu nerwowego".[8] Budzi to nadzieje na szersze ich zastosowanie niż tylko w leczeniu chorób krwi.
Mimo że komórki macierzyste z krwi pępowinowej lub dorosłego organizmu na obecnym etapie rozwoju medycyny są trudniejsze do uzyskania czy zastosowania klinicznego w porównaniu z embrionalnymi komórkami macierzystymi, to jednak ich wykorzystanie nie budzi zastrzeżeń etycznych. Natomiast zdobywanie komórek macierzystych w wyniku klonowania embrionów ludzkich i ich zabijania poprzez ekstrakcję komórek macierzystych jest z punktu widzenia etyki nie do przyjęcia.
Embrionalne komórki macierzyste można pozyskiwać z 5- lub 6-dniowych płodów, tworzących w tym okresie rozwoju blastocystę.[9] Komórki zewnętrzne blastocysty utworzą łożysko, a komórki wewnętrzne (20-100 komórek), które dadzą początek wszystkim narządom, to właśnie totipotencjalne komórki macierzyste, zdolne do utworzenia wszystkich tkanek i narządów ustroju. Ponieważ w przypadku komórek macierzystych embrionów otrzymywanych metodą zapłodnienia in vitro konieczne jest pokonanie bariery zgodności tkankowej u ewentualnych biorców przeszczepów, które pochodzą z tych komórek, zainteresowano się klonowaniem embrionów metodą wymiany jądra, czyli wprowadzenia w miejsce jądra komórki jajowej jądra pobranego z komórki dawcy.[10] Dawca jądra, będący zarazem biorcą przeszczepu z tak uzyskanych komórek macierzystych, nie wymaga pokonania bariery zgodności tkankowej. W ten sposób medycyna wybiera najłatwiejszy sposób nie tylko pozyskiwania, ale przyszłego stosowania komórek macierzystych. Nie oznacza to jednak, że jest to sposób etyczny.
"Do wykorzystania komórek macierzystych w medycynie - pisze Włodzimierz Korohoda z Instytutu Biologii Molekularnej UJ - nie są niezbędne komórki totipotencjalne z embrionów. Aby uzyskać rozmaite typy tkanek, neurony, kardiomiocyty, mięśnie, nabłonki itd., wystarczają komórki pluripotencjalne i multipotencjalne. Takie komórki można wykorzystać do implantacji w celu regeneracji serca po zawale (kardiomiocyty) lub leczenia choroby Parkinsona (neurony), wywołania zrastania kości (osteoblasty), gojenia ran (keratynocyty). Źródłem komórek pluripotencjalnych może być szpik, krew pępowinowa, a nawet tkanki dorosłego człowieka. (...) Większość biologów uważa - podsumowuje swoje stanowisko Korohoda - że przedstawiony kierunek prac zasługuje na poparcie, gdyż nie wiąże się z kontrowersjami etyczno-moralnymi".[11] Tak więc tzw. terapeutyczne klonowanie embrionów ludzkich "nie ma - jego zdaniem - żadnego uzasadnienia, poza finansowym. Naciski na dopuszczenie do takich prac, mimo niewątpliwych zastrzeżeń etycznych, wynikają nie z potrzeb naukowych, ale czysto merkantylnych".[12]
Próby degradacji statusu embrionu ludzkiego
Możliwość klonowania człowieka, wykorzystania totipotencjalności komórek macierzystych i rysujące się na horyzoncie możliwości kierowania plastycznością dorosłych komórek, sprowadzania ich do poziomu wcześniejszego, czyli od unipotencjalności do multipotencjalności - powinna wywołać na nowo dyskusję na temat początku życia ludzkiego oraz jego statusu moralnego i prawnego. Zaciera się bowiem różnica między komórkami somatycznymi a zarodkowymi, które stanowią początek życia. W etyce może to prowadzić do zatarcia różnicy między statusem ontycznym i moralnym embrionu ludzkiego w jego pierwszych stadiach rozwoju[13] a statusem komórek somatycznych naszego organizmu.
Dotychczas problem statusu moralnego embrionu ludzkiego nie tylko nie został właściwie postawiony, ale już na samym początku spotkał się z negacją. Tak uczynił Michael West, prezes firmy Advanced Cell Technology, argumentując, że z jego, naukowego, biologicznego punktu widzenia, to co powstało w wyniku przeprowadzonego przez niego 13 października 2001 roku klonowania tzw. terapeutycznego nie jest nowym osobnikiem, ale "wiązką komórek". W procedurze tej nie mamy - jego zdaniem - do czynienia z życiem ludzkim, ale z życiem komórek, które zostaną wykorzystane do celów naukowych i terapeutycznych.
W ten sposób niektórzy naukowcy pracujący dla różnych firm próbują ominąć wymagania etyczne i prawne dotyczące klonowania człowieka. Przykładem takiej sofistyki jest wprowadzenie odróżnienia klonowania terapeutycznego jako niebudzącego zastrzeżeń etycznych, od klonowania reprodukcyjnego, które może wzbudzać opory etyczne. Przez określenie "terapeutyczne" chce się osiągnąć akceptację etyczną tej procedury. Jako argumenty na rzecz klonowania przywołuje się przewidywane olbrzymie korzyści terapeutyczne dla milionów chorych ludzi. W tym kontekście etyków krytykujących tę procedurę postrzega się jako hamujących postęp medycyny i wyzwalanie ludzkości od uciążliwych chorób i cierpień.
Tymczasem gdy zapytamy, czy klonowanie terapeutyczne jest dla klonu ludzkiego terapeutyczne, to się okazuje, że nie tylko nie jest, ale wprost przeciwnie, prowadzi do jego zniszczenia. Ekstrakcja komórek macierzystych z embrionu nie jest jego terapią, lecz pozbawieniem życia. Z etycznego punktu widzenia mamy więc do czynienia z klonowaniem użytkowym, czyli w celu uzyskania komórek do badań naukowych, do wykorzystania w lecznictwie oraz dla zysku. Odnosząc to stanowisko do transplantologii, należałoby powiedzieć, że transplantacja terapeutyczna to taka, w której wszystkie tkanki i narządy żywego, zdrowego człowieka zostają od niego pobrane i użyte do leczenia innych ludzi. W tym wypadku również można by uznać, że człowiek dorosły nie jest jednostką, lecz zbiorem narządów, dlatego wolno go "rozłożyć" na cele terapeutyczne. Można też takie stanowisko poprzeć rachunkiem korzyści, w którym poświęcenie jednego zdrowego człowieka dla uratowania 10 chorych będzie opłacalne. Nietrudno jednak dostrzec absurdalność etyczną takich kalkulacji.
Okazuje się więc, że w "klonowaniu terapeutycznym" brano pod uwagę wszystko z wyjątkiem tej istoty ludzkiej, o którą w nim chodzi. Pominięto ją milczeniem, usunięto z dyskusji etycznej. Uczynił tak bez wielkiego namysłu nie filozof czy etyk, ale przedstawiciel firmy, która po to powstała, aby przynosić zyski. Tę samą procedurę klonowania raz nazwano klonowaniem reprodukcyjnym, a innym razem - klonowaniem terapeutycznym. W pierwszym przypadku embrion z definicji ma być początkiem życia ludzkiego i ma się nadawać do dalszego rozwoju, w drugim zaś - nie będzie początkiem, i to nie dlatego że nie może się rozwijać, ale z powodu przeznaczenia do celów, terapeutycznych.
Nasuwa się więc podejrzenie, że presja sukcesów naukowych i handlowych oraz redukcyjna mentalność niektórych specjalistów od inżynierii komórkowej stała się powodem nihilizacji statusu embrionu ludzkiego. Przeprowadza się ją dwukierunkowo - od biologii komórki do etyki, i odwrotnie - od etyki do pozytywnej oceny moralnej pewnych procedur. W pierwszym podejściu wystarczy zredukować klon ludzki do zbioru komórek zarodkowych, a te ostatnie zrównać z komórkami somatycznymi, w drugim - wystarczy wykorzystać etycznie pozytywny termin i nazwać klonowanie człowieka terapeutycznym, aby tę procedurę moralnie usprawiedliwić. Oczywiście w medycynie można się posługiwać terminami tej dyscypliny i twierdzić, że klon ludzki to komórka zarodkowa, komórka totipotencjalna. Jednak na gruncie etyki ta terminologia ma odmienne implikacje. Sprowadza ona bowiem (degraduje) status ontyczny i moralny embrionu ludzkiego do statusu komórek somatycznych naszego organizmu, które bez zastrzeżeń etycznych wykorzystuje się w badaniach naukowych czy w terapii. Takiej nihilizacji statusu istoty ludzkiej dokonuje się bez podejmowania dyskusji etycznej, bez ujawnienia zarówno tego co do niej skłania, jak i założeń filozoficznych i etycznych, które się za nimi kryją. A przecież za każdym rozstrzygnięciem etycznym kryją się decydujące o kulturze ludzkiej założenia antropologiczne i aksjologiczne.
Trzeba więc na nowo odpowiedzieć, czy klon ludzki jest ludzki? Czy jest początkiem życia ludzkiego? Powstaje on bowiem inaczej, niż dzieje się to po połączeniu plemnika z komórką jajową. Znane są różne formy klonowania: naturalne klonowanie przez podział zarodka i powstanie bliźniąt jednojajowych, klonowanie przez podział blastocysty, izolację czy reagregację blastomerów, czy też omawiane wyżej klonowanie w wyniku usunięcia jądra z oocytu i przeniesienia do niego jądra komórki somatycznej.[14]
To właśnie odmienność tej ostatniej procedury klonowania wykorzystuje się do podważenia statusu moralnego klonu ludzkiego. Można bowiem twierdzić, że cała ta procedura to inżynieria komórkowa, a nie naturalne poczęcia życia. W ten sposób klon ludzki można zdegradować do komórek wśród innych komórek organizmu.
Tak więc status embrionu ludzkiego podważa się poprzez odwołanie się zarówno do sposobów jego wykorzystania, jak i do sposobów jego powstania. W pierwszym wypadku nie ma embrionu ludzkiego, gdyż mamy do czynienia z terapią, w drugim też go nie ma, bo mamy do czynienia tylko z inżynierią komórkową. Stanowisko to jest dziwne na gruncie samej embriologii, wyróżniającej przecież różne formy klonowania jako początku życia. Jest ono już wprost błędne przy rozróżnieniu klonowania reprodukcyjnego i terapeutycznego. Rozróżnieniu temu służyło przekonanie, że klon reprodukcyjny jest właśnie klonem zdolnym po wszczepieniu do rozwoju, że jest początkiem życia. Przekonanie takie zostało potwierdzone choćby przez sklonowanie i hodowlę owcy Dolly. Klon tzw. terapeutyczny nie różni się od reprodukcyjnego pod względem metody powstania, nie powinien się więc różnić w swym statusie biologicznym i etycznym. Nie można więc, nawet dla szczytnych celów naukowych i terapeutycznych, wprowadzać sofistycznych argumentów i podważać statusu etycznego klonu ludzkiego.
"Spór sprowadza się do kolizji dwóch wartości: życie ludzkie czy użyteczność? Godność ludzka czy użyteczność? A przez użyteczność rozumiem w tym wypadku - stwierdza Zbigniew Szawarski - postęp naukowy w medycynie i biotechnologii, rewelacyjne wręcz metody leczenia różnego rodzaju chorób, zwłaszcza chorób degeneracyjnych, ale nie tylko".[15] W imię tej użyteczności embrion ludzki przegrywa z osobami dorosłymi. Przyznaje mu się prawa stopniowo, wraz z dalszymi etapami jego rozwoju. "Jeśli przyjąć tę argumentację - zauważa Andrzej Szostek - to należałoby uznać, że także wśród ludzi urodzonych wartość życia i prawo do życia poszczególnych jednostek będzie proporcjonalna do stopnia aktualizacji człowieczeństwa. Dziecko będzie miało nieco inne prawo (mniejsze) niż człowiek dorosły, chory nieco inne niż człowiek zdrowy, starszy i już bardzo przywiędły jeszcze mniejsze nawet niż dziecko, bo nawet nie jest potencjalnie rozwijającym się człowiekiem".[16]
Etyczną obronę statusu początku życia ludzkiego spotykamy nie tylko w twierdzeniach etyków, ale ze strony różnych autorytetów naukowych i religijnych. "Klonowanie embrionów, dokonywane w celach biomedycznych bądź z zamiarem wyprodukowania komórek macierzystych - mówił arcybiskup Renato Raffaele Martino w nowojorskiej siedzibie ONZ - jest pogwałceniem godności i integralności osoby ludzkiej. Klonowanie ludzkiego embrionu z myślą o jego uśmierceniu mogłoby doprowadzić do instytucjonalizacji celowego i systematycznego niszczenia powstającego życia ludzkiego w imię nieznanego "dobra" w postaci potencjalnej terapii bądź odkryć naukowych. Taka wizja jest nie do przyjęcia dla większości ludzi, także tych, którzy zdecydowanie opowiadają się za rozwojem nauki i medycyny. Ponieważ klonowanie embrionów oznacza stworzenie nowej istoty ludzkiej, którą pozbawia się możliwości rozwijania cech prawdziwie ludzkich w przyszłości, a zamiast tego poświęca się ją celom naukowym i skazuje na pewną śmierć, trzeba stwierdzić, że procesu tego nie można usprawiedliwiać niesieniem pomocy innym ludziom. Klonowanie embrionów jest pogwałceniem fundamentalnych praw człowieka".[17] Dokument w tej sprawie Papieskiej Akademii Pro Vita stwierdza: "Pobranie wewnętrznej masy komórkowej blastocysty, które ludzki embrion ciężko i nieodwracalnie uszkadza przez to, że przerywa jego rozwój, jest działaniem ciężko niemoralnym i dlatego całkowicie niedopuszczalnym".[18]
Dyskusja o statusie ontycznym, moralnym oraz prawnym embrionu ludzkiego musi się ciągle ożywiać, zwłaszcza w sytuacji coraz to nowych odkryć medycznych, ponieważ od niej dziś zależy, jaki humanizm zbudujemy; humanizm szanujący życie wszystkich czy tylko niektórych? Humanizm, który uprzedmiotowi i skomercjalizuje życie ludzkie, czy humanizm, który będzie je chronił od początku?
Technizacja życia ludzkiego i równia pochyła
Przeniesienie początku życia ludzkiego do laboratoriów przyczyniło się do przedmiotowego jego traktowania. Łatwiej jest uprzedmiotowić embrion ludzki niż uprzedmiotowić dorosłego człowieka. Inaczej bowiem ich spostrzegamy i inaczej bronią oni swej podmiotowości. W przypadku zygoty czy blastocysty mamy do czynienia z mikroorganizmem.[19] Na podstawie obserwacji w laboratorium trudno go potraktować jak podmiot, któremu przysługuje podobny szacunek, jakiego wymaga od nas człowiek dorosły. Zygota ludzka w laboratorium, której początek dała procedura zapłodnienia in vitro, czy też klonowanie, z pozycji obserwacji naukowej może być łatwo traktowana tylko jako biologiczny materiał laboratoryjny do celów naukowych, technicznych i komercyjnych. W badaniach naukowych w laboratoriach nie ma podejścia podmiotowego, w którym się dostrzega, że oto mamy do czynienia nie tylko z czymś, ale z kimś, z istotą ludzką, która mimo swoich mikrorozmiarów wkracza na swoją drogę życia i tym samym zyskuje szacunek i prawa należne rodzinie ludzkiej. Ze względu na ten mikrowymiar zniszczenie embrionów w pierwszych stadiach rozwoju w laboratoriach wydaje się zwykłą czynnością techniczną, usunięciem zbędnych przedmiotów, posprzątaniem przed następnym badaniem. Może się wydawać, że czynność ta nie podlega kwalifikacji etycznej, tak jak jej podlega zabicie embrionu w dalszych stadiach jego rozwoju lub zabicie urodzonego dziecka.
Do przełamania oporów etycznych przy niszczeniu embrionów ludzkich dla tzw. dobra nauki i ludzkości przyczynia się też propaganda sukcesów medycyny, która wzmacnia mentalność utylitarystyczną. Dzieje się tak przy propagowaniu możliwości wykorzystania embrionalnych komórek macierzystych. Miesza się tu przypuszczenia z fantazjami. W popularyzacji badań nie opisuje się całej skomplikowanej medycznie i etycznie sytuacji, niepowodzeń, niebezpieczeństw, czy też rzeczywistych małych kroków w terapii, lecz raczej przeważa retoryka o "cudownym leku na wszystko". Łatwe i entuzjastyczne obietnice leczenia prawie wszystkich chorób, regeneracji wszystkich narządów, laboratoryjnej hodowli tkanek i narządów do przeszczepów, oddziałują na świadomość milionów ludzi, zdobywając ich przychylność dla utylitarnego traktowania początku życia ludzkiego. Milcząco zaczyna funkcjonować przekonanie, że jest to zło konieczne, że dobry cel uświęca złe środki.
Propaganda sukcesu, nieuchronności postępu na skróty, toruje drogę biotechnologii prenatalnej. "Jak wyglądają na tym tle - pyta jeden z bioetyków - uczeni biorący udział w tym wyścigu, w którym oprócz żądzy wiedzy i żądzy sławy coraz większą rolę odgrywa żądza pieniędzy, która rychło wysunąć się może na plan pierwszy?"[20]
Powstaje pytanie, czy zsuwamy się po równi pochyłej od uprzedmiotowienia istoty ludzkiej w technikach in vitro, po nihilizację podmiotu ludzkiego w technikach klonowania, jego komercjalizację oraz ingerencję i manipulację genetyczną naturą człowieka?[21]
(Od Redakcji: Niniejszy artykuł jest oparty na wcześniejszej publikacji Autora w "Bioetycznych Zeszytach Pediatrii" Polsko-Amerykańskiego Instytutu Pediatrii [2003-2004; 1: 86-97])
Przypisy
1. Korohoda W.: Inżynieria komórkowa i tkankowa na początku XXI wieku - nowe nadzieje i nowe zagrożenia. Prace Komisji Zagrożeń Cywilizacyjnych PAU, 2002; 5: 109-123, 114
2. Pojda Z.: Kliniczne zastosowania komórek macierzystych - stan obecny i perspektywy: nowotwory. J. Oncol., 2002; 52: 145-150
3. Morciniec P.: Ocalić (obraz) człowieka: istota dyskusji o komórkach macierzystych. W: Ocalić cywilizacje - ocalić ludzkie życie. Kraków, 2002: 119-129, 124; Zalewski Z.: Czy istnieją granice postępu w badaniach naukowych w medycynie?: spór o komórki macierzyste. Sztuka Leczenia, 2002; 8: 47-52, 48
4. Pojda Z.: dz. cyt.: 146
5. Tamże: 147
6. Tamże s. 147-148. Zob. Marszałek M.T.: Komórki macierzyste wątroby i trzustki u zwierząt i człowieka. Postępy Biol. Komórki, 1999; 26: 135-157, 159-179; Majka M., Michałowska A., Ratajczak M.Z.: Próba izolacji ludzkich komórek macierzystych mięśni szkieletowych. Postępy Biol. Komórki, 2003; 30 (supl. 21): 17-24
7. Kucia M., Majka M., Ratajczak M.Z.: Plastyczność nieembrionalnych komórek macierzystych: fakt czy artefakt? Postępy Biol. Komórki, 2003; 30 (supl. 21): 3-16
8. Pojda Z.: dz. cyt.: 147. Zob. Pojda Z., Machaj E.K., Gajkowska A., Ołdak T., Jastrzewska M.: Badanie potencjalnej przydatności klinicznej komórek macierzystych uzyskiwanych z krwi pępowinowej. Postępy Biol. Komórki, 2003; 30 (supl. 21): 127-138; Wiktor-Jędrzejczak W., Urbanowska E., Rokicka M. i wsp.: Wstępna ocena możliwości wykorzystania kriotwórczych komórek macierzystych pozyskanych z różnych dawców krwi pępowinowej do jednoczesnego przeszczepiania u biorców dorosłych. Postępy Biol. Komórki, 2003; 30 (supl. 21): 139-147
9. Pojda Z.: dz. cyt.: 146
10. Zob. opis pierwszego sklonowania embrionu ludzkiego z 13.X. 2001. Cibelli J.B., Lanza R.P., West M.D.: Pierwszy klon. Świat Nauki, 2002; styczeń: 29-37. O tym, że próba ta była nieudana, piszą sami twórcy eksperymentu na s. 30: "Niestety, tylko jeden z zarodków doszedł do stadium sześciu komórek, po czym przestał się dzielić".
11. Korohoda W.: dz. cyt.: 115. Zob. tenże: Biologia i inżynieria komórkowa na przełomie wieków. Kosmos. Probl. Nauk Biol., 2000; 49: 403-412; tenże: Czy inżynieria komórkowa stanowi zagrożenie. Prace Komisji Zagrożeń Cywilizacyjnych PAU, 2000; 3: 7-18
12. Tamże: 113
13. Zob. Biesaga T.: Status embrionu - stanowisko personalizmu ontologicznego. Med. Prakt., 2004; 7-8: 28-31
14. Modliński J.A., Karasiewicz J.: Klonowanie ssaków: mity i rzeczywistość. W: Chyrowicz B., red.: Klonowanie człowieka. Lublin, 1999: 23-92
15. Komórki macierzyste - życie za życie? Debata w Ministerstwie Nauki i Informatyzacji 15 XII 2003, http://kbn.icm.edu.pl/komorki_macierzyste/20040217.html, s. 1-31
16. Tamże
17. Martino R.R.: W sprawie całkowitego zakazu klonowania człowieka (wystąpienie w nowojorskiej siedzibie ONZ, 23 IX 2002). L'Osservatore Romano, 2002; 12: 38-40. www.opoka.org.pl/zycie_kosciola/media/osservatore/
18. Pontifical Academy for Life: Declaration on the production and the scientific and therapeutic use of human embryonic stem cells. Vatican City, 2000, rozdz. Ethical problems nr 3; www.vatican.va/roman_curia/pontifical_academies/acdlife/index.htm
19. Karasiewicz J., Modliński J.: Komórki macierzyste ssaków: potencjalne źródło zróżnicowanych komórek do transplantacji. Postępy Biol. Komórki, 2001; 28: 219-242, 220
20. Zalewski Z.: dz. cyt.: 51
21. Zob. Chyrowicz B.: Bioetyka i ryzyko: argument "równi pochyłej" w dyskusji wokół osiągnięć współczesnej genetyki. Lublin, 2000: 307 i nn.
Komentarz
Obecnie stosowane techniki klonowania pozwalają otrzymywać żywotne i rozwijające się zarodki z komórek jajowych pozbawionych własnego materiału genetycznego (enukleowanych), które w żargonie technicznym nazywane są ooplazmą (rys. I).
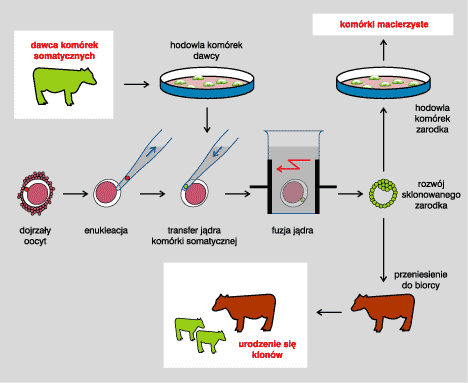
Rys. I. Technika klonowania zwierząt z zastosowaniem transferu jądra komórki somatycznej. Zarodek, identyczny w zakresie antygenów transplantacyjnych z dawcą komórki somatycznej, może być wykorzystany jako źródło komórek macierzystych (rysunki - Jacek Zieliński, Medycyna Praktyczna).
Po wprowadzeniu do niej jądra komórki innego osobnika - a jądro takie może pochodzić nie tylko z komórki innego zarodka, ale także ze specjalnie przygotowanych komórek somatycznych - następuje przeprogramowanie przeniesionego jądra, a powstała chimera zaczyna się dzielić i przekształca w zarodek wykazujący właściwości totipotencjalne lub przynajmniej pluripotencjalne. Tak uzyskane komórki są identyczne w zakresie antygenów transplantacyjnych z dawcą jądra komórki somatycznej; po ich przeszczepieniu nie występuje zjawisko odrzucania.
Nazwanie zarodka sklonowanego techniką transferu jądra chimerą jest uzasadnione współistnieniem w jego komórkach mitochondriów zarówno dawcy, jak i biorcy. Analiza mitochondrialnego DNA sklonowanych przy użyciu tej techniki ssaków wykazała, że w organizmie dorosłym wiele ważnych narządów, takich jak mózg i wątroba, uzyskuje zdecydowaną przewagę liczebną mitochondriów dawcy.[1] U kopytnych, których łożysko jest zbudowane z większej liczby warstw niż u człowieka, mogą się dodatkowo pojawić w zarodku mitochondria pochodzące z organizmu ciężarnej, do którego zarodek implantowano.[2] Białka kodowane przez genom mitochondriów nie wykazują ekspresji na powierzchni komórek, nie powodują zatem odpowiedzi odpornościowej.
Negatywna ocena etyczna klonowania embrionów ludzkich jest związana z ich potencjałem rozwojowym umożliwiającym wykształcenie kompletnego organizmu. Niemożliwe jest dokonanie rozgraniczenia między zarodkiem uzyskanym techniką transferu jądra komórki somatycznej a zapłodnieniem in vitro lub naturalnym zapłodnieniem komórki jajowej. Bez względu na potrzeby i okoliczności poczęcia wszystkie one charakteryzują się - jakkolwiek z różnym prawdopodobieństwem - rozwojem prowadzącym do urodzenia się dziecka.
Biologicznym punktem krytycznym powodującym negatywną ocenę etyczną klonowania jest wykorzystanie komórki jajowej, a dokładnie ooplazmy. Jest ona źródłem informacji zdolnym zmusić materiał genetyczny wprowadzonego do niej jądra komórkowego do rozwoju wbrew jego somatycznemu programowi. Skład tego eliksiru życia nie jest w pełni poznany, a nowe odkrycia molekularne, na przykład małych interferujących cząsteczek RNA, które dynamicznie regulują ekspresję genów, dołączą zapewne do poznanych już mechanizmów metylacji DNA i acetylacji histonów. Za nadrzędny mechanizm przeprogramowania komórek uważa się procesy demetylacji i remetylacji DNA, jednak wpływy epigenetyczne obejmują też przywrócenie długości telomerów i reorganizację histonów.[3]
Jajniki podczas życia kobiety uwalniają około 400 komórek jajowych zdolnych do zapłodnienia, jednakże 99,99% spośród około 7 milionów oocytów obecnych w jajnikach płodu obumiera w wyniku apoptozy, większość jeszcze przed urodzeniem. Problem pozyskiwania komórek jajowych kobiety do procedury transferu jądra ostatecznie może znaleźć rozwiązanie komercyjne, nieobojętne dla zdrowia dawczyni, ze względu na konieczność hormonalnej stymulacji jajeczkowania.
Współcześnie podejmowane i propagowane z entuzjazmem techniki pozyskiwania komórek macierzystych człowieka korzystają ze zdobyczy w dziedzinie biologii rozrodu zwierząt. Warto bliżej przyjrzeć się sporym już doświadczeniom zdobytym przy klonowaniu zwierząt gospodarskich. Odsetek odległych niepowodzeń w technice transferu jądra komórki somatycznej jest nadal duży. U tak uzyskanego bydła zwraca uwagę na przykład duża częstość występowania śmierci okołoporodowej spowodowanej wadami wrodzonymi serca i płuc,[4] a podczas kilkuletniej obserwacji nawet u 80% zwierząt rozwija się nadciśnienie płucne i kardiomiopatia zastoinowa.[5] Argument ten wykorzystuje się w dyskusji przeciwko klonowaniu reprodukcyjnemu, lecz za klonowaniem terapeutycznym, co zastanawia wobec planów użycia komórek macierzystych w leczeniu niewydolności serca u człowieka.
Chimeryzm spowodowany techniką transferu jądra komórki somatycznej wyklucza skuteczność leczenia chorób mitochondrialnych u dawcy, gdyż jego własna populacja tych organelli przeważałaby w tkankach krytycznych dla choroby, mimo ich repopulacji komórkami macierzystymi. W terapii innych chorób heteroplazmia, czyli obecność mitochondriów różnego pochodzenia, nie powinna jednak stanowić przeszkody.
Przeszczepianie narządów i tkanek, jako metoda leczenia, nie budzi kontrowersji etycznych, a od pierwszego przeszczepu serca upłynęło już 37 lat. Nadal jednak pojawiają się problemy podczas dyskusji dotyczącej źródeł, z których można pozyskać te deficytowe środki terapeutyczne. Powszechnie akceptowane jest stanowisko, że dawcą może być osoba zdolna do świadomej zgody na pobranie narządu, jeśli nie spowoduje to trwałego uszczerbku jej zdrowia, jak również osoba zmarła, jeśli uprzednio nie wyraziła zastrzeżeń osobiście lub wolą rodziny. Oddziały intensywnej terapii aktywnie zgłaszają dawców spośród swoich pacjentów wykazujących objawy śmierci pnia mózgu. Nie ma natomiast powszechnej akceptacji dla pobierania narządów od skazańca po wykonaniu na nim wyroku śmierci.
Pozyskane w dostatecznie dużej liczbie odmłodzone i zgodne tkankowo komórki macierzyste - obecnie taką możliwość daje tylko transfer jądra komórki somatycznej - wykazują szereg właściwości będących do niedawna marzeniem medycyny eksperymentalnej (rys. II).
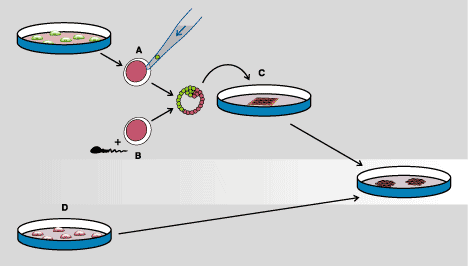
Rys. II. Totipotencjalne ludzkie komórki macierzyste pozyskane techniką transferu jądra komórki somatycznej (A) lub zapłodnienia in vitro (B), a następnie hodowli komórek zarodka (C). Możliwe jest też przeprogramowanie multipotencjalnych komórek macierzystych pobranych z krwi pępowinowej lub ze szpiku; w hodowli komórkowej (D) udaje się odtworzyć ich właściwości pluripotencjalne. Komórki macierzyste są wykorzystywane do: transplantacji, terapii genowej, badań przesiewowych i toksykologicznych leków, tworzenia modeli chorób człowieka, badań nad rozwojem zarodkowym, karcynogenezą i różnicowaniem oraz w badaniach genomowych i ekspresji genów. Wśród tkanek otrzymanych z komórek macierzystych są: neurony, komórki skóry, kardiomiocyty, komórki mięśni szkieletowych, trzuski, tarczycy i płuc.
O możliwości regeneracji mięśnia sercowego uszkodzonego przez zawał z użyciem komórek macierzystych pochodzących ze szpiku u myszy donosił już w 2001 roku zespół Piero Anversy z New York Medical College (pisałem już o tym na łamach "Medycyny Praktycznej" [5/2001, s. 186]).[6] Przez następne lata nie powiodły się próby powtórzenia jego eksperymentów, a u ludzi, którym podawano ich własne szpikowe komórki macierzyste poprawa hemodynamicznej czynności serca była znikomo mała i wyniosła po 6 miesiącach zaledwie 6%.[7] Tym większe nadzieje budzą próby leczenia zarodkowymi komórkami macierzystymi, które poza kardiomiocytami i układem przewodzącym odtworzyły, w modelu mysim, w pełni funkcjonalne krążenie wieńcowe.[8]
Do uznanych zastosowań komórek macierzystych zaliczają się przeszczepy komórek hemopoetycznych. Dobre wyniki dotyczą przeszczepów allogenicznych zarówno komórek macierzystych z krwi obwodowej od dawców stymulowanych filgrastimem (G-CSF), jak i komórek macierzystych krwi pępowinowej.[9,10]
Do eksperymentalnie testowanych zastosowań terapii komórkami macierzystymi w neurologii należy leczenie choroby Parkinsona, stwardnienia bocznego zanikowego, wrodzonych miopatii oraz poprzecznych uszkodzeń rdzenia. W cukrzycy próbuje się odtworzyć aparat wysepkowy trzustki; analogiczne zastosowanie komórki macierzyste mogą znaleźć w leczeniu wielu endokrynopatii.
Obecnie rysują się szanse rozwiązania problemu pozyskiwania dostatecznej liczby komórek macierzystych bez negatywnej oceny etycznej takiego postępowania. Metoda transferu jądra komórki somatycznej do ooplazmy innego gatunku, choć uwieńczona umiarkowanym sukcesem w tak egzotycznych zestawieniach jak mysz i królik, czy królik i panda olbrzymia, w medycynie nie wywołała dotychczas zainteresowania. Wydaje się, że dopiero rezygnacja z ooplazmy spowodowałaby uwolnienie od zarzutu kreacji nowego istnienia. Klonowanie poprzez przeniesienie jądra komórki somatycznej do komórki somatycznej dotychczas u ssaków nie było badane. Inną możliwością, testowaną już od kilku lat, jest fuzja komórki dawcy i komórki macierzystej in vitro, przy umiejętnym przygotowaniu tej ostatniej (np. przez napromienianie jej jądra) pozwalająca podmienić materiał genetyczny na pochodzący od dawcy. Skuteczność takiej fuzji komórkowej wykazywana była wielokrotnie przy podaniu komórek macierzystych bezpośrednio do organizmu biorcy.[11] Rozwiązaniem ostatecznym będzie jednak poznanie mechanizmów molekularnych, które działając poprzez zawarte w cytoplazmie cząsteczki skłaniają komórkę do odmłodzenia lub transdyferencjacji jej fenotypu. Wtedy też może się okazać, że procedura klonowania jest zbędna, bo zabieg dostarczenia tych cząsteczek wykonany będzie bezpośrednio w organizmie chorego.
dr hab. med. Marek Sanak
Zakład Biologii Molekularnej i Genetyki Klinicznej
II Katedry Chorób Wewnętrznych CM UJ w Krakowie
| Słowniczek
- totipotencjalne - zdolne do wykształcenia całego organizmu, np. zygota, blastula do stadium kilku blastomerów - pluripotencjalne - zdolne do różnicowania się w kierunku dowolnego z trzech listków zarodkowych - ektodermy, mezodermy lub endodermy - multipotencjalne - zdolne do różnicowania w kierunku różnych dojrzałych komórek w obrębie tego samego listka zarodkowego, np. komórki macierzyste szpiku lub krwi pępowinowej - unipotencjalne - odwarzające tylko jeden rodzaj komórek dojrzałych, np. komórki warstwy ziarnistej naskórka regenerujące keratynocyty - zapłodnienie - rozpoczyna się penetracją plemnika do komórki jajowej, trwa około 24 godzin, po 11 godzinach zostaje wydalone drugie ciałko kierunkowe, zawierające niepotrzebny komplet chromosomów matczynych; połączenie materiału genetycznego (przedjądrzy) oocytu i plemnika tworzy zygotę - zygota dzieli się co około 20 godzin, powstałe komórki blastuli nazywa się blastomerami, stadium 16 blastomerów to morula, która opuszcza jajowód i przekształca się w 4. dobie w blastocystę - blastocysta jest zbudowana z trofoblastu - warstwy płaskich komórek otaczających jamę, wewnętrzna grupa komórek blastocysty to embrioblast; blastocysta w 5. lub 6. dobie zagnieżdża się w błonie śluzowej macicy |
Piśmiennictwo
1. Inoue K., Ogonuki N., Yamamoto Y. i wsp.: Tissue-specific distribution of donor mitochondrial DNA in cloned mice produced by somatic cell nuclear transfer. Genesis, 2004; 39: 79-83
2. Hiendleder S., Bebbere D., Zakhartchenko V. i wsp.: Maternal-fetal transplacental leakage of mitochondrial DNA in bovine nuclear transfer pregnancies: potential implications for offspring and recipients. Cloning Stem Cells, 2004; 6: 150-156
3. Rideout W.M. 3rd, Eggan K., Jaenisch R.: Nuclear cloning and epigenetic reprogramming of the genome. Science, 2001; 293: 1093-1098
4. Li S., Li Y., Du W. i wsp.: Aberrant gene expression in cloned bovine of neonatal death. Biol. Reprod., 2004; DOI: 10.1095/biolreprod.104.029462
5. Hill J.R., Roussel A.J., Cibelli J.B. i wsp.: Clinical and pathologic features of cloned transgenic calves and fetuses (13 case studies). Theriogenology, 1999; 51: 1451-1465
6. Orlic D., Kajstura J., Chimenti S i wsp.: Bone marrow cells regenerate infarcted myocardium. Nature, 2001; 410: 701-705
7. Wollert K.C., Meyer G.P., Lotz J. i wsp.: Intracoronary autologous bone-marrow cell transfer after myocardial infarction: the BOOST randomised controlled clinical trial. Lancet, 2004; 364: 141-148
8. Lanza R., Moore M.A.S., Wakayama T. i wsp.: Regeneration of the infarcted heart with stem cells derived by nuclear transplantation. Circ. Res. 2004; 94: 820-827
9. Jacobsohn D.A., Duerst R., Tse W., Kletzel M.: Reduced intensity haemopoietic stem-cell transplantation for treatment of non-malignant diseases in children. Lancet, 2004; 364: 156-162
10. Coher Y., Nagler A.: Umbilical cord blood transplantation - how, when and for whom. Blood Rev., 2004; 18: 167-179
11. Willenbring H., Bailey A.S., Foster M. i wsp.: Myelomonocytic cells are sufficient for therapeutic cell fusion in liver. Nat. Med., 2004; 10: 744-748










