Skróty: TLR – receptor Toll-podobny
Zastosowanie szczepionek i wprowadzenie obowiązkowych szczepień ochronnych w ciągu ostatnich 200 lat pozwoliło opanować, a nawet zupełnie wyeliminować groźne choroby zakaźne. Przykładem jest opracowana przez Edwarda Jennera szczepionka przeciwko ospie prawdziwej, która przyczyniła się do eradykacji tej choroby. Szczepienia są jednym z najskuteczniejszych narzędzi w walce z chorobami zakaźnymi. W Stanach Zjednoczonych i Europie Zachodniej częstość występowania chorób zakaźnych i związana z nimi śmiertelność zmniejszyły się o 95–99% w porównaniu z okresem przed wprowadzeniem obowiązkowych szczepień ochronnych. Dzięki ich zastosowaniu zapadalności na takie choroby, jak błonica, tężec, odra, świnka, różyczka i poliomyelitis zmniejszyła się o >90%.1,2
Bardzo często używa się zamiennie terminów: „szczepienie” i „immunizacja”. Należy jednak pamiętać, że pierwszy termin oznacza czynne zapobieganie, a drugi interwencję, która może być zarówno czynna, jak i bierna. Szczepienia mają za zadanie wywołać odpowiedź immunologiczną podobną do powstającej przy reinfekcji po przebyciu zakażenia naturalnym drobnoustrojem. Długoterminowa odporność poszczepienna jest więc związana z powstaniem antygenowo swoistych „efektorów” i/lub komórek pamięci. Do pierwszej grupy należą przeciwciała zdolne do wiązania toksyn lub drobnoustrojów oraz cytotoksyczne limfocyty T rozpoznające i niszczące patogen.
Szczepionki „żywe”
Szczepionki zawierające żywe drobnoustroje o zmniejszonej chorobotwórczości (atenuowane) charakteryzują się dużą skutecznością. Dzięki zdolności wirusa szczepionkowego do replikacji w komórkach gospodarza, efekt ich działania utrzymuje się długotrwale (tab. 1.). Jednak obok oczekiwanego efektu (czyli uzyskania pamięci immunologicznej) replikacja wirusa wiąże się także z ryzykiem wystąpienia objawów niepożądanych. Ryzyko zamiany wirusa atenuowanego w postać wywołującą chorobę w przypadku szczepionki doustnej przeciwko poliomyelitis (OPV) szacuje się na około 1 na milion podanych dawek.2,3
| Tabela 1. Czynniki wpływające na odpowiedź poszczepienną u zdrowych osóba | |
|---|---|
| Czynnik | Mechanizm |
| typ szczepionki | |
| atenuowana vs inaktywowana | przeciwciała po szczepieniu „żywymi” szczepionkami utrzymują się długotrwale, prawdopodobnie ze względu na stałą obecność antygenu |
| polisacharydowa | odpowiedź krótkotrwała, związana z brakiem tworzenia centrów rozrodczych |
| schemat podawania | |
| odstęp pomiędzy dawkami schematu podstawowego | odstęp ≥3-tygodniowy pozwala na optymalny rozwój odpowiedzi pierwotnej |
| odstęp pomiędzy szczepieniem podstawowym a dawką przypominającą | odstęp ≥4-miesięczny pozwala na dojrzewanie powinowactwa limfocytów B pamięci |
| wiek w momencie szczepienia | wczesny wiek ogranicza powstawanie długo żyjących komórek plazmatycznych |
| a Opracowano na podstawie 11. pozycji piśmiennictwa. | |
Po wstrzyknięciu szczepionki zawarte w niej wirusy rozprzestrzeniają się przez sieć naczyń krwionośnych, osiągając miejsca docelowe. W przypadku szczepionek podawanych drogą donosową lub doustną replikacja następuje w obrębie błony śluzowej. Podobnie jak podczas naturalnego zakażenia dochodzi do aktywacji mechanizmów odporności wrodzonej. Nieswoiste (wrodzone) mechanizmy obronne człowieka można porównać do sił szybkiego reagowania. Nie wymagają one wstępnej aktywacji, a receptory rozpoznające drobnoustroje są niezmienne w ciągu życia osobnika. Mechanizmy te są niezbędne do rozwinięcia odpowiedzi swoistej. Pierwszą linią obrony układu immunologicznego są receptory rozpoznające wzorce (pattern recognition receptors – PRR), czyli struktury charakterystyczne dla drobnoustrojów, tzw. wzorce molekularne związane z patogenami (pathogen associated molecular patterns – PAMP). Wśród PRR najważniejsze są receptory Toll-podobne (Toll-like receptors – TLR), które rozpoznają bakterie i wirusy (również „szczepionkowe”), grzyby i pierwotniaki.4,5 Wśród komórek rozpoznających drobnoustroje za pomocą receptorów TLR wyróżniamy: komórki układu immunologicznego (makrofagi, komórki dendrytyczne, komórki tuczne, eozynofile, neutrofile, limfocyty B), komórki nabłonkowe, komórki śródbłonka, kardiomiocyty i adipocyty. TLR odgrywają istotną rolę w regulacji odpowiedzi immunologicznej. Aktywacja TLR umożliwia indukcję odpowiedzi swoistej (stymulacja limfocytów T). Z drugiej strony TLR odgrywają istotną rolę w utrzymaniu homeostazy odpowiedzi immunologicznej przez udział w indukcji komórek T regulatorowych.6 Po podaniu szczepionki zawierającej żywe wirusy podwójną nić RNA rozpoznają receptory TLR3, a pojedyncze nici RNA – receptory TLR8 i TLR10. Obecne w genomie bakteryjnym charakterystyczne niemetylowane dinukleotydy cytozyno-guaninowe (CpG – jeden z rodzajów PAMP) rozpoznawane są przez receptor TLR9, konstytucyjnie pojawiający się na limfocytach B oraz komórkach dendrytycznych. Po rozpoznaniu w wielu miejscach organizmu następuje aktywacja komórek dendrytycznych, które wędrują naczyniami limfatycznymi do okolicznych węzłów chłonnych. Odpowiedź na „żywe” szczepionki wirusowe nie zależy od drogi podania.7
W przypadku szczepionek zawierających żywe bakterie, na przykład szczepionki przeciwko gruźlicy zawierającej szczep Bacillus Calmette-Guérin (BCG), drobnoustrój mnoży się w miejscu wstrzyknięcia, wywołując miejscowy odczyn zapalny, jak również w regionalnych węzłach chłonnych. BCG rozpoznają receptory TLR2 i TLR3. Szczepionka BCG nie stymuluje produkcji swoistych przeciwciał, lecz aktywuje limfocyty T CD4 do produkcji cytokin (m.in. interferonu γ [IFN-γ]) aktywujących makrofagi (tab. 2.).8
| Tabela 2. Odpowiedź immunologiczna na poszczególne szczepionkia | ||||
|---|---|---|---|---|
| Choroba zakaźna/drobnoustrój | Typ szczepionki | IgG w surowicy | IgA błon śluzowych | Limfocyty T |
| tężec | toksoid | ++ | – | – |
| WZW typu A | inaktywowana | ++ | – | – |
| WZW typu B | rekombinowana | ++ | – | – |
| Haemophilus influenzae typu b | skoniugowana | ++ | – | – |
| grypa | podjednostkowa | ++ | – | – |
| „żywa”, donosowa | ++ | + | +(CD8) | |
| odra | atenuowana | ++ | – | +(CD8) |
| meningokoki | skoniugowana | ++ | – | – |
| świnka | atenuowana | ++ | – | ? |
| HPV | rekombinowana | ++ | – | – |
| krztusiec | inaktywowana | ++ | – | – |
| krztusiec | bezkomórkowa (białko) | ++ | – | +?(CD4) |
| pneumokoki | polisacharydowa | ++ | – | – |
| skoniugowana | ++ | – | – | |
| przeciwko poliomyelitis Sabina | żywa, atenuowana | ++ | ++ | – |
| przeciwko poliomyelitis Salka | inaktywowana | ++ | – | – |
| wścieklizna | inaktywowana | ++ | – | +? |
| rotawirus | atenuowana | + | ++ | +? |
| różyczka | atenuowana | ++ | + | +? |
| błonica | toksoid | ++ | – | – |
| gruźlica | atenuowana | – | – | ++ (CD4) |
| ospa wietrzna | atenuowana | ++ | – | +? |
| żółta gorączka | atenuowana | ++ | – | – |
| cholera | inaktywowana | ++ | – | – |
| dur brzuszny | polisacharydowa | ++ | – | – |
| zapalenie mózgu przenoszone przez kleszcze | inaktywowana | ++ | – | – |
| a Opracowano na podstawie 2. i 29. pozycji piśmiennictwa. HPV – ludzki wirus brodawczaka | ||||
Szczepionki inaktywowane
Szczepionki oparte na zabitych drobnoustrojach są mniej immunogenne w porównaniu ze szczepionkami „żywymi”. Podstawowym efektem szczepionek „zabitych” jest produkcja przeciwciał neutralizujących i powstawanie limfocytów B pamięci. Niemniej jednak mogą one zawierać PAMP, na przykład lipopolisacharydy aktywujące receptory TLR2 i TLR4 lub peptydoglikany, lipoproteiny i glikolipidy aktywujące TLR2. Po stymulacji tych receptorów następuje aktywacja mechanizmów odpowiedzi wrodzonej.9 Przy braku replikacji drobnoustroju odpowiedź ta ogranicza się jednak do miejsca wstrzyknięcia, dlatego w przypadku szczepionek inaktywowanych ważna jest droga ich podania. Wiele komórek dendrytycznych znajduje się w skórze właściwej oraz w dobrze unaczynionej tkance mięśniowej, natomiast mniej liczne są w tkance tłuszczowej, co tłumaczy preferowane domięśniowe podawanie szczepionek inaktywowanych.10 Po szczepieniu komórki dendrytyczne wędrują z miejsca wstrzyknięcia szczepionki do okolicznych węzłów chłonnych (pachowych albo pachwinowych). Aktywacja mechanizmów wrodzonych jest znacznie słabsza w porównaniu ze szczepionkami „żywymi”. Aby zwiększyć immunogenność, szczepionki inaktywowane zwykle podaje się w połączeniu z adiuwantami. Adiuwanty nie mogą wykazywać właściwości antygenowych i stymulować swoistej reakcji immunologicznej. Mają za zadanie przedłużyć czas pozostawania antygenu w miejscu wstrzyknięcia oraz dostarczyć dodatkowych sygnałów aktywujących komórki dendrytyczne i monocyty. Najsilniejszym adiuwantem pochodzenia naturalnego, wykorzystywanym tylko w badaniach eksperymentalnych, jest adiuwant Freunda, będący mieszaniną prątków gruźlicy i oleju parafinowego.2 Od wielu lat w szczepionkach powszechnie stosuje się związki glinu, zwykle siarczan glinu w połączeniu z wodorotlenkiem sodu lub potasu wraz ze zmienną ilością fosforanów (p. Glin w szczepionkach – jak odpowiedzieć na obawy rodziców? oraz Adiuwanty w szczepionkach stosowanych u dzieci – przyp. red.). Przedłużają one depot tkankowe antygenu szczepionki, a także stymulują napływ leukocytów do miejsca wstrzyknięcia. W miejscu podania szczepionki dochodzi również do wiązania glinu z błonami komórkowymi komórek dendrytycznych, co jest kluczowe dla efektu adiuwantowego. Pomimo znacznego postępu w opracowywaniu nowych adiuwantów, jak dotąd żaden z nich nie zapewnia takiej aktywacji odporności wrodzonej, jaką uzyskuje się w przypadku szczepionek zawierających żywe wirusy.11,12
Szczepionki podjednostkowe
W ostatnim czasie coraz większym zainteresowaniem cieszą się podjednostkowe szczepionki nowej generacji. Zawierają one wysoce oczyszczone immunogenne antygeny stanowiące fragmenty drobnoustrojów. Zastosowanie tego typu antygenów wyklucza przede wszystkim ryzyko rozwoju zakażenia drobnoustrojem „szczepionkowym”, a skład preparatu jest dobrze zbadany i zdefiniowany. Odpowiedź immunologiczna skierowana przeciwko wyselekcjonowanym antygenom wchodzącym w skład szczepionki podjednostkowej jest wysoce swoista. Jednak z drugiej strony, wskutek wykorzystania jedynie jednego z wielu antygenów efektywność szczepionki jest mniejsza.1,13,14 Wzbudzenie długotrwałej ochrony wymaga zatem zastosowania kilku dawek przypominających, a także użycia adiuwantów i nośników wspomagających transport, ekspozycję i trwałość w warunkach in vivo.1 Szczepionki podjednostkowe najczęściej są oparte na białkach, peptydach lub polisacharydach zawierających immunogenne epitopy antygenu. Mogą one posiadać co najmniej jeden epitop danego antygenu. Antygeny są izolowane z hodowli konkretnego szczepu drobnoustroju lub powstają na drodze rekombinacji z hodowli drobnoustrojów niepatogennych.1
Odpowiedź humoralna
Spoczynkowe limfocyty B przed kontaktem z antygenem produkują i uwalniają przeciwciała klasy IgM i IgD o małym powinowactwie do antygenu. W grudkach chłonnych limfocyty B rozpoznają T-zależne antygeny „szczepionkowe” prezentowane przez tzw. grudkowe komórki dendrytyczne (FDC). Precyzyjna odpowiedź humoralna na antygeny T-zależne wymaga ścisłej kooperacji limfocyta B i limfocyta T (rozpoznającego ten sam antygen). Zaangażowane są w nią m.in. pary cząsteczek: CD40 na limfocycie B i jej ligand (CD40L) na aktywowanym limfocycie T, CD80/86 na limfocycie B i CD28 na limfocycie T oraz produkcja odpowiednich cytokin. W grudkach chłonnych węzłów limfatycznych limfocyty B, swoiście rozpoznające antygen podany w szczepionce, przechwytują go z powierzchni FDC poprzez swoje receptory antygenowe – immunoglobuliny powierzchniowe (B-cell receptor – BCR). Swoiste rozpoznanie antygenu prowadzi z jednej strony do transdukcji sygnału, a z drugiej do endocytozy rozpoznanego antygenu. Antygen ulega przetworzeniu, a powstałe peptydy są prezentowane na powierzchni limfocyta B przy udziale cząsteczek MHC klasy II. Jeśli peptydy te zostaną swoiście rozpoznane przez grudkowe limfocyty T pomocnicze (Tfh), obie populacje komórkowe ulegną aktywacji i nastąpi ich ekspansja. W wyniku tej interakcji na limfocytach Tfh pojawia się CD40L. Niedługo po aktywacji część limfocytów B różnicuje się w krótko żyjące komórki plazmatyczne produkujące głównie przeciwciała klasy IgM. Mają one małe powinowactwo do antygenów, stanowiąc natychmiastową odpowiedź humoralną. Natomiast pozostała część aktywowanych, antygenowo swoistych limfocytów B przechodzi dalsze etapy dojrzewania w ośrodkach rozmnażania (germinal center) grudek limfatycznych. Na limfocytach tych zwiększa się ekspresja receptora CXCR5, dzięki czemu przyciągane są one do ośrodków rozmnażania przez komórki dendrytyczne wykazujące ekspresję CXCL13, ligandu dla CXCR5.1,2,15 W ośrodkach rozmnażania zachodzi tzw. dojrzewanie powinowactwa do antygenu dzięki somatycznym hipermutacjom genów kodujących immunoglobuliny (somatic hypermutation – SHM) i ich dodatkowym rearanżacjom (tzw. redagowanie receptorów). Somatyczna hipermutacja jest procesem, w trakcie którego dochodzi do mutacji punktowych genów dla regionów zmiennych immunoglobulin. Jeśli somatyczna hipermutacja doprowadzi do zwiększenia powinowactwa limfocytów B do antygenu, następuje ich dalsza ekspansja.16-18 Następnie, dzięki interakcji CD40 na limfocytach B oraz CD40L na zaktywowanych limfocytach T, dochodzi do aktywacji transkrypcji genów kodujących enzymy tnące DNA – AID (activation-induced cytidine deaminase) oraz UNG (uracil N-glycosylase).2,19 To z kolei umożliwia rekombinację ze zmianą klasy wytwarzanych przeciwciał (class switch recombination – CSR), czyli przełączanie izotypu produkowanych przeciwciał z IgM i IgD na IgG, IgA lub IgE. W trakcie przełączenia klas łańcuch ciężki µ immunoglobuliny M zostaje zastąpiony innym łańcuchem ciężkim, z zachowaniem swoistości antygenowej. Podsumowując, najważniejszymi etapami dojrzewania limfocytu B w wyniku aktywacji antygenem, które prowadzą do produkcji wysoce swoistych przeciwciał, są procesy somatycznej hipermutacji i przełączenie klas (CSR). Oba te procesy zachodzą w ośrodkach rozmnażania grudek limfatycznych i są stymulowane przez takie same sygnały: interakcje CD40L-CD40, sygnałowanie przez TLR i cytokiny.
Ostatecznie limfocyty B różnicują się w długo żyjące komórki plazmatyczne lub limfocyty B pamięci po przełączeniu klas (class-switched memory B cells) o immunofenotypie CD19+/CD27+/IgD-/IgM-. Komórki plazmatyczne zasiedlają szpik kostny, błony śluzowe i śledzionę. Komórki pamięci migrują do kolejnych drugorzędowych narządów limfatycznych. Są to komórki długo żyjące (nawet przez cały czas życia osobniczego), a po ponownym rozpoznaniu antygenu ulegają aktywacji, inicjując szybką odpowiedź wtórną.1,2,15,18 Ich próg aktywacji jest niski, wystarcza do tego mała ilość antygenu.16 Po kolejnym kontakcie ze swoistym antygenem, limfocyty B po przełączeniu klas mogą się różnicować do tzw. plazmablastów po przełączeniu klas lub do plazmocytów.16 Należy podkreślić, że limfocyty B pamięci nie są zdolne do produkcji przeciwciał bez ponownego kontaktu z antygenem. Taka reaktywacja może również mieć miejsce w odpowiedzi na inne, powszechnie występujące drobnoustroje lub drobnoustroje saprofityczne.18 Schemat dojrzewania i różnicowania krążących limfocytów B przedstawiono na rycinie.
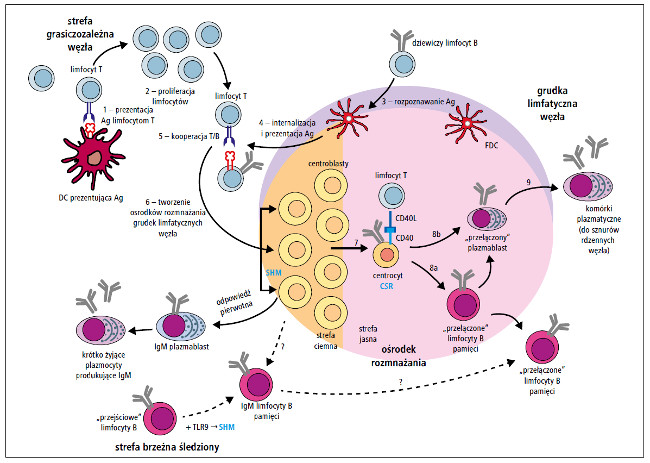
Ryc. Schemat dojrzewania i różnicowania krążących limfocytów B (Ag – antygen, CSR – przełączenie klas, DC – komórka dendrytyczna, FDC – grudkowa komórka dendrytyczna, SHM – somatyczna hipermutacja, TLR – receptor Toll-podobny)
Reaktywacja, proliferacja i różnicowanie limfocytów B pamięci odbywa się bez ponownego tworzenia ośrodków rozmnażania. Produkowane przez nie swoiste dla antygenów przeciwciała mają znacznie większe powinowactwo niż przeciwciała produkowane przez krótko żyjące komórki plazmatyczne, powstałe po pierwszym kontakcie z antygenem. Proces dojrzewania powinowactwa, zapoczątkowany w ośrodkach rozmnażania, trwa kilka miesięcy.18
Odpowiedź immunologiczna na antygeny polisacharydowe
Bakteryjne polisacharydy wchodzą w skład m.in. lipopolisacharydu (LPS), głównego składnika ściany komórkowej bakterii Gram-ujemnych. We wstępnej obronie przeciw bakteriom otoczkowym, które dostały się do organizmu drogą krwi, uczestniczą tzw. limfocyty B strefy brzeżnej (marginal zone).20-23 Komórki te produkują głównie immunoglobuliny klasy IgM o dużym powinowactwie do antygenu. Przeciwciała skierowane przeciwko antygenom polisacharydowym działają jak opsoniny ułatwiające fagocytozę, a po przyłączeniu składowych dopełniacza wywierają efekt cytotoksyczny.2 Wydaje się, że udział opisanych powyżej limfocytów B po przełączeniu klas we wstępnej obronie przed zakażeniami bakteriami otoczkowymi jest niewielki.24,25 Aktywacja krążących limfocytów B strefy brzeżnej w odpowiedzi na antygeny polisacharydowe, w odróżnieniu od limfocytów B aktywowanych w ośrodkach rozmnażania, jest bowiem niezależna od bezpośredniej pomocy limfocytów T pomocniczych (Th; odpowiedź T-niezależna).26 Polisacharydy oraz niemetylowane sekwencje CpG DNA są rozpoznawane przez komórki układu odpornościowego jako sygnał zagrożenia. TLR4 rozpoznaje LPS bakterii Gram-ujemnych, natomiast bakteryjne DNA (CpG) rozpoznawane jest przez TLR9. Co ciekawe, poprzez stymulację receptorów TLR9, w limfocytach B strefy brzeżnej dochodzi do indukcji somatycznej hipermutacji genów kodujących immunoglobuliny i produkcji swoistych przeciwciał. Fakt ten wskazuje na krzyżowanie się drogi wrodzonej (TLR9) i nabytej odporności.27 Jednak w porównaniu z klasycznymi limfocytami B pamięci po przełączeniu klas, limfocyty B strefy brzeżnej przechodzą ograniczony proces somatycznej hipermutacji.22,28-30 Ostatecznie limfocyty B strefy brzeżnej różnicują się w komórki plazmatyczne wydzielające IgM oraz w niewielkim stopniu IgG.27
Do przełączenia klas produkowanych przeciwciał w limfocytach B w odpowiedzi na antygeny T-niezależne dochodzi również na innej drodze niż w klasycznych, grudkowych limfocytach B pamięci. Indukcja AID – jednego z enzymów tnących DNA – w tych pierwszych jest możliwa (inaczej niż w ośrodkach rozmnażania) dzięki reakcji obecnych na limfocytach B receptorów TACI i BAFF-R z ich ligandami: APRIL i BAFF. Ligandy te są produkowane i wydzielane głównie przez komórki dendrytyczne i makrofagi.31,32 Uważa się, że do produkcji przeciwciał dla antygenów T-niezależnych niezbędny jest sygnał z receptora TACI. Interakcja APRIL-TACI jest kluczowa do syntezy IgA.31,32
Dojrzewanie limfocytów B strefy brzeżnej, a w konsekwencji również odpowiedź na antygeny polisacharydowe, jest związane ze śledzioną.25 Po 2. roku życia zwiększa się liczebność tej populacji limfocytów B we krwi obwodowej. Zwiększa się również częstość somatycznych hipermutacji w ich genach kodujących immunoglobuliny, co wiąże się z pojawieniem się struktur anatomicznych strefy brzeżnej śledziony oraz lepszą odpowiedzią humoralną przeciwko polisacharydowym antygenom T-niezależnym.22,33 U pacjentów z asplenią lub po wycięciu śledziony nie wykrywa się krążących limfocytów B strefy brzeżnej.22,27,34 Niezależna od limfocytów T indukcja somatycznych hipermutacji w limfocytach B strefy brzeżnej oraz udział mechanizmów odpowiedzi wrodzonej (TLR9) w ich dojrzewaniu wskazują, że limfocyty B strefy brzeżnej oraz klasyczne limfocyty B pamięci po przełączeniu klas dojrzewają na innej drodze.35 Uważa się, że tylko limfocyty B pamięci po przełączeniu klas reprezentują pulę „prawdziwych” limfocytów pamięci.25
Antygeny polisacharydowe docierają drogą krwi do obwodowych narządów limfatycznych (śledziony, węzłów chłonnych) i również są rozpoznawane w strefie brzeżnej. Podobnie jak w wyniku zakażenia bakteriami otoczkowymi, polisacharydy podane w szczepionce są wiązane przez receptory immunoglobulinowe limfocytów B (BCR), które następnie ulegają aktywacji. Procesy somatycznej hipermutacji i rekombinacji ze zmianą klasy przeciwciał zachodzą w nich jednak tylko w ograniczonym stopniu. Następnie komórki te różnicują się do komórek plazmatycznych.26 Dokładny mechanizm odpowiedzi na antygeny polisacharydowe u człowieka nadal pozostaje w sferze hipotez. Można przypuszczać, że podanie oczyszczonych polisacharydów nie będzie prowadzić do indukcji w limfocytach B dojrzewania powinowactwa poprzez proces somatycznej hipermutacji, ponieważ nie dojdzie do stymulacji receptorów TLR9 (brak DNA bakteryjnego), czego efektem będzie mniejsza swoistość przeciwciał produkowanych w odpowiedzi na taki antygen. Ponieważ kontakt z antygenami polisacharydowymi nie prowadzi do powstania grudkowych limfocytów B pamięci, w następstwie ponownego kontaktu z tymi samymi antygenami polisacharydowymi powstaje odpowiedź o identycznej kinetyce, jak w przypadku odpowiedzi pierwotnej, niezależnie od wcześniejszego szczepienia.36
Podsumowując, same oczyszczone polisacharydy wykazują słabą immunogenność u dzieci do 2. roku życia, co wynika z niedojrzałości anatomicznej ich układu odporności (strefy brzeżnej śledziony). Co więcej, produkcja przeciwciał w odpowiedzi na oczyszczone polisacharydy w sposób niezależny od limfocytów T jest krótkotrwała, gdyż nie powstają limfocyty B pamięci. Antygeny polisacharydowe obecne na bakteriach otoczkowych, jako grasiczoniezależne, indukują powstawanie swoistych przeciwciał głównie klasy IgM i w mniejszym stopniu klasy IgG o małym powinowactwie do antygenu (brak somatycznej hipermutacji w wyniku braku stymulacji TLR9 bakteryjnym DNA) i dopiero ich połączenie z białkami nośnikowymi (toksoid tężcowy, błoniczy, krztuścowy, białka błony zewnętrznej Neisseria meningitidis [outer membrane protein complex – OMPC]) – jak w szczepionkach skoniugowanych – sprawia, że aktywowane są limfocyty CD4+ (Th).2
Rola limfocytów T w odpowiedzi na szczepionki
Do prawidłowej odpowiedzi typu humoralnego (produkcja swoistych przeciwciał) konieczna jest kooperacja limfocytów B z limfocytami Th przez bezpośredni kontakt albo uwalniane cytokiny. Za wspomaganie odpowiedzi humoralnej odpowiedzialna jest subpopulacja limfocytów pomocniczych Th2. Odpowiedź typu komórkowego jest natomiast wspomagana przez subpopulację Th1. Limfocyty Th1 wytwarzające m.in. interleukinę 2 (IL-2) czy IFN-γ, ułatwiają aktywację, proliferację i różnicowanie prekursorów limfocytów cytotoksycznych oraz stymulują komórki odpowiedzi wrodzonej (makrofagi).37 Limfocyty Th2 wytwarzają m.in. IL-4 i IL-10, cytokiny będące czynnikami wzrostu i różnicowania limfocytów B – wspomagają one głównie odpowiedź typu humoralnego.
W układach eksperymentalnych dowiedziono, że rodzaj odpowiedzi aktywowanej przez szczepienia (Th1 vs Th2) zależy od dawki antygenu, drogi podania oraz rodzaju adiuwantu.11,38 Szczepionki „żywe” (wirusowe i bakteryjne), obok limfocytów Th, indukują również limfocyty T cytotoksyczne CD8+ zdolne do zabicia zakażonych komórek gospodarza. Aktywacja zarówno limfocytów CD4+, jak i CD8+ zależy od wstępnej odpowiedzi zapalnej stymulowanej, na przykład przez adiuwanty. W miejscu wstrzyknięcia tworzy się stan zapalny, a podane antygeny są fagocytowane przez niedojrzałe komórki dendrytyczne. Ulegają one aktywacji i wędrują do okolicznych węzłów chłonnych. Na swojej powierzchni prezentują fragmenty antygenu przy udziale MHC klasy II.39 Receptory limfocytów T (T cell receptors – TCR) łączą się swoiście z antygenami prezentowanymi w kontekście określonych cząsteczek MHC, dlatego odpowiedź komórkowa na antygeny zawarte w szczepionce może być różna w danej populacji. Dojrzałe komórki dendrytyczne wykazują na swojej powierzchni ekspresję licznych cząsteczek kostymulatorowych, które dostarczają drugiego sygnału niezbędnego do aktywacji limfocytów T. Aktywowane limfocyty CD4+ dostarczają sygnały stymulujące zarówno zwrotnie do komórek dendrytycznych, do limfocytów B, jak i do limfocytów CD8+. Aktywacja limfocytów CD4+ następuje po podaniu każdej szczepionki, z wyjątkiem szczepionek polisacharydowych nieskoniugowanych. Efektorowe limfocyty T ulegają apoptozie (tzn. zaprogramowanej śmierci) po kilku dniach od ich aktywacji.
W odpowiedzi typu komórkowego na antygeny zawarte w szczepionce powstają również limfocyty T pamięci. Receptory TCR limfocytów T pamięci wykazują takie samo powinowactwo do antygenu, jak limfocyty T dziewicze, ponieważ limfocyty T, w przeciwieństwie do limfocytów B, nie przechodzą dojrzewania powinowactwa (somatyczna hipermutacja). Obie populacje komórek różnią się natomiast izoformami fosfatazy tyrozynowej (CD45). Izoformy CD45 powstają w procesie alternatywnego składania mRNA (splicing). Polega on na łączeniu ze sobą różnych egzonów z pre-mRNA. W ten sposób z jednego genu może powstać więcej niż jedna cząsteczka mRNA, co jest źródłem zmienności białek. Limfocyty T pamięci charakteryzuje mała ekspresja izoformy CD45RA i duża CD45RO. Izoforma CD45RO jest krótsza, co ułatwia proces aktywacji limfocytów T pamięci. Mają one również więcej cząstek biorących udział w adhezji do komórek prezentujących antygen, stąd łatwiej ulegają aktywacji, szybciej proliferują i uwalniają więcej cytokin. Do ich pobudzenia wystarczy tylko jeden sygnał dostarczany przez receptor TCR. Wśród limfocytów T pamięci można wyróżnić populację limfocytów centralnych oraz efektorowych. Pierwsza z nich wędruje do węzłów chłonnych i szpiku kostnego, a jej zadaniem jest szybkie rozpoznanie antygenów prezentowanych przez komórki dendrytyczne i intensywna proliferacja. Populacja efektorowa napływa do miejsc, gdzie toczy się proces zapalny i bardzo szybko po rozpoznaniu patogenu wywiera efekt cytotoksyczny. Udowodniono, że limfocyty T pamięci mogą być obecne przez całe życie, nawet w przypadku braku ekspozycji na antygen.11,40
Mechanizmy efektorowe indukowane szczepieniami
Efektem szczepień ochronnych ma być wytworzenie trwałej i swoistej odpowiedzi przeciwko określonemu drobnoustrojowi. W wyniku szczepień powstają swoiste przeciwciała, które mogą pełnić swoją funkcję poprzez wiązanie aktywnych enzymatycznie miejsc toksyn bakteryjnych lub ograniczenie rozprzestrzeniania się drobnoustrojów w organizmie. Zapobiegają one replikacji wirusów, na przykład przez blokowanie integracji wirusa z komórką docelową. Przeciwciała biorą udział w procesie opsonizacji drobnoustrojów zewnątrzkomórkowych. Komórki żerne (np. makrofagi i neutrofile), dzięki obecności na ich powierzchni receptorów dla fragmentu Fc immunoglobuliny G (FcγR), intensywnie fagocytują opłaszczone patogeny (proces immunofagocytozy). IgG związana z antygenem inicjuje klasyczną drogę aktywacji dopełniacza, co prowadzi do zabicia komórki bakteryjnej lub komórki zakażonej.41 Szczepionki „żywe” prowadzą do powstawania swoistych limfocytów T cytotoksycznych (CD8+), które są zdolne do niszczenia komórki docelowej poprzez uwolnienie zawartości cytoplazmatycznych ziaren cytolitycznych zawierających m.in. perforynę i granzymy. Dodatkowo uwalniane są liczne cytokiny wspomagające komórki w walce z chorobotwórczym drobnoustrojem.
Piśmiennictwo:
1. Jarząb A., Skowicki M., Witkowska D.: Szczepionki podjednostkowe – antygeny, nośniki, metody koniugacji i rola adiuwantów. Immunol. Rev., 2003; 194: 8–182. Grzesiowski P., Hryniewicz W.: Immunologia szczepień ochronnych. (W:) Golab J., Jakobisiak M., Lasek W.: Immunologia. Warszawa, Wydawnictwo Naukowe PWN, 2002
3. Zeman K.: Zaburzenia odporności u dzieci. Warszawa, Wydawnictwo Lekarskie PZWL, 2002; 93–94: 165
4. Takeda K., Akira S.: Toll-like receptors in innate immunity. Int. Immunol., 2005; 17: 1–14
5. Akira S., Uematsu S., Takeuchi O.: Pathogen recognition and innate immunity. Cell, 2006;124: 783–801
6. Majewska M., Szczepanik M.: Rola receptorów toll-podobnych (TLR) w odporności wrodzonej i nabytej oraz ich funkcja w regulacji odpowiedzi immunologicznej. Postępy Hig. Med. Dośw., 2006; 60: 52–63
7. Hong Kong Measles Vaccine Committee: Comparative trial of live attenuated measles vaccine in Hong Kong by intramuscular and intradermal injection. Bull. World Health Organ., 1967; 36:375–384
8. Hanekom W.A.: The immune response to BCG vaccination of newborns. Ann. NY Acad. Sci., 2005; 1062: 69–78
9. van Duin D., Medzhitov R., Shaw A.C.: Triggering TLR signaling in vaccination. Trends Immunol., 2006; 27: 49–55
10. de Lalla F., Rinaldi E., Santoro D. i wsp.: Immune response to hepatitis B vaccine given at different injection sites and by different routes: a controlled randomized study. Eur. J. Epidemiol., 1988; 4: 256–258
11. www.who.int/immunization/documents/Elsevier_Vaccine_immunology.pdf
12. Krause A., Górska P., Ślusarczyk J.: Adiuwanty – substancje stymulujące odpowiedź immunologiczną – część I. Borgis – Medycyna Rodzinna, 2007; 3: 75–79
13. Jin Z., Chu C., Robbins J.B., Schneerson R.: Preparation and characterization of group a meningococcal capsular polysaccharide conjugates and evaluation of their immunogenicity in mice. Infect. Immun., 2003; 71: 5115–5120
14. Anderson P.W., Pichichero M.E., Stein E.C. i wsp.: Effect of oligosaccharide chain length, exposed terminal group, and hapten loading on the antibody response of human adults and infants to vaccines consisting of Haemophilus influenzae type b capsular antigen unitermally coupled to the diphtheria protein CRM197. J. Immunol., 1989; 142: 2464–2468
15. Szaflarska A., Kowalczyk D., Bukowska-Strakova K.: Patomechanizmy pierwotnych niedoborów odporności humoralnej. Alerg. Immunol., 2013; 1: 26–29
16. Diamond B., Grimaldi C.: B cells. (W:) Harris E.D., Budd R.C., Firestein G.S., et al. (eds): Kelley’s Textbook of Rheumatology. Philadelphia, Elsevier Saunders, 2005: 153–173
17. Tangye S.G., Good K.L.: Human IgM+CD27+ B cells: memory B cells or “memory” B cells? J. Immunol., 2007; 179: 13–19
18. McHeyzer-Williams L.J., McHeyzer-Williams M.G.: Antigen-specific memory B cell development. Ann. Rev. Immunol., 2005; 23: 487–513
19. Bukowska-Strakova K.: Ocena przydatności klinicznej oznaczania wybranych parametrów immunologicznych w różnych formach hypogammaglobulinemii u dzieci. Praca doktorska, Kraków, 2010
20. Guinamard R., Okigaki M., Schlessinger J., Ravetch J.V.: Absence of marginal zone B cells in Pyk-2-deficient mice defines their role in the humoral response. Nat. Immunol., 2000; 1: 31–36
21. Martin F., Oliver A.M., Kearney J.F.: Marginal zone and B1 B cells unite in the early response against T-independent blood-borne particulate antigens. Immunity, 2001; 14: 617–629
22. Weller S., Faili A., Aoufouchi S. i wsp.: Hypermutation in human B cells in vivo and in vitro. Ann. N Y Acad. Sci., 2003; 987: 158–165
23. Zandvoort A., Timens W.: The dual function of the splenic marginal zone: essential for initiation of anti-TI-2 responses but also vital in the general first-line defense against blood-borne antigens. Clin. Exp. Immunol., 2002; 130: 4–11
24. Carsetti R., Rosado M.M., Donnanno S. i wsp.: The loss of IgM memory B cells correlates with clinical disease in common variable immunodeficiency. J. Allergy Clin. Immunol., 2005; 115: 412–417
25. Kruetzmann S., Rosado M.M., Weber H. i wsp.: Human immunoglobulin M memory B cells controlling Streptococcus pneumoniae infections are generated in the spleen. J. Exp. Med., 2003; 197: 939–945
26. Lucas A.H., Reason D.C.: Polysaccharide vaccines as probes of antibody repertoires in man. Immunol. Rev., 1999; 171: 89–104
27. Capolunghi F., Cascioli S., Giorda E. i wsp.: CpG drives human transitional B cells to terminal differentiation and production of natural antibodies. J. Immunol., 2008; 180: 800–808
28. Dunn-Walters D.K., Isaacson P.G., Spencer J.: Analysis of mutations in immunoglobulin heavy chain variable region genes of microdissected marginal zone (MGZ) B cells suggests that the MGZ of human spleen is a reservoir of memory B cells. J. Exp. Med., 1995; 182: 559–566
29. Klein U., Rajewsky K., Kuppers R.: Human immunoglobulin (Ig)M+ IgD+ peripheral blood B cells expressing the CD27 cell surface antigen carry somatically mutated variable region genes: CD27 as a general marker for somatically mutated (memory) B cells. J. Exp. Med., 1998; 188: 1679–1689
30. Shi Y., Agematsu K., Ochs H.D., Sugane K.: Functional analysis of human memory B-cell subpopulations: IgD+ CD27+ B cells are crucial in secondary immune response by producing high affinity IgM. Clin. Immunol., 2003; 108: 128–137
31. Castigli E., Wilson S., Garibyan L. i wsp.: TACI is mutant in common variable immunodeficiency and IgA deficiency. Nat. Genet., 2005; 37: 829–834
32. Shulga-Morskaya S., Dobles M., Walsh M.E. i wsp.: B-cell activating factor belonging to the TNF family acts through separate receptors to support B cell survival and T cell-independent antibody formation.J Immunol., 2004; 173: 2331–2341
33. Zandvoort A., Lodewijk M.E., de Boer N.K. i wsp.: CD27 expression in the human splenic marginal zone: the infant marginal zone is populated by naive B cells. Tissue Antigens, 2001; 58: 234–242
34. Tierens A., Delabie J., Michiels L. i wsp.: Marginal-zone B cells in the human lymph node and spleen show somatic hypermutations and display clonal expansion. Blood, 1999; 93: 226–234
35. Scheeren F.A., Nagasawa M., Weijer K. i wsp.: T cell-independent development and induction of somatic hypermutation in human IgM+IgD+ CD27+ B cells. J. Exp. Med., 2008; 205: 2033–2042
36. Southern J., Deane S., Ashton L. i wsp.: Effects of prior polysaccharide vaccination on magnitude, duration, and quality of immune responses to and safety profile of a meningococcal serogroup C tetanus toxoid conjugate vaccination in adults. Clin. Diagn. Lab. Immunol., 2004; 11: 1100–1104
37. Kapsenberg M.L.: Dendritic-cell control of pathogen-driven T-cell polarization. Nat. Rev. Immunol., 2003; 3: 984–993
38. Kennedy J.S., Frey S.E., Yan L. i wsp.: Induction of human T cell-mediated immune responses after primary and secondary smallpox vaccination. J. Infect. Dis., 2004; 190: 1286–1294
39. Jutras I., Desjardins M.: Phagocytosis: at the crossroads of innate and adaptive immunity. Ann. Rev. Cell Dev. Biol., 2005; 21: 511–527
40. Jakóbisiak M.: Pamięć immunologiczna. (W:) Golab J., Jakobisiak M., Lasek W.: Immunologia. Warszawa, Wydawnictwo Naukowe PWN, 2002
41. Jakóbisiak M.: Powstawanie przeciwciał. (W:) Golab J., Jakobisiak M., Lasek W.: Immunologia. Warszawa, Wydawnictwo Naukowe PWN, 2002