Zobacz również komentarz do wytycznej: Profilaktyka grypy u dzieci i młodzieży za pomocą szczepień w sezonie 2010/2011. Co nowego w tegorocznych zaleceniach amerykańskiego Komitetu Doradczego ds. Szczepień Ochronnych (ACIP)? Tłumaczyli: lek. Iwona Rywczak, dr med. Piotr Sawiec, dr med. Jacek Mrukowicz, lek. Wojciech Strojny Skróty: ACIP – Komitet Doradczy ds. Szczepień Ochronnych, AIDS – zespół nabytego niedoboru odporności, CDC – Centers for Disease Control and Prevention, FDA (Food and Drug Administration) – Urząd ds. Żywności i Leków, HA – hemaglutynina, HI – przeciwciała hamujące hemaglutynację, HIV – ludzki wirus nabytego niedoboru odporności, HMO (Health Maintenance Organization) – organizacja pełniąca łącznie funkcje ubezpieczyciela i świadczeniodawcy ochrony zdrowia, organizująca i zarządzająca opieką zdrowotną (system opieki zarządzanej), ILI (influenza-like illness) – choroba grypopodobna, LAIV (live attenuated influenza vaccine) – "żywa" donosowa szczepionka przeciwko grypie, MAARI (medically attended acute respiratory illness) – ostra choroba układu oddechowego wymagająca porady lekarskiej, NHDS – National Hospital Discharge Survey, NHIS – badanie ankietowe National Health Interview Survey, NOP – niepożądany odczyn poszczepienny, ORS (oculorespiratory syndrome) – zespół objawów ze strony oczu i układu oddechowego, QALY (quality-adjusted life year) – rok życia skorygowany o jakość życia, PCR – łańcuchowa reakcja polimerazy, RT-PCR – PCR z odwrotną transkrypcją, TIV (trivalent inactivated influenza vaccine) – trójwalentna inaktywowana szczepionka przeciwko grypie, VSD – Vaccine Safety Datalink, VAERS (Vaccine Adverse Event Reporting System) – system raportowania niepożądanych odczynów poszczepiennych, ZGB – zespół Guillaina i Barrégo
Wprowadzenie
W Stanach Zjednoczonych coroczne epidemie grypy sezonowej zwykle występują w okresie od późnej jesieni do początku wiosny. Na grypę chorują osoby w każdym wieku, lecz największa zapadalność dotyczy dzieci.[1-3] Podczas corocznych epidemii ciężki przebieg choroby i zgony dotyczą głównie osób w wieku >=65 lat, dzieci do ukończenia 2. roku życia oraz chorych na niektóre choroby z grup dużego ryzyka powikłań grypy.[1,4,5] W latach 1990–1999 epidemie grypy były przyczyną średnio około 36 000 zgonów rocznie, a w latach 1979–2001 – 226 000 hospitalizacji rocznie.[6,7] Podtypy wirusa grypy A powstałe w wyniku wymiany dużych segmentów genomu (tj. skoku antygenowego) lub znacznie różniące się od tych, które wywoływały zakażenia w ciągu ostatnich kilkudziesięciu lat, mogą być przyczyną pandemii.[8] W kwietniu 2009 roku ustalono, że zapalenia układu oddechowego powodował nowy wirus grypy A (H1N1), podobny do wirusa grypy A (H1N1) wcześniej wyizolowanego od świń, ale różniący się od niego pod względem genetycznym i antygenowym. Do maja 2009 roku wirus ten rozprzestrzenił się na całym obszarze Ameryki Północnej, zidentyfikowano go także w wielu innych rejonach świata.[9,10] Zachorowalność na grypę pandemiczną wywołaną przez wirusa grypy A (H1N1) 2009 przekraczała w okresie wiosenno-letnim 2009 roku sezonowe wartości podstawowe; była to pierwsza pandemia od 1968 roku. W Stanach Zjednoczonych pandemię charakteryzowało znaczne zwiększenie aktywności wirusa grypy, co odnotowano w różnych systemach nadzoru nad zakażeniami tym wirusem. We wrześniu 2009 roku aktywność ta znacznie przekroczyła historyczne normy, szczyt osiągnęła pod koniec października i wróciła do sezonowej wartości podstawowej w styczniu 2010 roku (ryc. 1 i 2).
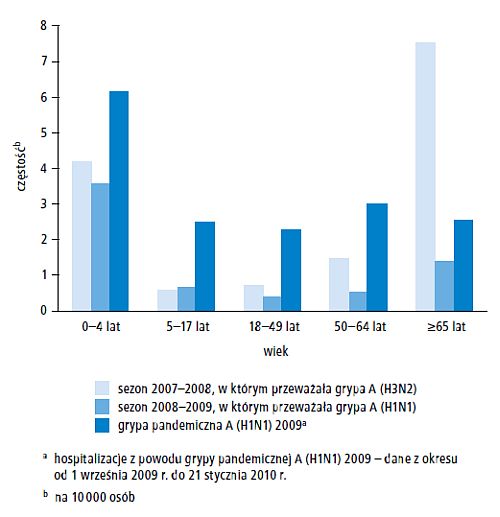
Ryc. 1. Łączna częstość hospitalizacji podczas trzech sezonów epidemicznych grypy w zależności od grupy wiekowej – Emerging Infections Program, Stany Zjednoczone, 2007–2010.
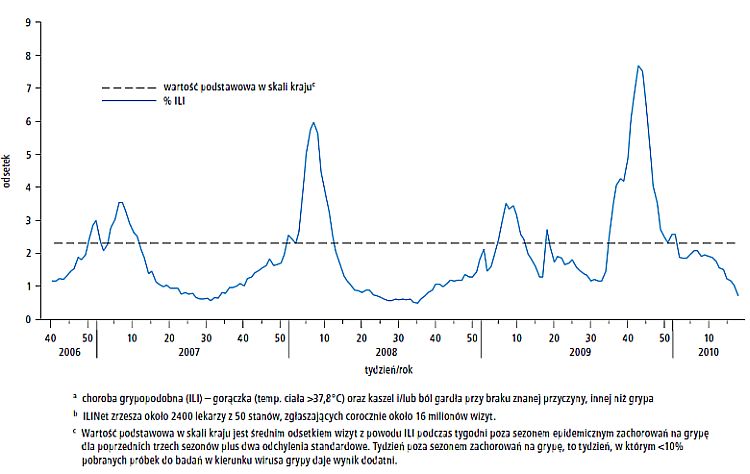
Ryc. 2. Odsetek wizyt u lekarza z powodu choroby grypopodobnej (influenza-like illness – ILI)a na podstawie danych z amerykańskiego systemu Outpatient Influenza-like Illness Surveillance Network (ILINet)b, w poszczególnych tygodniach roku – Stany Zjednoczone, 1 października 2006–1 maja 2010
W tym okresie >99% zidentyfikowanych wirusów stanowiły wirusy grypy pandemicznej A (H1N1) 2009.[11] Dane z badań epidemiologicznych przeprowadzonych podczas pandemii grypy A (H1N1) 2009 wskazują, że ryzyko powikłań tej grypy u osób w wieku 19–64 lat jest większe od typowego ryzyka powikłań grypy sezonowej.[12] Oczekuje się, że w kolejnych zimowych sezonach epidemicznych zakażenia wirusem grypy pandemicznej A (H1N1) 2009 nadal będą występować na półkuli północnej i południowej. Nie wiadomo jednak, czy wirus ten zastąpi jeden lub więcej podtypów wirusa grypy sezonowej A (H1N1 i H3N2) krążących od 1977 roku, czy będzie krążyć razem z nimi. W wirusach grypy często zachodzą zmiany antygenów na skutek mutacji punktowych i procesów rekombinacji, które mają miejsce podczas replikacji wirusa (przesunięcie antygenowe – antigenic drift). Nie można przewidzieć, jakie zmiany nastąpią w zakresie przesunięcia antygenowego i ewolucji szczepów wirusa grypy pandemicznej A (H1N1) 2009.
Najskuteczniejszą metodą zapobiegania zachorowaniom na grypę oraz powikłaniom tej choroby jest coroczne szczepienie.[8] Zaleca się coroczne szczepienie preparatami zawierającymi szczepy najlepiej dopasowane według prognoz systemów nadzoru nad zakażeniami wirusem grypy. Szczepionkę przeciwko grypie zaleca się każdej osobie w wieku >=6 miesięcy (jeżeli nie występują przeciwwskazania). Trójwalentną inaktywowaną szczepionkę przeciwko grypie (trivalent inactivated influenza vaccine – TIV) można podać każdej osobie >6. miesiąca życia, w tym osobom z grup dużego ryzyka powikłań grypy (ramka).
|
Ramka. Zestawienie zaleceń dotyczących szczepień przeciwko grypie (2010)
Należy corocznie szczepić wszystkie osoby, które ukończyły 6. mż.
Ochrona osób z grup największego ryzyka powikłań grypy powinna w dalszym
ciągu stanowić główny kierunek wysiłków, w miarę jak lekarze i programy
szczepień będą stopniowo wdrażać rutynowe szczepienia wszystkich, którzy
ukończyli 6. mż.
|
(...) Wprawdzie w ostatnich latach odsetek zaszczepionych osób w wielu grupach, w których szczepienie jest rutynowo zalecane, uległ w Stanach Zjednoczonych zwiększeniu, nadal jednak w wielu dziedzinach konieczna jest poprawa.[13] Konieczne jest więc wprowadzanie i rozwijanie strategii mających na celu zaszczepienie jak największej liczby osób w placówkach medycznych i niemedycznych.[14] Leki przeciwwirusowe stanowią dodatek do szczepień i są skuteczne zarówno w leczeniu grypy, jak i w profilaktyce farmakologicznej po ekspozycji na wirusy grypy. Pojawienie się w 2005 roku szczepów wirusa grypy opornych na jeden lub więcej z czterech zarejestrowanych leków przeciwwirusowych (oseltamiwir, zanamiwir, amantadynę i rymantadynę) utrudniło opracowanie zaleceń dotyczących leczenia przeciwwirusowego i profilaktyki farmakologicznej. Centers for Disease Control and Prevention (CDC) okresowo aktualizuje zalecenia dotyczące leczenia przeciwwirusowego i profilaktyki farmakologicznej grypy w odpowiedzi na nowe dane na temat modeli oporności na leki przeciwwirusowe wśród krążących szczepów oraz czynników ryzyka powikłań grypy.[15] Z paroma wyjątkami, szczepy wirusa grypy pandemicznej A (H1N1) 2009, które zaczęły krążyć w kwietniu 2009 roku, wykazywały wrażliwość na oseltamiwir.[16]
Metodyka
Komitet Doradczy ds. Szczepień Ochronnych (ACIP) CDC publikuje coroczne zalecenia dotyczące zapobiegania grypie i kontroli zachorowań. Grupa Robocza ACIP ds. grypy spotyka się co 2–4 tygodnie w ciągu całego roku, aby omówić nowo opublikowane badania kliniczne, dokonać przeglądu aktualnych wytycznych i rozważyć ewentualne zmiany w zaleceniach. Aktualizując coroczne zalecenia w celu przedłożenia ich całemu komitetowi ACIP, członkowie Grupy Roboczej uwzględniają szereg zagadnień, takich jak obciążenia związane z grypą, skuteczność i bezpieczeństwo szczepionek, odsetek zaszczepionych osób w grupach, w których szczepienie jest zalecane, możliwości wykonania szczepień i efektywność ponoszonych kosztów, a także przewidywana podaż szczepionek. Członkowie Grupy Roboczej zwracają się ponadto do wakcynologów, epidemiologów i producentów o okresowe aktualizacje danych dotyczących produkcji, bezpieczeństwa i skuteczności szczepionek. Konsultują się też z osobami odpowiedzialnymi za stanowe i lokalne programy szczepień. Dane dotyczące rejestracji zachorowań na grypę i oporności na leki przeciwwirusowe uzyskano z działu CDC ds. grypy. Komitet doradczy ds. szczepionek i innych produktów biologicznych (Vaccines and Related Biological Products Advisory Committee) doradza w kwestii wyboru szczepów wirusa grypy amerykańskiemu Urzędowi ds. Żywności i Leków (Food and Drug Administration – FDA), który decyduje, które szczepy zostaną zastosowane w danym roku w TIV.
Główne źródło danych, na podstawie których opracowywane są zalecenia dotyczące zapobiegania i kontroli zachorowań na grypę, stanowią opublikowane w recenzowanych czasopismach badania kliniczne oraz niepublikowane dane istotne dla omawianych kwestii. Wśród analizowanych lub przytaczanych badań największe znaczenie przypisano badaniom o najwyższej jakości oceniającym swoiste dla grypy parametry kliniczne. Na przykład najdokładniejszych szacunkowych danych dotyczących obciążenia systemu ochrony zdrowia wskutek zachorowań na grypę dostarczają dane populacyjne na temat zachorowań potwierdzonych laboratoryjnie. Natomiast najlepsze dane dotyczące skuteczności szczepionek lub leków przeciwwirusowych pochodzą z badań z randomizacją, których punktem końcowym są potwierdzone laboratoryjnie zachorowania na grypę, i w których uwzględnia się takie czynniki, jak czas i nasilenie krążenia wirusa grypy w populacji oraz zgodność antygenową szczepów szczepionkowych i krążących w populacji szczepów dzikich.[17,18] W populacjach, w których szczepienie jest już zalecane, nie przeprowadza się badań z randomizacją i z grupą kontrolną otrzymującą placebo ze względów etycznych, ale ważnych danych na temat bezpieczeństwa i skuteczności szczepionki lub leków przeciwwirusowych mogą też dostarczyć badania obserwacyjne, w których ocenia się zachorowania potwierdzone laboratoryjnie. Badania z randomizacją i z grupą kontrolną otrzymującą placebo są ponadto najlepszym źródłem danych dotyczących bezpieczeństwa szczepionek i leków przeciwwirusowych; jednak ze względu na zbyt małą liczbę uczestników, nie pozwalają na wykrycie związku pomiędzy podaniem szczepionki a rzadkimi zdarzeniami niepożądanymi.
Najlepszą metodą oceny częstości rzadkich poszczepiennych zdarzeń niepożądanych jest przeprowadzenie badań z grupą kontrolną po zaszczepieniu dużego odsetka danej populacji. W badaniach tych często wykorzystuje się skomputeryzowaną dokumentację medyczną z dużych, wieloośrodkowych baz danych w połączeniu z analizą dokumentacji tych pacjentów, u których stwierdzono niepożądany odczyn poszczepienny (NOP).[19-21] Dane dotyczące odsetka zaszczepionych osób uzyskane w reprezentatywnych, dobranych losowo populacjach i obejmujące weryfikacje szczepień na podstawie analizy dokumentacji medycznej mają większą wartość niż dane pochodzące z ograniczonych populacji lub niezawierające potwierdzenia szczepień; dane takie jednak rzadziej dotyczą dzieci w wieku >=5 lat.[22] Ponadto największy wpływ na formułowanie zaleceń mają badania oceniające skuteczność programu poprawy odsetka zaszczepionych osób, przeprowadzone z grupą kontrolną, w której nie stosowano interwencji. W tych spośród cytowanych badań, w których przeprowadzono porównania statystyczne, za granicę istotności statystycznej uznawano p <0,05 lub 95% przedział ufności (CI) pozwalający odrzucić hipotezę zerową (zakładającej brak efektu interwencji).
Dane przedstawione w niniejszym raporcie były aktualne 29 czerwca 2010 roku i stanowią zalecenia przedstawione wszystkim członkom ACIP, którzy zaakceptowali je 24 lutego i 24 czerwca 2010 roku. Dalsze modyfikacje stanowiska ACIP nastąpiły podczas późniejszego jego przeglądu przez CDC, dokonywanego w celu aktualizacji i ujednolicenia słownictwa. Zalecenia dotyczące szczepień odnoszą się jedynie do osób, u których nie występują przeciwwskazania do stosowania szczepionki (p. rozdz. "Przeciwwskazania i sytuacje wymagające szczególnej ostrożności"). Dalsze aktualizacje będą w razie potrzeby publikowane na stronie internetowej CDC dotyczącej grypy (http://www.cdc.gov/flu).
Najważniejsze zmiany i uaktualnienia dotychczasowych zaleceń
W 2010 roku do zaleceń wprowadzono 5 ważnych zmian lub uaktualnień:
1. Zaleca się rutynowe szczepienie przeciwko grypie wszystkich osób w wieku >=6 miesięcy. Jest to rozszerzenie wcześniejszych zaleceń, obejmujące corocznym szczepieniem dodatkowo wszystkich dorosłych w wieku 19–49 lat, poparte danymi wskazującymi na bezpieczeństwo corocznego szczepienia przeciwko grypie oraz skuteczność takiej profilaktyki dającej potencjalne korzyści dla wszystkich grup wiekowych. Do roku 2009 coroczne szczepienie zalecano już około 85% populacji amerykańskiej, co wynikało z obecności czynników ryzyka powikłań grypy lub bliskiego kontaktu z osobami obciążonymi większym ryzykiem takich powikłań. Jedyną grupą, której nie zalecano rutynowych szczepień, były zdrowe osoby dorosłe w wieku 18–49 lat (z wyłączeniem kobiet w ciąży), które nie były narażone na ryzyko zakażenia w związku z wykonywanym zawodem, lub które nie miały bliskiego kontaktu z osobami obciążonymi większym ryzykiem powikłań grypy. Jednak powikłania grypy wystąpiły także u osób dorosłych, u których nie zidentyfikowano wcześniej czynników ryzyka takich powikłań. Poza tym niektórzy dorośli, u których choroby towarzyszące lub czynniki związane z wiekiem zwiększają ryzyko powikłań, lub u których istnieje inne wskazanie do poddania się szczepieniu, są nieświadomi, że powinni otrzymać szczepionkę. Kolejnym argumentem popierającym rozszerzenie zaleceń corocznych szczepień na wszystkie osoby dorosłe jest obawa, że wirusy spokrewnione z wirusem grypy pandemicznej A (H1N1) 2009 będą nadal krążyć w sezonie epidemicznym 2010–2011, a istotny odsetek młodych dorosłych może pozostać podatny na zakażenie takimi wirusami. Dane z badań epidemiologicznych przeprowadzonych podczas pandemii w 2009 roku wskazują, że ryzyko wystąpienia powikłań w grupie wiekowej 19–49 lat jest większe, niż ryzyko zwykle obserwowane dla grypy sezonowej.[12,23,27]
2. Podobnie jak we wcześniejszych zaleceniach, wszystkim dzieciom w wieku od 6 miesięcy do ukończenia 9. roku życia, które otrzymują szczepionkę przeciwko grypie sezonowej po raz pierwszy, należy podać 2 dawki. Dzieci, które po raz pierwszy zaszczepiono tylko 1 dawką szczepionki przeciwko grypie sezonowej, w kolejnym sezonie epidemicznym powinny otrzymać raczej 2 dawki. Poza tym w sezonie 2010–2011 dzieci w wieku od 6 miesięcy do ukończenia 9. roku życia, którym nie podano przynajmniej 1 dawki monowalentnej szczepionki przeciwko grypie pandemicznej A (H1N1) 2009, powinny otrzymać 2 dawki szczepionki przeznaczonej na sezon 2010–2011, niezależnie od dotychczasowych szczepień przeciwko grypie. Dzieciom w wieku od 6 miesięcy do ukończenia 9. roku życia, u których nie można ustalić historii szczepień przeciwko grypie z sezonu 2009–2010 lub szczepień monowalentną szczepionką przeciwko grypie pandemicznej A (H1N1) 2009, należy podać 2 dawki szczepionki przeznaczonej na sezon 2010–2011.
3. Inaktywowane trójwalentne szczepionki przeciwko grypie przygotowywane na sezon epidemiczny 2010–2011 będą zawierały antygeny szczepów spokrewnionych ze szczepami A/California/7/2009 (H1N1), A/Perth/16/2009 (H3N2) i B/Brisbane/60/2008. Wirus szczepionkowy A (H1N1) pochodzi od wirusa grypy pandemicznej A (H1N1) 2009.
4. Nowo zarejestrowana trójwalentna szczepionka zawierająca 60 µg antygenu hemaglutyniny na każdy szczep szczepionkowy (Fluzone High-Dose [Sanofi Pasteur]) jest alternatywnym preparatem przeznaczonym dla osób w wieku >=65 lat (niezarejestrowana w Polsce – przyp. red.). W tej grupie wiekowej można podać jakikolwiek preparat TIV w standardowej dawce lub Fluzone High-Dose. Osobom <65. roku życia, które otrzymują szczepionkę inaktywowaną, należy podać TIV w standardowej dawce. (...)
Grypa – podstawowe informacje i epidemiologia
Wirusologia
Epidemiczne zachorowania u ludzi wywołują dwa typy wirusa grypy – A i B. Wirusy grypy A dzieli się na podtypy na podstawie swoistości antygenowej dwóch białek powierzchniowych – hemaglutyniny (H) i neuraminidazy (N). Od 1977 roku zachorowania na grypę u ludzi na całym świecie wywołują dwa podtypy wirusa grypy A – H1N1 i H3N2 – oraz wirusy grypy B. Wirusy grypy A i B dzieli się na dalsze grupy na podstawie ich cech antygenowych. Oba typy wirusów grypy podlegają częstym zmianom antygenowym, wynikającym z mutacji punktowych zachodzących podczas replikacji, które powodują powstawanie nowych wariantów wirusa (tzw. przesunięcie antygenowe [antigenic drift]).[8] W niedawno przeprowadzonych badaniach analizowano złożoną ewolucję molekularną i dynamikę epidemiologiczną wirusów grypy A.[28-30]
Nowe lub w znacznym stopniu różniące się podtypy wirusa grypy A mogą być przyczyną pandemii, jeżeli wykazują zdolność do wywoływania zachorowań u ludzi, skutecznie przenoszą się z człowieka na człowieka, a także w przypadku gdy nie stwierdzano wcześniej odporności u ludzi lub była ona niewielka.[8] W kwietniu 2009 roku odnotowano u ludzi zakażenia nowym wirusem grypy A (H1N1), który był później przyczyną pandemii.[9] Wirus grypy pandemicznej A (H1N1) 2009 powstał z wirusów grypy A krążących wśród świń w okresie ostatnich kilkudziesięciu lat, jego antygeny znacznie się różnią od wirusów ludzkiej grypy A (H1N1), które krążą od 1977 roku. Wirus pandemiczny A (H1N1) 2009 zawiera fragmenty genów, których nie stwierdzono wcześniej u ludzi lub zwierząt. Gen hemaglutyniny (HA), kodujący białko powierzchniowe spełniające najważniejszą rolę w odpowiedzi immunologicznej, wykazuje największe podobieństwo do HA obserwowanej w wirusach grypy krążących w tym samym czasie wśród świń. Wydaje się, że gen ten powstał z wirusa grypy H1N1 pochodzącego od ptaków, który był przyczyną pandemii w 1918 roku i przeniknął do populacji ludzkiej i świńskiej mniej więcej w tym samym czasie.[28]
Krążących obecnie w populacji wirusów grypy B nie dzieli się na podtypy, ale wyróżnia się dwie linie genetyczne o odmiennym rodowodzie (Yamagata i Victoria). W wirusach grypy B przesunięcie antygenowe zachodzi znacznie wolniej niż w wirusach grypy A. Wirusy grypy B z obu linii genetycznych stwierdzano w większości poprzednich sezonów epidemicznych.[31]
Odporność skierowana przeciwko antygenom powierzchniowym wirusa, zwłaszcza hemaglutyninie, zmniejsza ryzyko zakażenia, a jeśli do niego dojdzie – łagodzi przebieg choroby.[32] Niestety przeciwciała skierowane przeciwko jednemu typowi wirusa grypy lub jego podtypowi nie zapewniają ochrony przed zakażeniem innym typem lub podtypem wirusa. Co więcej – nawet w obrębie tego samego podtypu przeciwciała skierowane przeciwko jednemu szczepowi nie zawsze chronią przed zakażeniem innym szczepem, różniącym się pod względem antygenowym.[33] Częste powstawanie nowych wariantów wirusa grypy na drodze przesunięć antygenowych tłumaczy sezonowe epidemie zachorowań na grypę i wymusza coroczne zmiany składu szczepionki, które polegają na wprowadzaniu do niej jednego lub więcej nowych szczepów wirusa.
Większe zmiany antygenowe – tzw. skok antygenowy (antigenic shift [jest wynikiem wymiany całych segmentów RNA – przyp. red.]) – występują rzadziej. Wynikiem skoku antygenowego jest powstanie nowego podtypu wirusa grypy A mogącego wywołać pandemię. Choć nowy wirus grypy pandemicznej A (H1N1) 2009 nie jest nowym podtypem, okazuje się, że większość osób nie wytworzyła wcześniej przeciwciał przeciwko głównym epitopom jego hemaglutyniny, dlatego zakażenie mogło się szybko rozprzestrzenić w populacji.[28]
Korzystanie z opieki medycznej, hospitalizacje i zgony z powodu grypy
W Stanach Zjednoczonych coroczne epidemie grypy zwykle występują w miesiącach jesienno-zimowych, ale największe nasilenie zachorowań na grypę może mieć miejsce nawet w kwietniu lub w maju. Powikłania związane z grypą wymagające niezwłocznej opieki medycznej, w tym hospitalizacje oraz zgony, mogą być wynikiem bezpośredniego wpływu zakażenia wirusem grypy lub powikłań związanych z wiekiem, ciążą, ze współistniejącymi chorobami układu sercowo-naczyniowego i oddechowego lub z innymi chorobami przewlekłymi. Badania, w których oceniano kliniczne skutki zachorowań na grypę niepotwierdzoną laboratoryjnie (np. wymagające hospitalizacji zapalenia układu oddechowego występujące w sezonie epidemicznym zachorowań na grypę), mogą być trudne do interpretacji z powodu występowania w tym samym czasie w populacji także innych drobnoustrojów wywołujących zakażenia układu oddechowego (np. wirusa syncytium nabłonka oddechowego [RSV]).[34-36] Jednak w okresie krążenia wirusów grypy w populacji zwiększa się liczba wizyt w gabinetach lekarskich z powodu chorób układu oddechowego o ostrym przebiegu z towarzyszącą gorączką. Dane pochodzące z amerykańskiego systemu Outpatient Influenza-like Illness Surveillance Network (ILINet) wskazują, że zarówno w ciągu kolejnych sezonów epidemicznych grypy, jak i w kolejnych latach zwiększa się liczba wizyt u lekarza z powodu choroby grypopodobnej (influenza-like illness – ILI)a; dane dotyczące 2009 roku wskazują również (ryc. 2), że liczba zakażeń układu oddechowego związanych z krążeniem wirusa grypy pandemicznej A (H1N1) 2009 zwiększyła się wiosną oraz ponownie jesienią 2009 roku.[37,38]
W typowym zimowym sezonie zachorowań na grypę obserwuje się zwiększenie liczby zgonów i hospitalizacji w okresie rzeczywistego krążenia wirusów grypy. Na podstawie korelacji między aktywnością wirusa grypy a sezonową zmiennością pneumokokowego zapalenia płuc można stwierdzić, że u niektórych osób, u których za przyczynę hospitalizacji uznaje się inwazyjne pneumokokowe zapalenie płuc, prawdopodobne jest współistnienie zakażenia wirusem grypy.[39] Liczbę zgonów lub hospitalizacji wynikających przynajmniej częściowo z zakażenia grypą można oszacować na podstawie technik modelowych stosowanych do monitorowania krążących wirusów oraz analizy krajowych danych dotyczących umieralności lub hospitalizacji. Liczba ta obejmuje zgony i hospitalizacje, w przypadku których zakażenie wirusem grypy prawdopodobnie miało wpływ na umieralność, lecz niekoniecznie było jedyną przyczyną zgonu.[6,7,40,41]
Dodatkowe zgony i hospitalizacje w trakcie sezonu zachorowań na grypę, które prawdopodobnie przynajmniej częściowo wynikają z zakażenia grypą, mieszczą się w szerokiej kategorii zgonów i hospitalizacji spowodowanych chorobami płuc i układu krążenia. Wyliczenia obejmujące jedynie punkty końcowe/zmienne związane z zachorowaniami na zapalenie płuc lub grypę zaniżają odsetek ciężkich zachorowań spowodowanych przynajmniej częściowo wirusem grypy, ponieważ wykluczają uwarunkowane zakażeniem grypą zaostrzenia współistniejących chorób płuc i układu sercowo-naczyniowego.[6,7,40-42] Obliczono, że w Stanach Zjednoczonych w kolejnych sezonach epidemicznych 1979–1980 oraz 2000–2001 liczba chorych przyjmowanych do szpitali z powodu grypy podczas każdej epidemii wynosiła 55 000–431 000 (śr. 226 000).[7] W latach 1990–1999 w Stanach Zjednoczonych zwiększyła się liczba zgonów związanych z grypą, co częściowo wiązano ze znacznie większą liczbą osób w wieku >=65 lat, w tym również osób należących do grup zwiększonego ryzyka zgonu z powodu powikłań grypy.[6] W przypadku oceny obciążenia grypą na podstawie danych dotyczących umieralności obejmujących zgony spowodowane zarówno zapaleniem płuc i grypą, jak i zaburzeniami oddechowo-krążeniowymi, stwierdzono, że w latach 1976–1990 w każdym sezonie odnotowano około 19 000 zgonów z powodu powikłań grypy ze strony układu oddechowego lub sercowo-naczyniowego, a w latach 1990–1999 – około 36 000 (w każdym sezonie).[6] Na podstawie danych obejmujących jedynie zapalenia płuc i grypę szacunkowa średnia roczna liczba zgonów związanych z grypą wynosi 8000. Ponadto umieralność jest większa w sezonach, w których dominują zakażenia podtypem H3N2 wirusa grypy A.[43] Podtyp ten występował w 90% sezonów epidemicznych w latach 1990–1999 oraz w 57% sezonów w latach 1976–1990.[6] Umieralność obliczona na podstawie różnych technik modelowych ogólnie była podobna, choć szacunkowe wartości dla ostatnich lat, gdy dominowały wirusy grypy A (H1N1), były nieco mniejsze.[40]
Wirusy grypy mogą powodować zachorowania u osób ze wszystkich grup wiekowych.[1-5] Najczęściej chorują dzieci, ale ryzyko powikłań, hospitalizacji i zgonu z powodu grypy jest zwiększone u osób w wieku >=65 lat, dzieci w wieku <5 lat i osób w każdym wieku, u których występują choroby zwiększające ryzyko powikłań grypy.[1,4,5,44-47] W badaniach przeprowadzonych podczas kilku epidemii grypy sezonowej orientacyjna liczba hospitalizacji i zgonów w różnych grupach wiekowych była bardzo zróżnicowana. W latach 1990–1999 szacunkowy współczynnik umieralności z powodu płucnych lub sercowo-naczyniowych powikłań grypy wynosił 0,4–0,6/100 000 wśród osób do 49. roku życia, 7,5/100 000 wśród osób w wieku 50–64 lat i 98,3/100 000 u osób >=65. roku życia.[6] Podczas pandemii grypy A (H1N1) 2009 badania epidemiologiczne przeprowadzone w wielu krajach wykazały, że liczba hospitalizacji i zgonów wśród dzieci i osób dorosłych w wieku <65 lat przekroczyła wartości obserwowane w trakcie typowych zimowych epidemii grypy sezonowej.[12,23,25,48,49] W jednej z analiz średni wiek osób zmarłych w Stanach Zjednoczonych w okresie od maja do grudnia 2009 roku, u których rozpoznanie grypy potwierdzono laboratoryjnie, wynosił 37 lat. Dla porównania, szacowany średni wiek osób zmarłych z powodu grypy sezonowej w latach 1979–2001 wynosił 76 lat.[50] Szacowana liczba hospitalizacji i zgonów chorych w wieku >=65 lat była mniejsza od wartości obserwowanej podczas większości sezonowych epidemii. Różnica ta była spowodowana mniejszym ryzykiem zakażenia[51] w związku z częstszym występowaniem częściowej lub całkowitej odporności wśród starszych osób, co z kolei prawdopodobnie wynikało z ekspozycji na podobne antygenowo wirusy grypy A krążące w pierwszej połowie lat 50. XX wieku. Na wcześniej istniejącą odporność w pewnym stopniu wskazywały krzyżowo reagujące przeciwciała występujące u około 1/3 osób w starszym wieku,[52] co tłumaczono podobieństwem budowy białka hemaglutyniny wirusa H1N1 2009 i wirusów krążących wcześniej w XX wieku.[53]
Dzieci
Wśród dzieci w wieku <5 lat zachorowanie
na grypę jest częstym powodem wizyt w gabinetach
lekarskich i na oddziałach pomocy doraźnej.
Podczas dwóch sezonów epidemicznych
(2002–2003 i 2003–2004) odsetek dzieci w wieku
<5 lat zgłaszających się do gabinetów lekarskich i na oddziały pomocy doraźnej z objawami ostrej
choroby układu oddechowego lub gorączką, u których
laboratoryjnie potwierdzono grypę, wynosił
odpowiednio 10–19% i 6–29%. Opierając
się na tych danych, częstość wizyt związanych z grypą w przychodniach obliczono na 50–95
na 1000 dzieci, a na oddziałach pomocy doraźnej
na 6–27 na 1000 dzieci.[54] W wieloletnim badaniu
przeprowadzonym w Nowym Jorku wykorzystano
dane pochodzące z systemu nadzoru epidemiologicznego, gromadzone w celu oceny
częstości występowania zachorowań wywołanych
poszczególnymi szczepami wirusa grypy wśród
pacjentów zgłaszających się na oddziały pomocy
doraźnej. Poza oczekiwaną różnicą w zależności
od sezonu i grupy wiekowej stwierdzono, że epidemie
wywołane wirusem grypy B stanowiły ważną
przyczynę zachorowań wśród dzieci w wieku
szkolnym obserwowanych w kilku sezonach epidemicznych, a największe nasilenie corocznych
epidemii wywołanych zarówno wirusem grypy A,
jak i B wśród dzieci w wieku szkolnym występowało
wcześniej niż w innych grupach wiekowych.[55]
Badania retrospektywne wykorzystujące dane z dokumentacji medycznej wykazały podobną częstość
występowania choroby wśród dzieci w wieku
<5 lat w innych sezonach epidemicznych.[45,56,57]
Oszacowano, że w sezonie epidemicznym grypy, w porównaniu z okresem, kiedy wirus nie krąży w populacji, dochodzi do około 7–12 dodatkowych wizyt w przychodni i 5–7 przypadków dodatkowego przepisania antybiotyków na 100 dzieci w wieku <15 lat; wskaźniki te były odwrotnie proporcjonalne do wieku dziecka.[57] W latach 1993–2004 w Bostonie i okolicach częstość wizyt na oddziałach pomocy doraźnej z powodu choroby układu oddechowego wywołanej przez wirusa grypy wśród dzieci w wieku =<7 lat w zimowym okresie zachorowań na choroby układu oddechowego, ustalona na podstawie danych z nadzoru epidemiologicznego (monitorującego zakażenia wirusowe), wynosiła od 22,0 na 1000 dzieci w wieku 6–23 miesięcy do 5,4 na 1000 dzieci w wieku 5–7 lat.[58] Szacunkowa częstość hospitalizacji związanych z grypą jest znacznie większa wśród niemowląt i dzieci w wieku <2 lat niż wśród dzieci starszych i podobna jak w innych grupach o zwiększonym ryzyku powikłań grypy,[59-64] w tym u osób w wieku >=65 lat.[57,61] Na podstawie kart wypisowych obliczono, że w latach 1979–2001 w całych Stanach Zjednoczonych hospitalizacji z powodu zachorowania na grypę wymagało 108 dzieci w wieku <5 lat na 100 000 osobo-lat.[7] Wyniki niedawnych badań populacyjnych, w których oceniano częstość hospitalizacji związanych z grypą potwierdzoną laboratoryjnie, dały wartości zbliżone lub większe od badań, w których analizowano wypisy pacjentów znajdujące się w dokumentacji medycznej.[54,56,63,65,66]
Ryzyko hospitalizacji dzieci chorych na potwierdzoną laboratoryjnie grypę zmniejsza się z wiekiem i w ciągu roku wynosi od 240–720/100 000 dzieci w wieku <6 miesięcy do około 20/100 000 dzieci w wieku 2–5 lat.[54] Szacunkowe ryzyko hospitalizacji dzieci w wieku <5 lat chorych na choroby związane z dużym ryzykiem powikłań grypy wynosi około 250–500/100 000.[45,47,67]
Zgony związane z grypą występują u dzieci rzadko. Szacuje się, że w latach 90. XX stulecia w związku zachorowaniem na grypę co roku umierało średnio do 92 dzieci w wieku <5 lat (0,4/100 000 osób) oraz 32 651 (98,3/100 000) osób w wieku >=65 lat.[6] Spośród 153 zgonów dzieci związanych z potwierdzoną laboratoryjnie grypą, zgłoszonych w sezonie epidemicznym 2003–2004, 96 (63%) dotyczyło dzieci w wieku <5 lat, a 61 (40%) dzieci w wieku <2 lat. Spośród 149 zmarłych dzieci, których dotyczyły dane na temat ewentualnych chorób współistniejących, u 100 (67%) nie stwierdzono żadnej choroby, które w tym czasie stanowiły wskazanie do szczepienia.[68] W Kalifornii w sezonach 2003–2004 i 2004–2005 u 51% dzieci chorych na potwierdzoną laboratoryjnie grypę, które zmarły, i u 40% tych, które wymagały przyjęcia na oddział intensywnej opieki medycznej, nie występowały choroby współistniejące.[69] Dane te wskazują, że chociaż zgony częściej dotyczą dzieci z czynnikami ryzyka powikłań grypy, to u większości zmarłych dzieci ze wszystkich grup wiekowych nie stwierdzono znanych chorób zwiększających ryzyko powikłań grypy. Od 2004 roku w całych Stanach Zjednoczonych zgłasza się przypadki zgonów związanych z laboratoryjnie potwierdzonym zakażeniem wirusem grypy wśród dzieci (czyli osób <18. rż.). Liczba zgonów dzieci zgłaszanych rocznie do CDC w wynosiła od 47 w sezonie 2004–2005 do 88 w sezonie 2007–2008.[70] W okresie od kwietnia 2009 roku do marca 2010 roku w Stanach Zjednoczonych do CDC zgłoszono ponad 300 zgonów związanych z laboratoryjnie potwierdzonym zakażeniem wirusem H1N1 2009 wśród dzieci w większości obciążonych co najmniej jedną chorobą współistniejącą. Szacuje się, że doszło do ponad 1000 zgonów[71] (CDC, dane niepublikowane, 2010).
Odnotowano zwiększenie liczby zgonów dzieci spowodowanych równoczesnym zakażeniem wirusem grypy i Staphylococcus aureus, zwłaszcza szczepami opornymi na metycylinę (methicillin resistant S. aureus – MRSA).[38,72] Nasiliła się również ciężkość przebiegu tego równoczesnego zakażenia w porównaniu z zakażeniem samym wirusem grypy.[73] Nie ustalono przyczyny tego zjawiska, ale może ono odzwierciedlać coraz częstsze występowanie w populacji ogólnej kolonizacji szczepami MRSA, z których niektóre posiadają pewne czynniki zjadliwości.[74,75]
Dorośli
W porównaniu z dziećmi w wieku <5 lat, osobami
dorosłymi w wieku >=65 lat, kobietami w ciąży
oraz chorymi na choroby przewlekłe, u zdrowych
młodych dorosłych grypa sezonowa zwykle nie
ma ciężkiego przebiegu i rzadko jest przyczyną
hospitalizacji. Jednak u zdrowych dorosłych w wieku 19–49 lat zachorowanie na grypę jest
ważnym powodem zgłaszania się do przychodni
oraz nieobecności w pracy. Oddziaływanie grypy
istotnie zależy od sezonu, co utrudnia ocenę liczby
zachorowań w tej populacji. W większości badań
roczna zachorowalność wynosiła 2–10%; szacuje
się również, że jedno zachorowanie na grypę wiąże
się z opuszczeniem 0,6–2,5 dnia pracy.[76-80] W jednej z analiz ekonomicznych oceniono, że średnie
roczne obciążenie grypą sezonową u dorosłych w wieku 18–49 lat, nieobarczonych większym
ryzykiem powikłań grypy, to między innymi około 5 milionów zachorowań, 2,4 miliona wizyt w przychodniach,
32 000 hospitalizacji i 680 zgonów.[78]
Ryzyko hospitalizacji w sezonie epidemicznym
grypy zwiększa się znacznie u osób w wieku
>=65 lat. W retrospektywnej analizie dokumentacji
medycznej z lat 1996–2000 obliczono, że w sezonie
epidemicznym u osób w wieku >=65 lat z chorobami
współistniejącymi zwiększającymi ryzyko
powikłań grypy (tzn. >=1 choroba wymieniana jako
wskazanie do szczepienia) częstość hospitalizacji
związanych z grypą wynosiła około 560/100 000, w porównaniu z około 190/100 000 zdrowych osób w wieku podeszłym. Osoby w wieku 50–64 lat z chorobami współistniejącymi są także obarczone
znacznie większym ryzykiem hospitalizacji w sezonie epidemicznym niż zdrowe osoby w wieku
50–64 lat. Nie wykazano natomiast zwiększenia
ryzyka hospitalizacji związanej z grypą w zależności od chorób współistniejących w grupie zdrowych
dorosłych w wieku 50–64 lat.[44]
Każdego roku w miesiącach zimowych grypa
znacznie zwiększa liczbę zgonów związanych z zachorowaniem na zapalenie płuc i grypę. W latach 1976–2001 szacunkowo średnio 32 651
(90%) zgonów związanych z grypą dotyczyło dorosłych w wieku >=65 lat.[6]
Ryzyko zgonu związanego z grypą było największe u osób w najstarszym wieku, a u osób >=85. roku życia prawdopodobieństwo zgonu związanego z grypą było 16-krotnie większe niż u osób w wieku 65–69 lat.[6] W porównaniu ze zwykłymi sezonami grypy, podczas pandemii grypy H1N1 2009 w grupie większego ryzyka powikłań zakażenia znalazły się dorosłe osoby w wieku <65 lat[23,81,82], zwłaszcza 50–64 lat, u których występowały choroby zwiększające ryzyko powikłań. W sezonie 2009–2010 liczba hospitalizacji w zależności od wieku różniła się od typowych modeli dla grypy sezonowej, przy większej liczbie hospitalizacji w młodszych grupach wiekowych i mniejszej wśród osób >=65 lat (ryc. 1). Liczba hospitalizacji w różnych populacjach =<65 lat była większa od liczb obserwowanych w każdym wcześniejszym sezonie grypy.[26] W około 1/3 przypadków zachorowań zakończonych zgonem na podstawie badań sekcyjnych stwierdzono zapalenie płuc z cechami jednoczesnego inwazyjnego zakażenia bakteryjnego.[83] W 1 badaniu obejmującym dorosłych chorych w bardzo ciężkim stanie, wymagających wentylacji mechanicznej, wykazano, że zapalenie płuc o etiologii Streptococcus pneumoniae w momencie przyjęcia do szpitala było niezależnym czynnikiem ryzyka zgonu.[84] Poza tym w niektórych badaniach czynnikiem ryzyka hospitalizacji i zgonu wydawała się otyłość (wskaźnik masy ciała [body-mass index – BMI] >=30), a zwłaszcza otyłość chorobliwa (BMI >=40).[23,24,81,85,86] Konieczne są dalsze badania w celu ustalenia, czy otyłość jest czynnikiem ryzyka swoistym dla wirusów podobnych do wirusów H1N1 2009, czy też wcześniej nierozpoznanym czynnikiem ryzyka powikłań grypy wywołanej przez inne szczepy. Inne cechy epidemiologiczne pandemii z 2009 roku wywołanej wirusem H1N1 zwracają uwagę na rasowe i etniczne różnice w ryzyku powikłań grypy u osób dorosłych, obejmujące większą liczbę hospitalizacji w przypadku rasy czarnej oraz niewspółmiernie większą częstość zgonów wśród Indian amerykańskich i rdzennych mieszkańców Alaski, a także rdzennej ludności w innych krajach.[87-91] Przyczyną tych dysproporcji może być między innymi częstsze występowanie chorób predysponujących do powikłań lub różnice w opiece medycznej w tych grupach rasowych i etnicznych.[92,93] U osób zakażonych ludzkim wirusem nabytego niedoboru odporności (HIV) objawy grypy utrzymują się dłużej, a choroba ma cięższy przebieg.[94-98] W retrospektywnym badaniu obejmującym kobiety w młodszym i średnim wieku zakwalifikowane do programu Medicaid w stanie Tennessee w Stanach Zjednoczonych stwierdzono, że ryzyko hospitalizacji z powodu chorób serca lub płuc u kobiet zakażonych HIV było większe w sezonie krążenia wirusów grypy w populacji niż przed epidemią lub po jej zakończeniu. Ryzyko hospitalizacji było większe u kobiet zakażonych HIV niż u kobiet z innymi chorobami współistniejącymi.[99] W innym badaniu ryzyko zgonu związanego z grypą u chorych z zespołem nabytego niedoboru odporności (AIDS) obliczono na 94–146/100 000, w porównaniu z populacją ogólną, w której wynosiło ono 0,9–1,0/100 000 u osób w wieku 25–54 lat i 64–70/100 000 u osób w wieku >=65 lat.[100]
Związane z zachorowaniem na grypę zgony kobiet ciężarnych opisywano podczas pandemii w latach 1918–1919, 1957–1958 i 2009–2010.[48,101-106] Podczas pandemii w sezonie 2009–2010 obserwowano również ciężkie zakażenia w okresie poporodowym (tj. u kobiet, które urodziły dziecko w ciągu dwóch wcześniejszych tygodni).[48,107,108] Ponadto opisy przypadków i szereg badań epidemiologicznych wskazują, że ciąża zwiększa ryzyko powikłań grypy u matki.[109-114] W większości badań, w których próbowano ocenić wpływ grypy na kobiety w ciąży, oceniano hospitalizacje z powodu chorób układu oddechowego w sezonach epidemicznych grypy, a nie hospitalizacje z powodu grypy potwierdzonej laboratoryjnie. W sezonie epidemicznym grypy kobiety w ciąży znacznie częściej zgłaszają się do lekarzy z powodu chorób układu oddechowego niż kobiety niebędące w ciąży.[115] Kobiety ciężarne hospitalizowane w sezonie epidemicznym z powodu chorób układu oddechowego wymagają dłuższego pobytu w szpitalu niż hospitalizowane kobiety ciężarne bez chorób układu oddechowego. Częstość hospitalizacji z powodu chorób układu oddechowego była 2-krotnie większa w sezonie epidemicznym grypy.[116] W retrospektywnym badaniu kohortowym obejmującym około 134 000 kobiet ciężarnych, które przeprowadzono w Nowej Szkocji w latach 1990–2002, porównywano dokumentację medyczną kobiet ciężarnych z danymi tych samych kobiet w ciągu roku przed zajściem w ciążę. 0,4% ciężarnych hospitalizowano, a 25% zgłosiło się do lekarza z powodu choroby układu oddechowego. Częstość hospitalizacji kobiet będących w trzecim trymestrze ciąży była w sezonie epidemicznym 5-krotnie większa niż w sezonie epidemicznym w roku poprzedzającym zajście w ciążę i ponad 2-krotnie większa niż poza sezonem epidemicznym. Dodatkowego przyjęcia do szpitala w trzecim trymestrze ciąży wymagało 1210 na 100 000 kobiet ciężarnych z chorobami współistniejącymi i 68 na 100 000 kobiet bez chorób współistniejących.[117] W 1 badaniu nie stwierdzono niekorzystnych zdarzeń w okresie okołoporodowym ani powikłań porodu u kobiet ciężarnych hospitalizowanych z powodu chorób układu oddechowego,[118] w innym badaniu częściej obserwowano natomiast powikłania porodów, takie jak stan zagrożenia płodu, przedwczesny poród i cesarskie cięcie. U noworodków urodzonych przez kobiety, które w okresie ciąży przebyły laboratoryjnie potwierdzoną grypę, nie stwierdzano jednak częściej małej urodzeniowej masy ciała, wad wrodzonych ani zmniejszonej liczby punktów w skali Apgar niż u dzieci urodzonych przez kobiety niezakażone.[109,119]
W opisie serii przypadków przeprowadzonym podczas pandemii grypy H1N1 2009 odnotowano 56 zgonów wśród 280 kobiet przyjętych na oddziały intensywnej terapii.[120] 36 (64%) zgonów nastąpiło w trzecim trymestrze ciąży. Większe prawdopodobieństwo hospitalizacji na oddziale intensywnej terapii stwierdzono u kobiet w ciąży, u których leczenie rozpoczęto po upływie ponad 4 dni od wystąpienia objawów, w porównaniu z kobietami, które leczenie otrzymały w ciągu 2 dni (odpowiednio: 57 i 9%, ryzyko względne [RR]: 6,0 [95% CI: 3,5–10,6]).[120]
Metody zapobiegania zachorowaniom na grypę
Coroczne szczepienia są najskuteczniejszą strategią zapobiegania zachorowaniom na grypę. Strategie koncentrujące się na rutynowych szczepieniach osób obciążonych dużym ryzykiem powikłań grypy są zalecane od dawna, ale w większości tych grup ryzyka odsetek zaszczepionych osób jest nadal mały. Rutynowe szczepienia określonych osób (np. dzieci, osób kontaktujących się z pacjentami z grup dużego ryzyka powikłań grypy, personelu placówek ochrony zdrowia), które stanowią źródło zakażenia, mogą zapewnić dodatkową ochronę osób obciążonych dużym ryzykiem powikłań grypy i zmniejszyć ogólne obciążenie systemu ochrony zdrowia związane z grypą. Należy jednak zwiększyć odsetek zaszczepionych osób z tej grupy, zanim będzie można wiarygodnie ocenić rzeczywisty wpływ tej strategii na szerzenie się zakażenia w populacji. W ramach profilaktyki farmakologicznej można stosować leki przeciwwirusowe; wykazano, że zapobiegają one zachorowaniom na grypę. Leki te podawane w celach terapeutycznych zmniejszają ciężkość przebiegu i skracają czas trwania choroby, zwłaszcza jeżeli leczenie zostanie wdrożone w ciągu pierwszych 48 godzin od pojawienia się objawów grypy. Stosowanie leków przeciwwirusowych w profilaktyce i leczeniu grypy stanowi jedynie uzupełnienie szczepień, a profilaktyka pierwotna realizowana poprzez coroczne szczepienia jest najskuteczniejszą i najwydajniejszą strategią postępowania. Mimo jasno sformułowanych zaleceń leki przeciwwirusowe u osób hospitalizowanych z powodu podejrzenia grypy nadal nie są powszechnie stosowane.[121]
Stwierdzono, że po umyciu rąk rzadziej wykrywa się na nich wirusa grypy A oraz że taka czynność zmniejsza ogólną zapadalność na infekcyjne zapalenia układu oddechowego[121-124] Interwencje niefarmakologiczne (np. zalecenie częstego mycia rąk i zabiegi higieniczne mające na celu zmniejszenie emisji wirusów z dróg oddechowych do otoczenia) są racjonalne i niedrogie. Jednak jak dotąd nie wyjaśniono dokładnie, w jakim stopniu utrzymywanie higieny, na przykład mycie rąk, wpływa na przenoszenie wirusa grypy i takiego postępowania nie należy zalecać w zastępstwie lub jako alternatywę dla swoistych środków zapobiegawczych, takich jak szczepienia. Niewiele jest danych pozwalających ocenić skuteczność interwencji na poziomie zdrowia publicznego (np. zamykanie szkół, unikanie zgromadzeń czy stosowanie masek na twarz) w ograniczaniu szerzenia się grypy podczas typowych sezonowych epidemii.[125-127] W badaniu interwencyjnym obejmującym grupę studentów stwierdzono, że osoby mieszkające w akademikach, które poproszono o stosowanie masek chirurgicznych i alkoholowego preparatu odkażającego do rąk oraz które przeszkolono w zakresie używania masek i higieny rąk w okresie sezonu grypy, istotnie rzadziej zapadały na chorobę grypopodobną w porównaniu ze studentami, którym nie zalecono żadnych działań. Jednak ani samo noszenie maski, ani samo odkażanie rąk nie miało statystycznie istotnego wpływu na zmniejszenie częstości choroby grypopodobnej.[128] Podczas pandemii w 2009 roku w jednym z badań wykazano, że omówienie metod zapobiegania transmisji wirusa z domownikami, wśród których zidentyfikowano przypadek grypy, wiązało się z istotnie mniejszą liczbą dodatkowych zakażeń. Sugeruje to, że edukacja może być skutecznym sposobem zmniejszenia wtórnej transmisji.[129] Według ograniczonych danych, przenoszenie grypy sezonowej lub choroby grypopodobnej wśród domowników można zredukować poprzez noszenie masek chirurgicznych lub mycie rąk w okresie występowania początkowych objawów u pierwszego chorego domownika.[130,131] Jednak, jako metody ograniczania transmisji grypy, takie działania mogą uzupełniać szczepienia lub zapewniać pewną ochronę w przypadku braku szczepionki.[130-132]
Skuteczność, efektywność i bezpieczeństwo szczepionek przeciwko grypie
Jakość badań oceniających skuteczność i bezpieczeństwo szczepionek
Skuteczność (tzn. zapobieganie zachorowaniom u zaszczepionych uczestników badań klinicznych z grupą kontrolną) i efektywność (tzn. zapobieganie zachorowaniom w populacji zaszczepionej w rutynowej praktyce) inaktywowanej szczepionki przeciwko grypie zależy częściowo od wieku i stanu układu immunologicznego osoby zaszczepionej, od podobieństwa antygenowego wirusów znajdujących się w szczepionce do wirusów krążących w populacji (p. rozdz. "Efektywność szczepionki przeciwko grypie w przypadku różnic pomiędzy szczepami krążącymi a występującymi w szczepionce"), a także od rodzaju ocenianych punktów końcowych i zmiennych. Badania oceniające skuteczność i efektywność szczepionek mają różne punkty końcowe, takie jak zapobieganie ostrym chorobom układu oddechowego wymagającym porady lekarskiej (medically attended acute respiratory illness – MAARI), zapobieganie potwierdzonemu wirusologicznie zachorowaniu na grypę, zapobieganie hospitalizacjom lub zgonom spowodowanym grypą lub zapaleniem płuc, lub zapobieganie serokonwersji. Skuteczność i efektywność szczepionki w zapobieganiu bardziej swoistym punktom końcowym, takim jak laboratoryjnie potwierdzone zachorowanie na grypę, będzie większa niż w przypadku oceny parametrów mniej ściśle zdefiniowanych (nieswoistych), takich jak MAARI, niekiedy wywoływanych zakażeniem innymi drobnoustrojami chorobotwórczymi, którym nie można zapobiegać poprzez szczepienie przeciwko grypie.[133] Badania obserwacyjne porównujące mniej ściśle zdefiniowane punkty końcowe mogą być obarczone ryzykiem błędu, które trudno jest skorygować podczas analiz. Na przykład błąd w badaniu obserwacyjnym oceniającym, czy szczepienie przeciwko grypie zmniejsza umieralność, może być związany z większym prawdopodobieństwem zaszczepienia zdrowszych uczestników badania.134,135 Badania z randomizacją oceniające potwierdzone laboratoryjnie zachorowania na grypę są najbardziej przekonującym dowodem skuteczności szczepionki, ale ze względów etycznych nie można ich przeprowadzić w grupach osób, u których zalecane jest coroczne szczepienie.
Skład szczepionek przeciwko grypie
(...) Szczepionki TIV zawierają szczepy wirusów równoważne antygenowo szczepom zalecanym w danym roku: jeden podtyp H3N2 wirusa grypy A, jeden podtyp H1N1 wirusa grypy A i jeden szczep wirusa grypy B. Co roku na podstawie rejestracji krążenia wirusów grypy na całym świecie oraz stwierdzonego powstawania i rozprzestrzeniania się nowych szczepów może nastąpić zmiana przynajmniej jednego szczepu wirusa zawartego w szczepionce. W sezonie 2010–2011 trójwalentna szczepionka będzie zawierać szczepy spokrewnione z wirusem A/California/7/2009 (H1N1), A/Perth/16/2009 (H3N2) i B/Brisbane/60/2008. Antygen szczepu spokrewnionego z wirusem A/California/7/2009 (H1N1) uzyskano z wirusa pandemicznego A (H1N1) 2009 i jest to ten sam antygen, jaki zastosowano w monowalentnych szczepionkach przeciwko grypie pandemicznej A (H1N1) 2009. Antygen szczepu spokrewnionego z wirusem A/Perth/16/2009 (H3N2) różni się od antygenu szczepu spokrewnionego z wirusem H3N2 obecnym w szczepionce przeciwko grypie sezonowej na sezon 2009–2010, przeznaczonej dla krajów półkuli północnej. Nie zmieniono szczepu wirusa grypy B, jest to nadal B/Brisbane/16/2008, obecny w szczepionce przeznaczonej na sezon epidemiczny 2009–2010 dla krajów półkuli północnej.[136] Wirusy stosowane w produkcji (...) obecnie zarejestrowanych szczepionek są namnażane na zarodkach kurzych. W celu uzyskania optymalnej ochrony przed zakażeniem wirusami grypy szczepionkę podaje się co roku (tab. 1). Żadna ze szczepionek zarejestrowanych w Stanach Zjednoczonych nie zawiera adjuwantu. (...)
Tabela 1. Zasady stosowania trójwalentnych inaktywowanych szczepionek przeciwko grypie sezonowej
| Cecha | Zasady stosowania |
| sposób podania | wstrzyknięcie domięśniowe |
| rodzaj szczepionki | wirus niezakaźny (tzn. inaktywowany) |
| liczba szczepów wirusa zawartych w szczepionce | 3 (2 grypy A i 1 grypy B) |
| aktualizacja szczepów wirusów zawartych w szczepionce | corocznie |
| częstotliwość podawania szczepionki | coroczniea |
| zarejestrowany wiek szczepienia | >=6. mż.b |
| minimalny odstęp między 2 dawkami w sezonie zalecanymi dla dzieci w wieku od 6 miesięcy do ukończenia 9 rż., które są szczepione przeciwko grypie pierwszy raz | 4 tygodnie |
| możliwość stosowania u osób z grup ryzyka powikłań grypyc | tak |
| możliwość stosowania u dzieci chorujących na astmę lub dzieci w wieku 2–4 lat, u których w poprzednim roku wystąpił epizod świszczącego oddechu | tak |
| możliwość stosowania u bliskich krewnych lub osób z bliskiego kontaktu z pacjentami z niedoborami odporności niewymagającymi szczególnej ochrony przed zakażeniami | tak |
| możliwość stosowania u bliskich krewnych lub osób z bliskiego kontaktu z pacjentami z niedoborami odporności wymagającymi szczególnej ochrony przed zakażeniami (np. biorca przeszczepu hematopoetycznych komórek macierzystych) | tak |
| możliwość stosowania u bliskich krewnych lub osób z bliskiego kontaktu z pacjentami należącymi do grup większego ryzyka (w tym z kobietami w ciąży), lecz bez poważnych niedoborów odporności | tak |
| możliwość jednoczesnego podawania z innymi szczepionkami | takd |
| jeżeli nie jest podawana jednocześnie, może być zastosowana wcześniej niż 4 tygodnie po podaniu "żywej" szczepionki | tak |
| jeżeli nie jest podawana jednocześnie, może być zastosowana wcześniej niż 4 tygodnie po podaniu innej, "nieżywej" szczepionki | tak |
| a Dzieci od 6. mż. do ukończenia 9. rż., które nigdy nie były szczepione przeciwko grypie sezonowej lub którym nie podano przynajmniej 1 dawki monowalentnej szczepionki przeciwko grypie pandemicznej A (H1N1) 2009, powinny otrzymać 2 dawki szczepionki w odstępie co najmniej 4 tygodni. Dzieci od 6. mż. do ukończenia 9. rż. zaszczepione po raz pierwszy w sezonie 2009–2010 tylko 1 dawką preparatu przeciwko grypie sezonowej, w kolejnym roku powinny otrzymać 2 dawki w odstępie
co najmniej 4 tygodni.
b Warunki rejestracji zależą od preparatu. Prowadzący szczepienia powinni się zapoznać z aktualnymi informacjami dotyczącymi podawania szczepionek przeciwko grypie w sezonie epidemicznym 2010–2011, zawartymi w charakterystyce produktu leczniczego. c Osoby z grupy dużego ryzyka powikłań grypy ze względu na choroby współistniejące to dorośli i dzieci, u których występują: przewlekłe choroby układu oddechowego (w tym astma) lub sercowo-naczyniowego (z wyjątkiem nadciśnienia tętniczego), nerek, wątroby, układu nerwowego, hematologiczne, metaboliczne (w tym cukrzyca), z upośledzeniem odporności (w tym z immunosupresją wywołaną lekami lub ludzkim wirusem niedoboru odporności), kobiety będące w ciąży lub które zajdą w ciążę w sezonie zachorowań na grypę, osoby w wieku od 6 miesięcy do 18 lat leczone przewlekle kwasem acetylosalicylowym (ryzyko wystąpienia zespołu Reye'a w przypadku zakażenia "dzikim" wirusem grypy); pensjonariusze domów spokojnej starości oraz innych placówek przewlekłej opieki pielęgnacyjnej i medycznej, w których przebywają osoby przewlekle chore. d Jednoczesne (tzn. podczas tej samej wizyty, ale w różne miejsca – przyp. red.) podawanie inaktywowanej szczepionki przeciwko grypie systematycznie oceniano jedynie u dorosłych razem z podawaniem polisacharydowej szczepionki przeciwko pneumokokom lub szczepionki przeciwko półpaścowi. | |
TIV zawiera zabite wirusy, wobec czego nie może spowodować zachorowania na grypę. (...) Szczepionkę podaje się domięśniowo w postaci wstrzyknięcia. Preparaty TIV zostały zarejestrowane do stosowania u osób w wieku >=6 miesięcy, zarówno zdrowych, jak i z chorobami przewlekłymi (tab. 1). W trakcie produkcji TIV wirusy szczepionkowe pozbawia się zakaźności (tzn. inaktywuje [zabija]).[8] W Stanach Zjednoczonych (także w Polsce – przyp. red.) dostępne są jedynie szczepionki TIV zawierające elementy struktury wewnętrznej wirusa lub oczyszczone antygeny powierzchniowe (określane często odpowiednio jako typu "split" [zawierające rozszczepiony wirion] lub podjednostkowe). Standardowy preparat TIV zawiera 7,5 µg antygenu HA każdego z trzech szczepów szczepionkowych (dla dzieci <36. mż.) lub 15 µg (dla osób >=36. mż.) na każdy szczep (czyli w sumie 22,5 µg lub 45 µg HA). (...)
Wskaźniki poszczepiennej ochrony przed zakażeniem
Wskaźnikami immunologicznymi poszczepiennej ochrony przed zakażeniem wirusem grypy są miana przeciwciał przeciwko hemaglutyninie i przeciwciał neutralizujących wirusa w surowicy.[32,137] Zwiększenie miana przeciwciał po szczepieniu zmniejsza ryzyko choroby wywołanej szczepami podobnymi antygenowo do szczepów danego typu lub podtypu obecnych w szczepionce.[138-141] U większości zdrowych dzieci i dorosłych miana przeciwciał po szczepieniu są duże.[139,142] Wskaźniki immunologiczne, takie jak co najmniej minimalne ochronne miano przeciwciał (zwykle definiowane jako miano hemaglutynacji 1:32 lub 1:40) dobrze korelują z odpornością na poziomie populacji, jednak ich znaczenie dla indywidualnego pacjenta nie jest dobrze poznane. (...)
Czas utrzymywania się odporności
W większości sezonów epidemicznych zmienia się zalecany skład szczepionek przeciwko grypie. Co roku zastępuje się co najmniej jeden szczep wirusa szczepionkowego w celu zapewnienia lepszej ochrony przed dzikimi szczepami, które prawdopodobnie będą krążyć w danym sezonie. Jednak dane z badań klinicznych sugerują, że ochrona przed wirusami podobnymi antygenowo do tych zawartych w szczepionce utrzymuje się przez co najmniej 6–8 miesięcy. Po 3 latach od podania szczepionki zawierającej szczep A/Hong Kong/68 efektywność szczepienia w zapobieganiu grypie wywołanej przez wirusa A/Hong Kong/68 wynosiła 67%.[145] W badaniach z randomizacją obejmujących zdrowych studentów szczepienie TIV zapewniało w pierwszym roku 92% i 100% skuteczność w zapobieganiu zachorowaniom na grypę wywołaną odpowiednio przez wirusa H3N2 i H1N1 oraz zmniejszenie o 68% częstości zachorowań na grypę H1N1 w drugim roku (w którym wśród krążących wirusów dominował H1N1) bez ponownego podawania szczepionki.[146] W podobnym badaniu przeprowadzonym na grupie młodych dorosłych w sezonie 1986–1987, preparat TIV zmniejszył zapadalność na grypę A (H1N1) o 75% w pierwszym roku, H3N2 o 45% w drugim roku i H1N1 o 61% w trzecim roku od szczepienia. 146 Przez ponad rok od podania "żywej" szczepionki przeciwko grypie (LAIV) u dzieci wykrywa się powstałe po szczepieniu przeciwciała przeciwko grypie w surowicy i błonie śluzowej nosa (IgA).[147]
W porównaniu z młodymi zdrowymi dorosłymi, osoby w wieku >=65 lat zwykle wykazują mniejszą odpowiedź immunologiczną na szczepienie przeciwko grypie, co sugeruje, że odporność może się utrzymywać krócej (chociaż nadal przekracza jeden sezon epidemiczny grypy).[149,150] Jednak na podstawie przeglądu opublikowanych badań wywnioskowano, że brak jest danych jednoznacznie wskazujących na szybsze zanikanie odporności w starszym wieku,[151] a dodatkowe dawki szczepionki podane w trakcie tego samego sezonu nie zwiększają produkcji przeciwciał. W 1 badaniu stwierdzono, że w ciągu roku od zaszczepienia stężenie przeciwciał przeciwko grypie zmniejszyło się we wszystkich grupach wiekowych, w tym również u osób w wieku >=65 lat. Jednak w każdej grupie wiekowej odsetek osób, u których utrzymało się ochronne stężenie przeciwciał w surowicy, był nadal większy od standardów przyjętych w procedurach rejestracji szczepionek przeciwko sezonowej grypie A (H1N1) i grypie A (H3N2) dla wszystkich grup wiekowych. W badaniu tym stężenie przeciwciał przeciwko grypie B zmniejszało się szybciej, lecz we wszystkich grupach wiekowych przez co najmniej 6 miesięcy nadal znacznie przekraczało ono wartości progowe podane w wymaganiach rejestracyjnych.[152] Nie ma danych wskazujących, że częstość zakażenia u osób zaszczepionych jest większa, jeżeli otrzymały one szczepionkę na początku sezonu. Zakażenie u zaszczepionych osób starszych może raczej wynikać z osłabienia zdolności do wytworzenia odpowiedzi na szczepienie w zależności od wieku niż z krótszego czasu utrzymywania się odporności.
Immunogenność, skuteczność i efektywność inaktywowanej szczepionki przeciwko grypie
Dzieci
Dzieci w wieku >=6 miesięcy po otrzymaniu zalecanej
liczby dawek szczepionki przeciwko grypie zwykle
uzyskują ochronne miana przeciwciał przeciwko
określonym szczepom wirusów grypy.[137,142,153-157] W badaniach dotyczących immunogenności
monowalentnej szczepionki przeciwko grypie A (H1N1)
2009 wykazano, że u ponad 90% dzieci w wieku
>=9 lat po podaniu pojedynczej dawki uzyskano
ochronne stężenie przeciwciał przeciwko wirusowi
grypy. Wyniki oceny odpowiedzi po podaniu pojedynczej
dawki tej szczepionki u małych dzieci były
niespójne, przy czym odsetek dzieci w wieku 6–35
miesięcy, które odpowiedziały na to szczepienie
wytworzeniem ochronnego stężenia przeciwciał,
wynosił 20%. Jednak we wszystkich badaniach u 80–95% zaszczepionych niemowląt, dzieci i młodzieży
uzyskano ochronne stężenie przeciwciał
po podaniu 2 dawek szczepionki przeciwko wirusowi
grypy H1N1 2009[158-160] (National Institutes
of Health, dane niepublikowane, 2010).
Przeważnie w każdym sezonie zmienia się, w stosunku do poprzedniego sezonu, co najmniej jeden antygen wchodzący w skład szczepionki. W kolejnych latach, kiedy następuje zmiana składu szczepionek, u dzieci do ukończenia 9. roku życia, które otrzymały tylko 1 dawkę szczepionki podczas pierwszego szczepienia przeciwko grypie, szansa na wytworzenie ochronnego miana swoistych przeciwciał po podaniu tylko 1 dawki w kolejnym (drugim) roku immunizacji jest mniejsza niż u tych, którym podczas rozpoczynania szczepienia podano 2 dawki.[161-163] Jeśli antygeny zawarte w szczepionce nie ulegają wymianie w kolejnym sezonie epidemicznym, podanie dzieciom w wieku 6–23 miesięcy jednej dawki szczepionki wiosną, a drugiej jesienią powoduje wytworzenie podobnej odpowiedzi serologicznej jak podanie 2 dawek w okresie jesiennym.[164] Jednak w badaniu przeprowadzonym w sezonie, gdy antygeny szczepionki nie zmieniły się w stosunku do poprzedniego sezonu, stwierdzono 62% efektywność wobec choroby grypopodobnej u zdrowych dzieci, które otrzymały tylko 1 dawkę w poprzednim sezonie i tylko 1 dawkę w sezonie objętym badaniem, w porównaniu z 82% efektywnością u dzieci, które zaszczepiono 2 dawkami w odstępie >4 tygodni w sezonie objętym badaniem.[165]
Odpowiedź serologiczna u dzieci z grup zwiększonego ryzyka powikłań grypy (np. z chorobami przewlekłymi) może być słabsza niż stwierdzana zwykle u dzieci zdrowych.[166,167] Zauważono jednak, że u dzieci chorych na astmę miana przeciwciał po szczepieniu były podobne jak u dzieci zdrowych i nie uległy znacznym zmianom w okresie zaostrzeń astmy wymagających krótkotrwałego leczenia prednizonem.[168] Badania nad efektywnością szczepionki wykazały również, że odpowiednią ochronę w pierwszym sezonie, w którym szczepione są młodsze dzieci, zapewnia podanie 2 dawek. Wśród dzieci w wieku <5 lat, które nigdy wcześniej nie otrzymały szczepionki lub które otrzymały tylko 1 dawkę w pierwszym roku szczepienia, efektywność szczepienia jest mniejsza w porównaniu z dziećmi, które otrzymały 2 dawki podczas pierwszorazowej immunizacji. W 2 dużych badaniach retrospektywnych, obejmujących dzieci młodsze zaszczepione tylko 1 dawką TIV, w pierwszym roku szczepienia nie zaobserwowano zmniejszenia częstości zgłaszania się do lekarza z powodu choroby grypopodobnej w porównaniu z dziećmi nieszczepionymi.[165,169] Podobne wyniki uzyskano w badaniu kliniczno-kontrolnym obejmującym dzieci w wieku 6–59 miesięcy, w którym punktem końcowym była grypa potwierdzona laboratoryjnie.[170] Wyniki te, wraz z danymi dotyczącymi immunogenności wskazującymi, że produkcja swoistych przeciwciał jest istotnie większa, jeżeli młodsze dzieci otrzymają 2 dawki szczepionki, stanowią uzasadnienie zalecenia, aby wszystkim dzieciom do ukończenia 9. roku życia szczepionym po raz pierwszy podawać 2 dawki szczepionki w odstępie co najmniej 4 tygodni.
Ocena efektywności szczepienia w rutynowej praktyce i skuteczności w badaniach klinicznych u dzieci w wieku >=6 miesięcy różni się w zależności od sezonu i metodyki badania. W badaniu z randomizacją, przeprowadzonym w Stanach Zjednoczonych podczas 5 sezonów epidemicznych grypy (1985–1990), obejmującym dzieci w wieku 1–15 lat, coroczne szczepienia doprowadziły do znacznego (o 77–91%) zmniejszenia zachorowalności na potwierdzoną laboratoryjnie grypę.[139] W małym, trwającym rok badaniu z grupą kontrolną otrzymującą placebo skuteczność szczepionki w zapobieganiu potwierdzonym laboratoryjnie zachorowaniom na grypę wyniosła 56% u zdrowych dzieci w wieku 3–9 lat i 100% u zdrowych dzieci i młodzieży w wieku 10–18 lat.[171] W badaniu z randomizacją, przeprowadzonym metodą podwójnie ślepej próby z placebo podczas dwóch sezonów epidemicznych grypy, obejmującym dzieci w wieku 6–24 miesięcy, stwierdzono 66% skuteczność w zapobieganiu grypie potwierdzonej hodowlą wirusa w sezonie 1999–2000, lecz nie zaobserwowano istotnie mniejszej liczby takich przypadków w sezonie 2000–2001.[172] Badanie kliniczno-kontrolne przeprowadzone w sezonie epidemicznym 2003–2004 wykazało 49% skuteczność szczepionki w zapobieganiu grypie potwierdzonej laboratoryjnie.[170] W innym badaniu obserwacyjnym, obejmującym dzieci w wieku 6–59 miesięcy chore na grypę potwierdzoną laboratoryjnie, stwierdzono, że skuteczność szczepionki, w porównaniu z dziećmi z ujemnym wynikiem badania w kierunku zakażenia wirusem grypy, wynosiła 44% w sezonie epidemicznym 2003–2004 i 57% w sezonie 2004–2005.[173] W żadnym z tych badań niepełne pierwszorazowe szczepienie (tj. tylko 1 dawka u dziecka szczepionego po raz pierwszy) nie zapewniało ochrony. Z kolei w retrospektywnym badaniu obejmującym około 30 000 dzieci w wieku od 6 miesięcy do 8 lat, przeprowadzonym w sezonie epidemicznym 2003–2004, w którym szczepy antygenów w szczepionkach nie były optymalnie dopasowane do szczepów krążących w populacji, skuteczność szczepienia w profilaktyce zapalenia płuc rozpoznanego na podstawie obrazu klinicznego lub grypy wymagającej porady lekarskiej (bez laboratoryjnego potwierdzenia zakażenia) wyniosła 51% u dzieci, u których przeprowadzono pełny cykl szczepień, i 49% u około 5000 dzieci w wieku 6–23 miesięcy.[169] W innym retrospektywnym badaniu kohortowym, obejmującym podobną liczbę pacjentów, przeprowadzonym w tym samym sezonie epidemicznym w Denver, ale ograniczonym do zdrowych dzieci w wieku 6–21 miesięcy, efektywność 2 dawek TIV w zapobieganiu zachorowaniom na zapalenie płuc lub wizytom u lekarza w związku z grypą wyniosła 87%.[165] Efektywność TIV u dzieci może się zwiększać z wiekiem.[139,174] Na podstawie przeglądu systematycznego opublikowanych badań obliczono, że efektywność szczepionki u dzieci w wieku >2 lat wynosi 59%, a w celu potwierdzenia jej skuteczności u dzieci w wieku od 6 miesięcy do 2 lat konieczne jest przeprowadzenie dodatkowych wiarygodnych badań.[175]
Ze względu na potwierdzone skutki zdrowotne związane z zachorowaniem na grypę u dzieci chorych na inne choroby przewlekłe lub z upośledzeniem odporności i obowiązujące od dawna zalecenie szczepienia takich dzieci, w tej populacji nie przeprowadzono badań z randomizacją metodą podwójnie ślepej próby z placebo oceniających skuteczność szczepionek. W badaniu z grupą kontrolną, w którym nie stosowano randomizacji, obejmującym chore na astmę dzieci w wieku 2–6 lat i 7–14 lat, skuteczność szczepionki w zapobieganiu potwierdzonemu laboratoryjnie zakażeniu wirusem grypy A wynosiła odpowiednio 54 i 78%, a w przypadku potwierdzonego laboratoryjnie zakażenia wirusem grypy B odpowiednio 22 i 60%. W badaniu tym u zaszczepionych chorych na astmę dzieci w wieku 2–6 lat nie stwierdzono znacznego zmniejszenia częstości zakażeń wirusem grypy B w porównaniu z grupą kontrolną.[176] Związek pomiędzy szczepieniem a zapobieganiem zaostrzeniom astmy jest niejasny. W kilku badaniach stwierdzono, że szczepienie chroni przed takimi zaostrzeniami.[177,178] W niektórych badaniach wykazano, że TIV ogranicza zachorowalność na ostre zapalenie ucha środkowego. W 2 z nich zaobserwowano, że szczepienie zmniejsza o około 30% ryzyko wystąpienia związanego z grypą zapalenia ucha środkowego u dzieci w wieku (śr.) odpowiednio 20 i 27 miesięcy.[179,180] Niemniej jednak w innym dużym badaniu, obejmującym dzieci w wieku średnio 14 miesięcy, nie potwierdzono skuteczności TIV w zapobieganiu zachorowaniom na ostre zapalenie ucha środkowego.[172] Ze względu na małą swoistość tego punktu końcowego należy się spodziewać stosunkowo niewielkiej skuteczności szczepionki przeciwko grypie w zapobieganiu ostremu zapaleniu ucha środkowego, które może być wywołane przez różne drobnoustroje chorobotwórcze, a w diagnostyce na ogół nie stosuje się hodowli wirusów grypy.
Dorośli w wieku <65 lat
Jedna dawka TIV jest wysoce immunogenna u zdrowych dorosłych w wieku <65 lat. Zauważono,
że u dorosłych, którym w tym samym sezonie epidemicznym
podano drugą dawkę szczepionki, nie dochodziło do dodatkowego zwiększenia miana
przeciwciał lub było ono niewielkie.[181-183] Wysoce
immunogenne są również monowalentne szczepionki
przeciwko grypie A (H1N1) 2009 – ponad 90% dorosłych wytworzyło przeciwciała w stężeniu
uznawanym za ochronne.[160,184] Jeżeli szczepy
wirusa zwarte w szczepionce i krążące w populacji
są podobne pod względem antygenowym, szczepienie zapobiega zachorowaniu na grypę u około 70–90% zdrowych dorosłych w wieku
<65 lat.[77,80,185-187] Dodatkowo stwierdzono,
że szczepienie zdrowych osób dorosłych zmniejszyło
absencję chorobową w pracy i wykorzystanie
zasobów ochrony zdrowia, w tym zużycie antybiotyków,
jednak pod warunkiem dobrego dopasowania
antygenowego szczepów zastosowanych
do produkcji szczepionki i wirusów krążących w populacji.[77,185,186] W badaniach przeprowadzonych w różnych sezonach epidemicznych, w których
antygeny zawarte w szczepionce różniły się
od większości szczepów krążących w populacji,
skuteczność szczepionki w zapobieganiu zachorowaniom
na potwierdzoną laboratoryjnie grypę była znacznie mniejsza.[77,80,180,182,185,186]
W najnowszym z tych badań stwierdzono jednak, że skuteczność ochrony zdrowych dorosłych przed hospitalizacją z powodu grypy wynosiła 90%.[188] W kilku badaniach u niektórych chorych na choroby przewlekłe stwierdzano słabszą odpowiedź serologiczną po szczepieniu niż u zdrowych młodych dorosłych, wskutek czego pozostają oni podatni na zakażenie wirusami grypy i związane z grypą choroby górnych dróg oddechowych.[189-191] Skuteczność szczepionki u dorosłych w wieku <65 lat należących do grupy dużego ryzyka powikłań grypy jest zwykle mniejsza od opisywanej u zdrowych dorosłych. W badaniu kliniczno-kontrolnym, którym objęto dorosłych w wieku 50–64 lat, chorych na potwierdzoną wirusologicznie grypę w sezonie epidemicznym 2003–2004, w którym antygeny zawarte w szczepionce nie były dobrze dobrane do wirusów krążących w populacji, efektywność szczepionki oszacowano na 60% u osób zdrowych oraz na 48% u osób z jednym lub kilkoma czynnikami dużego ryzyka powikłań grypy.[188] U dorosłych w wieku 50–64 lat chorych na choroby znacznie zwiększające ryzyko powikłań grypy szczepienie zmniejszyło ryzyko hospitalizacji o 36%, natomiast u zdrowych dorosłych w tej samej grupie wiekowej aż o 90%.[188] Badanie z randomizacją przeprowadzone w Tajlandii, obejmujące dorosłych chorych na przewlekłą obturacyjną chorobę płuc (mediana wieku: 68 lat), wykazało 76% efektywność szczepionki w zapobieganiu laboratoryjnie potwierdzonej grypie w sezonie epidemicznym, w którym udało się dobrze dopasować antygeny w szczepionce do wirusów krążących w populacji. Efektywność ta nie zmniejszała się wraz ze zwiększeniem ciężkości przebiegu choroby płuc.[192]
W niewielu badaniach z randomizacją oceniano natomiast wpływ szczepienia przeciwko grypie na zmienne lub punkty końcowe niezwiązane z grypą. Badanie z randomizacją przeprowadzone w Argentynie, którym objęto 301 dorosłych hospitalizowanych z rozpoznaniem zawału serca lub poddawanych angioplastyce z powodu choroby wieńcowej (56% stanowili pacjenci w wieku >=65 lat), wykazało, że w grupie osób zaszczepionych odsetek zgonów z powodu chorób układu krążenia w pierwszym roku po szczepieniu był istotnie mniejszy (6%) niż w grupie osób nieszczepionych (17%).[193] W polskim badaniu z randomizacją, przeprowadzonym metodą podwójnie ślepej próby z placebo, obejmującym 658 osób z chorobą niedokrwienną serca, stwierdzono ponadto, że w ciągu 9-miesięcznej obserwacji incydent niedokrwienia mięśnia sercowego wystąpił u istotnie mniejszej liczby osób zaszczepionych przeciwko grypie niż u osób nieszczepionych (p <0,05 [p. także Med. Prakt. 10/2008, s. 90–93 – przyp. red.]).[194]
W badaniach obserwacyjnych, w których stosowano kliniczne punkty końcowe bez laboratoryjnego potwierdzenia zakażenia wirusem grypy, zwykle wykazywano znaczne zmniejszenie ryzyka hospitalizacji lub zgonu u dorosłych z czynnikami ryzyka powikłań grypy. W badaniu kliniczno-kontrolnym przeprowadzonym w Danii w latach 1999–2000 szczepienie zmniejszyło umieralność ogólną o 78%, a ryzyko hospitalizacji z powodu zakażeń dróg oddechowych i chorób układu sercowo-naczyniowego o 87%.[195] Korzyści opisywano już po pierwszym szczepieniu, a podczas kontynuacji szczepień w kolejnych latach ulegały one zwiększeniu.[196] U chorych na cukrzycę szczepienie przeciwko grypie o 56% zmniejszyło ryzyko wszystkich powikłań, o 54% ryzyko hospitalizacji i o 58% liczbę zgonów.[197] Niektórzy eksperci uważają, że znaczny wpływ szczepień na liczbę powikłań i zgonów obserwowany w tych badaniach należy interpretować ostrożnie, ponieważ trudno mieć pewność, czy wyjściowy stan zdrowia osób szczepionych był taki sam jak osób nieszczepionych.[134,135] Z kolei w jednej z metaanaliz opublikowanych badań nie uzyskano dowodów, że chorzy na astmę odnoszą korzyść ze szczepienia przeciwko grypie,[198] natomiast inna metaanaliza dostarczyła dowodów, że dla chorych na przewlekłą obturacyjną chorobę płuc szczepienie jest korzystne.[199]
Pacjenci z upośledzeniem odporności
Podanie TIV chorym z niewielkimi objawami
AIDS stymuluje wytworzenie swoistych przeciwciał ochronnych w dużym mianie.[200-202] Natomiast u pacjentów z zaawansowanym zakażeniem HIV i małą liczbą limfocytów CD4+ szczepionka
może nie indukować ochronnego miana przeciwciał,[202,203] a podanie im drugiej dawki nie poprawia odpowiedzi immunologicznej.[203,204] W badaniu z randomizacją i grupą kontrolną otrzymującą
placebo, obejmującym niewielką grupę chorych,
stwierdzono, że TIV bardzo skutecznie zapobiegała
objawowemu, potwierdzonemu wirusologicznie
zachorowaniu na grypę u pacjentów HIV-dodatnich, u których średnia liczba limfocytów CD4+ wynosiła
400/mm3; w badaniu tym uczestniczyło też
niewielu pacjentów, u których liczba limfocytów T
wynosiła <200/mm3.[200] W badaniu bez randomizacji
obejmującym pacjentów zakażonych wirusem
HIV wykazano, że szczepienie przeciwko grypie
było najbardziej efektywne u tych, u których liczba
limfocytów CD4+ wynosiła >100/mm3 lub u których
liczba kopii RNA HIV-1 była <30 000/ml.[95]
Na podstawie wyników kilku małych badań
stwierdzono, że immunogenność TIV u osób
po przeszczepieniu narządu miąższowego różni
się w zależności od jego rodzaju. W przypadku
przeszczepienia nerki lub serca odsetek pacjentów,
którzy wytworzyli ochronne miano przeciwciał,
był podobny lub nieznacznie mniejszy od odsetka
uzyskanego u zdrowych osób.[205-207] Jednak badanie
obejmujące osoby po przeszczepieniu wątroby
wykazało zmniejszoną odpowiedź immunologiczną
na szczepienie przeciwko grypie,[208-210] szczególnie
gdy szczepionkę podano w ciągu 4 miesięcy po przeszczepieniu.[208]
Kobiety w ciąży i noworodki
U kobiet w ciąży po szczepieniu stwierdza się
ochronne miano przeciwciał przeciwko wirusom
grypy.[211,212] Opisywano bierne przenikanie swoistych
przeciwciał przeciwko grypie przez łożysko,
co może zapewniać ochronę także noworodkowi
zaszczepionej kobiety.[211,213-216] W badaniu z randomizacją
przeprowadzonym w Bangladeszu, w którym
zaszczepiono kobiety w czasie trzeciego trymestru
ciąży, wykazano zmniejszenie liczby zachorowań
na choroby układu oddechowego z towarzyszącą
gorączką o 29% oraz redukcję ryzyka takich
chorób u ich dzieci w ciągu pierwszych 6 miesięcy
po urodzeniu o 36% (p. Med. Prakt. Pediatr. 1/2009, s. 93–96 – przyp. red.). Dodatkowo u niemowląt
urodzonych przez zaszczepione kobiety
stwierdzono zmniejszenie o 63% ryzyka zachorowania
na grypę potwierdzoną laboratoryjnie w pierwszym półroczu życia.[217] Wszystkie kobiety
objęte badaniem karmiły swoje dzieci piersią (śr.
przez 14 tygodni). W retrospektywnym badaniu
przeprowadzonym w latach 1997–2002, w którym
dokonywano przeglądu dokumentacji medycznej,
nie stwierdzono zmniejszenia częstości chorób
grypopodobnych u zaszczepionych kobiet w ciąży
lub urodzonych przez nie noworodków.[218] Także w innym badaniu przeprowadzonym w latach
1995–2001 u dzieci urodzonych przez zaszczepione
kobiety nie stwierdzono znaczącego zmniejszenia
liczby wizyt lekarskich spowodowanych chorobami
układu oddechowego.[219]
Osoby w podeszłym wieku
W 1 prospektywnym badaniu kohortowym stwierdzono,
że immunogenność u hospitalizowanych
osób w wieku >=65 lat lub 18–64 lat i co najmniej z jedną chorobą przewlekłą jest podobna do immunogenności u osób niehospitalizowanych.[220] Dane
na temat immunogenności pochodzące z 3 badań
obejmujących osoby w wieku >=65 lat wskazują,
że stosując preparaty zawierające dużą dawkę
antygenów, uzyskano istotnie większe miana
przeciwciał hamujących hemaglutynację (HI), w porównaniu z preparatami zawierającymi dawki
standardowe.[221-223] W 1 badaniu stwierdzono,
że wcześniej określone kryteria przewagi danego
preparatu (gdy dolna granica dwustronnego przedziału
ufności dla ilorazu średniej geometrycznej
miana HI przekracza 1,5 i różnica w 4-krotnym
zwiększeniu miana HI wynosi >10%) zostały
spełnione w przypadku antygenów wirusa grypy A (H1N1) i A (H3N2) u osób w wieku >=65 lat, które
otrzymały preparat TIV (Fluzone High-Dose,
Sanofi Pasteur) zawierający 4-krotnie większą
ilość hemaglutyniny (180 µg [60 µg dla każdego
szczepu]) na dawkę.[222,224] Dla antygenu grypy B
spełnione zostały wcześniej zdefiniowane kryteria
braku przewagi nad standardową szczepionką
(Fluzone, Sanofi Pasteur).[222]
W jedynym badaniu z randomizacją, obejmującym osoby w wieku >=60 lat niemieszkające w placówkach opieki przewlekłej, wykazano, że w sezonie epidemicznym, w którym antygeny zawarte w szczepionce były dobrze dopasowane do wirusów krążących w populacji, skuteczność szczepionki przeciwko grypie potwierdzonej laboratoryjnie wynosiła 58% (95% CI: 26–77%).[225] Oddzielnie opublikowano dodatkowe dane z tego badania, według których skuteczność u osób w wieku >=70 lat wynosiła 57% (95% CI: -36–87%) i była podobna do skuteczności u osób młodszych. Jednak badaniem tym objęto niewiele osób w wieku >75 lat, a szeroki przedział ufności dla oszacowania skuteczności u osób w wieku >=70 lat obejmował 0 (tzn. różnica nie była istotna statystycznie – przyp. red.).[226] Efektywność szczepionki przeciwko grypie w zapobieganiu MAARI u osób w podeszłym wieku mieszkających w domach spokojnej starości szacuje się na 20–40%,[227,228] a doniesienia o epidemicznych zachorowaniach wśród prawidłowo zaszczepionych pensjonariuszy takich placówek sugerowały nieskuteczność szczepienia, jeżeli krążące w populacji wirusy różnią się antygenowo od wirusów zawartych w szczepionce.[229,230] W niektórych zaś badaniach stwierdzono, że skuteczność szczepienia w zapobieganiu zgonom związanym z grypą może wynosić nawet 80%.[227,231-233]
U osób w podeszłym wieku niemieszkających w domach spokojnej starości lub innych placówkach opieki przewlekłej szczepienie przeciwko grypie zapobiega 27–70% hospitalizacji z powodu zapalenia płuc i grypy.[234-236] Zmniejsza również częstość występowania powikłań oraz ryzyko hospitalizacji związanej z grypą i zgonu u osób w wieku >=65 lat niemieszkających w placówkach opieki przewlekłej zarówno w przypadku współwystępowania chorób stanowiących czynnik ryzyka powikłań grypy (np. choroby serca, cukrzyca), jak i nieobciążonych takim ryzykiem.[235-240] Jednak w badaniach wykazujących znaczne zmniejszenie ryzyka hospitalizacji i zgonów wśród zaszczepionych osób w podeszłym wieku wykorzystano bazy danych dokumentacji medycznej, natomiast nie oceniono zmniejszenia liczby zachorowań na grypę potwierdzoną laboratoryjnie. Wyniki tych badań kwestionowano, ponieważ obawiano się, że w analizie nie uwzględniono różnic wynikających z większego prawdopodobieństwa zaszczepienia się osób zdrowszych, w porównaniu z osobami w gorszym stanie zdrowotnym.[134,125,232,241-244]
Immunogenność inaktywowanej szczepionki przeciwko grypie pandemicznej H1N1 z 2009 roku
Szczepionka przeciwko grypie sezonowej na rok 2010–2011 będzie zawierać antygeny szczepów spokrewnionych ze szczepem A (H1N1) California/7/2009, które również są zawarte w monowalentnej szczepionce przeciwko grypie pandemicznej H1N1 2009. Badania kliniczne nad monowalentnymi szczepionkami przeciwko grypie pandemicznej H1N1 2009 potwierdziły immunogenność antygenu szczepionkowego. Wykazano w nich również, że odsetek odpowiedzi na szczepienie jest podobny do odsetka obserwowanego po uodparnianiu antygenami wirusów grypy A zawartymi w szczepionkach przeciwko typowej grypie sezonowej. U 19–92% dzieci w wieku 6–35 miesięcy miano HI wynosiło co najmniej 40 po >=21 dniach od podania 1 dawki, a u >90% dzieci >=40 po podaniu 2 dawek w odstępie co najmniej 21 dni[159,160] (National Institutes of Health, dane niepublikowane, 2010). U 44–93% dzieci w wieku 3–9 lat miano HI wynosiło co najmniej 40 po >=21 dniach od podania 1 dawki, a u >90% dzieci >=40 po podaniu 2 dawek w odstępie co najmniej 21 dni[158-160] (National Institutes of Health, dane niepublikowane, 2010). W przypadku starszych dzieci i osób dorosłych odsetek odpowiedzi po podaniu 1 dawki przekraczał 90%,[160,184] chociaż w 1 badaniu średnia geometryczna mian była istotnie mniejsza u osób >=50. roku życia[184] i >=65. roku życia.[160] Inne dane dotyczące immunogenności szczepionki przeciwko grypie pandemicznej H1N1 2009 u osób z chorobami przewlekłymi lub u kobiet w ciąży nie są jeszcze dostępne, lecz wyniki badań przeprowadzonych w innych populacjach sugerują, że immunogenność może być podobna do tej stwierdzanej w badaniach dotyczących szczepionek przeciwko grypie sezonowej.
Dawkowanie, sposób podawania i przechowywanie TIV
Szczegółowy skład preparatów TIV różni się w zależności od ich producenta – należy się zapoznać z ulotką dołączoną do opakowania.
Wielodawkowe ampułki (obecnie niedostępne w sprzedaży w Polsce – przyp. red.) zwykle zawierają tiomersal jako środek konserwujący, ale dostępne są też wolne od środków konserwujących preparaty zawierające jedną dawkę szczepionki (tab. 2).
Tabela 2. Szczepionki przeciwko grypie dostępne w Polsce (oprac. red.)
| Nazwa handlowa | Producent | Postać leku | Opakowanie | Zawartość tiomersalu | Wskazania |
| Agrippal | Novartis | zaw. do wstrzyknięć | 1 ampułkostrzykawka 0,5 ml + igła | nie zawiera | >6. mż.a,b |
| Fluarix | GlaxoSmithKline Biologicals – Belgia | zaw. do wstrzyknięć | 1 ampułkostrzykawka 0,5 ml + igła | nie zawiera | >6. mż.a,b |
| IDflu | Sanofi Pasteur | zaw. do wstrzyknięć i.d. | 1 ampułkostrzykawka 0,1 ml z systemem mikrowstrzykiwania + mikroigła (dawka 9 µg/szczep) | nie zawiera | dorośli do 59. rż. |
| IDflu | Sanofi Pasteur | zaw. do wstrzyknięć i.d. | 1 ampułkostrzykawka 0,1 ml z systemem mikrowstrzykiwania + mikroigła (dawka 15 µg/szczep) | nie zawiera | dorośli >=60. rż. |
| Influvac | Solvay Pharmaceuticals | zaw. do wstrzyknięć i.m. i s.c. | 1 ampułkostrzykawka 0,5 ml + igła | nie zawiera | >6. mż.a,b |
| Influvac | Solvay Pharmaceuticals | zaw. do wstrzyknięć i.m. i s.c. | 10 ampułkostrzykawek 0,5 ml + igła | nie zawiera | >6. mż.a,b |
| Vaxigrip | Sanofi Pasteur | zaw. do wstrzyknięć i.m. i głęboko s.c. | 1 ampułkostrzykawka 0,5 ml | nie zawiera | >6. mż.a,b |
| Vaxigrip Junior | Sanofi Pasteur | zaw. do wstrzyknięć i.m. i głęboko s.c. | 1 strzykawka 0,25 ml | nie zawiera | 6.–35. mż.a |
| i.d. – śródskórnie, i.m. – domięśniowo, mż. – miesiąc życia, rż. – rok życia, s.c. – podskórnie, zaw. – zawiesina
a U dzieci w wieku od 6 miesięcy do ukończenia 9 lat szczepionych po raz pierwszy trójwalentną inaktywowaną szczepionką przeciwko grypie zaleca się 2 dawki w odstępie co najmniej 1 miesiąca, natomiast u tych, które otrzymały tylko 1 dawkę w pierwszym roku szczepienia, zaleca się 2 dawki w kolejnym roku. b dzieciom w wieku >6. mż. do 35. mż. można podać dawkę 0,25 ml lub 0,5 ml | |||||
Szczepionkę należy przechowywać w temperaturze 2–8°C i nie wolno jej zamrażać (preparat, który uległ zamrożeniu, należy zniszczyć). Zalecane dawkowanie i schemat szczepienia zależą od wieku osoby szczepionej (tab. 2). Nie należy natomiast stosować szczepionki przygotowanej na miniony sezon epidemiczny.
Zgodnie z zaleceniami szczepionkę przeciwko grypie wstrzykuje się domięśniowo. Dorosłym i starszym dzieciom szczepionkę podaje się w mięsień naramienny. W tych grupach wiekowych należy rozważyć stosowanie igły o długości >=2,5 cm, ponieważ igła o długości <2,5 cm może być za krótka do penetracji tkanki mięśniowej u niektórych dorosłych i dzieci starszych (w Polsce jednodawkowe szczepionki dostępne są w postaci ampułko- lub autostrzykawek z igłą o określonej długości – przyp. red.).[245] U dzieci, których masa mięśniowa umożliwia podanie szczepionki w mięsień naramienny, zaleca się stosowanie igły o długości 2,2–3,2 cm.[245] Niemowlętom i małym dzieciom szczepionkę należy podawać domięśniowo w przednioboczną okolicę uda. U dzieci w wieku <12 miesięcy do wstrzykiwania szczepionki stosuje się igłę o długości 2,2–2,5 cm.
Niepożądane odczyny po podaniu TIV
Dzieci
Badania potwierdzają bezpieczeństwo corocznego
podawania dzieciom i młodzieży TIV. W największym
opublikowanym badaniu populacyjnym
przeprowadzonym po zarejestrowaniu szczepionki
jej bezpieczeństwo oceniono poprzez Vaccine
Safety Datalink (VSD) w grupie 215 600 dzieci w wieku <18 lat i 8476 dzieci w wieku 6–23 miesięcy
objętych w latach 1993–1999 opieką jednej z 5 organizacji typu HMO (Health Maintenance
Organization – organizacja pełniąca łącznie funkcje
ubezpieczyciela i świadczeniodawcy ochrony
zdrowia, organizująca opiekę zdrowotną i zarządzająca
nią – przyp. red.). W badaniu tym w okresie 2 tygodni po podaniu TIV nie stwierdzono
częstszego występowania klinicznie istotnych
zdarzeń wymagających interwencji lekarskiej, w porównaniu z okresami obserwacji kontrolnej
obejmującej 3–4 tygodni przed szczepieniem i po nim.[246] W retrospektywnym badaniu kohortowym, w którym oceniano dokumentację medyczną
VSD 45 356 dzieci w wieku 6–23 miesięcy w latach
1991–2003, uzyskano dodatkowe dane potwierdzające
ogólne bezpieczeństwo TIV w tej grupie
wiekowej. Szczepienie nie zwiększało statystycznie
istotnie częstości zdarzeń wymagających
interwencji lekarskiej innych niż zapalenie błony
śluzowej żołądka/dwunastnicy, natomiast 13 chorób, w tym zapalenie górnych dróg oddechowych o ostrym przebiegu, zapalenie ucha środkowego i astma, występowały znamiennie rzadziej w ciągu 2 tygodni od podania szczepionki. W dokumentacji
medycznej większości dzieci z rozpoznaniem
zapalenia błony śluzowej żołądka/dwunastnicy
znajdowała się informacja, że objawy kliniczne
obejmowały samoistnie ustępujące wymioty lub
biegunkę. Dodatnia lub ujemna korelacja pomiędzy
szczepieniem TIV a którymkolwiek z powyższych
rozpoznań nie musi jednak wskazywać na związek
przyczynowo-skutkowy.[247] W badaniu nie wykazano
zwiększonego ryzyka drgawek gorączkowych w okresie 3 dni po szczepieniu. Nie zaobserwowano
także zwiększenia ryzyka drgawek gorączkowych w ciągu 14 dni po podaniu TIV, gdy w analizie
uwzględniono równoczesne podanie szczepionki
przeciwko odrze, śwince i różyczce (MMR), w przypadku
której znany jest związek z występowaniem
drgawek gorączkowych w drugim tygodniu
po szczepieniu.[247] W innej analizie oceniono ryzyko
wystąpienia niekorzystnych zdarzeń wcześniej
określonych w VSD, w tym drgawek i zespołu
Guillana i Barrégo po szczepieniu TIV podczas
trzech sezonów grypy (2005–2006, 2006–2007 i 2007–2008). Nie wykazano większego ryzyka
zdarzeń niepożądanych dla 1 195 552 dawek TIV
podanych dzieciom w wieku <18 lat.[248]
W badaniu obejmującym 791 zdrowych dzieci gorączkę po szczepieniu stwierdzono u 11,5% dzieci w wieku 1–5 lat, 5% w wieku 6–10 lat i 5% w wieku 11–15 lat.[139] Po podaniu TIV może wystąpić gorączka, złe samopoczucie, ból mięśni oraz inne objawy ogólne; najczęściej stwierdza się je u osób szczepionych po raz pierwszy (np. u małych dzieci).[249] Objawy te pojawiają się po 6–12 godzinach od szczepienia i utrzymują przez 1–2 dni.[249]
W Stanach Zjednoczonych dane dotyczące potencjalnych NOP po szczepieniu przeciwko grypie u dzieci są rejestrowane w ramach systemu biernego zgłaszania NOP (Vaccine Adverse Event Reporting System – VAERS). Jednak ze względu na ograniczenia systemu spontanicznych zgłoszeń ustalenie związku przyczynowo-skutkowego między poszczególnymi odczynami niepożądanymi a szczepieniem na podstawie analizy samych danych z VAERS jest zwykle niemożliwe. W opublikowanych przeglądach danych z VAERS, dotyczących stosowania TIV u dzieci w wieku 6–23 miesięcy, podano, że do najczęściej zgłaszanych potencjalnych NOP należały: gorączka, osutka skórna, odczyny w miejscu wstrzyknięcia oraz drgawki. Napady drgawek zgłaszano rzadko, a większość z nich stanowiły drgawki gorączkowe.[250,251] W tych badaniach najczęstszymi poważnymi NOP zgłoszonymi do VAERS i zdefiniowanymi według standardowych kryteriów były drgawki i gorączka[250,251]; badania w ramach VSD nie potwierdziły jednak związku TIV z drgawkami gorączkowymi, jaki sugerowały dane z VAERS.[247] W kwietniu 2010 roku australijski urząd Therapeutic Goods Administration ogłosił wstępne dane wskazujące na zwiększone ryzyko reakcji gorączkowych, w tym drgawek gorączkowych, u małych dzieci, które w Australii otrzymały trójwalentną szczepionkę z 2010 roku (Fluvax Jr [niezarejestrowana w Polsce – przyp. red.]). Jest to inaktywowana trójwalentna szczepionka dla dzieci stosowana w krajach półkuli południowej, produkowana przez CSL Biotherapies. Ryzyko wystąpienia drgawek gorączkowych oceniono na 5–9 epizodów na 1000 zaszczepionych dzieci w wieku <5 lat, większość przypadków dotyczyła dzieci <3 lat. Inne szczepionki przeciwko grypie, w tym szczepionka obowiązująca w poprzednim sezonie i szczepionka przeciwko grypie pandemicznej wytwarzane przez tę samą firmę, nie zwiększały ryzyka drgawek gorączkowych u dzieci w Stanach Zjednoczonych lub Australii. Według danych z lipca 2010 roku, jak dotąd nie wiadomo, dlaczego szczepionka CSL Biotherapies przeznaczona dla krajów półkuli południowej zwiększa ryzyko drgawek gorączkowych u małych dzieci.[252]
ACIP nadal będzie monitorować przeprowadzane w Australii badania nad bezpieczeństwem szczepionek i być może jeszcze w 2010 roku udostępni dalsze wytyczne stosowania preparatu Afluria, trójwalentnej szczepionki przeznaczonej dla krajów półkuli północnej, produkowanej przez CSL Biotherapies (niezarejestrowana w Polsce – przyp. red.). Osoby przeprowadzające szczepienia powinny się zapoznać z aktualnymi informacjami dotyczącymi podawania szczepionki CSL, które są dostępne na stronach internetowych CDC (http://www.cdc.gov/flu) i FDA (http://www.fda.gov/BiologicsBloodVaccines/SafetyAvailability/VaccineSafety/default.htm).
Dorośli
W badaniach z grupą kontrolną otrzymującą placebo
wykazano, że najczęstszym NOP po podaniu
szczepionki przeciwko grypie u dorosłych jest
bolesność w miejscu wstrzyknięcia utrzymująca
się do 2 dni po szczepieniu (10–64% zaszczepionych).[253,254] Ta miejscowa reakcja jest łagodna i rzadko utrudnia normalną aktywność. W badaniach
tych częstość występowania objawów
ogólnych (tj. gorączki, złego samopoczucia, bólu
mięśni i głowy) po podaniu TIV osobom w podeszłym
wieku i zdrowym młodym dorosłym była
podobna do obserwowanej po wstrzyknięciu placebo.[77,198,253-255] W 1 prospektywnym badaniu
kohortowym stwierdzono, że częstość zdarzeń
niepożądanych u pacjentów hospitalizowanych w wieku >=65 lat lub 18–64 lat chorych na przynajmniej
jedną chorobę przewlekłą oraz u osób
niehospitalizowanych była podobna.[220] Wśród osób
dorosłych szczepionych w kolejnych latach liczba
reakcji zmniejszyła się w drugim roku szczepienia.
[256] W badaniach klinicznych częstość poważnych
zdarzeń niepożądanych po podaniu TIV była
mniejsza niż 1%. Analizie poddano także NOP u dorosłych w wieku >=18 lat zgłoszone do VAERS w latach 1990–2005. Do najczęściej zgłaszanych
do VAERS zdarzeń niepożądanych w tej grupie
wiekowej należą m.in.: odczyny (w tym ból) w miejscu
wstrzyknięcia, gorączka, ból mięśni i ból głowy.
Przegląd bazy VAERS nie ujawnił nowych niepokojących
kwestii dotyczących bezpieczeństwa TIV. W przypadku podawania TIV osobom dorosłym,
14% zgłoszeń do VAERS zakwalifikowano jako
poważne zdarzenia niepożądane, był to podobny
odsetek do ogólnego odsetka takich zdarzeń w bazie VAERS. Najczęstszym zdarzeniem z tej
grupy był zespół Guillaina i Barrégo (ZGB).[257]
Potencjalny związek pomiędzy TIV a ZGB ciągle
stanowi przedmiot badań (p. "Zespół Guillaina i Barrégo"). W analizie VSD nie wykazano większego
ryzyka wcześniej zdefiniowanych zdarzeń
niepożądanych u 4 773 956 osób dorosłych, które
otrzymały TIV.[249] W porównaniu ze standardową dawką (45 µg
[Fluzone, Sanofi Pasteur]), reakcje miejscowe i ogólne zdarzenia niepożądane (informacje o nich uzyskano, zadając celowane pytania) u osób w wieku >=65 lat częściej obserwowano po podaniu
szczepionki zawierającej 180 µg antygenu HA
(Fluzone High-Dose, Sanofi Pasteur), lecz zwykle
były one łagodne i przemijające. W największym
badaniu stwierdzono, że ból w miejscu wkłucia
po podaniu preparatu Fluzone High-Dose zgłosiło
915 (36%) z 2 572 osób, a po podaniu szczepionki
Fluzone – 306 (24%) z 1260 zaszczepionych osób. U większości osób objętych badaniem ból był niewielki i ustąpił w ciągu 3 dni. W grupie otrzymującej
Fluzone High-Dose umiarkowaną lub wysoką
gorączką odnotowano u 1,1% zaszczepionych; odsetek
ten był znacznie mniejszy w grupie otrzymującej
Fluzone, gdzie wynosił ponad 0,3%.222 W trakcie
6-miesięcznego okresu obserwacji poważne
zdarzenia niepożądane stwierdzono u 6% osób z grupy otrzymującej Fluzone High-Dose i u 7% z grupy otrzymującej Fluzone.[222]
Kobiety w ciąży i noworodki
FDA przyznało inaktywowanej szczepionce przeciwko
grypie kategorię C, która oznacza, że nie
przeprowadzono odpowiednich badań na zwierzętach
dotyczących stosowania preparatu u kobiet w ciąży. Według dostępnych danych, szczepionka
przeciwko grypie podana kobiecie w ciąży nie
wpływa niekorzystnie na płód lub płodność. W badaniu obejmującym około 2000 kobiet w ciąży,
które w tym czasie otrzymały TIV, nie wykazano
niekorzystnych działań na płód ani na rozwój
dziecka w wieku niemowlęcym i w pierwszych
latach życia.[258] W badaniu kliniczno-kontrolnym
obejmującym 252 kobiety w ciąży, które otrzymały
TIV w ciągu 6 miesięcy przed porodem, również
nie stwierdzono ani NOP, ani różnic w sposobie
zakończenia ciąży w porównaniu z 826 nieszczepionymi ciężarnymi.[212] W latach 2000–2003
zaszczepiono około 2 000 000 kobiet w ciąży, a w tym okresie do VAERS zgłoszono tylko 20
zdarzeń niepożądanych u kobiet, które otrzymały
TIV, w tym 9 reakcji w miejscu wstrzyknięcia i 8
reakcji uogólnionych (np. gorączka, ból głowy, ból
mięśni). Ponadto zgłoszono 3 poronienia, ale nie
potwierdzono ich przyczynowego związku ze szczepieniem.[259] Podobne wyniki uzyskano w wielu
mniejszych badaniach,[211,213,260] a z niedawno
przeprowadzonego międzynarodowego przeglądu
danych dotyczących bezpieczeństwa TIV wywnioskowano,
że nie ma dowodów sugerujących niekorzystny
wpływ na płód.[261] W małym badaniu z randomizacją przeprowadzonym w Bangladeszu
stwierdzono, że częstość zdarzeń niepożądanych
związanych z TIV była podobna do częstości
odnotowanej u kobiet w ciąży, które zaszczepiono
polisacharydową szczepionką przeciwko pneumokokom, a w żadnej grupie nie zgłoszono ciężkiego
zdarzenia niepożądanego.[217]
Osoby chore przewlekle
W badaniu z randomizacją, przeprowadzonym w układzie naprzemiennym i obejmującym zarówno
dzieci, jak i dorosłych chorych na astmę, nie
stwierdzono częstszego występowania zaostrzeń
astmy po szczepieniu w żadnej grupie wiekowej,[262] a w 2 innych badaniach nie wykazano częstszego
występowania świszczącego oddechu po podaniu
TIV dzieciom[177] lub dorosłym chorym na astmę.[195] W 1 badaniu[104] stwierdzono, że obrzęk i bolesność w miejscu wstrzyknięcia szczepionki występowały u 20–28% chorych na astmę dzieci w wieku
od 9 miesięcy do 18 lat,[167] a w kolejnym[153] opisano
odczyn w miejscu wstrzyknięcia u 23% dzieci w wieku od 6 miesięcy do 4 lat chorych na przewlekłe
choroby serca lub płuc. W badaniu z randomizacją,
przeprowadzonym metodą ślepej próby w układzie naprzemiennym, którym objęto 1952
dorosłych i dzieci chorych na astmę, wykazano,
że ból mięśni był jedynym objawem, który częściej
zgłaszały osoby otrzymujące TIV (25%) niż otrzymujące
placebo (21%).[262] W innym zaś badaniu z grupą kontrolną otrzymującą placebo, w którym
oceniano TIV, reakcje w miejscu wstrzyknięcia
występowały z podobną częstością w grupie 53
dzieci w wieku od 6 miesięcy do 6 lat z chorobami zwiększającymi ryzyko powikłań grypy i u 305
zdrowych dzieci w wieku 3–12 lat.[157]
W badaniu obejmującym 52 dzieci w wieku od 6 miesięcy do 4 lat, chorych przewlekle i należących do grupy dużego ryzyka powikłań grypy, gorączkę obserwowano u 27%, a rozdrażnienie i bezsenność – u 25% dzieci.[153] W innym badaniu, którym objęto 33 dzieci w wieku 6–18 miesięcy, u 1 dziecka stwierdzono po szczepieniu rozdrażnienie, a u innego – gorączkę i drgawki.[263] W badaniach tych nie uwzględniono jednak grupy kontrolnej otrzymującej placebo.
Osoby z upośledzeniem odporności
Dane potwierdzające bezpieczeństwo TIV u osób
zakażonych HIV są ograniczone, ale nie ma
żadnych dowodów na klinicznie istotny wpływ
szczepienia na przebieg zakażenia HIV lub stan
układu immunologicznego osób zakażonych tym
wirusem. W 1 badaniu wykazano, że po szczepieniu
przeciwko grypie u jednej osoby zakażonej
HIV przejściowo (2–4 tyg.) zwiększyła się liczba
kopii RNA HIV.[264] W innych badaniach stwierdzono,
że po podaniu szczepionki przeciwko grypie
osobom HIV-dodatnim przejściowo zwiększa się
replikacja HIV-1 w osoczu lub komórkach jednojądrowych
krwi obwodowej.[202,265] W kolejnych, lepiej
zaplanowanych badaniach nie wykazano jednak
istotnego zwiększenia replikacji HIV.[266-269] Nie
zaobserwowano, aby szczepienie przeciwko grypie
powodowało zmniejszenie liczby limfocytów
T CD4+ lub przyspieszało rozwój AIDS w porównaniu z osobami nieszczepionymi.[202,270] Informacje
na temat wpływu leków przeciwretrowirusowych
na zwiększenie stężenia RNA HIV w surowicy
nosicieli po naturalnym zakażeniu wirusem grypy
lub po szczepieniu są ograniczone.[94,271]
Podobnie jest z danymi dotyczącymi pacjentów z upośledzeniem odporności o innej przyczynie. W badaniu obejmującym niewielką liczbę osób
stwierdzono, że szczepienie nie upośledza czynności
przeszczepionego narządu ani nie powoduje
epizodów odrzucenia przeszczepu u osób po alogenicznych
przeszczepieniach nerki,[205,206] serca[207]
lub wątroby.[208]
Reakcje nadwrażliwości natychmiastowej po szczepieniu przeciwko grypie
W rzadkich przypadkach składniki szczepionki mogą wywołać reakcje alergiczne, zwane również reakcjmi nadwrażliwości natychmiastowej. W reakcjach natychmiastowych, które zwykle występują w ciągu od kilku minut do kilku godzin po ekspozycji, uczestniczą wcześniej obecne w organizmie immunoglobuliny klasy E (IgE) skierowane przeciwko składnikowi szczepionki.[272] Objawy reakcji natychmiastowych to łagodna pokrzywka oraz obrzęk naczynioruchowy aż do wstrząsu anafilaktycznego. Anafilaksja jest ciężką, zagrażającą życiu reakcją, obejmującą wiele układów narządowych, niekiedy przebiegającą z szybką progresją objawów. Objawy anafilaksji to między innymi uogólniona pokrzywka, świszczący oddech, obrzęk w obrębie jamy ustnej i gardła, trudności w oddychaniu, wymioty, spadek ciśnienia tętniczego, zaburzenia przytomności i wstrząs. Niekiedy obserwuje się mniej nasilone objawy, takie jak zaczerwienienie oczu i chrypka.[246,272-275]
Reakcje alergiczne mogą wywoływać antygeny szczepionki, resztkowa zawartość białka zwierzęcego, substancje przeciwdrobnoustrojowe, konserwujące, stabilizujące lub inne składniki preparatu.[276] Poszczególni producenci wykorzystują różne procesy technologiczne oraz różne substancje w celu inaktywacji wirusów, niekiedy też dodają antybiotyki, aby zapobiec wzrostowi bakterii. Dodatkowe informacje o szczegółowym składzie znajdują się w ulotce producenta dołączonej do preparatu. Według zaleceń ACIP, personel przeprowadzający szczepienie powinien się zapoznać ze schematem postępowania w stanach zagrożenia życia; wymagany jest również certyfikat potwierdzający umiejętność prowadzenia resuscytacji oddechowo-krążeniowej.[246] Amerykańska sieć Clinical Immunization Safety Assessment (CISA) oceniająca bezpieczeństwo szczepionek, współtworzona przez CDC i sześć medycznych ośrodków badawczych specjalizujących się w dziedzinie bezpieczeństwa szczepionek, opracowała algorytm postępowania diagnostycznego i podejmowania decyzji o podawaniu kolejnych dawek szczepionki u osób, u których podejrzewa się natychmiastową reakcję nadwrażliwości po podaniu szczepionki.[272]
Reakcje natychmiastowe po podaniu TIV (...) występują rzadko. W analizie przeprowadzonej w ramach VSD, obejmującej dzieci w wieku <18 lat należące do czterech organizacji typu HMO, oszacowano, że w latach 1991–1997 całkowite ryzyko wystąpienia anafilaksji po szczepieniu wynosiło około 1,5 przypadku na 500 000 podanych dawek, a żaden z tych przypadków nie dotyczył podania TIV.[277] Reakcje anafilaktyczne po podaniu TIV (...) osobom dorosłym rzadko odnotowywano w VAERS.[257]
Przyczyną niektórych reakcji natychmiastowych po TIV jest resztkowa zawartość w szczepionce białka jaja kurzego.[278] Szczepionki przeciwko grypie zawierają jedynie niewielką jego ilość, wystarczającą jednak, aby spowodować wystąpienie natychmiastowej reakcji u osób z ciężką nadwrażliwością na kurze jaja. Zadanie przed szczepieniem pytania, czy spożywanie jaj nie powoduje objawów niepożądanych, jest rozsądną metodą ustalenia, kto może być narażony na ryzyko reakcji alergicznej po szczepieniu przeciwko grypie.[246] Jeżeli wywiad wskazuje na wystąpienie pokrzywki, obrzęku warg lub języka, lub nagłej duszności po spożyciu jaj kurzych, należy przeprowadzić odpowiednie postępowanie diagnostyczne, aby rozstrzygnąć, czy taką osobę można zaszczepić przeciwko grypie. Konsultacji lekarskiej przed szczepieniem wymagają również osoby, u których udokumentowano nadwrażliwość na białko jaja kurzego zależną od przeciwciał klasy IgE, w tym u chorych na astmę zawodową lub z innymi postaciami alergii na białko jaja kurzego, ponieważ ryzyko wystąpienia reakcji alergicznych po szczepieniu przeciwko grypie jest większe również w takich przypadkach.[279-281] Opracowano schemat postępowania w przypadku szczepienia przeciwko grypie dzieci chorych na astmę o ciężkim przebiegu i z nadwrażliwością na białko jaja kurzego.[280] Mogą się zdarzać również reakcje nadwrażliwości na inne składniki szczepionki, ale występują one rzadko. Wstrzyknięcie preparatu zawierającego tiomersal może spowodować rozwój nadwrażliwości typu późnego (typ IV).[282] W większości przypadków nie dochodzi jednak do wystąpienia reakcji na tę substancję, jeśli jest ona podana jako składnik szczepionki – nawet u osób, u których testy płatkowe lub śródskórne potwierdzają uczulenie.[283,284] Jeżeli jednak reakcja wystąpi, najczęściej jest to odczyn miejscowy o charakterze nadwrażliwości opóźnionej.[283]
Objawy ze strony oczu i układu oddechowego po podaniu TIV
U niektórych osób w ciągu 24 godzin po podaniu TIV występują objawy ze strony oczu i układu oddechowego, zwykle jednak są one łagodne i ustępują bez swoistego leczenia. W niektórych badaniach przeprowadzonych w Stanach Zjednoczonych objawy te obejmowały: zaczerwienienie oka (od <1 do 6%), kaszel (1–7%), świszczący oddech (1%) oraz uczucie ucisku w klatce piersiowej (1–3%).[274,275,285-287] W większości nie były to jednak badania z placebo, dlatego określenie związku przyczynowo-skutkowego było niemożliwe. Poza tym objawy ze strony oczu i układu oddechowego występują w przebiegu wielu chorób układu oddechowego i alergii sezonowych, dlatego w okresie wykonywania szczepień mogły występować niezależnie. W badaniu z placebo dotyczącym oceny skuteczności szczepionki u młodych dorosłych stwierdzono, że 2% osób zaszczepionych preparatem Fluzone (Sanofi Pasteur) przeznaczonym na sezon 2006–2007 zgłosiło zaczerwienienie oczu, podczas gdy nie obserwowano takich przypadków w grupie kontrolnej (p = 0,03).[288] W podobnym badaniu przeprowadzonym w sezonie epidemicznym 2005–2006 stwierdzono, że zaczerwienienie oczu wystąpiło u 3% osób, które otrzymały Fluzone, oraz u 1% badanych z grupy placebo, jednak różnica ta nie była statystycznie istotna.[289] Zespół objawów ze strony oczu i układu oddechowego (oculorespiratory syndrome – ORS) – ostrą, samoistnie ustępującą reakcję na TIV z nasilonymi objawami ocznymi i oddechowymi – opisano po raz pierwszy w Kanadzie w sezonie epidemicznym 2000–2001. Wstępna definicja przypadku ORS obejmuje wystąpienie w ciągu 2–24 godzin po podaniu TIV co najmniej jednego z następujących objawów: zaczerwienienie obu oczu i/lub obrzęk twarzy, i/lub objawy ze strony układu oddechowego (kaszel, świszczący oddech, uczucie ucisku w klatce piersiowej, trudności w oddychaniu, ból gardła, chrypka, utrudnione połykanie lub obrzęk twarzy).[290] ORS opisany w Kanadzie był silnie związany z jednym preparatem (Fluviral S/F [Shire Biologics, Quebec, Kanada]), niedostępnym w Stanach Zjednoczonych w sezonie epidemicznym 2000–2001[291] (niezarejestrowany w Polsce – przyp. red.). Dalsze badania zaplanowane w ramach systemów monitorowania bezpieczeństwa szczepionek i analiza danych z badań przeprowadzonych przed 2000 rokiem w Kanadzie, Stanach Zjednoczonych i kilku krajach europejskich umożliwiły zidentyfikowanie osób z objawami ze strony oczu i układu oddechowego spełniających kryteria rozpoznania ORS.[292-294]
Nie ustalono przyczyny ORS, jednak badania sugerują, że jest to reakcja niezależna od IgE.[295] Po modyfikacji procesu produkcji preparatu odpowiedzialnego za występowanie ORS w latach 2000–2001 częstość występowania tego zespołu objawów w Kanadzie znacznie się zmniejszyła.[293] W 1 badaniu z placebo wykazano, że nowa wersja preparatu Fluviral jest związana z występowaniem jedynie chrypki, kaszlu i świądu lub bólu oczu (lecz nie zaczerwienienia). Stwierdzono, że objawy ORS po zastosowaniu nowej wersji szczepionki były łagodne, ustępowały w ciągu 24 godzin i zwykle nie wymagały porady lekarskiej.[296] Objawy ze strony oczu i układu oddechowego zgłaszane po podaniu TIV, w tym ORS, wykazują pewne podobieństwo do natychmiastowych reakcji nadwrażliwości. W 1 badaniu wykazano, że ryzyko nawrotu ORS po kolejnym szczepieniu jest małe, a u osób z objawami ze strony oczu lub układu oddechowego (np. zaczerwienieniem obu oczu, kaszlem, bólem gardła lub chrypką), które nie obejmowały dolnych dróg oddechowych, po ponownym zaszczepieniu szczepionką TIV nie obserwowano poważnych NOP.[297]
Ponowne szczepienie osób, u których po podaniu TIV wystąpiły objawy ze strony oczu lub układu oddechowego
Przed podjęciem decyzji o ponownym zaczepieniu przeciwko grypie pacjenta, u którego wystąpiły objawy ze strony oczu i układu oddechowego, lekarz powinien ustalić, czy obecne są niepokojące objawy IgE-zależnej, natychmiastowej reakcji nadwrażliwości (p. rozdz. "Reakcje nadwrażliwości natychmiastowej po szczepieniu przeciwko grypie"). Gdy nie ma pewności, czy objawy zgłaszane lub obserwowane po podaniu TIV stanowią IgE-zależną reakcję nadwrażliwości, należy się skonsultować z alergologiem lub immunologiem. Osób z objawami reakcji prawdopodobnie IgE-zależnej po podaniu TIV nie należy szczepić przeciwko grypie, chyba że wykluczy się nadwrażliwość lub szczepienie będzie wykonywane pod ścisłym nadzorem lekarza.[272] Objawy ze strony oczu lub układu oddechowego obserwowane po TIV często są przypadkowe i nie mają związku ze szczepieniem, co stwierdzono w grupie otrzymującej placebo w kilku badaniach z randomizacją. Ustalenie w praktyce, czy objawy te są przypadkowe lub związane z ORS, zwykle nie jest możliwe. Osoby, u których po podaniu TIV wystąpiło zaczerwienienie oczu, łagodny obrzęk górnej części twarzy lub łagodne objawy ze strony układu oddechowego (np. ból gardła, kaszel lub chrypka) bez innych niepokojących objawów nadwrażliwości, mogą otrzymać TIV w kolejnych sezonach epidemicznych bez dalszej diagnostyki. W 2 badaniach wykazano, że u osób, u których wystąpiły objawy ORS po podaniu TIV, ryzyko nawrotu zespołu po kolejnym podaniu tej szczepionki było większe, jednak objawy zwykle były łagodniejsze niż w trakcie pierwszego epizodu.[297,298]
Przeciwwskazania i sytuacje wymagające szczególnej ostrożności
TIV jest przeciwwskazana i nie należy jej podawać osobom, u których wystąpiła reakcja anafilaktyczna na białko jaja kurzego lub inne składniki szczepionki (chyba że tę osobę poddano procedurze odczulania). W takich przypadkach w profilaktyce grypy można zastosować leki przeciwwirusowe. Skład szczepionki jest podany na ulotce informacyjnej dołączanej przez producenta do każdego opakowania. Choroby o ostrym, umiarkowanym lub ciężkim przebiegu z towarzyszącą gorączką zwykle stanowią wskazanie do opóźnienia szczepienia do czasu ustąpienia objawów. Zachorowania takie (bez względu na gorączkę) należą do stanów wymagających zachowania szczególnej ostrożności przy podawaniu TIV, podobnie jak wystąpienie ZGB w ciągu 6 tygodni po podaniu poprzedniej dawki szczepionki przeciwko grypie.
Zespół Guillaina i Barrégo
ZGB u dorosłych osób występuje z częstością 10–20/1 000 000/rok.[292] Zebrane dotąd dane wskazują, że z wystąpieniem ZGB wiążą się różne zakażenia, najczęściej Campylobacter jejuni i zakażenia górnych dróg oddechowych.[300-302] W niedawno przeprowadzonym badaniu stwierdzono, że czynnikiem wyzwalającym ZGB było potwierdzone serologicznie zakażenie wirusem grypy, a czas od początku zachorowania na grypę do wystąpienia ZGB wynosił 3–30 dni. Szacunkowa częstość ZGB związanego z zachorowaniem na grypę była 4–7 razy większa niż częstość ZGB związanego ze szczepieniem przeciwko grypie.[303] Po zastosowaniu w 1976 roku szczepionki zawierającej szczepy wirusa grypy wyizolowane od świni obserwowano częstsze występowanie ZGB[304,305]; oszacowano, że na 100 000 zaszczepionych występował jeden dodatkowy przypadek ZGB. Ryzyko ZGB związane ze szczepieniem przeciwko grypie było większe u osób w wieku >=25 lat.[306] Trudno jednak uzyskać wiarygodne dane epidemiologiczne wskazujące na potencjalne niewielkie zwiększenie ryzyka wystąpienia tej rzadkiej choroby o wieloczynnikowej etiologii, a związek przyczynowo-skutkowy między ZGB a podaniem szczepionek przeciwko grypie zawierających antygeny innych szczepów wirusa nie jest oczywisty.
Dotychczasowe badania nie wykazały, że ryzyko ZGB po podaniu szczepionki przeciwko grypie innej niż szczepionka zastosowana w 1976 roku zwiększa się w takim stopniu, jaki zaobserwowano w sezonie epidemicznym 1976–1977. W sumie w żadnym z badań prowadzonych podczas 3 z 4 sezonów epidemicznych w latach 1977–1991 nie stwierdzono statystycznie istotnej różnicy ryzyka względnego (RR) zachorowania na ZGB po szczepieniu przeciwko grypie.[307-309] Jednak w sezonach 1992–1993 i 1993–1994 ryzyko wynosiło 1,7 (95% CI: 1,0–2,8; p = 0,04) w okresie 6 tygodni po szczepieniu przeciwko grypie, co oznacza w praktyce nieco ponad 1 dodatkowe zachorowanie na ZGB wśród 1 000 000 zaszczepionych osób; najwięcej zachorowań obserwowano 2 tygodnie po szczepieniu.[305] Wyniki badania przeprowadzonego w latach 1992–2004 w stanie Ontario w Kanadzie, w którym oceniano dane z dokumentacji medycznej, wykazały słaby, ale statystycznie istotny związek czasowy pomiędzy szczepieniem przeciwko grypie a późniejszym przyjęciem do szpitala z powodu ZGB. Nie stwierdzono jednak zwiększenia częstości ZGB w populacji po wprowadzeniu w stanie Ontario w 2000 roku publicznego programu masowych szczepień przeciwko grypie.[243] Dane pochodzące z VAERS donoszą o coraz rzadszych zgłoszeniach ZGB po szczepieniu przeciwko grypie we wszystkich grupach wiekowych, pomimo częstszego zgłaszania innych NOP po podaniu tej szczepionki.[304] Natomiast według opublikowanych danych z brytyjskiej bazy General Practice Research Database (GPRD) szczepienie przeciwko grypie wiąże się ze zmniejszonym ryzykiem zachorowania na ZGB, nie jest jednak jasne, czy jest to wynik ochrony przed zachorowaniem na grypę, czy wyciągnięcia błędnego wniosku ze względu na "objęcie szczepieniem zdrowych osób" (np. prawdopodobieństwo zaszczepienia jest większe, a ryzyko zachorowania na ZGB mniejsze u osób zdrowych).[311] Na podstawie innej analizy tej samej bazy danych nie stwierdzono związku pomiędzy szczepieniem a ZGB przez 9 lat; w ciągu 6 tygodni po podaniu szczepionki wystąpiły jedynie 3 przypadki ZGB.[313] Trzecia analiza bazy GPRD wykazała, że ZGB wiązał się z niedawnym wystąpieniem ILI, lecz nie ze szczepieniem przeciwko grypie.[313,314] Ryzyko wystąpienia ZGB oszacowane na podstawie wyników nielicznych badań wskazujących na zależność pomiędzy szczepieniem a ZGB, jest małe (nieco ponad 1/1 000 000 zaszczepionych osób). Potencjalne korzyści ze szczepienia przeciwko grypie – zapobieganie ciężkim zachorowaniom, hospitalizacjom i zgonom – znacznie przewyższają ryzyko wystąpienia ZGB. Żadne dane nie wskazują też na różnice wskaźnika śmiertelności z powodu ZGB u osób szczepionych przeciwko grypie i osób nieszczepionych. Wstępne dane z systemów monitorujących szczepienia monowalentnymi szczepionkami przeciwko grypie pandemicznej A (H1N1) 2009 sugerują, że nawet jeżeli istnieje ryzyko wystąpienia ZGB po podaniu szczepionek inaktywowanych, to nie jest ono istotnie większe od ryzyka obserwowanego w niektórych sezonach epidemicznych dla preparatów TIV.[315] Nadal prowadzone są badania dotyczące oceny potencjalnego ryzyka ZGB.[316]
Stosowanie TIV u osób z ZGB w wywiadzie
Zapadalność na ZGB w populacji ogólnej jest bardzo mała, ale ryzyko wystąpienia tego zespołu jest istotnie większe u osób, które już tę chorobę przebyły.[299] W takich sytuacjach większe jest również ryzyko przypadkowego wystąpienia ZGB po szczepieniu przeciwko grypie. Nie wiadomo, czy szczepienie przeciwko grypie może swoiście zwiększyć ryzyko nawrotu ZGB. Spośród 311 osób z ZGB, które odpowiedziały na ankietę, 11 (4%) zgłosiło pewne nasilenie objawów po podaniu szczepionki przeciwko grypie, jednak niektórzy jednocześnie otrzymali również inne szczepionki, a nawrót objawów ogólnie przebiegał łagodnie.[317] W ramach środków ostrożności zasadniczo nie powinno się szczepić osób nienależących do grup ryzyka, u których ZGB wystąpił do 6 tygodni po poprzednim szczepieniu. Jako alternatywę lekarz może rozważyć profilaktyczne stosowanie przez takie osoby leków przeciwwirusowych aktywnych wobec wirusów grypy. Poza tym ograniczone dane uzasadniają coroczne szczepienia przeciwko grypie większości osób, u których w wywiadzie stwierdza się przebycie ZGB, a równocześnie występuje duże ryzyko ciężkich powikłań grypy (grupy ryzyka – p. wyżej).
Środek konserwujący (tiomersal) w ampułkach zawierających wiele dawek TIV
Tiomersal – związek rtęci stosowany od lat 30. XX wieku w szczepionkach i innych lekach jako środek konserwujący – dodaje się obecnie do ampułek zawierających wiele dawek szczepionki przeciwko grypie w celu zmniejszenia ryzyka wzrostu bakterii w preparacie.[318] Żadne dane naukowe nie wskazują, że podanie szczepionki zawierającej tiomersal (w tym przeciwko grypie) było przyczyną NOP innych niż sporadyczne miejscowe reakcje nadwrażliwości. Dostępne dane naukowe nie wskazują również na szkodliwość takich szczepionek dla dzieci urodzonych przez kobiety zaszczepione podczas ciąży. Coraz więcej danych sugeruje brak zwiększonego ryzyka zaburzeń rozwoju układu nerwowego lub innych uszkodzeń wynikających z ekspozycji na szczepionki zawierające tiomersal.[319-328] W Stanach Zjednoczonych Public Health Service i inne instytucje zaleciły wprowadzenie działań na rzecz eliminacji tiomersalu lub zminimalizowania jego zawartości w szczepionkach w celu ograniczenia całkowitego narażenia na rtęć osób otrzymujących te preparaty, zwłaszcza niemowląt.[319,320,329] Ponadto utrzymujące się w społeczeństwie obawy dotyczące ekspozycji na rtęć zawartą w szczepionkach postrzegano jako potencjalną przeszkodę w zaszczepieniu większego odsetka osób i zmniejszeniu obciążenia związanego z chorobami, którym można zapobiegać poprzez szczepienia (w tym również z grypą). W związku z tym od połowy 2001 roku szczepionki rutynowo stosowane w Stanach Zjednoczonych u niemowląt w wieku <6 miesięcy nie zawierają tiomersalu w ogóle lub zawierają tylko jego śladową ilość, dzięki czemu ogólne narażenie dzieci na rtęć pochodzącą ze szczepionek znacznie się zmniejszyło.[246] ACIP i inne amerykańskie agencje rządowe oraz medyczne towarzystwa naukowe stale popierają wysiłki na rzecz opracowania szczepionek niezawierających tiomersalu (w Polsce również stopniowo zmniejszana jest liczba preparatów zawierających tiomersal – przyp. red.).
(...) Korzyści ze szczepienia przeciwko grypie we wszystkich grupach, w których jest ono zalecane, w tym u kobiet w ciąży i młodszych dzieci, przewyższają obawy związane z teoretycznym ryzykiem wynikającym z narażenia na zawarty w preparatach tiomersal. Ryzyko ciężkiego przebiegu zakażenia wirusem grypy jest zwiększone zarówno u małych dzieci, jak i u kobiet w ciąży. Wykazano, że szczepienie je zmniejsza, podobnie jak ryzyko powikłań. W przeciwieństwie do tych faktów nie ma wiarygodnych danych naukowych potwierdzających powikłania wynikające z ekspozycji na szczepionki zawierające tiomersal jako środek konserwujący. Dlatego osobom, u których wskazane jest podanie TIV, można podawać dowolny dostępny preparat odpowiedni ze względu na wiek i występujące u nich czynniki ryzyka. Analiza raportów VAERS nie wykazała różnicy w profilu bezpieczeństwa pomiędzy szczepionkami zawierającymi tiomersal i niezawierającymi tego środka konserwującego u dzieci w wieku 6–23 miesięcy.[251]
Niezależnie od tego, w wielu stanach Ameryki wprowadzono przepisy zakazujące podawania szczepionek zawierających związki rtęci, choć przyjęte kryteria są różne.[330] (...) Wiele preparatów zawierających jedną dawkę TIV nie zawiera tiomersalu i należy się spodziewać, że będą one częściej stosowane (tab. 2). Powyższe regulacje prawne mogą jednak stanowić przeszkodę dla realizacji szczepień, jeśli w stanach zagrożenia (np. pandemią – przyp. red.) będzie brakowało szczepionek niezawierających tiomersalu. (...)
Monitorowanie bezpieczeństwa monowalentnej szczepionki przeciwko grypie pandemicznej H1N1 2009
Szczepionka przeciwko grypie sezonowej na rok 2010–2011 będzie zawierać antygeny szczepów spokrewnionych ze szczepem A (H1N1) California/7/2009, które również są obecne w monowalentnej szczepionce przeciwko grypie pandemicznej H1N1 2009. Badania kliniczne nad immunogennością i bezpieczeństwem szczepionek przeciwko grypie pandemicznej H1N1 2009 wskazują, że profil odpowiedzi na szczepienie u dzieci i dorosłych jest podobny do profilu dla szczepionek przeciwko grypie sezonowej.[158-160,184] W ramach programu szczepień przeciwko grypie pandemicznej wprowadzono ciągłe kompleksowe monitorowanie bezpieczeństwa szczepionki przeciwko wirusowi H1N1 2009.[363] National Vaccine Advisory Committee powołał pozarządową grupę roboczą w celu przeprowadzenia niezależnego przeglądu danych dotyczących bezpieczeństwa. Członkowie tej grupy są przedstawicielami innych federalnych komitetów doradczych, a także ekspertami w dziedzinie chorób wewnętrznych, pediatrii, immunologii i bezpieczeństwa szczepionek.[314] Dane z dwóch pierwszych miesięcy po wdrożeniu szczepień przeciwko wirusowi H1N1 uzyskane z VAERS i VSD sugerują, że profile bezpieczeństwa szczepionki monowalentnej przeciwko grypie A (H1N1) 2009 i przeciwko grypie sezonowej są podobne. W lipcu 2010 roku nadal analizowano i przeglądano dane na temat bezpieczeństwa szczepionki pochodzące z różnych systemów.[314,316]
Efektywność szczepień w ograniczeniu szerzenia się grypy na osoby z kontaktu
Ograniczenie szerzenia się grypy z opiekunów i współmieszkańców na pacjentów z grup dużego ryzyka może wśród nich zmniejszyć liczbę chorób grypopodobnych i powikłań. Zakażenia wirusami grypy i choroby grypopodobne często występują u personelu placówek ochrony zdrowia.[369-371] Za przyczynę tworzenia się ognisk zachorowań na grypę uznano niedostateczny odsetek zaszczepionych pracowników szpitali i instytucji opieki długoterminowej.[372-374] W badaniu, w którym w jednym sezonie epidemicznym oceniano miano swoistych przeciwciał, uzyskano serologiczne dowody przebycia zakażenia wirusem grypy u 23% pracowników placówek ochrony zdrowia; u większości z nich choroba miała przebieg lekki lub subkliniczny.[369] W badaniach obserwacyjnych wykazano, że szczepienie personelu placówek ochrony zdrowia wiąże się ze zmniejszeniem liczby zgonów pensjonariuszy domów spokojnej starości.[375,376] W badaniu z randomizacją klastrową (randomizacji poddano grupy pacjentów, a nie poszczególne osoby – przyp. red.), obejmującym 2604 pensjonariuszy z 44 domów spokojnej starości, stwierdzono istotne zmniejszenie liczby zgonów, chorób grypopodobnych i wizyt lekarskich związanych z tymi chorobami w ośrodkach, w których personelowi proponowano szczepienie przeciwko grypie (48% zaszczepionych), w porównaniu z ośrodkami, gdzie nie stosowano takich rozwiązań (6% zaszczepionych [Med. Prakt. Supl. Szczepienia 2/2007, s. 27–29 – przyp. red.]).[377] W innym badaniu wykazano, że w domach spokojnej starości, w których szczepieniami objęto swoiście personel (70% zaszczepionych), częstość choroby grypopodobnej wśród pensjonariuszy i liczba opuszczonych dni pracy była istotnie mniejsza w porównaniu z placówkami, w których nie zastosowano takiej interwencji (32% zaszczepionych).[378] W 1 przeglądzie stwierdzono, że szczepienie personelu w ośrodkach, w których szczepiono także pensjonariuszy, istotnie zmniejszyło umieralność ogólną osób w podeszłym wieku oraz ryzyko zgonu z powodu zapalenia płuc.[379]
W badaniach epidemiologicznych dotyczących epidemii grypy w populacji ogólnej wykazano, że największa zachorowalność na grypę zwykle dotyczy dzieci w wieku szkolnym. Sugeruje to, że powszechne szczepienia dzieci mogą ograniczyć przenoszenie choroby na współmieszkańców, a także inne osoby w populacji. Wyniki niektórych badań wskazują, że korzyści wynikające ze szczepienia dzieci mogą odnieść także kontaktujący się z nimi dorośli oraz osoby z grup dużego ryzyka powikłań grypy. Jednak dane te są ograniczone, a w badaniach nie potwierdzano laboratoryjnie zachorowania na grypę. W badaniu z randomizacją przeprowadzonym metodą pojedynczo ślepej próby, stanowiącym część badania nad efektywnością szczepionki w latach 1996–1997, wykazano, że szczepienie dzieci w wieku przedszkolnym szczepionką TIV zmniejszało częstość powikłań związanych z grypą u niektórych z ich współmieszkańców.[380] W badaniu z randomizacją i placebo w grupie kontrolnej, obejmującym dzieci z nawracającymi zakażeniami układu oddechowego, wykazano, że krewni dzieci, które otrzymały "żywą" donosową szczepionkę przeciwko grypie (live attenuated influenza vaccine – LAIV, obecnie niedostępną w Stanach Zjednoczonych [niedostępna w Polsce – przyp. red.]), rzadziej chorowali na infekcyjne zapalenia układu oddechowego i opuszczali mniej dni w pracy niż rodziny, których dzieci otrzymały placebo.[381] W badaniu z randomizacją klastrową przeprowadzonym w wiejskich koloniach huteryckich w Kanadzie porównano przypadki laboratoryjnie potwierdzonej grypy u niezaszczepionych osób ze społeczności, w których dzieciom podano szczepionkę przeciwko grypie (83% zaszczepionych), ze społecznościami, w których dzieci otrzymały w zamian szczepionkę przeciwko WZW typu A (p. Med. Prakt. Pediatr. 5/2010, s. 90–95 – przyp. red.). Skuteczność szczepienia przeciwko grypie w zapobieganiu zachorowaniom na grypę u osób nieszczepionych wynosiła 61% (95% CI: 8–81%).[382]
W badaniach bez randomizacji obejmujących ogólną populację stwierdzono, że podanie LAIV zmniejsza ekonomiczne i medyczne następstwa związane z MAARI[383,384] i chorobą grypopodobną (np. nieobecność w pracy i liczba wizyt u lekarza) u osób kontaktujących się z zaszczepionymi.[384] W gospodarstwach domowych, w których dzieci uczęszczały do szkół realizujących programy szczepienia LAIV, zgłaszano mniej chorób grypopodobnych i wizyt u lekarza w okresie największej zapadalności na grypę, w porównaniu z gospodarstwami, w których dzieci uczęszczały do szkół nierealizujących takich szczepień. Jednak w populacjach otrzymujących LAIV nie obserwowano zmniejszenia ogólnej liczby dni nieobecności w szkole.[384] W sezonie epidemicznym grypy 2005–2006 szczepienia przeciwko grypie przeprowadzone w szkołach na terenie całego hrabstwa Carroll (stan Maryland – przyp. tłum.) wiązały się ze zmniejszeniem liczby dni nieobecności w szkołach podstawowych i średnich na terenie tego hrabstwa, w porównaniu z innym hrabstwem, w którym nie wdrożono takiego programu.[385] W badaniach tych punktami końcowymi nie były zachorowania na grypę potwierdzoną laboratoryjnie.
W niektórych badaniach również wykazano zmniejszenie liczby zachorowań na grypę wśród osób żyjących w społecznościach, w których wprowadzono programy powszechnych szczepień dzieci. W badaniu obserwacyjnym przeprowadzonym w ogólnej populacji podczas pandemii w 1968 roku stwierdzono, że podanie monowalentnej inaktywowanej szczepionki przeciwko grypie dzieciom w wieku szkolnym (86% zaszczepionych) pochodzącym z jednej społeczności zmniejszyło liczbę zachorowań na grypę we wszystkich grupach wiekowych, w porównaniu z inną populacją, w której nie prowadzono tak intensywnej akcji szczepień dzieci w tym wieku.[386] Z kolei w badaniu obserwacyjnym przeprowadzonym w Rosji wykazano zmniejszenie zapadalności na choroby grypopodobne u mieszkających w danej społeczności osób w podeszłym wieku po wprowadzeniu programu szczepień ochronnych z zastosowaniem inaktywowanej szczepionki przeciwko grypie u dzieci w wieku 3–6 lat (57% zaszczepionych) oraz dzieci i młodzieży w wieku 7–17 lat (72% zaszczepionych).[387] W badaniu bez randomizacji, przeprowadzonym w populacji ogólnej w trakcie 3 sezonów epidemicznych grypy, wśród dorosłych w wieku >=35 lat zamieszkujących w społecznościach, w których wszystkim dzieciom >=18. miesiąca życia oferowano LAIV (szacunkowy odsetek zaszczepionych to 20–25%), obserwowano zmniejszenie liczby MAARI o 8–18%. w porównaniu ze społecznościami, w których nie prowadzono takich programów szczepień.[383] W kolejnym sezonie epidemicznym ci sami badacze stwierdzili zmniejszenie, w porównaniu z populacjami kontrolnymi, liczby MAARI o 9% w grupie osób w wieku 35–44 lat zamieszkujących w społecznościach, w których stosowano opisaną powyżej interwencję (szacunkowy odsetek zaszczepionych dzieci w wieku szkolnym to 31%). Jednak liczba MAARI wśród osób w wieku >=45 lat była mniejsza w społecznościach objętych szczepieniami, niezależnie od zachorowalności na grypę w danej społeczności, co sugeruje, że nie można przypisać tej redukcji szczepieniom dzieci w wieku szkolnym przeciwko grypie.[365]
Największe badanie oceniające wpływ zwiększenia odsetka osób zaszczepionych przeciwko grypie na zdrowie publiczne to badanie ekologiczne, opisujące sytuację w prowincji Ontario w Kanadzie – jedynej prowincji, w której w 2000 roku wprowadzono program powszechnych szczepień przeciwko grypie. Na podstawie modeli opracowanych w oparciu o dane administracyjne oraz dane z systemu nadzoru epidemiologicznego po wdrożeniu programu w prowincji Ontario, w porównaniu z innymi prowincjami, stwierdzono istotne zmniejszenie umieralności związanej z grypą, wskaźnika hospitalizacji, liczby wizyt na oddziałach pomocy doraźnej i w gabinetach lekarskich. Zmniejszenie to było najbardziej widoczne w młodszych grupach wiekowych.[388] Ponadto, w porównaniu z innymi prowincjami, istotnie rzadziej przepisywano antybiotyki w związku z zachorowaniem na grypę.[389]
Efektywność szczepienia przeciwko grypie w przypadku różnic pomiędzy szczepami krążącymi w populacji a antygenami w szczepionce
Szczepienie może zapewnić ograniczoną, lecz nadal istotną odporność krzyżową na niektóre szczepy z przesunięciem antygenowym, w tym zmniejszyć ryzyko poważnych skutków, takich jak hospitalizacja. Zwykle w każdym sezonie epidemicznym identyfikuje się przynajmniej jeden szczep ze zmianami antygenowymi, w porównaniu ze szczepami zastosowanymi do produkcji szczepionki. Poza tym w ostatnich latach krążyły równocześnie dwie różne linie wirusa grypy B i zaobserwowano ograniczoną odporność krzyżową na linię niezawartą w szczepionce.[70] Oceny efektywności klinicznej szczepionek przeciwko grypie nie można jednak dokonać jedynie na podstawie laboratoryjnej oceny stopnia zgodności antygenowej pomiędzy szczepami zastosowanymi do produkcji szczepionki a szczepami krążącymi w środowisku. W niektórych sezonach epidemicznych wśród "dzikich" wirusów grypy dominują szczepy znacznie zróżnicowane pod względem antygenowym i – w porównaniu z sezonami, gdy dopasowanie antygenowe było dobre – obserwuje się niekiedy zmniejszenie efektywności szczepionki.[77,170,188,239,289,390] Jednak nawet w latach, w których dopasowanie antygenowe nie było dobre (skutek przesunięcia antygenowego), szczepienie w znacznym stopniu chroniło przed poważnymi skutkami grypy, być może w wyniku stymulowania produkcji przeciwciał zdolnych do reakcji krzyżowej.[77,188,289,352]
Na przykład w 1 z badań przeprowadzonych podczas sezonu epidemicznego 2003–2004, gdy głównym szczepem krążącym był wirus grypy A (H3N2), różniący się antygenowo od szczepu zawartego w szczepionce przeznaczonej na ten sezon, efektywność szczepienia w zapobieganiu potwierdzonej laboratoryjnie grypie wśród osób w wieku 50–64 lat wynosiła 60% dla osób zdrowych i 48% dla osób z chorobami zwiększającymi ryzyko powikłań grypy.[188] Analiza przeprowadzona w trakcie trwania sezonu epidemicznego 2007–2008 wykazała, że ogólna efektywność szczepionki wynosiła 44%, w tym 54% u osób zdrowych w wieku 5–49 lat oraz 58% wobec wirusa grypy A, choć stwierdzono, że większość wirusów krążących na obszarze badania należała do podtypu A (H3N2) z przesunięciem antygenowym oraz podtypu B z innej linii niż szczepy zastosowane do produkcji szczepionki.[391] U dzieci szczepionki TIV i Laiv zapewniają ochronę przed zakażeniem nawet w sezonach, gdy szczepy zastosowane do produkcji szczepionki i krążące nie są dobrze dopasowane antygenowo. W 2 badaniach obserwacyjnych wykazano, że efektywność szczepionki w zapobieganiu chorobom grypopodobnym wynosiła 49–69%, natomiast w badaniu kliniczno-kontrolnym obejmującym młodsze dzieci w sezonie epidemicznym 2003–2004, gdy – zgodnie z danymi z nadzoru epidemiologicznego – głównym typem wirusa był typ A (H3N2) z przesunięciem antygenowym, efektywność w zapobieganiu potwierdzonej laboratoryjnie grypie wymagającej porady lekarskiej wynosiła 49%.[165,169] Jednak szczepionki przeciwko grypie sezonowej 2009–2010 nie zapewniły ochrony przed zachorowaniami wymagającymi porady lekarskiej spowodowanymi przez wirus grypy pandemicznej A (H1N1) 2009 ze względu na znaczne zmiany w kluczowych antygenach wirusa w stosunku do niedawno krążących szczepów.[392]
Konieczne są dalsze usprawnienia w gromadzeniu reprezentatywnych wirusów krążących w populacji oraz wykorzystywaniu danych z nadzoru epidemiologicznego w celu przewidywania przesunięć antygenowych w nadchodzących sezonach. Produkcja TIV jest trudnym procesem, trwającym 6–8 miesięcy. Istotne jest także skrócenie czasu produkcji szczepionek, co pozwoli wydłużyć okres niezbędny do zidentyfikowania właściwych antygenów mających wejść w jej skład. W celu lepszego zrozumienia efektywności szczepień w sezonach, w których nie udało się dobrze dopasować składu antygenowego szczepionek, koniecznie należy zebrać dane z wielu sezonów w jednolity sposób.
Efektywność kosztów szczepienia przeciwko grypie
Badania ekonomiczne dotyczące szczepień przeciwko grypie trudno porównywać, ponieważ stosowano w nich różne wskaźniki zarówno dla kosztów, jak i korzyści (np. bezwzględne koszty, opłacalność [efektywność kosztów], wydajność kosztów czy przydatność kosztów). Jednak wyniki większości badań wskazują, że szczepienie zmniejsza lub minimalizuje koszty związane z opieką medyczną, koszty społeczne i indywidualne, absencję związaną z grypą oraz ogranicza spadek wydajności pracy. W 1 z badań przeprowadzanych w Stanach Zjednoczonych roczne obciążenie ekonomiczne związane z sezonowym zachorowaniem na grypę (dla populacji z 2003 r. i obliczone w dolarach amerykańskich [USD]) wyniosło 87,1 miliarda USD, w tym 10,4 miliarda bezpośrednich kosztów medycznych.[78]
Przeprowadzone w Stanach Zjednoczonych badania oceniające szczepienia przeciwko grypie u osób >=65. roku życia wykazały ogólne zmniejszenie kosztów ponoszonych przez społeczeństwo, a także istotne zmniejszenie liczby osób hospitalizowanych i zgonów.[234,235] Na podstawie badania obejmującego większą populację efektywność kosztów szczepienia u osób w wieku 50–64 lat obliczono na 28 000 USD na zyskany rok życia skorygowany o jakość życia (quality-adjusted life year – QALY [wg cen w USD z 2000 r.]), a u osób w wieku >=65 lat na 980 USD na zyskany QALY.[393]
W analizach ekonomicznych dotyczących osób w wieku <65 lat w kwestii szczepienia przeciwko grypie uzyskano rozbieżne wyniki. Według wyników 2 badań przeprowadzonych w Stanach Zjednoczonych szczepienia mogą zmniejszyć zarówno bezpośrednie koszty medyczne, jak i koszty pośrednie związane z absencją w pracy i zmniejszoną wydajnością.[79,394] Z kolei inne amerykańskie badanie nie wykazało, aby strategia szczepienia zdrowych, pracujących osób dorosłych przyniosła oszczędności związane z wydajnością i absencją, chociaż szczepienie nadal oceniono jako opłacalne.[395] W prowincji Ontario w Kanadzie, gdzie w 2000 roku wdrożono program powszechnych szczepień przeciwko grypie, oszacowano, że koszty tego programu były około 2-krotnie większe niż koszty programu szczepień przeznaczonego dla konkretnych populacji. Jednak liczba zachorowań zmniejszyła się o 61%, a umieralność na grypę o 28%, co przyniosło łącznie szacunkowy zysk 1134 QALY na sezon z punktu widzenia płatnika świadczeń zdrowotnych. Większość zaoszczędzonych kosztów wynikała z mniejszej liczby hospitalizacji. Inkrementalny współczynnik kosztów-efektywności określono na 10 797 dolarów kanadyjskich na zyskany QALY.[396]
Analizy kosztów potwierdziły znaczne obciążenie finansowe systemu opieki zdrowotnej związane z zachorowaniami u dzieci. W badaniu obejmującym 727 dzieci leczonych w jednym ośrodku w latach 2000–2004 stwierdzono, że średni całkowity koszt hospitalizacji związanych z grypą wynosił 13 159 USD (39 792 USD w przypadku chorych przyjętych na oddział intensywnej opieki medycznej i 7030 USD w przypadku chorych leczonych tylko na oddziałach szpitalnych).[397] Strategie szczepienia dzieci chorych na choroby zwiększające ryzyko powikłań grypy są bardziej efektywne pod względem ponoszonych kosztów niż szczepienie wszystkich dzieci.[395] W analizie porównującej koszty szczepienia dzieci w różnym wieku za pomocą TIV lub LAIV wykazano, że w przypadku obu szczepionek koszt każdego zyskanego QALY zwiększa się wraz z wiekiem. Koszt zyskanego QALY liczony w USD według wartości z 2003 roku dla rutynowych szczepień wynosił 12 000 USD dla zdrowych dzieci w wieku 6–23 miesięcy i 119 000 USD dla zdrowej młodzieży w wieku 12–17 lat w przypadku szczepienia TIV; w przypadku szczepienia LAIV wartości te wynosiły odpowiednio 9000 i 109 000 USD.[398] Zakres szacunkowych wartości kosztów uzyskany w ekonomicznych analizach szczepień dzieci był szeroki, lecz ogólnie strategię tę oceniono jako oszczędną bądź wydajną.[399-402]
Wyniki analiz ekonomicznych zmieniają się w zależności od rodzaju placówki wykonującej szczepienia, a jego realizacja w instytucjach opieki medycznej pociąga za sobą większe planowane koszty. W opublikowanym modelu średni koszt (wartości za 2004 r.) szczepienia był mniejszy dla szczepień masowych (17,04 USD) i szczepień wykonywanych w aptekach (11,57 USD) niż dla umówionych wizyt u lekarza (28,67 USD).[403] Przewidywano, że szczepienie przeprowadzone poza placówkami medycznymi przyniesie oszczędności zdrowym osobom w wieku >=50 lat oraz dorosłym z grupy dużego ryzyka bez względu na wiek. W populacji zdrowych osób w wieku 18–49 lat uniknięcie zachorowania na grypę kosztowałoby 90 USD, jeśli szczepienie miałoby miejsce w aptece, 210 USD w przypadku szczepienia masowego (np. podczas kampanii – przyp. red.) oraz 870 USD w przypadku szczepienia podczas wizyty u lekarza.[403] (...)
Odsetek zaszczepionych osób w populacji
Należy monitorować wpływ opóźnień w dostawach szczepionek, zmian zaleceń dotyczących szczepień przeciwko grypie (w tym grup ryzyka), poziomu refundacji szczepionek, a także innych czynników na odsetek zaszczepionych dzieci i dorosłych w populacji. Jednym z zadań programu "Healthy People 2010" (zadanie nr 14-29a) prowadzonego w Stanach Zjednoczonych jest corocznie szczepienie przeciwko grypie 90% osób w wieku >=65 lat[406,407]; cel ten ma zostać osiągnięty do 2010 roku. Do realizacji tych planów konieczne jest jednak wdrożenie nowych strategii zmierzających do zwiększenia odsetka zaszczepionych osób w populacji.[408,409]
Według analizy ostatecznego zestawu danych za rok 2009 i pierwotnej wersji danych za rok 2010, zebranych podczas badania ankietowego National Health Interview Survey (NHIS), szacunkowy odsetek osób w wieku >=65 lat oraz 50–64 lat zaszczepionych w całym kraju podczas sezonów epidemicznych 2007–2008 i 2008–2009 zwiększył się nieznacznie (tab. 3) i jest tylko minimalnie większy od poziomu obserwowanego przed sezonem 2004–2005, kiedy zabrakło szczepionki.[410-412] W sezonach 2007–2008 i 2008–2009 szacunkowy odsetek zaszczepionych dorosłych w wieku 18–49 lat obarczonych czynnikami ryzyka powikłań grypy wynosił odpowiednio 25 i 30% (dane NHIS); wartość ta była znacząco mniejsza od docelowego poziomu wyznaczonego w programach "Healthy People 2000" i "Healthy People 2010" wynoszącego 60% (tab. 3).[406,407] Według obliczeń, w sezonie epidemicznym 2006–2007 szczepieniem objęto odpowiednio 24 i 55% dorosłych w wieku 18–49 lat i 50–64 lat chorych na astmę. Zgodnie z założeniami ogólnokrajowymi zakres ten powinien osiągnąć wartość 60%.[413]
Badania epidemiologiczne przeprowadzone podczas pandemii w 2009 roku wskazują, że wśród dorosłych w wieku <65 lat z grupy dużego ryzyka liczba hospitalizacji i zgonów była większa niż we wszystkich innych populacjach. Właśnie takie osoby były jedną z pierwszych grup docelowych dla szczepień przeciwko grypie pandemicznej H1N1 2009, gdy podaż szczepionki była ograniczona.[414] Jednak szczepieniem monowalentną szczepionką przeciwko grypie pandemicznej H1N1 2009 objęto <40% osób dorosłych <65 lat z współwystępującymi chorobami zwiększającymi ryzyko powikłań.[415] Podczas pandemii grypy A (H1N1) 2009 szacunkowe dane do obliczenia odsetka zaszczepionych preparatami przeciwko grypie sezonowej oraz monowalentną szczepionką przeciwko wirusowi H1N1 2009 na szczeblu stanowym uzyskano dzięki ankietom telefonicznym przeprowadzonym przez Behavioral Risk Factor Surveillance System (BRFSS) i National 2009 H1N1 Flu Survey. Do 31 stycznia 2010 roku odsetek ten u osób w wieku .6 miesięcy mieścił się w granicach 30,3–54,5% (mediana: 40,6%). Mediana dla dzieci w wieku od 6 miesięcy do 17 lat wynosiła 41,2%, dla osób w wieku 18–49 lat z grupy dużego ryzyka 38,3%, dla osób nieobciążonych takim ryzykiem 28,8%, dla grupy wiekowej 50–64 lat 45,5% i 69,3% dla grupy wiekowej >=65 lat. W porównaniu z poprzednim sezonem, wyniki te sugerują duże zwiększenie liczby zaszczepionych dzieci i umiarkowane zwiększenie liczby zaszczepionych osób w wieku 18–49 lat nieobciążonych dużym ryzykiem powikłań.[415,416] Jednak odsetek zaszczepionych oszacowany na podstawie danych BRFSS jest zwykle większy od wartości uzyskanych za pośrednictwem NHIS.[416]
Badania przeprowadzone wśród dzieci i osób dorosłych wskazują, że często nie wykorzystuje się okazji do zaszczepienia osób z grup dużego ryzyka powikłań grypy (np. w trakcie ich hospitalizacji z innych przyczyn). W 1 badaniu wykazano, że 23% dzieci przewlekle hospitalizowanych z powodu grypy przebywało w szpitalu również w poprzednim sezonie szczepień przeciwko grypie.[417] W innym badaniu, obejmującym hospitalizowanych chorych mających ubezpieczenie Medicare, tylko 31,6% osób zaszczepiono przed przyjęciem do szpitala, 1,9% – w chwili przyjęcia, a 10,6% – w trakcie hospitalizacji.[418] W badaniu przeprowadzonym w Nowym Jorku w latach 2001–2005, obejmującym 7063 dzieci w wieku 6–23 miesięcy, stwierdzono zwiększenie odsetka dzieci, które otrzymały 2 dawki szczepionki, z 1,6% do 23,7%. Chociaż średnia liczba wizyt stanowiących okazję do szczepienia zmniejszyła się w ciągu badania z 2,9 do 2,0 na 1 dziecko, w ostatnim roku badania 55% wszystkich wizyt nadal stanowiło niewykorzystaną okazję do szczepień.[419] Zapewnienie stałego zapasu szczepionek w szpitalu zwiększa odsetek zaszczepionych wśród hospitalizowanych pacjentów,[420] a szczepienie takich pacjentów jest bezpieczne i pozwala wytworzyć zadowalającą odpowiedź immunologiczną.[220] W jednym z badań ankietowych stwierdzono też, że najsilniejszym czynnikiem przemawiającym na rzecz szczepienia było przekonanie respondentów, że należą do grupy dużego ryzyka. Wiele osób z grup dużego ryzyka jednak o tym nie wiedziało.[421,422] W jednym z badań ponad połowa dorosłych, którym nie podano szczepionki, twierdziła, że poddałaby się szczepieniu, gdyby otrzymała takie zalecenie od swojego lekarza.[422] (...)
Odsetek zaszczepionych dzieci z grup dużego ryzyka powikłań grypy jest niestety mały. W sezonie epidemicznym 2004–2005 wśród dzieci w wieku 2–17 lat chorych na astmę szacowano go na 29%.[428] W sezonie epidemicznym 2007–2008, czyli czwartym sezonie, w którym ACIP zalecił szczepienia przeciwko grypie wszystkich dzieci w wieku 6–23 miesięcy, co najmniej 1 dawkę szczepionki otrzymało 41% dzieci, a wśród dzieci szczepionych pierwszy raz 23% otrzymało 2 dawki szczepionki (dane National Immunization Survey).[429] Wyniki osiągnięte w poszczególnych stanach były jednak bardzo różne.[429] Dane z 8 ośrodków typu sentinel Immunization Information System w sezonie 2008–2009 wskazywały, że 48% dzieci w wieku 6–23 miesięcy otrzymało przynajmniej 1 dawkę, a 29% otrzymało pełny cykl szczepienia. 430 W ośrodkach tych odsetek zaszczepionych starszych dzieci był mniejszy i odwrotnie proporcjonalny do wieku. Odsetek dzieci, które otrzymały pełny cykl szczepień, wynosił od 22% (wiek 2–4 lat) do 9% (wiek 13–18 lat).[430] Podobnie jak w przypadku osób w podeszłym wieku, tak i w przypadku dzieci zaobserwowano, że zalecanie szczepień przez lekarza oraz świadomość, iż "zaszczepienie dziecka to dobry pomysł" dodatnio korelowały z prawdopodobieństwem szczepienia dzieci w wieku 6–23 miesięcy.[431] Podobnie było w przypadku dzieci chorych na astmę, u których prawdopodobieństwo szczepienia zwiększało się, gdy ich rodzice pamiętali, że lekarz zalecił szczepienie lub gdy byli przekonani, że szczepionka okazała się skuteczna.[432] W innym badaniu przeprowadzonym w poradni pediatrycznej po wprowadzeniu systemu przypominania i wezwań na szczepienia stwierdzono zwiększenie odsetka zaszczepionych dzieci chorych na astmę z 5 do 32%.[433] Takie systemy mogą być szczególnie użyteczne, gdy ograniczony dostęp do szczepionek stwarza konieczność objęcia celowanym szczepieniem dzieci obciążonych dużym ryzykiem powikłań.[434] Mimo że zaleca się coroczne szczepienie przeciwko grypie personelu placówek ochrony zdrowia i stanowią one priorytet w ograniczaniu skutków grypy w takich ośrodkach oraz zwiększaniu wykorzystania szczepionek przeciwko grypie,[435-437] na podstawie danych NHIS stwierdzono, że w sezonie 2006–2007 odsetek zaszczepionych w tej grupie wynosił jedynie 44%, a w sezonie 2007–2008 – 49% (tab. 3).
Tabela 3. Odsetek osób zaszczepionycha w grupach docelowych w sezonach epidemicznych 2006–2007, 2007–2008 oraz 2008–2009 w Stanach Zjednoczonych według badań ankietowych National Health Interview Survey (NHIS) z lat 2007–2009 oraz National Immunization Survey (NIS) z lat 2006–2008
| Grupa docelowa | Sezon 2006–2007 | Sezon 2007–2008 | Sezon 2008–2009 | ||||||
| liczebność próby (ogólna)b | odsetek zaszczepionych przeciwko grypie | liczebność próby (ogólna) | odsetek zaszczepionych przeciwko grypie | liczebność próby (ogólna) | odsetek zaszczepionych przeciwko grypie | ||||
| % | (95% CI)c | % | (95% CI)c | % | (95% CI)c | ||||
| osoby szczepione ze względu na wiek | |||||||||
| w wieku 6–23 mies. (NISd) | 9710 | 31,8 | (30,2–33,4) | 11 964 | 40,7 | (39,1–42,2) | dane niedostępneh | ||
| w wieku 2–4 lat | 853 | 37,9 | (34,2–41,7) | 674 | 40,3 | (35,8–45,0) | 652 | 41,8 | (36,5–47,4) |
| w wieku 50–64 lat | 3746 | 36,0 | (34,0–38,0) | 3258 | 38,4 | (36,4–40,4) | 3136 | 40,1 | (37,9–42,3) |
| w wieku >=65 lat | 3086 | 65,6 | (63,3–67,9) | 2658 | 66,3 | (64,2–68,3) | 2455 | 65,5 | (63,2–67,8) |
| osoby z grup dużego ryzykae | |||||||||
| w wieku 5–17 lat | 387 | 33,0 | (26,2–40,7) | 262 | 36,2 | (29,3–43,6) | 273 | 34,7 | (27,8–42,3) |
| w wieku 18–49 lat | 1186 | 25,5 | (22,4–28,9) | 1049 | 30,4 | (27,1–34,0) | 1087 | 33,0 | (29,7–36,4) |
| w wieku 50–64 lat | 1117 | 46,1 | (42,8–49,4) | 1001 | 48,4 | (44,7–52,2) | 1048 | 51,3 (47,2–55,3) | |
| w wieku 18–64 lat | 2303 | 35,3 | (33,0–37,7) | 2050 | 38,8 | (36,2–41,4) | 2135 | 42,0 | (39,3–44,6) |
| osoby spoza grup dużego ryzyka | |||||||||
| w wieku 5–17 lat | 3307 | 17,5 | (15,9–19,2) | 2925 | 21,1 | (19,3–23,1) | 2906 | 24,6 | (22,4–26,9) |
| w wieku 18–49 lat | 7905 | 15,3 | (14,2–16,4) | 6467 | 17,0 | (15,7–18,3) | 6083 | 19,3 | (18,1–20,7) |
| w wieku 50–64 lat | 2619 | 31,8 | (29,5–34,1) | 2248 | 34,1 | (31,7–36,6) | 2083 | 34,3 | (31,8–36,9) |
| kobiety w ciążyf | 177 | 13,4 | (8,5–20,5) | 113 | 24,2 | (15,1–36,6) | 177 | 11,3 | (6,4–19,0) |
| personel placówek ochrony zdrowiag | 850 | 44,4 | (40,2–48,7) | 1037 | 49,0 | (45,1–52,8) | dane niedostępne | ||
| osoby mieszkające z osobami z grup dużego ryzyka (w tym z dziećmi w wieku <5 lat)i | |||||||||
| w wieku 5–17 lat | 741 | 26,0 | (21,5–31,1) | 968 | 24,8 | (21,4–28,6) | 997 | 26,0 | (23,6–30,3) |
| w wieku 18–49 lat | 1349 | 17,0 | (15,0–19,4) | 1753 | 19,5 | (17,1–22,1) | 1775 | 23,7 | (21,4–26,2) |
|
a Osoby, które podczas wywiadu przeprowadzonego w jakimkolwiek dniu pomiędzy marcem a sierpniem, odpowiedziały twierdząco na pytanie: "Czy w ciągu ostatnich 12 miesięcy podano Panu (Pani) szczepionkę przeciwko grypie (w zastrzyku lub donosowo)?" oraz odpowiedziały na pytanie: "W którym miesiącu i roku po raz ostatni podano Panu (Pani) szczepionkę w zastrzyku lub donosowo?"
b liczebność poszczególnych populacji wraz z podgrupami jest dostępna na stronie http://www.cdc.gov/flu/professionals/vaccination/pdf/influenza_vaccine_target_populations.pdf c 95% CI – 95% przedział ufności d W badaniu NIS w celu zwiększenia dokładności obliczeń fakt szczepienia potwierdzał świadczeniodawca. Szacunkowe informacje NIS dla sezonu 2008–2009 będą dostępne latem lub jesienią 2010 roku. e Do grupy dużego ryzyka powikłań grypy kwalifikowano osoby dorosłe, które zgłosiły jedno z następujących zdarzeń: 1) zostały kiedykolwiek poinformowane przez lekarza, że chorują na cukrzycę, rozedmę płuc, chorobę wieńcową, dławicę piersiową, zawał serca lub inną chorobę serca; 2) w ciągu poprzedzających 12 miesięcy ustalono u nich rozpoznanie nowotworu złośliwego (z wyjątkiem nowotworu skóry innego niż czerniak) lub w ciągu poprzedzających 12 miesięcy zostały poinformowane przez lekarza, że chorują na chłoniaka, białaczkę lub inny nowotwór złośliwy układu krwiotwórczego; 3) zostały poinformowane przez lekarza, że chorują na przewlekłe zapalenie oskrzeli lub występuje u nich choroba nerek lub niewydolność nerek; 4) zgłosiły wystąpienie epizodu lub napadu astmy w poprzedzających 12 miesiącach. W przypadku dzieci w wieku <18 lat do grup dużego ryzyka kwalifikowano te, których rodzice lub opiekunowie zostali kiedykolwiek poinformowani przez lekarza, że dziecko choruje na cukrzycę, mukowiscydozę, niedokrwistość sierpowatokrwinkową, wrodzoną wadę serca, inną chorobę serca, chorobę układu nerwowego lub mięśniowego (drgawki, porażenie mózgowe dziecięce, dystrofię mięśniową), lub dzieci, u których w poprzedzających 12 miesiącach wystąpił epizod lub napad astmy. f w wieku 18–44 lat, kobiety będące w ciąży w chwili przeprowadzania ankiety, nieobciążone chorobami zwiększającymi ryzyko powikłań grypy g zatrudnieni w placówkach lub przedsiębiorstwach związanych z ochroną zdrowia zgodnie z kategoriami zatrudnienia wg CDC National Center for Health Statistics h dane do tej pory niedostępne i Dzieci lub dorośli zamieszkujący w gospodarstwie domowym, w którym jednocześnie zamieszkiwała co najmniej jedna z następujących osób: dziecko w wieku <2 lat, osoba dorosła w wieku >=65 lat lub jakakolwiek osoba w wieku 2–17 lat z grupy dużego ryzyka (definicja wyżej – p. przypis e). W celu uzyskania danych na temat osób zamieszkujących w danym gospodarstwie domowym i ich ewentualnej przynależności do grup dużego ryzyka dokonano łącznej oceny ankietowanych dorosłych i dzieci oraz akt osobowych NHIS. Wykluczono dorosłych zatrudnionych w ochronie zdrowia lub należących do grup dużego ryzyka. Ponieważ ocena przynależności do grup dużego ryzyka była niemożliwa w przypadku innych osób w wieku 18–64 lat mieszkających w danym gospodarstwie domowym, niektórzy dorośli w wieku 18–64 lat mieszkający razem z osobami w wieku 18–64 lat, należącymi do grup dużego ryzyka, nie zostali uwzględnieni w analizie. Należy poza tym zauważyć, że chociaż zalecenia dotyczące szczepienia dzieci w wieku 2–4 lat nie obowiązywały w sezonie epidemicznym 2005–2006, na potrzeby tych obliczeń uznano, że u dzieci w wieku 2–4 lat istniały wskazania do szczepienia, aby ułatwić porównanie danych dotyczących odsetka osób zaszczepionych w kolejnych latach. | |||||||||
Podczas pandemii w 2009 roku odsetek zaszczepionych przeciwko grypie sezonowej był większy, lecz pozostał mały dla szczepionki przeciwko grypie pandemicznej. Do połowy stycznia 2010 roku odsetek pracowników ochrony zdrowia zaszczepionych przeciwko grypie pandemicznej A (H1N1) i przeciwko grypie sezonowej oszacowano odpowiednio na 37 i 62%. Dane uzyskano z ankiety przeprowadzonej telefonicznie przez RAND Corporation według procedury nieco innej niż zastosowana przez NHIS.[438] Łącznie 64% pracowników otrzymało jedną z tych szczepionek, i był to największy odsetek ze wszystkich wcześniejszych sezonów, lecz jedynie 35% z nich otrzymało obie szczepionki.[438] Szczepienia personelu placówek ochrony zdrowia wiązały się zarówno ze zmniejszeniem absencji chorobowej w pracy,[370] jak i ze zmniejszeniem umieralności pensjonariuszy domów spokojnej starości[375,377] i ryzyka hospitalizacji pacjentów w podeszłym wieku.[379] Zaszczepienie większego odsetka pracowników zależało od starszego wieku, zatrudnienia w szpitalu, zapewniania polisy ubezpieczeniowej przez pracodawcę, uprzedniego szczepienia przeciwko pneumokokom lub WZW typu B albo wizyty u lekarza w poprzedzającym roku. (...) Pracownicy placówek ochrony zdrowia niewyrażający zgody na szczepienie jako powód podają między innymi wątpliwości dotyczące ryzyka zachorowania na grypę i konieczności szczepienia, obawy związane ze skutecznością szczepionki oraz działaniami niepożądanymi, a także niechęć do poddawania się wstrzyknięciom.[439]
W sezonie epidemicznym 2007–2008 zwiększył się odsetek zaszczepionych kobiet ciężarnych – zaszczepiono 24% kobiet bez cukrzycy, chorób serca, płuc i innych wybranych chorób związanych z dużym ryzykiem wystąpienia powikłań. Jednak odsetek zaszczepionych przeciwko grypie sezonowej w latach 2008–2009 obliczono na jedynie 11%, co daje wynik bliższy szacunkom sprzed roku 2007 i prawdopodobnie raczej odzwierciedla różnice spowodowane małą liczebnością grupy niż istotne wahania w wartościach odsetka zaszczepionych osób (tab. 3). Nie wiadomo dokładnie, dlaczego wciąż tak mało kobiet w ciąży decyduje się na szczepienie przeciwko grypie. Jednak w badaniu oceniającym akceptację szczepionki przeciwko grypie przez kobiety w ciąży stwierdzono, że na szczepienie zdecydowało się 71% kobiet, którym je zaproponowano.[440] Natomiast z ankiety przeprowadzonej w 1999 roku wśród ginekologów i położników wynika, że tylko 39% z nich zaszczepiło przeciwko grypie swoje pacjentki w ciąży, chociaż 86% zgodziło się, że ryzyko powikłań i zgonów związanych z grypą zwiększa się podczas ostatnich dwóch trymestrów ciąży.[441] Podczas pandemii grypy H1N1 2009 ciąża była ważnym czynnikiem ryzyka.[06,120] Ponieważ oczekuje się, że wirus ten nadal będzie krążył w sezonie epidemicznym 2010–2011, konieczne jest zwiększenie odsetka zaszczepionych kobiet w ciąży.
Liczba osób zaszczepionych przeciwko grypie we wszystkich grupach, którym zaleca się szczepienie, nadal jest niewystarczająca. Niezależnie od okresu największego nasilenia zachorowań na grypę, liczba podawanych szczepionek zmniejsza się znacznie pod koniec listopada. Zgodnie z wynikami NHIS dotyczącymi trzech ostatnich sezonów epidemicznych, dla których dane są dostępne, około 84% wszystkich szczepionek przeciwko grypie podaje się w okresie od września do listopada. Wśród osób w wieku >=65 lat w miesiącach od września do listopada szczepionkę przyjęło 92% z nich.[442] Ponieważ wiele osób, którym zaleca się szczepienie, nie zostaje zaszczepionych do końca listopada, CDC zachęca swoich partnerów odpowiedzialnych za zdrowie publiczne oraz lekarzy do utworzenia poradni przeprowadzających szczepienia oraz wdrożenia innych działań promujących coroczne szczepienia przeciwko grypie podczas Narodowego Tygodnia Szczepień Przeciwko Grypie (6–12 grudnia 2010 r.) i przez pozostałą część sezonu epidemicznego. Informacja o szczepieniu przeciwko grypie uzyskana od osób dorosłych stanowi równie czułą i swoistą metodę zbierania danych, jak korzystanie z dokumentacji medycznej.[443] W praktyce klinicznej zgłoszenie szczepienia przeciwko grypie przez pacjenta należy więc uznawać za dowód jego wykonania.[443] Natomiast wyniki oceny wiarygodności informacji o szczepieniu dziecka uzyskanej od jego rodziców nie są jeszcze dostępne. Szacunkowy odsetek zaszczepionych monowalentną szczepionką przeciwko grypie A (H1N1) 2009 wskazuje, że większość dawek podano wstępnie ustalonym grupom docelowym oraz że do 2 stycznia 2010 roku (ok. 90 dni po udostępnieniu szczepionki po raz pierwszy) szczepionkę otrzymało 20% populacji amerykańskiej (61 milionów osób), w tym 28% osób ze wstępnie ustalonych grup docelowych. Szacuje się, że szczepionkę podano 30% amerykańskich dzieci w wieku od 6 miesięcy do 18 lat, w tym 33% dzieci w wieku od 6 miesięcy do 4 lat. Obliczono też, że w szczególnych grupach szczepionkę otrzymało 38% kobiet w ciąży, 22% personelu medycznego i 12% osób w wieku 25–64 lat z chorobami zwiększającymi ryzyko powikłań grypy. (...) Uzyskane wartości są podobne do szacunkowych odsetków zaszczepionych przeciwko grypie sezonowej. Sugeruje to, że obawy związane z pandemią nie były na tyle silne, aby pokonać niektóre przeszkody w szczepieniach przeciwko grypie wśród osób obciążonych większym ryzykiem powikłań grypy.
Zalecenia dotyczące szczepienia przeciwko grypie w sezonie epidemicznym 2010–2011
W Stanach Zjednoczonych zaleca się rutynowe szczepienie wszystkich osób w wieku =6 miesięcy. Uważa się, że w sezonie 2009–2010 wskazanie do podania szczepionki dotyczy już 85% populacji amerykańskiej.[444] Zalecenie powszechnych szczepień wszystkich osób w wieku >=6 miesięcy eliminuje potrzebę ustalenia, czy każda osoba posiada wskazania do szczepienia i podkreśla znaczenie zapobiegania zachorowaniom na grypę we wszystkich grupach wiekowych. Rozszerzenie zaleceń dotyczących corocznych szczepień na wszystkie osoby dorosłe popierają dane wskazujące na bezpieczeństwo i skuteczność szczepionki przeciwko grypie. Poza tym w każdym sezonie epidemicznym obserwuje się zachorowania i zgony z powodu grypy wśród dorosłych w wieku <50 lat, w tym również u osób uprzednio zdrowych. Chociaż w tej grupie wiekowej większość przypadków powikłań grypy dotyczy osób obciążonych medycznymi czynnikami ryzyka, u niektórych nie zidentyfikowano wcześniej takich czynników lub były one obecne, lecz pacjent nie zdawał sobie sprawy z konieczności poddania się szczepieniu. Rozszerzenie zaleceń na wszystkie osoby dorosłe odzwierciedla potrzebę usunięcia potencjalnych przeszkód w realizacji szczepień przeciwko grypie, do których należy brak świadomości istnienia wskazań do szczepienia u osób z grupy większego ryzyka powikłań grypy oraz u osób mających z nimi bliski kontakt. Chociaż obecnie można wyprodukować wystarczającą liczbę szczepionek pokrywającą przewidywane zwiększenie zapotrzebowania, w żadnym roku nie można zagwarantować odpowiedniej dostawy szczepionek ani ich dystrybucji. Dodatkowe dane przemawiające za rozszerzeniem zaleceń na wszystkie osoby dorosłe uzyskano podczas pandemii w 2009 roku. Badania epidemiologiczne przeprowadzone podczas pandemii wywołanej przez wirus grypy A (H1N1) w 2009 roku wskazują, że ryzyko powikłań u dorosłych w wieku <50 lat, które zachorowały na grypę pandemiczną A (H1N1) 2009, jest większe niż zwykle obserwowane przy grypie sezonowej.[12] Znaczne rozprzestrzenianie się grypy H1N1 2009 wśród młodych dorosłych w takich środowiskach, jak kampusy uniwersyteckie,[445] stanowiło częściowe uzasadnienie szczepienia w pierwszej kolejności wszystkich osób w wieku od 6 miesięcy do 24 lat podczas działań prowadzonych w zwalczaniu pandemii w 2009 roku. Oczekuje się, że wirusy spokrewnione z wirusem A (H1N1) 2009 nadal będą krążyć w sezonie epidemicznym 2010–2011, a istotny odsetek młodych dorosłych jeszcze nie wytworzył odporności w wyniku naturalnego zakażenia tym wirusem.[446] Poza tym zakażenia o ciężkim przebiegu obserwowano częściej u niektórych młodych dorosłych, u których nie zidentyfikowano wcześniej czynnika ryzyka powikłań grypy, w tym u osób otyłych, u pewnych mniejszości rasowych i etnicznych oraz kobiet w okresie poporodowym.[24,48,85,86,90,447]
Preparaty TIV przygotowywane na sezon epidemiczny 2010–2011 (...) będą zawierały antygeny szczepów spokrewnionych ze szczepem A/California/7/2009 (H1N1), A/Perth/16/2009(H3N2) i B/Brisbane/60/2008. Wirus grypy B zawarty w szczepionce przeznaczonej na sezon 2010–2011 pochodzi z linii Victoria.[448] Wymienione wirusy posiadają odpowiednie właściwości w hodowli na zarodkach kurzych oraz odpowiadają podtypom wirusa grypy, które prawdopodobnie będą krążyć w populacji w sezonie epidemicznym 2010–2011. Szczep H1N1 zalecany dla trójwalentnej szczepionki na sezon 2010–2011 to ten sam szczep zawarty w monowalentnej szczepionce przeciwko H1N1 podawanej podczas pandemii w 2009 roku. Szczep pochodzący od wirusa grypy pandemicznej z 2009 roku zastąpił szczep wirusa grypy sezonowej H1N1 wchodzący w skład szczepionek od 1977 roku.
Osoby w wieku >=65 lat mogą otrzymać standardową dawkę TIV (15 µg na szczep) lub nowo zarejestrowany preparat TIV zawierający 60 µg antygenu HA na każdy szczep szczepionkowy (Sanofi Pasteur). TIV zarejestrowana jest do stosowania u osób z grupy zwiększonego ryzyka (tab. 2). Wszystkie dzieci w wieku od 6 miesięcy do ukończenia 9. roku życia, które nigdy wcześniej nie były szczepione przeciwko grypie (...), podczas pierwszego szczepienia powinny otrzymać 2 dawki odpowiedniej dla ich wieku szczepionki, a w każdym kolejnym sezonie pojedynczą dawkę. Osoby, którym podano monowalentną szczepionkę przeciwko grypie pandemicznej H1N1 2009, powinny także otrzymać preparat TIV (...) przeznaczony na sezon 2010–2011 w celu zapewnienia ochrony przed szczepami wirusa grypy A (H3N2) i B, które według oczekiwań będą krążyć w sezonie epidemicznym 2010–2011. Poza tym nie wiadomo przez jak długo utrzymuje się ochrona po podaniu monowalentnej szczepionki przeciwko wirusowi H1N1 2009, ale wraz z upływem czasu prawdopodobnie będzie ona coraz mniejsza. Dodatkowo należy dołożyć wszelkich starań, aby zapewnić coroczne rutynowe szczepienie grup zwiększonego ryzyka zakażenia grypą lub jej powikłań. Dotyczy to między innymi wszystkich dzieci w wieku od 6 miesięcy do 18 lat, wszystkich osób w wieku >=50 lat oraz innych obciążonych ryzykiem medycznych powikłań grypy. Takie osoby, osoby z nimi mieszkające oraz osoby z kontaktu, a także wszyscy pracownicy placówek ochrony zdrowia powinni być nadal głównym celem kampanii szczepień do czasu wdrożenia przez lekarzy i programy szczepień rutynowego szczepienia wszystkich osób w wieku >=6 miesięcy (ramka). Mimo że w czasie dwóch poprzednich sezonów epidemicznych zalecano objęcie szczepieniami około 85% populacji Stanów Zjednoczonych, to w sezonie 2008–2009 lub 2009–2010 szczepionkę przeciwko grypie sezonowej otrzymało <50% populacji. Szacuje się, że szczepieniem przeciwko grypie pandemicznej H1N1 2009 objęto <40% populacji.[438]
Uzasadnienie szczepień w określonych populacjachb
Dzieci w wieku od 6 miesięcy do 18 lat
Zaleca się coroczne szczepienie wszystkich dzieci w wieku od 6 miesięcy do 18 lat. Zdrowe dzieci w wieku 2–18 lat mogą otrzymać szczepionkę żywą
(niedostępną w Polsce – przyp. red.) lub inaktywowaną.
Dzieci w wieku 6–23 miesięcy oraz dzieci w wieku 2–4 lat z dodatnim wywiadem w kierunku
astmy, epizodów świszczącego oddechu lub obciążone
chorobami zwiększającymi ryzyko powikłań
grypy, należy zaszczepić preparatem TIV (...).
Zalecenia, aby rutynowymi szczepieniami przeciwko
grypie objąć wszystkie dzieci oraz młodzież w wieku od 6 miesięcy do 18 lat, ustalono
na podstawie: 1) dowodów na skuteczność i bezpieczeństwo
szczepionki u dzieci w wieku szkolnym
(p. rozdz. "Skuteczność, efektywność i bezpieczeństwo
szczepionki przeciwko grypie"), 2) licznych
dowodów świadczących o znaczącym niekorzystnym
wpływie zachorowań na grypę u dzieci w wieku szkolnym i osoby kontaktujące się z nimi
(np. absencja w szkole, częstsze stosowanie antybiotyków,
wizyty u lekarza oraz absencja rodziców w pracy [p. rozdz. "Korzystanie z opieki medycznej,
hospitalizacje i zgony z powodu grypy"]) oraz
3) oczekiwań, że uproszczenie zaleceń dotyczących
szczepienia przeciwko grypie wszystkich
dzieci w wieku szkolnym i młodzieży bez względu
na wiek zwiększy odsetek zaszczepionych dzieci z grup dużego ryzyka powikłań grypy oraz osób
kontaktujących się z takimi pacjentami.
Wśród dzieci zwykle notuje się największą zachorowalność
na grypę w okresie epidemii i są one
głównym źródłem rozprzestrzeniania się wirusa w obrębie populacji.[1,2] Zaszczepienie odpowiednio
dużego odsetka dzieci zapewni uzyskanie pośrednich
korzyści, takich jak zmniejszenie zachorowalności
wśród osób mających bliski kontakt z dziećmi i ograniczenie szerzenia się zakażenia w populacji
(tzw. odporność zbiorowiskowa – przyp. red.).[449]
Osiągnięcie i utrzymanie zmniejszonych wskaźników
zachorowań na grypę na poziomie populacyjnym
będzie wymagało mobilizacji lokalnego
zaplecza oraz wdrożenia programu powtarzanych
corocznie kampanii szczepień w celu wsparcia lekarzy i narodowych programów szczepień w dążeniu
do zapewnienia dzieciom w każdym wieku
szczepionki przeciwko grypie. W wielu rejonach
konieczne będzie wprowadzenie nowatorskich działań w wybranych społecznościach, obejmujących
na przykład program masowych szczepień w szkołach
lub innych miejscach, co stanowiłoby uzupełnienie
akcji szczepień prowadzonej w gabinetach
lekarskich czy w publicznych ośrodkach zdrowia.
Badania bez randomizacji przeprowadzane w ogólnych
populacjach wykazały rzadsze występowanie
objawów grypopodobnych oraz zmniejszenie liczby
wizyt lekarskich u współmieszkańców zamieszkujących w społecznościach objętych programem
powszechnego szczepienia dzieci w wieku szkolnym, w porównaniu ze społecznościami, w których
nie realizowano takich programów.[365,386,387]
Wszystkie dzieci w wieku od 6 miesięcy do ukończenia 9. roku życia, które są szczepione pierwszy raz przeciwko grypie, powinny otrzymać 2 dawki szczepionki w pierwszym roku szczepienia. Dzieci w wieku od 6 miesięcy do 9 lat, którym po raz pierwszy podano szczepionkę przeciwko grypie sezonowej w sezonie 2009–2010 i była to tylko 1 dawka, w sezonie 2010–2011 powinny otrzymać raczej 2, niż 1 dawkę. Poza tym dzieciom z tej grupy wiekowej, które nie otrzymały przynajmniej 1 dawki monowalentnej szczepionki przeciwko wirusowi grypy A (H1N1) 2009, powinno się podać 2 dawki szczepionki przeciwko grypie sezonowej przeznaczonej na sezon epidemiczny 2010–2011, niezależnie od wcześniejszej historii szczepień (ryc. 3). Jeżeli u dzieci z tej grupy wiekowej nie można ustalić historii szczepienia preparatami przeciwko grypie sezonowej na rok 2009–2010 lub szczepionką monowalentną przeciwko grypie pandemicznej (H1N1), należy podać 2 dawki szczepionki sezonowej na rok 2010–2011. U wszystkich dzieci należy zachować co najmniej 4-tygodniowy odstęp między podaniem pierwszej i drugiej dawki.
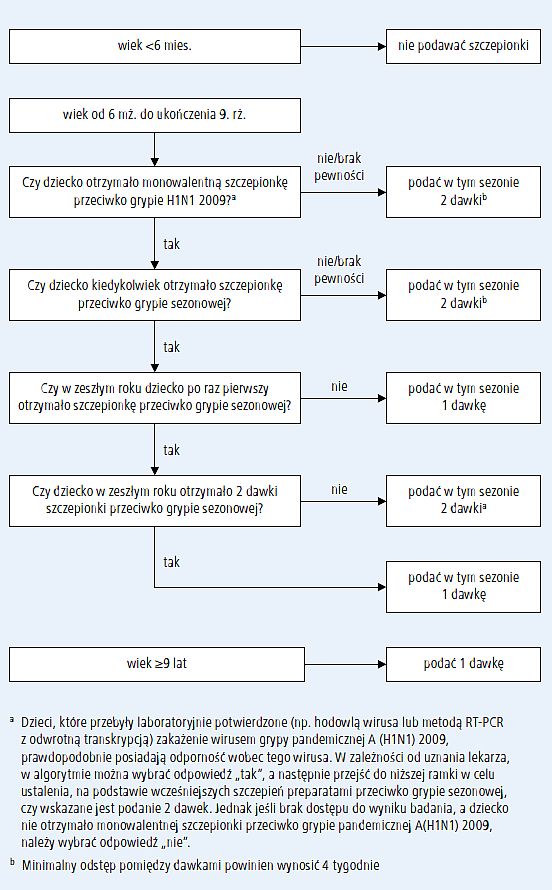
Ryc. 3. Zalecana liczba dawek szczepionki u dzieci w sezonie epidemicznym 2010–2011 Rycina opracowana przez CDC wraz z American Academy of Pediatrics, Committee on Infectious Diseases
Podawanie 2 dawek dzieciom, które nie otrzymały monowalentnej szczepionki przeciwko wirusowi A (H1N1) 2009, niezależnie od poprzednich szczepień przeciwko grypie sezonowej, jest nowym zaleceniem. Zalecenia zmieniono w oparciu o wyniki kilku badań dotyczących immunogenności, w których stwierdzono, że w porównaniu ze starszymi dziećmi i osobami dorosłymi, dzieci w wieku <9 lat uzyskują mniejsze stężenie przeciwciał i rzadziej wytwarzają ochronne miano przeciwciał po podaniu pojedynczej dawki preparatu zawierającego antygen wirusa pandemicznego H1N1 2009. Jednak ponad 80% niemowląt i dzieci w wieku <3 lat i ponad >90% starszych dzieci, które zaszczepiono 2 dawkami szczepionki zawierającej antygen szczepu H1N1 2009, osiąga ochronne stężenie przeciwciał[158,160] (National Institutes of Health, dane niepublikowane, 2010). W związku z tym aktualne dane dotyczące immunogenności wskazują, że do wytworzenia ochronnego stężenia przeciwciał większość małych dzieci wymaga podania co najmniej 2 dawek preparatu zawierającego antygen wirusa H1N1 2009. Zalecenie to obejmuje dzieci, którym podano co najmniej 2 dawki szczepionki sezonowej w poprzednim sezonie epidemicznym i które według wcześniejszych wytycznych otrzymałyby tylko 1 dawkę szczepionki przeznaczonej na rok 2010–2011. Podania drugiej dawki nie wymagają dzieci szczepione po raz pierwszy, które w momencie podania pierwszej dawki miały ukończone 8 lat, lecz kolejny raz zgłosiły się po ukończeniu 9 lat. Dzieci w wieku od 6 miesięcy do ukończenia 9. roku życia, których nie zaszczepiono wcześniej szczepionką sezonową i które otrzymały jedynie szczepionkę monowalentną przeciwko grypie pandemicznej H1N1 2009, należy zaszczepić 2 dawkami preparatu przeznaczonego na sezon 2010–2011 w celu zapewnienia odpowiedniej ochrony przed zakażeniem wirusem grypy A (H3N2) i B. W miarę możliwości dzieci, które zgodnie z zaleceniami powinny otrzymać 2 dawki szczepionki sezonowej, należy zaszczepić przed rozpoczęciem sezonu epidemicznego. Jednak zaleca się szczepienie, w tym również drugą dawką, nawet gdy wirus grypy już zaczął krążyć w danej społeczności.
Dzieci, które przebyły laboratoryjnie potwierdzone (np. metodą PCR z odwrotną transkrypcją lub hodowlą wirusa) zakażenie wirusem grypy pandemicznej A (H1N1) 2009, prawdopodobnie posiadają odporność na tego wirusa. Dotychczas nie stwierdzono negatywnych skutków podawania 2 dawek szczepionki przeciwko grypie sezonowej na rok 2010–2011 dziecku, u którego doszło wcześniej do zakażenia wirusem pandemicznym A (H1N1) 2009. Jednak według uznania lekarza prowadzącego szczepienie, takie dziecko może otrzymać odpowiednią liczbę dawek szczepionki sezonowej (1 lub 2), bez względu na wcześniejsze podawanie monowalentnej szczepionki przeciwko grypie A (H1N1) 2009. U większości dzieci nie przeprowadzono jednak swoistej diagnostyki (tj. nie wykonano żadnych badań lub wykorzystano szybki test antygenowy), a u innych lekarz prowadzący szczepienie nie ma dostępu do dokumentacji potwierdzającej wykonanie testu swoistego dla antygenu wirusa H1N1 2009. Jeżeli wynik testu jest niedostępny i nie podano monowalentnej szczepionki przeciwko grypie pandemicznej A (H1N1) 2009, nie można przyjąć, że dzieci, u których w okresie 2009–2010 wystąpiła choroba układu oddechowego z towarzyszącą gorączką, przebyły grypę A (H1N1). Dzieci te należy zaszczepić 2 dawkami szczepionki przeznaczonej na sezon 2010–2011. Lekarze, którzy ustalają liczbę dawek szczepionki dla dzieci z laboratoryjnie potwierdzoną grypą pandemiczną A (H1N1) 2009 (ryc. 3), powinni również określić, czy istnieje wskazanie do podania 2 dawek na podstawie historii szczepień szczepionkami sezonowymi.
Osoby obciążone dużym ryzykiem
wystąpienia powikłań grypy
Szczepienie w celu uniknięcia zachorowania
na grypę jest szczególnie ważne dla osób należących
do grup dużego ryzyka powikłań grypy
lub o zwiększonym prawdopodobieństwie wizyt w poradni, oddziale ratunkowym lub hospitalizacji. W przypadku niedostatecznej podaży szczepionki, w pierwszej kolejności szczepieniu należy poddać
następujące osoby:
1) wszystkie dzieci w wieku od 6 miesięcy do ukończenia 5 lat (59 mies.)
2) wszystkie osoby w wieku >=50 lat
3) dorosłych i dzieci chorych na przewlekłe choroby
płuc (w tym astmę), układu sercowo-naczyniowego
(z wyjątkiem izolowanego nadciśnienia
tętniczego), nerek, wątroby, układu
nerwowego, układu krwiotwórczego lub choroby
metaboliczne (w tym cukrzycę)
4) dorosłych i dzieci w stanie immunosupresji
(w tym spowodowanej lekami lub zakażeniem
HIV)
5) kobiety, które są lub będą w ciąży w czasie
sezonu epidemicznego grypy
6) dzieci i młodzież (w wieku od 6 miesięcy
do 18 lat) leczone przewlekle kwasem acetylosalicylowym,
co może zwiększyć u nich ryzyko
wystąpienia zespołu Reye'a w przypadku zachorowania
na grypę
7) pensjonariusze domów spokojnej starości oraz
innych placówek przewlekłej opieki pielęgnacyjnej i medycznej (...)
8) osoby z chorobliwą otyłością (BMI >=40)
9) personel medyczny
10) osoby mieszkające wspólnie z dziećmi w wieku
<5 lat lub osobami w wieku >=50 lat, lub opiekujące
się nimi, ze szczególnym uwzględnieniem
osób pozostających w bliskim kontakcie z dziećmi w wieku <6 miesięcy, oraz
11) osoby mieszkające wspólnie z chorymi na choroby
znacznie zwiększające ryzyko ciężkich
powikłań grypy lub opiekujące się nimi.
U dzieci ryzyko ciężkich powikłań grypy sezonowej jest największe do ukończenia 2. roku życia (dzieci z tej grupy wiekowej znacznie częściej wymagają hospitalizacji z powodu powikłań związanych z grypą niż dzieci starsze).[7,54,61] W porównaniu ze starszymi dziećmi, dzieci do ukończenia 5. roku życia częściej trafiają do gabinetów lekarskich lub na oddziały pomocy doraźnej z powodu grypy.[54] Uważa się, że przewlekłe choroby układu nerwowego zwiększają ryzyko powikłań grypy ze względu na upośledzenie funkcji układu oddechowego lub usuwania wydzieliny z dróg oddechowych, co zwiększa ryzyko zachłyśnięcia. Choroby te obejmują zaburzenia czynności poznawczych, uszkodzenie rdzenia kręgowego, choroby przebiegające z drgawkami lub choroby nerwowo-mięśniowe.[46]
Badanie obserwacyjne przeprowadzone podczas pandemii H1N1 w 2009 roku wskazuje, że otyłość chorobliwa i przypuszczalnie również otyłość mniejszego stopnia może być nowym lub wcześniej nierozpoznanym czynnikiem ryzyka powikłań grypy.[85] W innym badaniu stwierdzono większe ryzyko zgonu na grypę pandemiczną H1N1 2009 u Indian amerykańskich i rdzennych mieszkańców Alaski.[90] Te medyczne i rasowe/etniczne czynniki ryzyka mogą odzwierciedlać częstsze występowanie przewlekłych chorób współistniejących, w tym również chorób, o których nie wie ani pacjent, ani lekarz prowadzący. U osób pochodzących z innych grup mniejszościowych, między innymi u osób rasy czarnej, wykazano większą liczbę hospitalizacji w wyniku laboratoryjnie potwierdzonej grypy niż u pacjentów rasy białej (CDC, dane niepublikowane, 2010). Konieczne są dodatkowe badania w celu ustalenia przyczyn tego zjawiska. Do czasu, gdy lekarze i programy szczepień obejmą wszystkie osoby w wieku .6 miesięcy, należy zachęcać wszystkich pacjentów z chorobami przewlekłymi, kobiety w ciąży oraz każdą osobę z grupy większego ryzyka powikłań grypy pandemicznej H1N1 2009 do rutynowego poddawania się corocznemu szczepieniu przeciwko grypie (ramka).
Współmieszkańcy lub opiekunowie
pacjentów z grup dużego ryzyka
powikłań grypy
Każdego roku należy szczepić wszystkie osoby,
które ukończyły 6. miesiąc życia. Współmieszkańcy
lub opiekunowie osób z grup dużego ryzyka powikłań
grypy powinni w dalszym ciągu stanowić
główny cel szczepień, w miarę jak lekarze i programy
szczepień będą stopniowo wdrażać rutynowe
szczepienia wszystkich osób. W przypadku
niedostatecznej podaży szczepionki, w pierwszej
kolejności szczepieniu należy poddać:
1) personel medyczny
2) współmieszkańców (w tym dzieci) i opiekunów
dzieci w wieku do 59 miesięcy i osoby w wieku
>=50 lat
3) współmieszkańców (w tym dzieci) i opiekunów
osób z grup dużego ryzyka ciężkich powikłań
grypy.
Osoby zdrowe zakażone wirusem grypy, w tym
osoby z bezobjawowo przebiegającym zakażeniem,
mogą stanowić źródło zakażenia osób z grup
dużego ryzyka powikłań grypy. Oprócz personelu
medycznego szczepieniami należy objąć także inne
osoby mogące stanowić źródło zakażenia pacjentów z grup dużego ryzyka:
1) pracowników ośrodków zajmujących się osobami
wymagającymi stałej pomocy w wykonywaniu
codziennych czynności oraz pracowników
innych placówek, w których mieszkają osoby z grup dużego ryzyka
2) osoby zapewniające opiekę domową pacjentom z grup ryzyka
3) współmieszkańców osób z grup ryzyka, w tym
dzieci i matek noworodków.
Ponieważ dzieci w wieku <5 lat, w porównaniu z dziećmi starszymi, są zagrożone zwiększonym
ryzykiem hospitalizacji związanej z grypą,[7,47,61,450,451] dodatkowo zaleca się szczepienie
osób kontaktujących się z nimi w domu, a także sprawujących nad nimi opiekę poza
domem; dotyczy to zwłaszcza opiekunów dzieci,
które nie ukończyły 6. miesiąca życia, ponieważ
szczepionki przeciwko grypie nie zostały zarejestrowane
dla dzieci w wieku <6 miesięcy.
Wszystkich pracowników placówek ochrony
zdrowia, a także osoby szkolone w tym kierunku,
należy szczepić przeciwko grypie co roku.
Szczepieniami trzeba objąć lekarzy, pielęgniarki oraz pozostały personel szpitali i placówek lecznictwa otwartego, w tym także personel zespołów wyjazdowych pomocy doraźnej (np. sanitariuszy, ratowników medycznych), a także pracowników domów spokojnej starości oraz innych ośrodków przewlekłej opieki pielęgnacyjnej lub medycznej, którzy kontaktują się z pensjonariuszami lub chorymi, oraz studentów mających kontakt z pacjentami.[436,437,452]
Placówki medyczne powinny zapewnić swoim pracownikom szczepionki przeciwko grypie, stosując rozwiązania o udowodnionej skuteczności w zakresie zwiększania odsetka zaszczepionych osób. Celem powinno być zaszczepienie 100% pracowników, u których nie występują przeciwwskazania medyczne. Administracja tych instytucji powinna uznać odsetek zaszczepionych pracowników za jeden z wyznaczników skuteczności programów zapewnienia bezpieczeństwa pacjentom i rozważyć konieczność uzyskania pisemnej odmowy szczepienia przeciwko grypie od pracowników, którzy nie zgadzają się na nie z przyczyn innych niż przeciwwskazania medyczne.[437,453,454] Należy regularnie oceniać i zgłaszać odsetek zaszczepionych pracowników w danej instytucji, a pracownicy i administracja powinni znać odsetki zaszczepionych osób na poszczególnych oddziałach i wśród pracowników różnych specjalności.[437]
Zaszczepienie odpowiedniego odsetka pracowników w poszczególnych placówkach można osiągnąć za pomocą różnych strategii. Badania wykazały, że zorganizowane kampanie szczepień zapewniają zwiększenie odsetka zaszczepionego personelu medycznego kosztem umiarkowanych nakładów, wykorzystując metody zwiększające akceptację szczepień.[435,437,455,456] Stwierdzono, że polityka obowiązkowych szczepień wszystkich pracowników ochrony zdrowia, poza osobami posiadającymi przeciwwskazania medyczne, jest skutecznym postępowaniem w osiąganiu dużego odsetka zaszczepionych pracowników.[456-458] Szpitale oraz systemy ochrony zdrowia, które wprowadziły szczepienia swoich pracowników, często osiągają odsetek zaszczepienia przekraczający 90%, a zgodnie z niektórymi programami osoby odmawiające poddania się szczepieniu mimo braku przeciwwskazań medycznych są zobowiązane do noszenia masek chirurgicznych w czasie sezonu zachorowań na grypę.[458] Wysiłki na rzecz zwiększenia odsetka zaszczepionego personelu medycznego, w tym obowiązkowe szczepienia, znajdują poparcie różnych ogólnokrajowych organizacji akredytacyjnych i zawodowych (m.in. Infectious Diseases Society of America), a w niektórych stanach są usankcjonowane prawnie.[457,459,460] Dla placówek rozważających wprowadzenie obowiązkowych szczepień ważną kwestią jest możliwość niewyrażenia zgody przez pracowników, obejmującego również wysuwanie zastrzeżeń prawnych.[459,461] Konieczne są badania oceniające wpływ obowiązkowych szczepień pracowników placówek ochrony zdrowia na stan zdrowia pacjentów.
Komisja Wspólna Organizacji Ochrony Zdrowia ds. Akredytacji (Joint Commission on Accreditation of Health-Care Organizations) przyjęła standard kontroli zakażeń, zgodnie z którym akredytowane placówki i instytucje proponują szczepienia przeciwko grypie pracownikom, w tym także wolontariuszom i licencjonowanym osobom praktykującym samodzielnie, którzy mają bliski kontakt z pacjentami. Od 1 stycznia 2007 roku standard ten jest wymogiem akredytacyjnym.[462] W niektórych stanach obowiązują przepisy dotyczące szczepienia personelu placówek opieki długoterminowej, 463 wymaga się, aby placówki medyczne proponowały pracownikom szczepienia przeciwko grypie lub aby personel medyczny był szczepiony przeciwko grypie, a w razie braku zgody na szczepienie osoby te muszą podać religijny, medyczny lub filozoficzny powód takiej odmowy.[464,465] Nie zaleca się szczepienia dzieci w wieku <6 miesięcy, a leki przeciwwirusowe aktywne wobec wirusów grypy nie są zarejestrowane dla tej grupy wiekowej. Ochrona młodych niemowląt, u których ryzyko hospitalizacji z powodu grypy jest podobne jak u osób w podeszłym wieku, zależy więc od szczepienia osób mających z nimi bliski kontakt (tzw. strategia kokonu – przyp. red.). W niedawno przeprowadzonym w Bangladeszu badaniu stwierdzono, że niemowlęta, których matki zaszczepiono w ciąży, są w znacznym stopniu chronione przed grypą potwierdzoną laboratoryjnie dzięki przekazanym przez łożysko swoistym przeciwciałom lub poprzez zmniejszenie ryzyka kontaktu z wirusem grypy dzięki uodpornieniu matki (p. Med. Prakt. Pediatr. 1/2009, s. 93–69 – przyp. red.).[217] Wszyscy domownicy, personel placówek ochrony zdrowia, opiekunowie i inne osoby mające bliski kontakt z młodymi niemowlętami powinni się poddać szczepieniu przeciwko grypie.
Pacjenci z upośledzeniem odporności są obciążeni dużym ryzykiem powikłań grypy, ale ich odpowiedź immunologiczna na szczepienie może być niedostateczna. Szczepienia osób pozostających w bliskim kontakcie z tą grupą pacjentów, w tym także personelu placówek ochrony zdrowia, może zmniejszyć ryzyko przeniesienia grypy na pacjentów.
Kobiety w ciąży i w okresie
poporodowym
Szczepienie kobiet w ciąży jest korzystne zarówno
dla nich samych, jak i noworodków. Rutynowe
szczepienie wszystkich kobiet w ciąży zalecają
również American College of Obstetricians and
Gynecologists oraz American Academy of Family
Physicians.[469] Kobiety po porodzie narażone są
również na ryzyko powikłań grypy, dlatego należy
je zaszczepić.[108] (...)
Kobiety karmiące piersią
Karmienie piersią nie osłabia odpowiedzi immunologicznej i nie stanowi przeciwwskazania do szczepienia.[246] (...) W 1 badaniu z randomizacją
przeprowadzonym w Bangladeszu u niemowląt
urodzonych przez matki zaszczepione w okresie
ciąży zaobserwowano mniejsze ryzyko zachorowania
na grypę potwierdzoną laboratoryjnie (p. Med. Prakt. Pediatr. 1/2009, s. 93–96 – przyp.
red.). Jednak nie ustalono roli karmienia piersią w ochronie przed grypą, w porównaniu z biernym
przekazywaniem matczynych przeciwciał w czasie
ciąży.[217]
Osoby podróżujące
Ryzyko zakażenia wirusem grypy podczas podróży
zależy od pory roku i regionu świata, do którego
się wyjeżdża. W krajach tropikalnych ryzyko
zachorowania występuje przez cały rok, a w strefie
klimatu umiarkowanego na półkuli południowej
sezon epidemiczny trwa od kwietnia do września. W strefie klimatu umiarkowanego, zarówno
na półkuli południowej, jak i północnej, turyści są narażeni na zakażenie wirusem grypy także latem,
zwłaszcza gdy podróżują w dużych, zorganizowanych
grupach (np. na statkach wycieczkowych),
ponieważ ich towarzysze podróży mogą pochodzić z obszarów aktualnie objętych sezonem epidemicznym.[470,471] Na obszarach tropikalnych grypa
występuje przez cały rok. W badaniu obejmującym
Szwajcarów podróżujących do krajów tropikalnych
lub subtropikalnych wykazano, że grypa była najczęściej
występującą w tej grupie chorobą, której
można zapobiegać poprzez szczepienia.[472]
Każda osoba podróżująca, która chce zmniejszyć
swoje ryzyko zakażenia wirusem grypy,
powinna rozważyć szczepienie, najlepiej co najmniej 2 tygodnie przed wyjazdem. W szczególności
osoby należące do grup ryzyka, które nie
były szczepione w ciągu poprzedniej jesieni lub
zimy, powinny rozważyć zaszczepienie się przed
podróżą, jeśli:
1) wyjeżdżają do krajów tropikalnych
2) podróżują w dużej, zorganizowanej grupie (bez
względu na porę roku)
3) podróżują do krajów półkuli południowej w okresie od kwietnia do września.
Nie ma danych na temat korzyści wynikających z ponownego szczepienia przed podróżą planowaną
na lato u osób, które w ciągu poprzedniej
jesieni otrzymały szczepionkę przeciwko grypie.
Jeśli osobę taką zaszczepiono przed podróżą
szczepionką przygotowaną na ubiegły sezon epidemiczny,
podczas nadchodzącej jesieni lub zimy
szczepienie należy powtórzyć szczepionką o uaktualnionym
składzie. Osoby z grup ryzyka przed
podróżą zagraniczną planowaną w lecie powinny
się skontaktować ze swoim lekarzem, aby uzyskać
od niego informacje na temat objawów grypy i ryzyka zachorowania oraz innych chorób związanych z wyjazdem.
Szczepienie przeciwko grypie a stosowanie leków przeciwwirusowych
Dopuszczalne jest podanie TIV osobom otrzymującym leki przeciwwirusowe w celach leczniczych lub profilaktycznych. (...)
Jednoczesne podawanie szczepionki przeciwko grypie i innych szczepionek
(...) Wśród osób dorosłych w wieku >=50 lat bezpieczeństwo i immunogenność szczepionki przeciwko półpaścowi (niezarejestrowanej w Polsce – przyp. red.) oraz TIV były podobne zarówno po ich jednoczesnym podaniu, jak i po zachowaniu 4-tygodniowego odstępu pomiędzy szczepieniami.[476] Wobec braku konkretnych danych o niekorzystnej interakcji między tymi szczepionkami, najlepiej jest postępować zgodnie z ogólnymi zaleceniami ACIP dotyczącymi szczepień (p. Med. Prakt. Pediatr. WS 1/2009 – przyp. red.).[246] Inaktywowane szczepionki nie wpływają na odpowiedź immunologiczną na inne szczepionki inaktywowane lub "żywe". (...) Po podaniu "żywej" szczepionki należy się wstrzymać z podaniem kolejnej "żywej" szczepionki przez co najmniej 4 tygodnie.
Zalecenia dotyczące podawania szczepionki i programów szczepień
Odsetek osób zaszczepionych przeciwko grypie w Stanach Zjednoczonych znacznie się zwiększył w ciągu ostatnich 20 lat, a szczepionkę przeciwko grypie sezonowej lub pandemicznej A (H1N1) w sezonie 2009–2010 otrzymał rekordowy odsetek dzieci. Jednak przeważająca liczba osób w większości grup objętych zaleceniem szczepień nie poddała się corocznemu szczepieniu. Tam gdzie to możliwe, należy wdrożyć strategie zwiększania odsetka zaszczepionych osób, w tym systemy przypominania o szczepieniach i wezwań na szczepienie (...).[408,409,423] Liczbę zaszczepionych osób można zwiększyć, podając szczepionkę przed sezonem epidemicznym grypy pacjentom przebywającym w szpitalu, podczas rutynowych wizyt u lekarza, a także oferując szczepienie w aptekach, sklepach spożywczych, zakładach pracy i innych miejscach; pozwala to uniknąć dodatkowej wizyty pacjenta u lekarza lub w przychodni w celu szczepienia. Zorganizowane kampanie szczepień (...) stanowią okazję do ponownego zwrócenia uwagi opinii publicznej na korzyści, bezpieczeństwo i dostępność szczepień przeciwko grypie w sezonie epidemicznym. Pandemia w 2009 roku stworzyła okazje do wprowadzenia nowatorskich programów podawania szczepionek w różnych placówkach, a nabyte doświadczenie należy wykorzystać przy opracowywaniu programów rutynowych szczepień przeciwko grypie.
Omówienie ryzyka NOP
Osoby, które nie zgadzają się na szczepienie (w tym pracownicy ochrony zdrowia), często wyrażają niepokój odnośnie do bezpieczeństwa szczepionek. Przy informowaniu pacjentów o zdarzeniach niepożądanych lekarze powinni udostępnić informacje o szczepionkach (Vaccine Information Statements, dostępne na http://www.cdc.gov/vaccines/pubs/vis) oraz zwrócić szczególną uwagę na ryzyko i korzyści wynikające ze szczepienia. Lekarz powinien poinformować pacjenta lub rodziców, że 1) TIV zawiera niezakaźne zabite wirusy i nie może wywołać grypy; 2) u wielu pacjentów nie występują działania niepożądane, a większość takich działań, jak ból w miejscu wkłucia, przebiega łagodnie, ustępuje i można je leczyć, 3) po podaniu szczepionki przypadkowo mogą wystąpić objawy towarzyszące lub choroba dróg oddechowych niezwiązane ze szczepieniem.
Jeżeli pacjent obawia się poważniejszych zdarzeń niepożądanych, można go uspokoić, omawiając z nim wiele dostępnych badań dotyczących bezpieczeństwa szczepionek, stosowane obecnie systemy monitorowania bezpieczeństwa, doświadczenie lekarza w stosowaniu szczepionek przeciwko grypie oraz doświadczenie uzyskane podczas realizowania programów szczepień. Osoby przeprowadzające szczepienia, które obawiają się wystąpienia ciężkich NOP, obserwują lub zgłaszają takie epizody, powinny pamiętać, że względnie częste zdarzenia mogą wystąpić po szczepieniu w wyniku zbiegu okoliczności. Na przykład, w jednym z badań, uwzględniając podstawowe ryzyko samoistnego poronienia w ogólnej populacji, oszacowano, że u 397 na 1 milion zaszczepionych kobiet może wystąpić samoistne poronienie w ciągu 1 dnia od szczepienia.[477] Jeżeli zaszczepi się dużą liczbę osób, jak podczas corocznych kampanii szczepień przeciwko grypie, to wskutek przypadkowej zbieżności w czasie obserwowane będą nawet rzadkie zdarzenia niepożądane. Na przykład, jeśli szczepieniu poddano 10 milionów osób, oczekuje się, że w ciągu 6 tygodni od szczepienia zgodnie z ryzykiem populacyjnym wystąpi około 22 przypadków ZGB oraz 6 nagłych zgonów bez związku ze szczepieniem.[477] (...)
Termin przeprowadzania corocznych szczepień przeciwko grypie
Działania na rzecz szczepień powinny być skoordynowane w celu zapewnienia szczepień maksymalnej liczbie osób w ciągu kilku miesięcy, z naciskiem na wykonanie szczepienia przed rozpoczęciem sezonu epidemicznego (krążenia wirusa grypy w populacji). Nawet jeżeli dystrybucja szczepionki rozpocznie się przed październikiem, to jej zakończenie nie nastąpi wcześniej niż w grudniu lub w styczniu. Poniższe zalecenia odzwierciedlają ten wydłużony okres dystrybucji szczepionek.
Nie można ustalić optymalnego terminu szczepień, ponieważ w każdym roku sezon epidemiczny grypy rozpoczyna się i kończy w różnym czasie, czas jego trwania jest różny, a w danej populacji w ciągu jednego roku może wystąpić więcej niż jeden okres nasilonych zachorowań. W Stanach Zjednoczonych zachorowania na grypę mogą się rozpocząć już w październiku, ale w ciągu >80% sezonów epidemicznych od 1976 roku maksymalne nasilenie zachorowań (często odpowiadające połowie sezonu) obserwowano w styczniu lub później, a w >60% sezonów nastąpiło ono w lutym lub później (ryc. 1 [podobnie w Polsce – przyp. red.]). Zasadniczo lekarze powinni zacząć proponować szczepienia wkrótce po pojawieniu się szczepionki na rynku, a jeżeli to możliwe – przed październikiem. Aby nie stracić okazji do szczepień przeciwko grypie, należy je proponować podczas rutynowych wizyt w placówkach ochrony zdrowia lub hospitalizacji, jeżeli tylko szczepionka jest dostępna w sprzedaży.
Działania na rzecz szczepień należy kontynuować przez cały sezon epidemiczny grypy, ponieważ czas jego trwania jest różny, a w niektórych populacjach zachorowania na grypę pojawiają się dopiero w lutym lub w marcu. Lekarze powinni rutynowo proponować szczepienie przeciwko grypie, a zorganizowane kampanie szczepień powinny trwać przez cały sezon epidemiczny, także po rozpoczęciu krążenia wirusa grypy w danej populacji. Podanie szczepionki w grudniu lub później, nawet w okresie zachorowań na grypę, prawdopodobnie przyniesie korzyści w większości sezonów epidemicznych. Dorośli na ogół uzyskują maksymalne miano swoistych przeciwciał przeciwko wirusom grypy już 2 tygodnie po szczepieniu.[478,479] Wszystkie dzieci w wieku od 6 miesięcy do ukończenia 9 lat, którym według zaleceń należy podać 2 dawki szczepionki, powinny otrzymać pierwszą dawkę niezwłocznie po pojawieniu się preparatu na rynku, a drugą po upływie co najmniej 4 tygodni. Taka praktyka zwiększa szansę na podanie obu dawek przed nasileniem zachorowań na grypę lub tuż po nim.
Zachęca się, aby osoby planujące organizację opieki medycznej przewidziały co najmniej jeden punkt szczepień czynny przez cały grudzień. (...) W przypadku niedoborów lub opóźnień dostaw szczepionek znaczny odsetek dawek może zostać wprowadzony do obrotu dopiero w listopadzie lub grudniu (a nawet później). Jeżeli opóźnienia w dostawach szczepionek są duże lub gdy liczba zachorowań nie ulega zmniejszeniu, należy rozważyć przedłużenie działania punktów szczepień co najmniej do stycznia, pod warunkiem że szczepionki będą dostępne. (...)
Strategie wdrażania zaleceń dotyczących szczepień
Rozszerzenie zaleceń na wszystkie osoby w wieku >=6 miesięcy podkreśla znaczenie łatwej dostępności do szczepionek w różnych placówkach. Wiele osób z grupy największego ryzyka powikłań prawdopodobnie będzie kontynuować szczepienia w placówkach medycznych. Jednak szczepienia w takich ośrodkach muszą być w coraz większym stopniu uzupełniane przez szczepienia w placówkach pozamedycznych, co zwiększa wygodę i dostęp do szczepionek. W trakcie realizacji programu szczepień przeciwko wirusowi H1N1 w sezonie 2009–2010, podjęto szczególne działania na szczeblu krajowym i lokalnym umożliwiające prowadzenie szczepień w takich placówkach, jak szkoły, apteki, miejsca pracy i wydziały zdrowia urzędów administracji publicznej.
Placówki medyczne
Placówki medyczne pozostają głównym elementem
całościowej strategii szczepień przeciwko grypie.
Wyniki badań konsekwentnie wskazują, że zalecenie
lekarza najsilniej skłania do poddania się
szczepieniu.[425,480,481] Podczas gdy ośrodki pozamedyczne
spełniają ważną rolę dla osób zmotywowanych
do przyjęcia szczepionki, placówki medyczne
są kluczowym miejscem ułatwiającym szczepienie
wszystkich pacjentów, którzy przychodzą do tych
placówek, niekoniecznie w celu zaszczepienia się.
Na skuteczny program szczepień składają się:
1) działania informacyjne i edukacyjne dla personelu
medycznego oraz potencjalnych odbiorców
programu szczepień; 2) plan identyfikacji osób,
którym zaleca się szczepienie; 3) stosowanie systemów
przypominania o szczepieniach i wzywania
na szczepienia; 4) ocena odsetka zaszczepionych w danej poradni z przekazaniem tej informacji
pracującym tam lekarzom; 5) działania zmierzające
do usunięcia barier administracyjnych i ekonomicznych ograniczających dostęp do szczepień
(...).[409,482,483] (...) Uznanymi powszechnie
strategiami zwiększania liczby osób zaszczepionych
na grypę są ponadto metody przypominania o szczepieniach lekarzom (np. odpowiednie oznakowanie
kart lub dokumentacji pacjentów) oraz
pacjentom. Osoby, u których wskazane jest szczepienie
przeciwko grypie, można zidentyfikować i zaszczepić w wymienionych poniżej warunkach.
Placówki ochrony zdrowia
zapewniające stałą ambulatoryjną
opiekę medyczną
Personel placówek ochrony zdrowia zapewniających
ciągłą ambulatoryjną opiekę medyczną
(np. prywatne praktyki lekarskie, przychodnie
publicznej ochrony zdrowia, przychodnie przyzakładowe,
ośrodki hemodializy, specjalistyczne
przychodnie szpitalne, ambulatoryjne ośrodki
rehabilitacji) powinien proponować szczepienie
wszystkim pacjentom podczas wizyt kontrolnych
przez cały sezon epidemiczny grypy. W karcie
ambulatoryjnej pacjenta lub w systemie informacji o szczepieniach należy odnotować złożenie
propozycji szczepienia i fakt jego wykonania lub
odmowę poddania się szczepieniu. Pacjenci, niemający
wyznaczonej wizyty kontrolnej jesienią,
powinni zostać zawiadomieni o potrzebie szczepienia
przeciwko grypie listownie, telefonicznie
lub w inny sposób.
Ambulatoryjne placówki doraźnej
pomocy medycznej
Placówki doraźnej pomocy medycznej (jak ambulatoria
pogotowia ratunkowego, izby przyjęć szpitali,
szpitalne oddziały ratunkowe) przez cały sezon
epidemiczny powinny proponować szczepienie lub
wręczać ulotkę z informacją o zasadności szczepienia
oraz o tym, gdzie można szczepionkę kupić i gdzie wykonać szczepienie. Ulotka powinna być
zredagowana w sposób zrozumiały dla pacjentów
tych placówek.
Szpitale
Szpital powinien być głównym miejscem identyfikacji i szczepienia osób, u których występuje duże
ryzyko powikłań grypy. Szczepienie przeciwko grypie
należy zaproponować wszystkim niezaszczepionym
osobom, hospitalizowanym w okresie od pojawienia
się szczepionki na rynku, jeżeli nie istnieją
przeciwwskazania do podania szczepionki. Osoby
te należy zdecydowanie zachęcać do szczepienia
przed wypisaniem ze szpitala. Należy rozważyć
wpisanie stałego zalecenia lekarskiego dotyczącego
szczepienia każdego takiego pacjenta.
Domy spokojnej starości i inne ośrodki
przewlekłej opieki pielęgnacyjnej
lub medycznej
Należy rutynowo szczepić wszystkich pensjonariuszy
ośrodków przewlekłej opieki pielęgnacyjnej lub
medycznej. Optymalnie wszystkich pensjonariuszy
należy szczepić tuż przed rozpoczęciem sezonu
epidemicznego. W większości sezonów epidemicznych
ośrodki stacjonarnej opieki przewlekłej będą
dysponować inaktywowaną szczepionką przeciwko
grypie w październiku lub listopadzie, a szczepienia
należy rozpocząć niezwłocznie po otrzymaniu
szczepionki. Tak szybko jak to możliwe po przyjęciu
pensjonariusza do ośrodka, należy omówić z nim korzyści i ryzyko szczepienia oraz udostępnić
mu odpowiednie materiały edukacyjne.[488]
Wymagana jest świadoma zgoda pacjenta, jednak
aby zrealizować stałe zlecenie lekarskie dotyczące
szczepienia, pacjent nie musi wyrazić zgody
pisemnie.[489] Pacjentów przyjętych po zakończeniu
akcji szczepień należy zaszczepić w dniu przyjęcia
do ośrodka. (...)
Podczas pandemii w 2009 roku u ludzi w starszym wieku rzadziej obserwowano zachorowania o ciężkim przebiegu, lecz nadal występowały epidemie wśród pensjonariuszy domów opieki i innych placówek opieki długoterminowej.[490] Chociaż nie wiadomo, jakie wirusy będą krążyć w sezonie 2010–2011, w każdym zimowym sezonie epidemicznym krążą różnorodne typy i podtypy wirusa grypy, które u starszych osób często powodują zakażenia, również o ciężkim przebiegu (np. H3N2). Wszystkim pensjonariuszom i pracownikom należy podać szczepionkę przeznaczoną na sezon epidemiczny 2010–2011.
Wizyty domowe pielęgniarek i innych
pracowników zapewniających opiekę
osobom z grup ryzyka
Od chwili, kiedy szczepionka przeciwko grypie
stanie się dostępna na rynku, aż do końca sezonu
epidemicznego pielęgniarki zapewniające opiekę
domową chorym powinny szczepić osoby z grup
ryzyka w domu. Natomiast inne osoby opiekujące
się chorym, w tym współmieszkańców (również
dzieci), należy skierować na szczepienie do przychodni.
Szczepienie personelu medycznego
Placówki ochrony zdrowia powinny proponować
szczepienie przeciwko grypie całemu personelowi
medycznemu, w tym także pracownikom pełniącym
jedynie dyżury nocne lub w dni wolne od pracy.
Programem takim należy objąć zwłaszcza personel
opiekujący się osobami z grup ryzyka powikłań
grypy. Należy prowadzić edukację pracowników,
uświadamiając im korzyści wynikające ze szczepień i potencjalne skutki zdrowotne grypy zarówno
dla nich, jak i dla członków ich rodzin oraz pacjentów.
Personelowi medycznemu należy zapewnić
dostęp do nieodpłatnego szczepienia przeciwko
grypie w miejscu pracy w ramach programu
ochrony zdrowia dla pracowników.[437,455,462]
Inne placówki
Poszerza się dostęp do szczepień przeciwko grypie w placówkach pozamedycznych. W sezonie
2009–2010 33% szczepionek podano w wydziałach
zdrowia urzędów administracji publicznej,
aptekach, zakładach pracy, szkołach lub innych
placówkach pozamedycznych (CDC, dane niepublikowane,
2009). W placówkach tych podano
45% szczepionek przeciwko wirusowi H1N1 2009
(CDC, dane niepublikowane, 2010). Dostępność
szczepionek w wielu miejscach, takich jak apteki i zakłady pracy, jest szczególnie ważna dla osób,
które nie mają stałego kontaktu z systemem
opieki zdrowotnej. Poza tym, ponieważ niedawno
zaleceniem szczepienia przeciwko grypie objęto
wszystkie osoby w wieku .6 miesięcy, konieczne
jest wdrożenie trwałych strategii wykraczających
poza szczepienia w gabinetach lekarskich.
Szczepienia przeprowadzane w szkołach stwarzają
okazję do pokonywania takich trudności,
jak duża liczba dzieci do zaszczepienia, krótki
okres, w którym można podać szczepionkę oraz
potrzeba corocznego szczepienia. W kilku stanach i w ramach kilku programów szczepień przeprowadzono
skuteczne szczepienia w szkołach zarówno
preparatami przeciwko grypie sezonowej[492,493], jak i pandemicznej H1N1 2009.[494] Jednak szczepienia
przeprowadzane w szkołach mogą implikować
trudności związane z finansowaniem szczepionki
oraz programów szczepień,[493] ponieważ zasady
refundacji mogą się różnić od tych obowiązujących w placówkach ochrony zdrowia. Poza tym dokumentację
szczepień danej osoby należy dostarczyć
do lekarza podstawowej opieki zdrowotnej oraz
do odpowiednich rejestrów stanowych lub lokalnych.
W celu dotarcia do ludzi w starszym wieku należy uwzględnić placówki pozamedyczne, takie jak ośrodki codziennej pomocy dla osób w podeszłym wieku, kluby emerytów i ośrodki rekreacyjne dla osób starszych. W takich placówkach należy przed sezonem epidemicznym proponować szczepienie uczęszczającym do nich osobom, pensjonariuszom i personelowi. Szczepienia należy też oferować w miesiącach jesiennych i zimowych. Ponadto należy podjąć starania, aby zaszczepić nowo przyjętych pacjentów lub pracowników w celu zapobiegania zachorowaniom i przenoszeniu zakażenia z tych osób. W edukacji personelu należy podkreślać zalety szczepienia jako ochrony przed grypą nie tylko dla osoby zaszczepionej, ale całego personelu i pacjentów.
Kierunki badań naukowych i modyfikacji zaleceń w przyszłości
Chociaż dostępne szczepionki przeciwko grypie są skuteczne i bezpieczne, konieczne są dodatkowe badania w celu usprawnienia działań profilaktycznych. Wśród osób z przewlekłymi chorobami największa śmiertelność w przebiegu grypy dotyczy osób >=65 lat,[6,7,24] co stwarza potrzebę opracowania bardziej immunogennych szczepionek przeciwko grypie dla osób zagrożonych większym ryzykiem powikłań grypy. Istnieje również potrzeba prowadzenia dalszych badań w celu zrozumienia potencjalnych błędów systematycznych popełnianych przy szacunkowym określaniu wpływu szczepienia osób w podeszłym wieku na zmniejszenie ryzyka hospitalizacji i zgonów.[134,241,495] Konieczne są dodatkowe badania oceniające względną efektywność i użyteczność kosztów szczepień przeciwko grypie u dzieci i dorosłych, zwłaszcza w wieku <65 lat. W planowaniu takich badań należy uwzględnić coroczną zmienność zapadalności na grypę, ciężkości zachorowań, kosztów i częstości hospitalizacji oraz efektywności szczepień.[496] Konieczne są także dodatkowe dane umożliwiające precyzyjniejsze wyliczenie korzyści dla pacjentów wynikających ze szczepienia personelu ochrony zdrowia[379] oraz oszacowanie wpływu, jaki wywrze zalecenie powszechnych szczepień na epidemiologię grypy, zwłaszcza w odniesieniu do osób obciążonych większym ryzykiem powikłań. Poza tym należy lepiej poznać sposoby motywowania osób, szczególnie z grupy ryzyka powikłań grypy, oraz osób z bliskiego kontaktu do zgłaszania się na coroczne szczepienia przeciwko grypie.
Rozszerzenie zalecenia corocznych szczepień na wszystkie dzieci w wieku od 6 miesięcy do 18 lat będzie wymagało poważnego zwiększenia środków na badania epidemiologiczne w celu zainicjowania długoterminowych obserwacji umożliwiających ocenę wpływu tej decyzji na szerzenie się choroby w populacji. W Kanadzie porównano zalecenie powszechnych szczepień wdrożone w Ontario w 2000 roku z typowymi praktykami stosowanymi w innych kanadyjskich prowincjach. Przeprowadzenie tych badań było trudne, lecz wykazały one, że zalecenie powszechnych corocznych szczepień przeciwko grypie wiąże się z ogólnym zmniejszeniem liczby zgonów z powodu grypy, hospitalizacji, wizyt na oddziałach pomocy doraźnej i w gabinetach lekarskich oraz zużycia antybiotyków.[388,389,396] Jednak różnice pomiędzy systemem ochrony zdrowia w Kanadzie i Stanach Zjednoczonych ograniczają możliwość odniesienia wyników z Ontario do Stanów Zjednoczonych, a ocena wpływu zalecenia powszechnych szczepień w Stanach Zjednoczonych wymaga prawdopodobnie wielu lat. Konieczne będzie także dodatkowe planowanie w celu poprawy systemów monitorowania efektywności, bezpieczeństwa i odsetka osób objętych szczepieniem oraz poprawy strategii wprowadzania zaleceń w życie. Programy szczepień umożliwiające coroczne szczepienia przeciwko grypie dużych populacji mogą stanowić elastyczną i trwałą platformę dla prowadzenia szczepień i monitorowania wyników innych interwencji w zakresie zdrowia publicznego, na które również istnieje pilne zapotrzebowanie (np. szczepień w przypadku zagrożenia pandemią grypy albo podawania preparatów profilaktycznych lub leczniczych przeciwko chorobom spowodowanym atakiem terrorystycznym).
Szczepionka przeciwko grypie sezonowej a grypa ptasia i grypa świń
W całych Stanach Zjednoczonych istnieje obowiązek zgłaszania przypadków zakażeń ludzi nowymi lub innymi niż ludzkie szczepami wirusa grypy A, w tym wirusa grypy A pochodzenia zwierzęcego.[497] Zakażenia te należy szybko zidentyfikować oraz przeanalizować w celu ustalenia potencjalnych źródeł narażenia, identyfikacji innych przypadków zachorowań oraz oceny możliwości przeniesienia choroby z człowieka na człowieka, ponieważ drogi przenoszenia mogą się zmieniać z czasem wraz ze zmianami struktury wirusów grypy A.
W Afryce, Azji i na Bliskim Wschodzie odnotowano sporadyczne ciężkie i śmiertelne zakażenia ludzi silnie chorobotwórczymi wirusami ptasiej grypy A (H5N1), przede wszystkim u osób, które bez zabezpieczenia bezpośrednio lub blisko kontaktowały się z chorymi lub martwymi ptakami, zakażonymi w trakcie masowych zachorowań ptaków wywołanych wirusem H5N1.[498-506] W zakażeniach H5N1, które zakończyły się zgonem, obserwowano ciężką chorobę dolnej części układu oddechowego z niewydolnością wielonarządową, jednak odnotowano również zakażenia bezobjawowe i o łagodnym przebiegu klinicznym.[507-510] Prawdopodobnie w niektórych przypadkach grupowego występowania nastąpiło ograniczone, krótkotrwałe przeniesienie wirusa H5N1 z człowieka na człowieka.[508,511] Dotychczas nie ma dowodów na wymianę fragmentów genomu pomiędzy ludzkim wirusem grypy A i wirusem H5N1. Wirusy wywodzące się ze szczepów obecnie krążących wśród drobiu (np. wirus H5N1, który powodował ogniska zachorowań na ptasią grypę u zwierząt i niekiedy zakażał też ludzi) mają jednak potencjał do rekombinacji z ludzkimi wirusami grypy A.[512,513] W Stanach Zjednoczonych dotychczas nie wykryto silnie chorobotwórczych wirusów grypy H5N1 u dzikiego lub domowego ptactwa. Dostępne są wskazówki dotyczące przeprowadzania testów diagnostycznych u osób z podejrzeniem zakażenia wirusem H5N1 w Stanach Zjednoczonych i obserwacji osób z kontaktu.[514,515] W 2009 i 2010 roku nadal odnotowywano zakażenia H5N1 u ludzi, między innymi w Azji Środkowo-Wschodniej i Południowo-Wschodniej.[516]
Stwierdzono również przypadki zachorowań wśród ludzi wywołane innymi podtypami wirusa ptasiej grypy A, obejmujące zakażenia słabo i silnie chorobotwórczymi wirusami. Zgłoszone zakażenia słabo chorobotwórczymi wirusami ptasiej grypy u ludzi miały różny przebieg kliniczny, na przykład w Wielkiej Brytanii odnotowano zapalenie spojówek wywołane wirusem grypy A (H7N7) oraz zapalenie dolnych dróg oddechowych i zapalenie spojówek wywołane wirusem grypy A (H7N2), a w Hongkongu i Chinach niepowikłaną chorobę grypopodobną wywołaną wirusem grypy A (H9N2).[517-523] W Stanach Zjednoczonych zgłoszono dwa przypadki zakażenia ludzi słabo chorobotwórczym wirusem grypy A (H7N2).[520] Chociaż zakażenia ludzi silnie chorobotwórczymi wirusami H7N7 zwykle przebiegają pod postacią choroby grypopodobnej lub zapalenia spojówek, odnotowano również po kontakcie z drobiem ciężkie zakażenia, a w Holandii jeden przypadek zakończył się zgonem.[524,526] Zapalenie spojówek spowodowane zakażeniem silnie chorobotwórczym wirusem grypy A (H7N3) stwierdzono również w Kanadzie, a słabo chorobotwórczym wirusem A (H7N3) – w Wielkiej Brytanii.[517,525] Z kolei sporadyczne zakażenia silnie chorobotwórczym wirusem ptasiej grypy A (H5N1) były przyczyną ciężkich zachorowań w wielu krajach, przy całkowitym wskaźniku śmiertelności >60%.[508,526]
Wirusy grypy świń typu A (H1N1, H1N2, H3N2), w tym wirusy powstałe w wyniku resegregacji segmentów genomowego RNA (tzw. reasortanty), występują endemicznie w Stanach Zjednoczonych wśród świń.[527] Niedawno odnotowano dwa skupiska zakażeń świń wirusem grypy A (H2N3).[528] Wśród świń do zachorowań dochodzi najczęściej w chłodniejszych miesiącach (późna jesień lub zima) lub czasami po wprowadzeniu nowych osobników do stada podatnego na zakażenie. W Stanach Zjednoczonych szacunkowo u 30% świń stwierdza się serologiczne wskaźniki zakażenia wirusem grypy świń typu A (H1N1); miały tam również miejsce sporadyczne zakażenia różnymi wirusami grypy świń typu A u ludzi, lecz częstość tych zakażeń pozostaje nieznana.[529-534] Osoby zakażone tym wirusem zwykle zgłaszają bezpośredni kontakt z chorymi świniami lub pobyt w miejscu, gdzie takie zwierzęta przebywały (np. targi rolne lub gospodarstwa), a występujących u nich objawów nie można klinicznie odróżnić od zakażeń dróg oddechowych wywołanych innymi wirusami.[531,532,535,536] Zakażenia wirusem świńskiej grypy nie wiązały się z ekspozycją domowników na produkty z wieprzowiny lub z jej spożyciem. W diagnostyce różnicowej choroby grypopodobnej należy uwzględnić grypę świń typu A, jeżeli pacjent miał niedawno kontakt ze świniami. Rzadkie przypadki zachorowań wiązane z kontaktem z zakażonymi świniami nie wywołały transmisji wirusa z człowieka na człowieka ani masowych zachorowań w populacji.[9,536] Wirus pandemicznej grypy A (H1N1) 2009 zawiera pewne geny wcześniej identyfikowane w wirusach, które obecnie krążą w populacji świń, lecz nie stwierdzono definitywnego związku pomiędzy początkiem pandemii a kontaktem człowieka ze świniami. Chociaż odporność na grypę świń typu A w ogólnej populacji ludzi wydaje się mała (<2%), w niektórych badaniach u 10–20% osób stykających się zawodowo ze świniami (np. hodowcy świń lub weterynarze) stwierdzono przeciwciała przeciwko wirusowi grypy świń typu A (H1N1), co stanowi dowód na wcześniejsze zakażenie.[529,537]
Nie oczekuje się, że obecnie stosowane szczepionki przeciwko grypie zapewnią ochronę przed zakażeniem wirusami ptasiej grypy A, w tym wirusem H5N1, czy też ochronę przed obecnie krążącym wyłącznie wśród świń wirusem grypy typu A.[318,448] Niemniej jednak zmniejszenie ryzyka zachorowania na grypę sezonową poprzez szczepienie osób, które mogą być narażone na kontakt z wirusami grypy innymi niż ludzkie (np. wirusy H5N1), może zmniejszyć teoretyczne ryzyko rekombinacji pomiędzy wirusem grypy A pochodzenia zwierzęcego i ludzkim wirusem grypy A. CDC zaleciły, aby osoby zatrudnione przy likwidowaniu ognisk zachorowań na grypę ptasią u drobiu były szczepione przeciwko grypie.[538,539] W ramach planu gotowości do pandemii Occupational Safety and Health Administration (OSHA) wydała instrukcję dotyczącą zachowania bezpieczeństwa dla pracowników mających kontakt z drobiem, która ma zostać wprowadzona na wypadek podejrzenia lub potwierdzenia ogniska zachorowań na ptasią grypę w hodowli drobiu na terenie Stanów Zjednoczonych. Instrukcja OSHA zaleca, aby pracownicy zakładu, w którym nastąpiły zachorowania, otrzymali szczepionkę przeciwko grypie. OSHA zaleca też, żeby personel placówek ochrony zdrowia zajmujący się osobami z podejrzeniem zakażenia lub potwierdzonym zakażeniem ptasią grypą zaszczepiono najnowszą dostępną szczepionką przeciwko grypie, zmniejszając w ten sposób ryzyko równoczesnego zakażenia ludzkim wirusem grypy A.[539]
Zalecenia dotyczące stosowania leków przeciwwirusowych w profilaktyce i leczeniu grypy
Coroczne szczepienia są podstawową strategią zapobiegania powikłaniom grypy. Leki przeciwwirusowe aktywne wobec wirusów grypy stanowią pomocne uzupełnienie profilaktyki, a także są skuteczne w przypadku ich wczesnego zastosowania w leczeniu grypy. W Stanach Zjednoczonych są dostępne cztery zarejestrowane leki przeciwwirusowe: amantadyna, rymantadyna, zanamiwir i oseltamiwir. Nowe leki przeciwwirusowe, takie jak peramiwir i zanamiwir w postaci dożylnej, mogą być dostępne w ramach protokołów badawczych.[540] W trakcie sezonu epidemicznego 2007–2008 w Stanach Zjednoczonych i innych krajach zwiększyła się częstość występowania ludzkich wirusów grypy A (H1N1), w których mutacja spowodowała powstanie oporności na oseltamiwir.[541-543] Według stanu na lipiec 2010 roku w Stanach Zjednoczonych około 99% przebadanych izolatów wirusów ludzkiej grypy sezonowej A (H1N1) (tj. nie związanej z pandemią w 2009 r.) wykazywało oporność na oseltamiwir; oporności tej nie stwierdzono u żadnego z przebadanych izolatów wirusów grypy A (H3N2) i B. Jednak po maju 2009 roku wyizolowano niewiele wirusów grypy sezonowej do przeprowadzenia testów. Według danych z czerwca 2010 roku, z kilkoma wyjątkami, szczepy wirusa grypy pandemicznej A (H1N1) 2009, które zaczęły krążyć w kwietniu 2009 roku, pozostawały wrażliwe na oseltamiwir, a wszystkie były wrażliwe na zanamiwir.[16] Na całym świecie zgłoszono sporadyczne przypadki zakażeń wirusem pandemicznym A (H1N1) 2009 z mutacją H275Y w genie neuraminidazy, wiążącą się z opornością na oseltamiwir. Jednak według stanu na czerwiec 2010 roku, nie wykryto trwałej transmisji tego wirusa w społecznościach. 544 Takie zakażenia wirusami opornymi na oseltamiwir stwierdzono u pacjentów z ciężkim upośledzeniem odporności, u osób otrzymujących oseltamiwir profilaktycznie oraz u osób, które nie przyjmowały wcześniej oseltamiwiru, w tym w niektórych skupiskach zachorowań na grypę.[544-549] Stosując leki przeciwwirusowe w terapii grypy, należy się zapoznać z zaleceniami CDC dotyczą cymi tych preparatów.[15] Nowe wytyczne postępowania klinicznego w grypie, obejmujące stosowanie leków przeciwgrypowych, udostępnia również Infectious Diseases Society of America i Światowa Organizacja Zdrowia.[550-552] Zalecenia ACIP dotyczące leków przeciwwirusowe zostaną opublikowane oddzielnie, jeszcze w 2010 roku.(...)
_________________________________________________________________
a Chorobę grypopodobną (ILI) definiuje się jako gorączkę
(temp. ciała >37,8°C) oraz kaszel i/lub ból gardła
przy braku znanej przyczyny, innej niż grypa.
b Pozostawiono informacje, które dotyczą trójwalentnych
szczepionek inaktywowanych (TIV), jedynej
grupy preparatów dostępnych w Polsce; w polskim
tłumaczeniu usunięto natomiast zalecenia i uwagi,
które dotyczą "żywych" szczepionek przeciwko grypie
(LAIV) – przyp. red.
Piśmiennictwo
1. Monto A.S., Kioumehr F.: The Tecumseh Study of Respiratory Illness. IX. Occurrence of influenza
in the community, 1966–1971. Am. J. Epidemiol., 1975; 102: 553–563
2. Glezen W.P., Couch R.B.: Interpandemic influenza in the Houston area, 1974–1976.
N. Engl. J. Med., 1978; 298: 587–592
3. Glezen W.P., Greenberg S.B., Atmar R.L., et al.: Impact of respiratory virus infections
on persons with chronic underlying conditions. JAMA, 2000; 283: 499–505
4. Barker W.H.: Excess pneumonia and influenza associated hospitalization during influenza
epidemics in the United States, 1970–1978. Am. J. Public Health, 1986; 76: 761–765
5. Barker W.H., Mullooly J.P.: Impact of epidemic type A influenza in a defined adult population.
Am. J. Epidemiol., 1980; 112: 798–811
6. Thompson W.W., Shay D.K., Weintraub E., et al.: Mortality associated with influenza and
respiratory syncytial virus in the United States. JAMA, 2003; 289: 179–186
7. Thompson W.W., Shay D.K., Weintraub E., et al.: Influenza-associated hospitalizations
in the United States. JAMA, 2004; 292: 1333–1340
8. Cox N.J., Subbarao K.: Influenza. Lancet, 1999; 354: 1277–1282
9. Dawood F.S., Jain S., Finelli L., et al.: Emergence of a novel swine-origin influenza A (H1N1) virus in humans. N. Engl. J. Med., 2009; 360: 2605–2615
10. World Health Organization. New influenza A (H1N1) virus: global epidemiological situation,
June 2009. Wkly Epidemiol. Rec., 2009; 84: 249–257
11. CDC. Update: influenza activity – United States, August 30, 2009–January 9, 2010. MMWR,
2010; 59: 38–43
12. Jain S., Kamimoto L., Bramley A.M., et al.: Hospitalized patients with 2009 H1N1 influenza
in the United States, April–June 2009. N. Engl. J. Med., 2009; 361: 1935–1944
13. CDC. Influenza vaccination coverage among children and adults – United States, 2008–09
influenza season. MMWR, 2009; 58: 1091–1095
14. Task Force on Community Prevention Services. The guide to community preventive
services. New York, NY: Oxford University Press; 2005. Available at http://www.thecommunityguide.org/library/book/index.html. Accessed July 12, 2010
15. CDC. Updated interim recommendations for the use of antiviral medications in the treatment
and prevention of influenza for the 2009–10 season. Available at http://www.cdc.gov/H1N1flu/recommendations.htm. Accessed July 12, 2010
16. World Health Organization. Update on oseltamivir-resistant influenza A (H1N1) 2009
influenza virus: January 2010. Wkly Epidemiol. Rec., 2010; 85: 37–40
17. Nichol K.L., Treanor J.J.: Vaccines for seasonal and pandemic influenza. J. Infect. Dis. 2006;
194 (supl. 2): S111–S118
18. Smith N.M., Shay D.K.: Influenza vaccination for elderly people and their care workers.
Lancet, 2006; 368: 1752–1753
19. Ellenberg S.S., Foulkes M.A., Midthun K., et al.: Evaluating the safety of new vaccines:
summary of a workshop. Am. J. Public Health, 2005; 95: 800–807
20. Institute of Medicine. Vaccine safety research, data access, and public trust. Washington,
DC, National Academies Press, 2005
21. Chen R.T., DeStefano F., Davis R.L., et al.: The Vaccine Safety Datalink: immunization
research in health maintenance organizations in the USA. Bull. World Health Organ.,
2000; 78: 186–194
22. Bartlett D.L., Ezzati-Rice T.M., Stokley S., et al.: Comparison of NIS and NHIS/NIPRCS vaccination
coverage estimates. National Immunization Survey. National Health Interview
Survey/National Immunization Provider Record Check Study. Am. J. Prev. Med., 2001;
20: 25–27
23. Kumar A., Zarychanski R., Pinto R., et al.: Critically ill patients with 2009 influenza A (H1N1) infection in Canada. JAMA, 2009; 302: 1872–1879
24. Louie J.K., Acosta M., Winter K., et al.: Factors associated with death or hospitalization
due to pandemic 2009 influenza A (H1N1) infection in California. JAMA, 2009; 302:
1896–1902
25. Echevarria-Zuno S., Mejia-Arangure J.M., Mar-Obeso A.J., et al.: Infection and death
from influenza A H1N1 virus in Mexico: a retrospective analysis. Lancet, 2009; 374:
2072–2079
26. CDC. FluView: week ending May 20, 2010. Available at http://www.cdc.gov/flu/weekly>.Accessed July 12, 2010
27. CDC. Update: influenza activity – United States, August 30, 2009–March 27, 2010, and
composition of the 2010–11 influenza vaccine. MMWR, 2010; 59: 423–430
28. Garten R.J., Davis C.T., Russell C.A., et al.: Antigenic and genetic characteristics
of swine-origin 2009 A (H1N1) influenza viruses circulating in humans. Science, 2009;
325: 197–201
29. Nelson M.I., Viboud C., Simonsen L., et al.: Multiple reassortment events in the evolutionary
history of H1N1 influenza A virus since 1918. PLoS Pathog., 2008; 4: e1 000 012
30. Russell C.A., Jones T.C., Barr I.G., et al.: The global circulation of seasonal influenza A (H3N2) viruses. Science, 2008; 320: 340–346
31. Xu X., Lindstrom S.E., Shaw M.W., et al.: Reassortment and evolution of current human
influenza A and B viruses. Virus Res. 2004; 103: 55–60
32. Clements M.L., Betts R.F., Tierney E.L., et al.: Serum and nasal wash antibodies associated
with resistance to experimental challenge with influenza A wild-type virus. J. Clin.
Microbiol., 1986; 24: 157–160
33. Couch R.B., Kasel J.A.: Immunity to influenza in man. Ann. Rev. Microbiol., 1983; 37:
529–549
34. Cooney M.K., Fox J.P., Hall C.E.: The Seattle Virus Watch. VI. Observations of infections
with and illness due to parainfluenza, mumps and respiratory syncytial viruses and
Mycoplasma pneumoniae. Am. J. Epidemiol., 1975; 101: 532–551
35. Glezen W.P., Taber L.H., Frank A.L., et al.: Risk of primary infection and reinfection with
respiratory syncytial virus. Am. J. Dis. Child., 1986; 140: 543–546
36. Glezen W.P.: Morbidity associated with the major respiratory viruses. Pediatr. Ann., 1990;
19: 535–540
37. CDC. Update: novel influenza A (H1N1) virus infections – worldwide, May 6, 2009. MMWR,
2009; 58: 453–458
38. CDC. Update: influenza activity – United States, August 30, 2009–January 9, 2010.
MMWR, 2010; 59: 38–43
39. Walter N.D., Taylor T.H., Shay D.K., et al.: Influenza circulation and the burden of invasive
pneumococcal pneumonia during a non-pandemic period in the United States. Clin.
Infect. Dis., 2010; 50: 175–183
40. Thompson W.W., Moore M.R., Weintraub E., et al.: Estimating influenza-associated
deaths in the United States. Am. J. Public Health, 2009; 99 (suppl. 2): S225–S230
41. Thompson W.W., Weintraub E., Dhankhar P., et al.: Estimates of US influenza-associated
deaths made using four different methods. Influenza Other Respi. Viruses, 2009; 3:
37–49
42. Simonsen L., Taylor R., Viboud C., et al.: US flu mortality estimates are based on solid
science. BMJ, 2006; 332: 177–178
43. Simonsen L., Clarke M.J., Williamson G.D., et al.: The impact of influenza epidemics
on mortality: introducing a severity index. Am. J. Public Health, 1997; 87: 1944–1950
44. Mullooly J.P., Bridges C.B., Thompson W.W., et al.: Influenza- and RSV-associated hospitalizations
among adults. Vaccine, 2007; 25: 846–855
45. O'Brien M.A., Uyeki T.M., Shay D.K., et al.: Incidence of outpatient visits and hospitalizations
related to influenza in infants and young children. Pediatrics, 2004; 113:
585–593
46. Keren R., Zaoutis T.E., Bridges C.B., et al.: Neurological
and neuromuscular disease as a risk factor for respiratory failure in children hospitalized with influenza infection. JAMA, 2005; 294: 2188–2194
47. Neuzil K.M., Wright P.F., Mitchel E.F. Jr., Griffin M.R.: The burden of influenza illness
in children with asthma and other chronic medical conditions. J. Pediatr., 2000; 137:
856–864
48. Louie J.K., Acosta M., Jamieson D.J., et al.: Severe 2009 H1N1 influenza in pregnant and
postpartum women in California. N. Engl. J. Med., 2009; 362: 27–35
49. Libster R., Bugna J., Coviello S., et al.: Pediatric hospitalizations associated with 2009
pandemic influenza A (H1N1) in Argentina. N. Engl. J. Med., 2010; 362: 45–55
50. Viboud C., Miller M., Olson D., et al.: Preliminary estimates of mortality and years of
life lost associated with the 2009 a/h1n1 pandemic in the US and comparison with past
influenza seasons. PLoS Curr. Influenza, 2010: RRN1153
51. Cauchemez S., Donnelly C.A., Reed C., et al.: Household transmission of 2009 pandemic
influenza A (H1N1) virus in the United States. N. Engl. J. Med., 2009; 361: 2619–2627
52. Hancock K., Veguilla V., Lu X., et al.: Cross-reactive antibody responses to the 2009
pandemic H1N1 influenza virus. N. Engl. J. Med., 2009; 361: 1945–1952
53. Wei C.J., Boyington J.C., Dai K., et al.: Cross-neutralization of 1918 and 2009 influenza
viruses: role of glycans in viral evolution and vaccine design. Sci. Transl. Med., 2010; 2:
24ra21
54. Poehling K.A., Edwards K.M., Weinberg G.A., et al.: The underrecognized burden of influenza
in young children. N. Engl. J. Med., 2006; 355: 31–40
55. Olson D.R., Heffernan R.T., Paladini M., et al.: Monitoring the impact of influenza by
age: emergency department fever and respiratory complaint surveillance in New York
City. PLoS Med., 2007; 4: e247
56. Neuzil K.M., Zhu Y., Griffin M.R., et al.: Burden of interpandemic influenza in children
younger than 5 years: a 25-year prospective study. J. Infect. Dis., 2002; 185: 147–152
57. Neuzil K.M., Mellen B.G., Wright P.F., et al.: The effect of influenza on hospitalizations,
outpatient visits, and courses of antibiotics in children. N. Engl. J. Med., 2000; 342:
225–231
58. Bourgeois F.T., Valim C., Wei J.C., et al.: Influenza and other respiratory virus-related
emergency department visits among young children. Pediatrics, 2006; 118: e1–e8
59. Simonsen L., Fukuda K., Schonberger L.B., et al.: The impact of influenza epidemics
on hospitalizations. J. Infect. Dis., 2000; 181: 831–837
60. Glezen W.P., Decker M., Perrotta D.M.: Survey of underlying conditions of persons hospitalized
with acute respiratory disease during influenza epidemics in Houston, 1978–1981.
Am. Rev. Respir. Dis., 1987; 136: 550–555
61. Izurieta H.S., Thompson W.W., Kramarz P. et al.: Influenza and the rates of hospitalization
for respiratory disease among infants and young children. N. Engl. J. Med., 2000; 342:
232–239
62. Mullooly J.P., Barker W.H.: Impact of type A influenza on children: a retrospective study.
Am. J. Public Health, 1982; 72: 1008–1016
63. Ampofo K., Gesteland P.H., Bender J., et al.: Epidemiology, complications, and cost
of hospitalization in children with laboratory-confirmed influenza infection. Pediatrics,
2006; 118: 2409–2417
64. Coffin S.E., Zaoutis T.E., Rosenquist A.B., et al.: Incidence, complications, and risk
factors for prolonged stay in children hospitalized with community-acquired influenza.
Pediatrics, 2007; 119: 740–748
65. Iwane M.K., Edwards K.M., Szilagyi P.G., et al.: Population-based surveillance for hospitalizations
associated with respiratory syncytial virus, influenza virus, and parainfluenza
viruses among young children. Pediatrics, 2004; 113: 1758–1764
66. Schrag S.J., Shay D.K., Gershman K., et al.: Multistate surveillance for laboratory-confirmed,
influenza-associated hospitalizations in children: 2003–2004. Pediatr. Infect.
Dis. J., 2006; 25: 395–400
67. Miller E.K., Griffin M.R., Edwards K.M., et al.: Influenza burden for children with asthma.
Pediatrics, 2008; 121: 1–8
68. Bhat N., Wright J.G., Broder K.R., et al.: Influenza-associated deaths among children
in the United States, 2003–2004. N. Engl. J. Med., 2005; 353: 2559–2567
69. Louie J.K., Schechter R., Honarmand S. et al.: Severe pediatric influenza in California,
2003–2005: implications for immunization recommendations. Pediatrics, 2006; 117:
e610–e618
70. CDC. Influenza activity – United States and worldwide, 2007–2008 season. MMWR,
2008; 57: 692–697
71. CDC. Updated CDC estimates of 2009 H1N1 influenza cases, hospitalizations and deaths
in the United States, April 2009–February 13, 2010. Available at http://www.cdc.gov/h1n1flu/estimates_2009_h1n1.htm. Accessed July 12, 2010
72. Finelli L., Fiore A., Dhara R., et al.: Influenza-associated pediatric mortality
in the United States: increase of Staphylococcus aureus coinfection. Pediatrics, 2008;
122: 805–811
73. Reed C., Kallen A.J., Patton M., et al.: Infection with community-onset Staphylococcus
aureus and influenza virus in hospitalized children. Pediatr. Infect. Dis. J., 2009; 28:
572–576
74. Creech C.B. 2nd, Kernodle D.S., Alsentzer A., et al.: Increasing rates of nasal carriage
of methicillin-resistant Staphylococcus aureus in healthy children. Pediatr. Infect. Dis. J.,
2005; 24: 617–621
75. CDC. Severe methicillin-resistant Staphylococcus aureus community-acquired pneumonia
associated with influenza – Louisiana and Georgia, December 2006–January 2007.
MMWR, 2007; 56: 325–329
76. Olsen G.W., Burris J.M., Burlew M.M., et al.: Absenteeism among employees who participated
in a workplace influenza immunization program. J. Occup. Environ. Med., 1998;
40: 311–316
77. Bridges C.B., Thompson W.W., Meltzer M.I., et al.: Effectiveness and cost-benefit of
influenza vaccination of healthy working adults: a randomized controlled trial. JAMA,
2000; 284: 1655–1663
78. Molinari N.A., Ortega-Sanchez I.R., Messonnier M.L., et al.: The annual impact of
seasonal influenza in the US: measuring disease burden and costs. Vaccine, 2007; 25:
5086–5096
79. Nichol K.L., Mallon K.P., Mendelman P.M.: Cost benefit of influenza vaccination in healthy,
working adults: an economic analysis based on the results of a clinical trial of trivalent
live attenuated influenza virus vaccine. Vaccine, 2003; 21: 2207–2217
80. Campbell D.S., Rumley M.H.: Cost-effectiveness of the influenza vaccine in a healthy,
working-age population. J. Occup. Environ. Med., 1997; 39: 408–414
81. Dominguez-Cherit G., Lapinsky S.E., Macias A.E., et al.: Critically ill patients with 2009
influenza A (H1N1) in Mexico. JAMA, 2009; 302: 1880–1887
82. Lee E.H., Wu C., Lee, E.U., et al.: Fatalities associated with the 2009 H1N1 influenza A virus in New York City. Clin. Infect. Dis., 2010; 50; 1498–1504
83. Mauad T., Hajjar L.A., Callegari G.D., et al.: Lung pathology in fatal novel human influenza A (H1N1) infection. Am. J. Respir. Crit. Care Med., 2010; 181: 72–79
84. Estenssoro E., Rios F.G., Apezteguia C., et al.: Pandemic 2009 influenza A (H1N1) in
Argentina: a study of 337 patients on mechanical ventilation. Am. J. Respir. Crit. Care
Med., 2010 (Epub Mar 4, 2010)
85. Morgan O.W., Bramley A., Fowlkes A., et al.: Morbid obesity as a risk factor for hospitalization
and death due to 2009 pandemic influenza A (H1N1) disease. PLoS ONE, 2010; 5:
e9694
86. CDC. Intensive-care patients with severe novel influenza A (H1N1) virus infection –
Michigan, June 2009. MMWR, 2009; 58: 749–752
87. Webb S.A., Pettila V., Seppelt I., et al.: Critical care services and 2009 H1N1 influenza
in Australia and New Zealand. N. Engl. J. Med., 2009; 361: 1925–1934
88. Baker M.G., Wilson N., Huang Q.S., et al.: Pandemic influenza A (H1N1)v in New Zealand:
the experience from April to August 2009. Euro Surveill., 2009; 14
89. La Ruche G., Tarantola A., Barboza P., et al.: The 2009 pandemic H1N1 influenza and
indigenous populations of the Americas and the Pacific. Euro Surveill., 2009; 14
90. CDC. Deaths related to 2009 pandemic influenza A (H1N1) among American Indian/
Alaska Natives – 12 states, 2009. MMWR, 2009; 58: 1341–1344
91. Zarychanski R., Stuart T.L., Kumar A., et al.: Correlates of severe disease in patients with
2009 pandemic influenza (H1N1) virus infection. CMAJ, 2010; 182: 257–264
92. Groom A.V., Jim C., Laroque M., et al.: Pandemic influenza preparedness and vulnerable
populations in tribal communities. Am. J. Public Health, 2009; 99 (suppl. 2):
S271–S278
93. Hutchins S.S., Fiscella K., Levine R.S., et al.: Protection of racial/ethnic minority
populations during an influenza pandemic. Am. J. Public Health, 2009; 99 (suppl. 2):
S261–S270
94. Couch R.B.: Influenza, influenza virus vaccine, and human immunodeficiency virus
infection. Clin. Infect. Dis., 1999; 28: 548–551
95. Fine A.D., Bridges C.B., De Guzman A.M., et al.: Influenza A among patients with human
immunodeficiency virus: an outbreak of infection at a residential facility in New York
City. Clin. Infect. Dis., 2001; 32: 1784–1791
96. Radwan H.M., Cheeseman S.H., Lai K.K., et al.: Influenza in human immunodeficiency
virus-infected patients during the 1997–1998 influenza season. Clin. Infect. Dis., 2000;
31: 604–606
97. Safrin S., Rush J.D., Mills J.: Influenza in patients with human immunodeficiency
virus
infection. Chest, 1990; 98: 33–37
98. Tasker S.A., O'Brien W.A., Treanor J.J., et al.: Effects of influenza vaccination
in HIV-infected adults: a double-blind, placebo-controlled trial. Vaccine, 1998; 16:
1039–1042
99. Neuzil K.M., Reed G.W., Mitchel E.F. Jr., et al.: Influenza-associated morbidity and mortality
in young and middle-aged women. JAMA, 1999; 281: 901–907
100. Lin J.C., Nichol K.L.: Excess mortality due to pneumonia or influenza during influenza
seasons among persons with acquired immunodeficiency syndrome. Arch. Intern. Med.,
2001; 161: 441–446
101. Harris J.: Influenza occurring in pregnant women: a statistical study of thirteen hundred
and fifty cases. JAMA, 1919; 72: 978–980
102. Freeman D.W., Barno A.: Deaths from Asian influenza associated with pregnancy.
Am. J. Obstet. Gynecol., 1959; 78: 1172–1175
103. Naleway A.L., Smith W.J., Mullooly J.P.: Delivering influenza vaccine to pregnant women.
Epidemiol. Rev., 2006; 28: 47–53
104. Widelock D., Csizmas L., Klein S.: Influenza, pregnancy, and fetal outcome. Public Health
Rep., 1963; 78: 1–11
105. Louria D.B., Blumenfeld H.L., Ellis J.T. et al.: Studies on influenza in the pandemic
of 1957–1958. II. Pulmonary complications of influenza. J. Clin. Invest., 1959; 38:
213–265
106. Jamieson D.J., Honein M.A., Rasmussen S.A., et al.: H1N1 2009 influenza virus infection
during pregnancy in the USA. Lancet, 2009; 374: 451–458
107. 2009 pandemic influenza A (H1N1) in pregnant women requiring intensive care – New
York City, 2009. MMWR, 2010; 59: 321–326
108. Creanga A.A., Johnson T.F., Graitcer S.B., et al.: Severity of 2009 pandemic influenza A (H1N1) virus infection in pregnant women. Obstet. Gynecol., 2010; 115: 717–726
109. Irving W.L., James D.K., Stephenson T. et al.: Influenza virus infection in the second and
third trimesters of pregnancy: a clinical and seroepidemiological study. BJOG, 2000;
107: 1282–1289
110. Kirshon B., Faro S., Zurawin R.K., et al.: Favorable outcome after treatment with amantadine
and ribavirin in a pregnancy complicated by influenza pneumonia. A case report.
J. Reprod. Med., 1988; 33: 399–401
111. Neuzil K.M., Reed G.W., Mitchel E.F., et al.: Impact of influenza on acute cardiopulmonary
hospitalizations in pregnant women. Am. J. Epidemiol., 1998; 148: 1094–1102
112. Schoenbaum S.C., Weinstein L.: Respiratory infection in pregnancy. Clin. Obstet. Gynecol.,
1979; 22: 293–300
113. Shahab S., Glezen W.: Influenza virus. In: Gonik B., eds: Viral diseases in pregnancy.
New York, Springer-Verlag, 1994: 215–223
114. Kort B.A., Cefalo R.C., Baker V.V.: Fatal influenza A pneumonia in pregnancy.
Am. J. Perinatol., 1986; 3: 179–182
115. Mullooly J.P., Barker W.H., Nolan T.F. Jr.: Risk of acute respiratory disease among pregnant
women during influenza A epidemics. Public Health Rep., 1986; 101: 205–211
116. Cox S., Posner S.F., McPheeters M., et al.: Hospitalizations with respiratory illness among
pregnant women during influenza season. Obstet. Gynecol., 2006; 107: 1315–1322
117. Dodds L., McNeil S.A., Fell D.B., et al.: Impact of influenza exposure on rates of hospital
admissions and physician visits because of respiratory illness among pregnant women.
CMAJ, 2007; 176: 463–468
118. Hartert T.V., Neuzil K.M., Shintani A.K., et al.: Maternal morbidity and perinatal outcomes
among pregnant women with respiratory hospitalizations during influenza season.
Am. J. Obstet. Gynecol., 2003; 189: 1705–1712
119. Griffiths P.D., Ronalds C.J., Heath R.B.: A prospective study of influenza infections during
pregnancy. J. Epidemiol. Community Health, 1980; 34: 124–128
120. Siston A.M., Rasmussen S.A., Honein M.A., et al.: Pandemic 2009 influenza A (H1N1) virus
illness among pregnant women in the United States. JAMA, 2010; 303: 1517–1525
121. McGeer A., Green K.A., Plevneshi A., et al.: Antiviral therapy and outcomes of influenza
requiring hospitalization in Ontario, Canada. Clin. Infect. Dis., 2007; 45: 1568–1575
122. Grayson M.L., Melvani S., Druce J., et al.: Efficacy of soap and water and alcohol-based
hand-rub preparations against live H1N1 influenza virus on the hands of human volunteers.
Clin. Infect. Dis., 2009; 48: 285–291
123. Jefferson T., Foxlee R., Del Mar C., et al.: Interventions for the interruption or reduction
of the spread of respiratory viruses. Cochrane Database Syst. Rev., 2007; (4):
CD006 207
124. Luby S.P., Agboatwalla M., Feikin D.R., et al.: Effect of handwashing on child health: a randomised controlled trial. Lancet, 2005; 366: 225–233
125. Inglesby T.V., Nuzzo J.B., O'Toole T. et al.: Disease mitigation measures in the control
of pandemic influenza. Biosecur. Bioterror., 2006; 4: 366–375
126. Bell D.M.: Non-pharmaceutical interventions for pandemic influenza, national and community
measures. Emerg. Infect. Dis., 2006; 12: 88–94
127. Aiello A.E., Coulborn R.M., Aragon T.J., et al.: Research findings from nonpharmaceutical
intervention studies for pandemic influenza and current gaps in the research. Am.
J. Infect. Control, 2010; 38: 251–258
128. Aiello A.E., Murray G.F., Perez V., et al.: Mask use, hand hygiene, and seasonal influenza-like
illness among young adults: a randomized intervention trial. J. Infect. Dis., 2010;
201: 491–498
129. France A.M., Jackson M., Schrag S., et al.: Household transmission of 2009 influenza A (H1N1) virus after a school-based outbreak in New York City, April–May 2009. J. Infect.
Dis., 2010; 201: 984–992
130. Cowling B.J., Zhou Y., Ip D.K., et al.: Face masks to prevent transmission of influenza virus: a systematic review. Epidemiol. Infect., 2010; 138: 449–456
131. MacIntyre C.R., Cauchemez S., Dwyer D.E., et al.: Face mask use and control of respiratory
virus transmission in households. Emerg. Infect. Dis., 2009; 15: 233–241
132. Cowling B.J., Chan K.H., Fang V.J., et al.: Facemasks and hand hygiene to prevent influenza
transmission in households: a cluster randomized trial. Ann. Intern. Med., 2009; 151:
437–446
133. Nichol K.L.: Heterogeneity of influenza case definitions and implications for interpreting
and comparing study results. Vaccine, 2006; 24: 6726–6728
134. Jackson L.A., Jackson M.L., Nelson J.C., et al.: Evidence of bias in estimates of influenza
vaccine effectiveness in seniors. Int. J. Epidemiol., 2006; 35: 337–344
135. Simonsen L., Taylor R.J., Viboud C., et al.: Mortality benefits of influenza vaccination
in elderly people: an ongoing controversy. Lancet Infect. Dis., 2007; 7: 658–666
136. Food and Drug Administration. Influenza virus vaccine for the 2010–2011 season. Available
at http://www.fda.gov/BiologicsBloodVaccines/GuidanceComplianceRegulatoryInform
ation/Post-MarketActivities/LotReleases/ucm202750.htm. Accessed July 12, 2010
137. Kilbourne E.: Influenza. New York, Plenum Medical Book Company, 1987
138. Oxford J.S., Schild G.C., Potter C.W., et al.: The specificity of the anti-haemagglutinin
antibody response induced in man by inactivated influenza vaccines and by natural
infection. J. Hyg. (Lond), 1979; 82: 51–61
139. Neuzil K.M., Dupont W.D., Wright P.F., et al.: Efficacy of inactivated and cold-adapted
vaccines against influenza A infection, 1985 to 1990: the pediatric experience. Pediatr.
Infect. Dis. J., 2001; 20: 733–740
140. Potter C.W., Oxford J.S.: Determinants of immunity to influenza infection in man. Br. Med.
Bull., 1979; 35: 69–75
141. Hirota Y., Kaji M., Ide S., et al.: Antibody efficacy as a keen index to evaluate influenza
vaccine effectiveness. Vaccine, 1997; 15: 962–967
142. La Montagne J.R., Noble G.R., Quinnan G.V., et al.: Summary of clinical trials of inactivated
influenza vaccine – 1978. Rev. Infect. Dis., 1983; 5: 723–736
143. Treanor J., Wright P.F.: Immune correlates of protection against influenza in the human
challenge model. Dev. Biol. (Basel), 2003; 115: 97–104
144. Belshe R.B., Nichol K.L., Black S.B., et al.: Safety, efficacy, and effectiveness of live, attenuated,
cold-adapted influenza vaccine in an indicated population aged 5–49 years.
Clin. Infect. Dis., 2004; 39: 920–927
145. Foy H.M., Cooney M.K., McMahan R.: A Hong Kong influenza immunity three years after
immunization. JAMA, 1973; 226: 758–761
146. Couch R.B., Keitel W.A., Cate T.R.: Prevention of influenza virus infections by current
inactivated influenza vaccines. In: Brown L.E., Hampson A.W., Webster R.G., (eds.):
Options for the control of influenza III. Amsterdam, Netherlands, Elsevier, 1996
147. Bernstein D.I., Yan L., Treanor J., et al.: Effect of yearly vaccinations with live, attenuated,
cold-adapted, trivalent, intranasal influenza vaccines on antibody responses in children.
Pediatr. Infect. Dis. J., 2003; 22: 28–34
148. Gaglani M.J., Piedra P.A., Herschler G.B., et al.: Direct and total effectiveness of the intranasal,
live-attenuated, trivalent cold-adapted influenza virus vaccine against
the 2000–2001 influenza A (H1N1) and B epidemic in healthy children. Arch. Pediatr.
Adolesc. Med., 2004; 158: 65–73
149. McElhaney J.E.: The unmet need in the elderly: designing new influenza vaccines for older
adults. Vaccine, 2005; 23 (suppl. 1): S10–S25
150. Goodwin K., Viboud C., Simonsen L.: Antibody response to influenza vaccination in the elderly: a quantitative review. Vaccine, 2006; 24: 1159–1169
151. Skowronski D.M., Tweed S.A., De Serres G.: Rapid decline of influenza vaccine-induced
antibody in the elderly: is it real, or is it relevant? J. Infect. Dis., 2008; 197: 490–502
152. Song J.Y., Cheong H.J., Hwang I.S., et al.: Long-term immunogenicity of influenza vaccine
among the elderly: risk factors for poor immune response and persistence. Vaccine, 2010;
28: 3929–3935
153. Daubeney P., Taylor C.J., McGaw J., et al.: Immunogenicity and tolerability of a trivalent
influenza subunit vaccine (Influvac) in high-risk children aged 6 months to 4 years. Br.
J. Clin. Pract., 1997; 51: 87–90
154. Gonzalez M., Pirez M.C., Ward E., et al.: Safety and immunogenicity of a paediatric presentation
of an influenza vaccine. Arch. Dis. Child., 2000; 83: 488–491
155. Negri E., Colombo C., Giordano L., et al.: Influenza vaccine in healthy children: a meta-analysis.
Vaccine, 2005; 23: 2851–2861
156. Wright P.F., Cherry J.D., Foy H.M., et al.: Antigenicity and reactogenicity of influenza
A/USSR/77 virus vaccine in children – a multicentered evaluation of dosage and safety.
Rev. Infect. Dis., 1983; 5: 758–764
157. Wright P.F., Thompson J., Vaughn W.K., et al.: Trials of influenza A/New Jersey/76 virus
vaccine in normal children: an overview of age-related antigenicity and reactogenicity.
J. Infect. Dis., 1977; 136 (supl.): S731–S741
158. Arguedas A., Soley C., Lindert K.: Responses to 2009 H1N1 vaccine in children 3 to 17
years of age. N. Engl. J. Med., 2010; 362: 370–372
159. Nolan T., McVernon J., Skeljo M., et al.: Immunogenicity of a monovalent 2009 influenza A (H1N1) vaccine in infants and children: a randomized trial. JAMA, 2010; 303: 37–46
160. Plennevaux E., Sheldon E., Blatter M., et al.: Immune response after a single vaccination
against 2009 influenza A H1N1 in USA:a preliminary report of two randomised controlled
phase 2 trials. Lancet, 2009; 375: 41–48
161. Neuzil K.M., Jackson L.A., Nelson J., et al.: Immunogenicity and reactogenicity of 1 versus 2 doses of trivalent inactivated influenza vaccine in vaccine-naive 5–8-year-old children.
J. Infect. Dis., 2006; 194: 1032–1039
162. Walter E.B., Neuzil K.M., Zhu Y., et al.: Influenza vaccine immunogenicity in 6- to
23-month-old children: are identical antigens necessary for priming? Pediatrics, 2006;
118: e570–e578
163. Englund J.A., Walter E.B., Gbadebo A., et al.: Immunization with trivalent inactivated
influenza vaccine in partially immunized toddlers. Pediatrics, 2006; 118: e579–e585
164. Englund J.A., Walter E.B., Fairchok M.P., et al.: A comparison of 2 influenza vaccine
schedules in 6- to 23-month-old children. Pediatrics, 2005; 115: 1039–1047
165. Allison M.A., Daley M.F., Crane L.A., et al.: Influenza vaccine effectiveness in healthy 6- to
21-month-old children during the 2003–2004 season. J. Pediatr., 2006; 149: 755–762
166. Bell T.D., Chai H., Berlow B., et al.: Immunization with killed influenza virus in children
with chronic asthma. Chest, 1978; 73: 140–145
167. Groothuis J.R., Lehr M.V., Levin M.J.: Safety and immunogenicity of a purified haemagglutinin
antigen in very young high-risk children. Vaccine, 1994; 12: 139–141
168. Park C.L., Frank A.L., Sullivan M., et al.: Influenza vaccination of children during acute asthma
exacerbation and concurrent prednisone therapy. Pediatrics, 1996; 98: 196–200
169. Ritzwoller D.P., Bridges C.B., Shetterly S., et al.: Effectiveness of the 2003–2004 influenza
vaccine among children 6 months to 8 years of age, with 1 vs. 2 doses. Pediatrics, 2005;
116: 153–159
170. Shuler C.M., Iwamoto M., Bridges C.B., et al.: Vaccine effectiveness against medically
attended, laboratory-confirmed influenza among children aged 6 to 59 months,
2003–2004. Pediatrics, 2007; 119: e587–e595
171. Clover R.D., Crawford S., Glezen W.P., et al.: Comparison of heterotypic protection against
influenza A/Taiwan/86 (H1N1) by attenuated and inactivated vaccines to A/Chile/83–like
viruses. J. Infect. Dis., 1991; 163: 300–304
172. Hoberman A., Greenberg D.P., Paradise J.L., et al.: Effectiveness of inactivated influenza
vaccine in preventing acute otitis media in young children: a randomized controlled trial.
JAMA, 2003; 290: 1608–1616
173. Eisenberg K.W., Szilagyi P.G., Fairbrother G., et al.: Vaccine effectiveness against laboratory-confirmed
influenza in children 6 to 59 months of age during the 2003–2004 and
2004–2005 influenza seasons. Pediatrics, 2008; 122: 911–919
174. Zangwill K.M., Belshe R.B.: Safety and efficacy of trivalent inactivated influenza vaccine
in young children: a summary for the new era of routine vaccination. Pediatr. Infect.
Dis. J., 2004; 23: 189–197
175. Jefferson T., Rivetti A., Harnden A., et al.: Vaccines for preventing influenza in healthy
children. Cochrane Database Syst. Rev., 2008; (2): CD004 879
176. Sugaya N., Nerome K., Ishida M., et al.: Efficacy of inactivated vaccine in preventing
antigenically drifted influenza type A and well-matched type B. JAMA, 1994; 272:
1122–1126
177. Kramarz P., Destefano F., Gargiullo P.M., et al.: Does influenza vaccination prevent asthma
exacerbations in children? J. Pediatr., 2001; 138: 306–310
178. Ong B.A., Forester J., Fallot A.: Does influenza vaccination improve pediatric asthma
outcomes? J. Asthma, 2009; 46: 477–480
179. Clements D.A., Langdon L., Bland C., et al.: Influenza A vaccine decreases the incidence
of otitis media in 6- to 30-month-old children in day care. Arch. Pediatr. Adolesc. Med.,
1995; 149: 1113–1117
180. Heikkinen T., Ruuskanen O., Waris M., et al.: Influenza vaccination in the prevention
of acute otitis media in children. Am. J. Dis. Child., 1991; 145: 445–448
181. Gross P.A., Weksler M.E., Quinnan G.V. Jr., et al.: Immunization of elderly people with two
doses of influenza vaccine. J. Clin. Microbiol., 1987; 25: 1763–1765
182. Feery B.J., Cheyne I.M., Hampson A.W., et al.: Antibody response to one and two doses
of influenza virus subunit vaccine. Med. J. Aust., 1976; 1: 186, 188–189
183. Levine M., Beattie B.L., McLean D.M.: Comparison of one- and two-dose regimens of influenza
vaccine for elderly men. CMAJ, 1987; 137: 722–726
184. Greenberg M.E., Lai M.H., Hartel G.F., et al.: Response to a monovalent 2009 influenza A (H1N1) vaccine. N. Engl. J. Med., 2009; 361: 2405–2413
185. Jefferson T.O., Rivetti D., Di Pietrantonj C., et al.: Vaccines for preventing influenza
in healthy adults. Cochrane Database Syst. Rev., 2007; (2): CD001 269
186. Nichol K.L., Lind A., Margolis K.L., et al.: The effectiveness of vaccination against influenza
in healthy, working adults. N. Engl. J. Med., 1995; 333: 889–893
187. Monto A.S., Ohmit S.E., Petrie J.G., et al.: Comparative efficacy of inactivated and live
attenuated influenza vaccines. N. Engl. J. Med., 2009; 361: 1260–1267
188. Herrera G.A., Iwane M.K., Cortese M., et al.: Influenza vaccine effectiveness among
50–64-year-old persons during a season of poor antigenic match between vaccine and
circulating influenza virus strains: Colorado, United States, 2003–2004. Vaccine, 2007;
25: 154–160
189. Blumberg E.A., Albano C., Pruett T., et al.: The immunogenicity
of influenza virus vaccine
in solid organ transplant recipients. Clin. Infect. Dis., 1996; 22: 295–302
190. Dorrell L., Hassan I., Marshall S., et al.: Clinical and serological
responses to an inactivated
influenza vaccine in adults with HIV infection, diabetes, obstructive airways disease,
elderly adults and healthy volunteers. Int. J. STD AIDS, 1997; 8: 776–779
191. McElhaney J.E., Beattie B.L., Devine R., et al.: Age-related decline in interleukin 2 production
in response to influenza vaccine. J. Am. Geriatr. Soc., 1990; 38: 652–658
192. Wongsurkiat P., Maranetra K.N., Wasi C., et al.: Acute respiratory illness in patients with
COPD and the effectiveness of influenza vaccination. Chest, 2004; 125: 2011–2020
193. Gurfinkel E.P., Leon de la Fuente R., Mendiz O., et al.: Flu vaccination in acute coronary
syndromes and planned percutaneous coronary interventions (FLUVACS) Study. Eur.
Heart J., 2004; 25: 25–31
194. Ciszewski A., Bilinska Z.T., Brydak L.B., et al.: Influenza vaccination in secondary prevention
from coronary ischaemic events in coronary artery disease: FLUCAD study. Eur. Heart J.,
2008; 29: 1350–1358
195. Hak E., Buskens E., van Essen G.A., et al.: Clinical effectiveness of influenza vaccination
in persons younger than 65 years with high-risk medical conditions: the PRISMA study.
Arch. Intern. Med., 2005; 165: 274–280
196. Hak E., Buskens E., Nichol K.L., et al.: Do recommended high-risk adults benefit from a first
influenza vaccination? Vaccine, 2006; 24: 2799–2802
197. Looijmans-Van den Akker I., Verheij T.J., Buskens E., et al.: Clinical effectiveness of first
and repeat influenza vaccination in adult and elderly diabetic patients. Diabetes Care,
2006; 29: 1771–1776
198. Cates C.J., Jefferson T.O., Rowe B.H.: Vaccines for preventing influenza in people with
asthma. Cochrane Database Syst. Rev., 2008; (2): CD000 364
199. Poole P.J., Chacko E., Wood-Baker R.W., et al.: Influenza vaccine for patients with chronic
obstructive pulmonary disease. Cochrane Database Syst. Rev., 2006; (1): CD002 733
200. Chadwick E.G., Chang G., Decker M.D., et al.: Serologic response to standard inactivated
influenza vaccine in human immunodeficiency virusinfected children. Pediatr. Infect.
Dis. J., 1994; 13: 206–211
201. Huang K.L., Ruben F.L., Rinaldo C.R. Jr., et al.: Antibody responses after influenza
and pneumococcal immunization in HIV-infected homosexual men. JAMA, 1987; 257:
2047–2050
202. Staprans S.I., Hamilton B.L., Follansbee S.E., et al.: Activation of virus replication after
vaccination of HIV-1-infected individuals. J. Exp. Med., 1995; 182: 1727–1737
203. Kroon F.P., van Dissel J.T., de Jong J.C., et al.: Antibody response after influenza vaccination
in HIV-infected individuals: a consecutive 3-year study. Vaccine, 2000; 18:
3040–3049
204. Miotti P.G., Nelson K.E., Dallabetta G.A., et al.: The influence of HIV infection on antibody
responses to a two-dose regimen of influenza vaccine. JAMA, 1989; 262: 779–783
205. Scharpe J., Evenepoel P., Maes B., et al.: Influenza vaccination is efficacious and safe
in renal transplant recipients. Am. J. Transplant., 2008; 8: 332–337
206. Edvardsson V.O., Flynn J.T., Deforest A., et al.: Effective immunization against influenza
in pediatric renal transplant recipients. Clin. Transplant., 1996; 10: 556–560
207. Fraund S., Wagner D., Pethig K., et al.: Influenza vaccination in heart transplant recipients.
J. Heart Lung Transplant., 1999; 18: 220–225
208. Lawal A., Basler C., Branch A., et al.: Influenza vaccination in orthotopic liver transplant
recipients: absence of post administration ALT elevation. Am. J. Transplant., 2004; 4:
1805–1809
209. Madan R.P., Tan M., Fernandez-Sesma A., et al.: A prospective, comparative study
of the immune response to inactivated influenza vaccine in pediatric liver transplant
recipients and their healthy siblings. Clin. Infect. Dis., 2008; 46: 712–718
210. Duchini A., Hendry R.M., Nyberg L.M., et al.: Immune response to influenza vaccine
in adult liver transplant recipients. Liver Transpl., 2001; 7: 311–333
211. Sumaya C.V., Gibbs R.S.: Immunization of pregnant women with influenza A/New
Jersey/76 virus vaccine: reactogenicity and immunogenicity in mother and infant.
J. Infect. Dis., 1979; 140: 141–146
212. Munoz F.M., Greisinger A.J., Wehmanen O.A., et al.: Safety of influenza vaccination
during pregnancy. Am. J. Obstet. Gynecol., 2005; 192: 1098–1106
213. Englund J.A., Mbawuike I.N., Hammill H., et al.: Maternal immunization with influenza
or tetanus toxoid vaccine for passive antibody protection in young infants. J. Infect. Dis.,
1993; 168: 647–656
214. Puck J.M., Glezen W.P., Frank A.L., et al.: Protection of infants from infection with influenza A virus by transplacentally acquired antibody. J. Infect. Dis., 1980; 142: 844–849
215. Reuman P.D., Ayoub E.M., Small P.A.: Effect of passive maternal antibody on influenza
illness in children: a prospective study of influenza A in mother-infant pairs. Pediatr.
Infect. Dis. J., 1987; 6: 398–403
216. Steinhoff M.C., Omer S.B., Roy E., et al.: Influenza immunization in pregnancy–antibody
responses in mothers and infants. N. Engl. J. Med., 2010; 362: 1644–1646
217. Zaman K., Roy E., Arifeen S.E., et al.: Effectiveness of maternal influenza immunization
in mothers and infants. N. Engl. J. Med., 2008; 359: 1555–1564
218. Black S.B., Shinefield H.R., France E.K., et al.: Effectiveness of influenza vaccine during
pregnancy in preventing hospitalizations and outpatient visits for respiratory illness
in pregnant women and their infants. Am. J. Perinatol., 2004; 21: 333–339
219. France E.K., Smith-Ray R., McClure D., et al.: Impact of maternal influenza vaccination
during pregnancy on the incidence of acute respiratory illness visits among infants. Arch.
Pediatr. Adolesc. Med., 2006; 160: 1277–1283
220. Berry B.B., Ehlert D.A., Battiola R.J., et al.: Influenza vaccination is safe and immunogenic
when administered to hospitalized patients. Vaccine, 2001; 19: 3493–3498
221. Couch R.B., Winokur P., Brady R., et al.: Safety and immunogenicity of a high dosage
trivalent influenza vaccine among elderly subjects. Vaccine, 2007; 25: 7656–7663
222. Falsey A.R., Treanor J.J., Tornieporth N., et al.: Randomized, double-blind controlled
phase 3 trial comparing the immunogenicity of high-dose and standard-dose influenza
vaccine in adults 65 years of age and older. J. Infect. Dis., 2009; 200: 172–180
223. Keitel W.A., Atmar R.L., Cate T.R., et al.: Safety of high doses of influenza vaccine
and effect on antibody responses in elderly persons. Arch. Intern. Med., 2006; 166:
1121–1127
224. Sanofi pasteur, Inc. Fluzone and Fluzone High-Dose [Prescribing information]. Swiftwater,
PA, sanofi pasteur Inc, 2009
225. Govaert T.M., Thijs C.T., Masurel N. et al.: The efficacy of influenza vaccination in elderly
individuals. A randomized double-blind placebo-controlled trial. JAMA, 1994; 272:
1661–1665
226. Thijs C., Beyer W.E., Govaert P.M., et al.: Mortality benefits of influenza vaccination
in elderly people. Lancet Infect. Dis., 2008; 8: 460–461; author reply 463–465
227. Monto A.S., Hornbuckle K., Ohmit S.E.: Influenza vaccine effectiveness among elderly
nursing home residents: a cohort study. Am. J. Epidemiol., 2001; 154: 155–160
228. Ohmit S.E., Arden N.H., Monto A.S.: Effectiveness of inactivated influenza vaccine among
nursing home residents during an influenza type A (H3N2) epidemic. J. Am. Geriatr. Soc.,
1999; 47: 165–171
229. Coles F.B., Balzano G.J., Morse D.L.: An outbreak of influenza A (H3N2) in a well immunized
nursing home population. J. Am. Geriatr. Soc., 1992; 40: 589–592
230. Libow L.S., Neufeld R.R., Olson E., et al.: Sequential outbreak of influenza A and B
in a nursing home: efficacy of vaccine and amantadine. J. Am. Geriatr. Soc., 1996; 44:
1153–1157
231. Arden N., Patriarcha P., Kendal A.: Experiences in the use and efficacy of inactivated
influenza vaccine in nursing homes. In: Kendal A., Patriarca P., eds: Options for the control
of influenza. New York, Alan R. Liss, Inc., 1986
232. Jefferson T., Rivetti D., Rivetti A., et al.: Efficacy and effectiveness of influenza vaccines
in elderly people: a systematic review. Lancet, 2005; 366: 1165–1174
233. Patriarca P.A., Weber J.A., Parker R.A., et al.: Efficacy of influenza vaccine in nursing
homes. Reduction in illness and complications during an influenza A (H3N2) epidemic.
JAMA, 1985; 253: 1136–1139
234. Nichol K.L., Wuorenma J., von Sternberg T.: Benefits of influenza vaccination for low-,
intermediate-, and high-risk senior citizens. Arch. Intern. Med., 1998; 158: 1769–1776
235. Mullooly J.P., Bennett M.D., Hornbrook M.C., et al.: Influenza vaccination programs for
elderly persons: cost-effectiveness in a health maintenance organization. Ann. Intern.
Med., 1994; 121: 947–952
236. Nichol K.L., Nordin J.D., Nelson D.B., et al.: Effectiveness of influenza vaccine in the community-dwelling
elderly. N. Engl. J. Med., 2007; 357: 1373–1381
237. Gross P.A., Hermogenes A.W., Sacks H.S. et al.: The efficacy of influenza vaccine in elderly
persons. A meta-analysis and review of the literature. Ann. Intern. Med., 1995; 123:
518–527
238. Hak E., Nordin J., Wei F., et al.: Influence of high-risk medical conditions on the effectiveness
of influenza vaccination among elderly members of 3 large managed-care
organizations. Clin. Infect. Dis., 2002; 35: 370–377
239. Nordin J., Mullooly J., Poblete S. et al.: Influenza vaccine effectiveness in preventing
hospitalizations and deaths in persons 65 years or older in Minnesota, New York, and
Oregon: data from 3 health plans. J. Infect. Dis., 2001; 184: 665–670
240. Patriarca P.A., Weber J.A., Parker R.A., et al.: Risk factors for outbreaks of influenza
in nursing homes. A case-control study. Am. J. Epidemiol., 1986; 124: 114–119
241. Jackson L.A., Nelson J.C., Benson P. et al.: Functional status is a confounder of the association
of influenza vaccine and risk of all cause mortality in seniors. Int. J. Epidemiol.,
2006; 35: 345–352
242. Simonsen L., Viboud C., Taylor R.J.: Effectiveness of influenza vaccination. N. Engl. J. Med.,
2007; 357: 2729–2730; author reply 2730–2731
243. Nelson J.C., Jackson M.L., Jackson L.A.: Effectiveness of influenza vaccination. N. Engl.
J. Med., 2007; 357: 2728–2729; author reply 2730–2731
244. Jefferson T., Di Pietrantonj C., Al-Ansary L.A., et al.: Vaccines for preventing influenza
in the elderly. Cochrane Database Syst. Rev., 2010; (2): CD004 876
245. CDC. General recommendations on immunization: recommendations of the Advisory
Committee on Immunization Practices (ACIP). MMWR, 2006; 55 (No. RR-15)
246. France E.K., Glanz J.M., Xu S. et al.: Safety of the trivalent inactivated influenza vaccine
among children: a population-based study. Arch. Pediatr. Adolesc. Med., 2004; 158:
1031–1036
247. Hambidge S.J., Glanz J.M., France E.K., et al.: Safety of trivalent inactivated influenza
vaccine in children 6 to 23 months old. JAMA, 2006; 296: 1990–1997
248. Greene S.K., Kulldorff M., Lewis E.M., et al.: Near real-time surveillance for influenza
vaccine safety: proof-of-concept in the Vaccine Safety Datalink Project. Am. J. Epidemiol.,
2010; 171: 177–188
249. Barry D.W., Mayner R.E., Hochstein H.D., et al.: Comparative trial of influenza vaccines.
II. Adverse reactions in children and adults. Am. J. Epidemiol., 1976; 104: 47–59
250. McMahon A.W., Iskander J.K., Haber P. et al.: Inactivated influenza vaccine (IIV) in children
<2 years of age: examination of selected adverse events reported to the Vaccine
Adverse Event Reporting System (VAERS) after thimerosal-free or thimerosal-containing
vaccine. Vaccine, 2008; 26: 427–429
251. Rosenberg M., Sparks R., McMahon A., et al.: Serious adverse events rarely reported
after trivalent inactivated influenza vaccine (TIV) in children 6–23 months of age. Vaccine,
2009; 27: 4278–4283
252. Therapeutic Goods Administration. Investigation into febrile reactions in young children
following 2010 seasonal trivalent influenza vaccination: status report as at 2 July 2010.
Available at http://www.tga.gov.au/alerts/medicines/fluvaccine-report100 702.htm.
Accessed July 19, 2010
253. Govaert T.M., Dinant G.J., Aretz K., et al.: Adverse reactions to influenza vaccine in elderly
people: randomised double blind placebo controlled trial. BMJ, 1993; 307: 988–990
254. Margolis K.L., Nichol K.L., Poland G.A., et al.: Frequency of adverse reactions to influenza
vaccine in the elderly. A randomized, placebo-controlled trial. JAMA, 1990; 264:
1139–1141
255. Nichol K.L., Margolis K.L., Lind A., et al.: Side effects associated with influenza vaccination
in healthy working adults. A randomized, placebo-controlled trial. Arch. Intern. Med.,
1996; 156: 1546–1550
256. Ohmit S.E., Gross J., Victor J.C., et al.: Reduced reaction frequencies with repeated
inactivated or live-attenuated influenza vaccination. Vaccine, 2009; 27: 1050–1054
257. Vellozzi C., Burwen D.R., Dobardzic A., et al.: Safety of trivalent inactivated influenza vaccines
in adults: background for pandemic influenza vaccine safety monitoring. Vaccine,
2009; 27: 2114–2120
258. Heinonen O.P., Shapiro S., Monson R.R., et al.: Immunization during pregnancy against
poliomyelitis and influenza in relation to childhood malignancy. Int. J. Epidemiol., 1973;
2: 229–235
259. Pool V., Iskander J.: Safety of influenza vaccination during pregnancy. Am. J. Obstet.
Gynecol., 2006; 194: 1200; author reply 1201
260. Deinard A.S., Ogburn P. Jr.: A/NJ/8/76 influenza vaccination program: effects on maternal
health and pregnancy outcome. Am. J. Obstet. Gynecol., 1981; 140: 240–245
261. Mak T.K., Mangtani P., Leese J., et al.: Influenza vaccination in pregnancy: current
evidence and selected national policies. Lancet Infect. Dis., 2008; 8: 44–52
262. Centers TALAAR. The safety of inactivated influenza vaccine in adults and children with
asthma. N. Engl. J. Med., 2001; 345: 1529–1536
263. Groothuis J.R., Levin M.J., Rabalais G.P. et al.: Immunization of high-risk infants younger
than 18 months of age with split-product influenza vaccine. Pediatrics, 1991; 87:
823–828
264. Ho D.D.: HIV-1 viraemia and influenza. Lancet, 1992; 339: 1549
265. O'Brien W.A., Grovit-Ferbas K., Namazi A., et al.: Human immunodeficiency virus-type 1 replication can be increased in peripheral blood of seropositive patients after influenza
vaccination. Blood, 1995; 86: 1082–1089
266. Glesby M.J., Hoover D.R., Farzadegan H., et al.: The effect of influenza vaccination on human
immunodeficiency virus type 1 load: a randomized, double-blind, placebo-controlled
study. J. Infect. Dis., 1996; 174: 1332–1336
267. Fowke K.R., D'Amico R., Chernoff D.N. et al.: Immunologic and virologic evaluation after
influenza vaccination of HIV-1-infected patients. AIDS, 1997; 11: 1013–1021
268. Fuller J.D., Craven D.E., Steger K.A., et al.: Influenza vaccination of human immunodeficiency
virus (HIV)-infected adults: impact on plasma levels of HIV type 1 RNA and
determinants of antibody response. Clin. Infect. Dis., 1999; 28: 541–547
269. Amendola A., Boschini A., Colzani D., et al.: Influenza vaccination of HIV-1-positive and
HIV-1-negative former intravenous drug users. J. Med. Virol., 2001; 65: 644–648
270. Sullivan P.S., Hanson D.L., Dworkin M.S. et al.: Effect of influenza vaccination on disease
progression among HIV-infected persons. AIDS, 2000; 14: 2781–2785
271. Gunthard H.F., Wong J.K., Spina C.A., et al.: Effect of influenza vaccination on viral
replication and immune response in persons infected with human immunodeficiency
virus receiving potent antiretroviral therapy. J. Infect. Dis., 2000; 181: 522–531
272. Wood R.A., Berger M., Dreskin S.C., et al.: An algorithm for treatment of patients with
hypersensitivity reactions after vaccines. Pediatrics, 2008; 122: e771–e777
273. Ruggeberg J.U., Gold M.S., Bayas J.M., et al.: Anaphylaxis: case definition and guidelines
for data collection, analysis, and presentation of immunization safety data. Vaccine,
2007; 25: 5675–5684
274. GlaxoSmithKline Biologicals. FLULAVAL [Prescribing information]. Research Triangle
Park, NC, GlaxoSmithKline, 2008
275. CSL Biotherapies Inc. AFLURIA [Prescribing information]. King of Prussia, PA, CSL
Biotherapies Inc., 2008
276. Grabenstein J.D.: Clinical management of hypersensitivities to vaccine components. Hosp.
Pharm., 1997; 32: 77–87
277. Bohlke K., Davis R.L., Marcy S.M., et al.: Risk of anaphylaxis after vaccination of children
and adolescents. Pediatrics, 2003; 112: 815–820
278. Tey D., Heine R.G.: Egg allergy in childhood: an update. Curr. Opin. Allergy Clin. Immunol.,
2009; 9: 244–250
279. James J.M., Zeiger R.S., Lester M.R., et al.: Safe administration of influenza vaccine to
patients with egg allergy. J. Pediatr., 1998; 133: 624–628
280. Murphy K.R., Strunk R.C.: Safe administration of influenza vaccine in asthmatic children
hypersensitive to egg proteins. J. Pediatr., 1985; 106: 931–933
281. Zeiger R.S.: Current issues with influenza vaccination in egg allergy. J. Allergy Clin.
Immunol., 2002; 110: 834–840
282. Zheng W., Dreskin S.C.: Thimerosal in influenza vaccine: an immediate hypersensitivity
reaction. Ann. Allergy Asthma Immunol., 2007; 99: 574–575
283. Aberer W.: Vaccination despite thimerosal sensitivity. Contact Dermatitis, 1991; 24:
6–10
284. Kirkland L.R.: Ocular sensitivity to thimerosal: a problem with hepatitis B vaccine?
South Med. J., 1990; 83: 497–499
285. GlaxoSmithKline Biologicals. FLUARIX [Prescribing information]. Research Triangle Park,
NC, GlaxoSmithKline, 2008
286. Sanofi PasteurSanofi Pasteur Inc. Fluzone [Prescribing information]. Swiftwater, PA,
Sanofi PasteurSanofi Pasteur Inc., 2008
287. Novartis. FLUVIRIN [Prescribing information]. Emeryville, CA, Novartis, 2008
288. Ohmit S.E., Victor J.C., Teich E.R., et al.: Prevention of symptomatic seasonal influenza
in 2005–2006 by inactivated and live attenuated vaccines. J. Infect. Dis., 2008; 198:
312–317
289. Ohmit S.E., Victor J.C., Rotthoff J.R., et al.: Prevention of antigenically drifted influenza
by inactivated and live attenuated vaccines. N. Engl. J. Med., 2006; 355: 2513–2522
290. National Advisory Committee on Immunization. An Advisory Committee Statement (ACS).
Supplementary statement on influenza vaccination: continued use of Fluviral influenza
vaccine in the 2000–2001 season. Can. Commun. Dis. Rep., 2001; 27: 1–3
291. Boulianne N., de Serres G., Duval B., et al.: Clinical manifestations and incidence of oculo-respiratory
syndrome following influenza vaccination – Quebec, 2000. Can. Commun.
Dis. Rep., 2001; 27: 85–90
292. Spila-Alegiani S., Salmaso S., Rota M.C., et al.: Reactogenicity in the elderly of nine commercial
influenza vaccines: results from the Italian SVEVA study. Study for the evaluation
of adverse events of influenza vaccination. Vaccine, 1999; 17: 1898–1904
293. Anonymous. Oculo-respiratory syndrome following influenza vaccination: review
of post-marketing surveillance through four influenza seasons in Canada. Can. Commun.
Dis. Rep., 2005; 31: 217–225
294. Khromova A.P.V., Chen R.: Oculo-respiratory syndrome following influenza vaccine
– United States, 1990–2002: new or previously unrecognized? [Presentation].1st international
conference on therapeutic risk management and 19th international conference
on pharmacoepidemiology. Philadelphia, PA, USA, August 21–23, 2003
295. Skowronski D.M., de Serres G., Hebert J., et al.: Skin testing to evaluate oculo-respiratory
syndrome (ORS) associated with influenza vaccination during the 2000–2001 season.
Vaccine, 2002; 20: 2713–2719
296. Scheifele D.W., Duval B., Russell M.L., et al.: Ocular and respiratory symptoms attributable
to inactivated split influenza vaccine: evidence from a controlled trial involving
adults. Clin. Infect. Dis., 2003; 36: 850–857
297. Skowronski D.M., Strauss B., Kendall P., et al.: Low risk of recurrence of oculorespiratory
syndrome following influenza revaccination. CMAJ, 2002; 167: 853–858
298. de Serres G., Skowronski D.M., Guay M., et al.: Recurrence risk of oculorespiratory
syndrome after influenza vaccination: randomized controlled trial of previously affected
persons. Arch. Intern. Med., 2004; 164: 2266–2272
299. Ropper A.H.: The Guillain-Barré syndrome. N. Engl. J. Med., 1992; 326: 1130–1136
300. Guarino M., Casmiro M., d'Alessandro R.: Campylobacter jejuni infection and
Guillain-Barré syndrome: a case-control study. Emilia-Romagna Study Group on Clinical
and Epidemiological problems in neurology. Neuroepidemiology, 1998; 17: 296–302
wytyczne
301. Jacobs B.C., Rothbarth P.H., van der Meche F.G., et al.: The spectrum of antecedent
infections in Guillain-Barré syndrome: a case-control study. Neurology, 1998; 51:
1110–1115
302. Sheikh K.A., Nachamkin I., Ho T.W., et al.: Campylobacter jejuni lipopolysaccharides
in Guillain-Barré syndrome: molecular mimicry and host susceptibility. Neurology, 1998;
51: 371–378
303. Sivadon-Tardy V., Orlikowski D., Porcher R., et al.: Guillain-Barré syndrome and influenza
virus infection. Clin. Infect. Dis., 2009; 48: 48–56
304. Haber P., DeStefano F., Angulo F.J., et al.: Guillain-Barré syndrome following influenza
vaccination. JAMA, 2004; 292: 2478–2481
305. Lasky T., Terracciano G.J., Magder L., et al.: The Guillain-Barré syndrome and
the 1992–1993 and 1993–1994 influenza vaccines. N. Engl. J. Med., 1998; 339:
1797–1802
306. Schonberger L.B., Bregman D.J., Sullivan-Bolyai J.Z., et al.: Guillain-Barré syndrome
following vaccination in the National Influenza Immunization Program, United States,
1976–1977. Am. J. Epidemiol., 1979; 110: 105–123
307. Hurwitz E.S., Schonberger L.B., Nelson D.B., et al.: Guillain-Barré syndrome and
the 1978–1979 influenza vaccine. N. Engl. J. Med., 1981; 304: 1557–1561
308. Kaplan J.E., Katona P., Hurwitz E.S., et al.: Guillain-Barré syndrome in the United States,
1979–1980 and 1980–1981. Lack of an association with influenza vaccination. JAMA,
1982; 248: 698–700
309. Chen R., Kent J., Rhodes P., et al.: Investigations of a possible association between
influenza vaccination and Guillain-Barré syndrome in the United States, 1990–1991
[Abstract 040]. Post Marketing Surveillance, 1992; 6: 5–6
310. Juurlink D.N., Stukel T.A., Kwong J., et al.: Guillain-Barré syndrome after influenza vaccination
in adults: a population-based study. Arch. Intern. Med., 2006; 166: 2217–2221
311. Tam C.C., O'Brien S.J., Petersen I., et al.: Guillain-Barré syndrome and preceding infection
with campylobacter, influenza and Epstein-Barr virus in the general practice research
database. PLoS ONE, 2007; 2: e344
312. Hughes R.A., Charlton J., Latinovic R., et al.: No association between immunization and
Guillain-Barré syndrome in the United Kingdom, 1992 to 2000. Arch. Intern. Med., 2006;
166: 1301–1304
313. Stowe J., Andrews N., Wise L., et al.: Investigation of the temporal association
of Guillain-Barré syndrome with influenza vaccine and influenza like illness using
the United Kingdom General Practice Research Database. Am. J. Epidemiol., 2009;
169: 382–388
314. CDC. Safety of influenza A (H1N1) 2009 monovalent vaccines – United States, October
1–November 24, 2009. MMWR, 2009; 58: 1351–1356
315. CDC. Preliminary results: surveillance for Guillain-Barré syndrome after receipt of influenza A (H1N1) 2009 monovalent vaccine – United States, 2009–2010. MMWR, 2010;
59: 657–661
316. National Vaccine Advisory Committee. Reports, recommendations, and resolutions 2010.
Available at http://www.hhs.gov/nvpo/nvac/reports/index.html. Accessed July 12,
2010
317. Pritchard J., Mukherjee R., Hughes R.A.: Risk of relapse of Guillain-Barré syndrome or
chronic inflammatory demyelinating polyradiculoneuropathy following immunisation.
J. Neurol. Neurosurg. Psychiatry, 2002; 73: 348–349
318. CDC. Recommendations regarding the use of vaccines that contain thimerosal as a preservative.
MMWR, 1999; 48: 996–998
319. CDC. Summary of the joint statement on thimerosal in vaccines. MMWR, 2000; 49: 622,
631
320. McCormick M., Bayer R., Berg A., et al.: Report of the Institute of Medicine. Immunization
safety review: vaccines and autism. Washington, DC, Institute of Medicine, 2004
321. Pichichero M.E., Cernichiari E., Lopreiato J., et al.: Mercury concentrations and metabolism
in infants receiving vaccines containing thiomersal: a descriptive study. Lancet,
2002; 360: 1737–1741
322. Verstraeten T., Davis R.L., DeStefano F., et al.: Safety of thimerosal-containing vaccines: a two-phased study of computerized health maintenance organization databases.
Pediatrics, 2003; 112: 1039–1048
323. Tozzi A.E., Bisiacchi P., Tarantino V., et al.: Neuropsychological performance 10 years
after immunization in infancy with thimerosal-containing vaccines. Pediatrics, 2009;
123: 475–482
324. Schechter R., Grether J.K.: Continuing increases in autism reported to California's developmental
services system: mercury in retrograde. Arch. Gen. Psychiatry, 2008; 65:
19–24
325. Pichichero M.E., Gentile A., Giglio N. et al.: Mercury levels in newborns and infants after
receipt of thimerosal-containing vaccines. Pediatrics, 2008; 121: e208–e214
326. Thompson W.W., Price C., Goodson B., et al.: Early thimerosal exposure and neuropsychological
outcomes at 7 to 10 years. N. Engl. J. Med., 2007; 357: 1281–1292
327. Stratton K., Gable A., McCormick M.C.: Report of the Institute of Medicine. Immunization
safety review: thimerosal containing vaccines and neurodevelopmental disorders.
Washington, DC, National Academy Press, 2001
328. Croen L.A., Matevia M., Yoshida C.K., et al.: Maternal Rh D status, anti-D immune globulin
exposure during pregnancy, and risk of autism spectrum disorders. Am. J. Obstet.
Gynecol., 2008; 199: 234. e1–e6
329. Stratton K., Gable A., McCormick M., eds.: Report of the Institute of Medicine.
Immunization safety review: thimerosal-containing vaccines and neurodevelopmental
disorders. Washington, DC, Institute of Medicine, 2001
330. Gostin L.O.: Medical countermeasures for pandemic influenza: ethics and the law. JAMA,
2006; 295: 554–556
331. Medimmune Vaccines, Inc. FluMist [Package insert]. Gaithersburg, MD, Medimmune
Vaccines, Inc., 2007
332. Vesikari T., Karvonen A., Korhonen T. et al.: A randomized, double-blind study of the safety,
transmissibility and phenotypic and genotypic stability of cold-adapted influenza
virus vaccine. Pediatr. Infect. Dis. J., 2006; 25: 590–595
333. Block S.L., Yogev R., Hayden F.G., et al.: Shedding and immunogenicity of live attenuated
influenza vaccine virus in subjects 5–49 years of age. Vaccine, 2008; 26: 4940–4946
334. Talbot T.R., Crocker D.D., Peters J., et al.: Duration of virus shedding after trivalent intranasal
live attenuated influenza vaccination in adults. Infect. Control Hosp. Epidemiol.,
2005; 26: 494–500
335. Ali T., Scott N., Kallas W., et al.: Detection of influenza antigen with rapid antibody-based
tests after intranasal influenza vaccination (FluMist). Clin. Infect. Dis., 2004; 38:
760–762
336. King J.C. Jr., Treanor J., Fast P.E., et al.: Comparison of the safety, vaccine virus shedding,
and immunogenicity of influenza virus vaccine, trivalent, types A and B, live cold-adapted,
administered to human immunodeficiency virus (HIV)-infected and non-HIV-infected
adults. J. Infect. Dis., 2000; 181: 725–728
337. King J.C. Jr., Fast P.E., Zangwill K.M., et al.: Safety, vaccine virus shedding and immunogenicity
of trivalent, cold-adapted, live attenuated influenza vaccine administered
to human immunodeficiency virus-infected and noninfected children. Pediatr. Infect.
Dis. J., 2001; 20: 1124–1131
338. Cha T.A., Kao K., Zhao J., et al.: Genotypic stability of cold-adapted influenza virus
vaccine in an efficacy clinical trial. J. Clin. Microbiol., 2000; 38: 839–845
339. Buonagurio D.A., O'Neill R.E., Shutyak L., et al.: Genetic and phenotypic stability
of cold-adapted influenza viruses in a trivalent vaccine administered to children in a day
care setting. Virology, 2006; 347: 296–306
340. King J.C. Jr., Lagos R., Bernstein D.I., et al.: Safety and immunogenicity of low and high
doses of trivalent live cold-adapted influenza vaccine administered intranasally as drops
or spray to healthy children. J. Infect. Dis., 1998; 177: 1394–1397
341. Lee M.S., Mahmood K., Adhikary L., et al.: Measuring antibody responses to a live attenuated
influenza vaccine in children. Pediatr. Infect. Dis. J., 2004; 23: 852–856
342. Zangwill K.M., Droge J., Mendelman P., et al.: Prospective, randomized, placebo-controlled
evaluation of the safety and immunogenicity of three lots of intranasal trivalent
influenza vaccine among young children. Pediatr. Infect. Dis. J., 2001; 20: 740–746
343. Nolan T., Lee M.S., Cordova J.M., et al.: Safety and immunogenicity of a live-attenuated
influenza vaccine blended and filled at two manufacturing facilities. Vaccine, 2003; 21:
1224–1231
344. Belshe R.B., Gruber W.C., Mendelman P.M., et al.: Correlates of immune protection
induced by live, attenuated, cold-adapted, trivalent, intranasal influenza virus vaccine.
J. Infect. Dis., 2000; 181: 1133–1137
345. Boyce T.G., Gruber W.C., Coleman-Dockery S.D., et al.: Mucosal immune response to
trivalent live attenuated intranasal influenza vaccine in children. Vaccine, 1999; 18:
82–88
346. Belshe R.B., Mendelman P.M., Treanor J., et al.: The efficacy of live attenuated,
cold-adapted, trivalent, intranasal influenza virus vaccine in children. N. Engl. J. Med.,
1998; 338: 1405–1412
347. Belshe R.B., Gruber W.C., Mendelman P.M., et al.: Efficacy of vaccination with live attenuated,
cold-adapted, trivalent, intranasal influenza virus vaccine against a variant
(A/Sydney) not contained in the vaccine. J. Pediatr., 2000; 136: 168–175
348. Belshe R.B., Gruber W.C.: Prevention of otitis media in children with live attenuated
influenza vaccine given intranasally. Pediatr. Infect. Dis. J., 2000; 19: S66–S71
349. Vesikari T., Fleming D.M., Aristegui J.F., et al.: Safety, efficacy, and effectiveness
of cold-adapted influenza vaccine-trivalent against community-acquired, culture-confirmed
influenza in young children attending day care. Pediatrics, 2006; 118:
2298–2312
350. Tam J.S., Capeding M.R., Lum L.C., et al.: Efficacy and safety of a live attenuated,
cold-adapted influenza vaccine, trivalent against culture-confirmed influenza in young
children in Asia. Pediatr. Infect. Dis. J., 2007; 26: 619–628
351. Belshe R.B., Couch R.B., Glezen W.P., Treanor J.T.: Live attenuated intranasal influenza
vaccine. Vaccine, 2002; 20: 3429–3430
352. Nichol K.L., Mendelman P.M., Mallon K.P., et al.: Effectiveness of live, attenuated intranasal
influenza virus vaccine in healthy, working adults: a randomized controlled trial.
JAMA, 1999; 282: 137–144
353. Redding G., Walker R.E., Hessel C., et al.: Safety and tolerability of cold-adapted influenza
virus vaccine in children and adolescents with asthma. Pediatr. Infect. Dis. J., 2002; 21:
44–48
354. Piedra P.A., Yan L., Kotloff K., et al.: Safety of the trivalent, cold-adapted influenza
vaccine in preschool-aged children. Pediatrics, 2002; 110: 662–672
355. Bergen R., Black S., Shinefield H., et al.: Safety of cold-adapted live attenuated influenza
vaccine in a large cohort of children and adolescents. Pediatr. Infect. Dis. J., 2004; 23:
138–144
356. Belshe R.B., Ambrose C.S., Yi T.: Safety and efficacy of live attenuated influenza vaccine
in children 2–7 years of age. Vaccine, 2008; 26 (supl. 4): D10–D16
357. Belshe R.B., Edwards K.M., Vesikari T., et al.: Live attenuated versus inactivated influenza
vaccine in infants and young children. N. Engl. J. Med., 2007; 356: 685–696
358. Piedra P.A., Gaglani M.J., Riggs M., et al.: Live attenuated influenza vaccine, trivalent,
is safe in healthy children 18 months to 4 years, 5 to 9 years, and 10 to 18 years
of age in a community-based, nonrandomized, open-label trial. Pediatrics, 2005; 116:
e397–e407
359. Gaglani M.J., Piedra P.A., Riggs M., et al.: Safety of the intranasal, trivalent, live attenuated
influenza vaccine (LAIV) in children with intermittent wheezing in an open-label
field trial. Pediatr. Infect. Dis. J., 2008; 27: 444–452
360. Belshe R., Lee M.S., Walker R.E., et al.: Safety, immunogenicity and efficacy of intranasal,
live attenuated influenza vaccine. Expert Rev. Vaccines, 2004; 3: 643–654
361. Izurieta H.S., Haber P., Wise R.P., et al.: Adverse events reported following live,
cold-adapted, intranasal influenza vaccine. JAMA, 2005; 294: 2720–2725
362. Jackson L.A., Holmes S.J., Mendelman P.M., et al.: Safety of a trivalent live attenuated
intranasal influenza vaccine, FluMist, administered in addition to parenteral trivalent
inactivated influenza vaccine to seniors with chronic medical conditions. Vaccine, 1999;
17: 1905–1909
363. Destefano F., Tokars J.: H1N1 vaccine safety monitoring: beyond background rates. Lancet,
2009; 375: 1146–1147
364. Treanor J.J., Kotloff K., Betts R.F., et al.: Evaluation of trivalent, live, cold-adapted
(CAIV-T) and inactivated (TIV) influenza vaccines in prevention of virus infection and
illness following challenge of adults with wild-type influenza A (H1N1), A (H3N2), and
B viruses. Vaccine, 1999; 18: 899–906
365. Piedra P.A., Gaglani M.J., Kozinetz C.A., et al.: Trivalent live attenuated intranasal
influenza vaccine administered during the 2003–2004 influenza type A (H3N2) outbreak
provided immediate, direct, and indirect protection in children. Pediatrics, 2007; 120:
e553–e564
366. Wang Z., Tobler S., Roayaei J., et al.: Live attenuated or inactivated influenza vaccines
and medical encounters for respiratory illnesses among US military personnel. JAMA,
2009; 301: 945–953
367. Fleming D.M., Crovari P., Wahn U., et al.: Comparison of the efficacy and safety of live
attenuated cold-adapted influenza vaccine, trivalent, with trivalent inactivated influenza
virus vaccine in children and adolescents with asthma. Pediatr. Infect. Dis. J., 2006; 25:
860–869
368. Ashkenazi S., Vertruyen A., Aristegui J., et al.: Superior relative efficacy of live attenuated
influenza vaccine compared with inactivated influenza vaccine in young children with
recurrent respiratory tract infections. Pediatr. Infect. Dis. J., 2006; 25: 870–879
369. Wilde J.A., McMillan J.A., Serwint J., et al.: Effectiveness of influenza vaccine in health
care professionals: a randomized trial. JAMA, 1999; 281: 908–913
370. Elder A.G., O'Donnell B., McCruden E.A., et al.: Incidence and recall of influenza in a cohort
of Glasgow healthcare workers during the 1993–4 epidemic: results of serum testing
and questionnaire. BMJ, 1996; 313: 1241–1242
371. Lester R.T., McGeer A., Tomlinson G., et al.: Use of, effectiveness of, and attitudes
regarding influenza vaccine among house staff. Infect. Control Hosp. Epidemiol., 2003;
24: 839–844
372. Cunney R.J., Bialachowski A., Thornley D., et al.: An outbreak of influenza A in a neonatal
intensive care unit. Infect. Control Hosp. Epidemiol., 2000; 21: 449–454
373. Salgado C.D., Giannetta E.T., Hayden F.G., et al.: Preventing nosocomial influenza by
improving the vaccine acceptance rate of clinicians. Infect. Control Hosp. Epidemiol.,
2004; 25: 923–928
374. Sato M., Saito R., Tanabe N., et al.: Antibody response to influenza vaccination in nursing
home residents and healthcare workers during four successive seasons in Niigata, Japan.
Infect. Control Hosp. Epidemiol., 2005; 26: 859–866
375. Carman W.F., Elder A.G., Wallace L.A., et al.: Effects of influenza vaccination
of health-care workers on mortality of elderly people in long-term care: a randomised
controlled trial. Lancet, 2000; 355: 93–97
376. Potter J., Stott D.J., Roberts M.A., et al.: Influenza vaccination of health care workers
in long-term-care hospitals reduces the mortality of elderly patients. J. Infect. Dis., 1997;
175: 1–6
377. Hayward A.C., Harling R., Wetten S., et al.: Effectiveness of an influenza vaccine programme
for care home staff to prevent death, morbidity, and health service use among
residents: cluster randomised controlled trial. BMJ, 2006; 333: 1241
378. Lemaitre M., Meret T., Rothan-Tondeur M., et al.: Effect of influenza vaccination of
nursing home staff on mortality of residents: a cluster-randomized trial. J. Am. Geriatr.
Soc., 2009; 57: 1580–1586
379. Thomas R.E., Jefferson T.O., Demicheli V., et al.: Influenza vaccination for health-care
workers who work with elderly people in institutions: a systematic review. Lancet Infect.
Dis., 2006; 6: 273–279
380. Hurwitz E.S., Haber M., Chang A., et al.: Effectiveness of influenza vaccination of day
care children in reducing influenza-related morbidity among household contacts. JAMA,
2000; 284: 1677–1682
381. Esposito S., Marchisio P., Cavagna R., et al.: Effectiveness of influenza vaccination
of children with recurrent respiratory tract infections in reducing respiratory-related
morbidity within the households. Vaccine, 2003; 21: 3162–3168
382. Loeb M., Russell M.L., Moss L., et al.: Effect of influenza vaccination of children on infection
rates in Hutterite communities: a randomized trial. JAMA, 2010; 303: 943–950
383. Piedra P.A., Gaglani M.J., Kozinetz C.A., et al.: Herd immunity in adults against influenza-related
illnesses with use of the trivalent-live attenuated influenza vaccine (CAIV-T)
in children. Vaccine, 2005; 23: 1540–1548
384. King J.C. Jr., Stoddard J.J., Gaglani M.J., et al.: Effectiveness of school-based influenza
vaccination. N. Engl. J. Med., 2006; 355: 2523–2532
385. Davis M.M., King J.C. Jr., Moag L., et al.: Countywide school-based influenza immunization:
direct and indirect impact on student absenteeism. Pediatrics, 2008; 122:
e260–e265
386. Monto A.S., Davenport F.M., Napier J.A., et al.: Modification of an outbreak of influenza
in Tecumseh, Michigan by vaccination of schoolchildren. J. Infect. Dis., 1970; 122:
16–25
387. Ghendon Y.Z., Kaira A.N., Elshina G.A.: The effect of mass influenza immunization
in children on the morbidity of the unvaccinated elderly. Epidemiol. Infect., 2006; 134:
71–78
388. Kwong J.C., Stukel T.A., Lim J., et al.: The effect of universal influenza immunization
on mortality and health care use. PLoS Med., 2008; 5: e211
389. Kwong J.C., Maaten S., Upshur R.E., et al.: The effect of universal influenza immunization
on antibiotic prescriptions: an ecological study. Clin. Infect. Dis., 2009; 49: 750–756
390. Keitel W.A., Cate T.R., Couch R.B., et al.: Efficacy of repeated annual immunization
with inactivated influenza virus vaccines over a five year period. Vaccine, 1997; 15:
1114–1122
391. CDC. Interim within-season estimate of the effectiveness of trivalent inactivated influenza
vaccine – Marshfield, Wisconsin, 2007–08 influenza season. MMWR, 2008; 57:
393–398
392. CDC. Effectiveness of 2008–09 trivalent influenza vaccine against 2009 pandemic influenza A (H1N1) – United States, May–June 2009. MMWR, 2009; 58: 1241–1245
393. Maciosek M.V., Solberg L.I., Coffield A.B., et al.: Influenza vaccination health impact
and cost effectiveness among adults aged 50 to 64 and 65 and older. Am. J. Prev. Med.,
2006; 31: 72–79
394. Nichol K.L.: Cost-benefit analysis of a strategy to vaccinate healthy working adults
against influenza. Arch. Intern. Med., 2001; 161: 749–759
395. Meltzer M.I., Neuzil K.M., Griffin M.R., et al.: An economic analysis of annual influenza
vaccination of children. Vaccine, 2005; 23: 1004–1014
396. 3Sander B., Kwong J.C., Bauch C.T., et al.: Economic appraisal of Ontario's Universal
Influenza Immunization Program: a cost-utility analysis. PLoS Med., 2010; 7:
e1 000 256
397. Keren R., Zaoutis T.E., Saddlemire S., et al.: Direct medical cost of influenza-related
hospitalizations in children. Pediatrics, 2006; 118: e1321–e1327
398. Prosser L.A., Bridges C.B., Uyeki T.M., et al.: Health benefits, risks, and cost-effectiveness
of influenza vaccination of children. Emerg. Infect. Dis., 2006; 12: 1548–1558
399. Cohen G.M., Nettleman M.D.: Economic impact of influenza vaccination in preschool
children. Pediatrics, 2000; 106: 973–976
400. White T., Lavoie S., Nettleman M.D.: Potential cost savings attributable to influenza
vaccination of school-aged children. Pediatrics, 1999; 103: e73
401. Luce B.R., Zangwill K.M., Palmer C.S., et al.: Cost-effectiveness analysis of an intranasal
influenza vaccine for the prevention of influenza in healthy children. Pediatrics, 2001;
108: e24
402. Dayan G.H., Nguyen V.H., Debbag R., et al.: Cost-effectiveness of influenza vaccination
in high-risk children in Argentina. Vaccine, 2001; 19: 4204–4213
403. Prosser L.A., O'Brien M.A., Molinari N.A., et al.: Non-traditional settings for influenza
vaccination of adults: costs and cost effectiveness. Pharmacoeconomics, 2008; 26:
163–178
404. Coleman M.S., Fontanesi J., Meltzer M.I., et al.: Estimating medical practice expenses
from administering adult influenza vaccinations. Vaccine, 2005; 23: 915–923
405. Yoo B.K., Szilagyi P.G., Schaffer S.J., et al.: Cost of universal influenza vaccination of
children in pediatric practices. Pediatrics, 2009;124 (suppl. 5): S499–S506
406. US Department of Health and Human Services. Healthy people 2000: national health promotion
and disease prevention objectives – full report, with commentary. Washington,
DC: US Department of Health and Human Services, Public Health Service, Washington,
DC, 1991
407. US Department of Health and Human Services. Healthy People 2010, With understanding
and improving health and objectives for improving health (2 vols.) Washington, DC, US
Department of Health and Human Services, 2000
408. CDC. Improving influenza, pneumococcal polysaccharide, and hepatitis B vaccination
coverage among adults aged <65 years at high risk: a report on recommendations
of the Task Force on Community Preventive Services. MMWR, 2005; 54 (No. RR-5)
409. Ndiaye S.M., Hopkins D.P., Shefer A.M., et al.: Interventions to improve influenza, pneumococcal
polysaccharide, and hepatitis B vaccination coverage among high-risk adults: a systematic review. Am. J. Prev. Med., 2005; 28: 248–279
410. Lu P., Bridges C.B., Euler G.L., et al.: Influenza vaccination of recommended adult populations,
U.S., 1989–2005. Vaccine, 2008; 26: 1786–1793
411. CDC. Early release of selected estimates based on data from the January–June 2008
National Health Interview Survey. Hyattsville, MD: US Department of Health and
Human Services, CDC, National Center for Health Statistics, 2008
412. CDC. Percentage of persons of all ages without health insurance coverage at the time
of interview: United States, 1997–September 2009. Available at http://www.cdc.gov/nchs/data/nhis/earlyrelease/earlyrelease201003.pdf. Accessed July 12, 2010
413. Lu P.J., Euler G.L., Callahan D.B.: Influenza vaccination among adults with asthma findings
from the 2007 BRFSS survey. Am. J. Prev. Med., 2009; 37: 109–115
414. CDC. Use of influenza A (H1N1) 2009 monovalent vaccine: recommendations of
the Advisory Committee on Immunization Practices (ACIP), 2009. MMWR, 2009; 58
(No. RR-10)
415. CDC. Interim results: state-specific influenza A (H1N1) 2009 monovalent vaccination
coverage – United States, October 2009–January 2010. MMWR, 2010; 59: 363–368
416. CDC. Interim results: state-specific seasonal influenza vaccination coverage – United
States, August 2009–January 2010. MMWR, 2010; 59: 477–484
417. Zerr D.M., Englund J.A., Robertson A.S., et al.: Hospital-based influenza vaccination
of children: an opportunity to prevent subsequent hospitalization. Pediatrics, 2008;
121: 345–348
418. Bratzler D.W., Houck P.M., Jiang H., et al.: Failure to vaccinate Medicare inpatients: a missed opportunity. Arch. Intern. Med., 2002; 162: 2349–2356
419. Verani J.R., Irigoyen M., Chen S., et al.: Influenza vaccine coverage and missed opportunities
among inner-city children aged 6 to 23 months: 2000–2005. Pediatrics, 2007; 119:
e580–e586
420. Fedson D.S., Houck P., Bratzler D.: Hospital-based influenza and pneumococcal vaccination:
Sutton's Law applied to prevention. Infect. Control Hosp. Epidemiol., 2000;
21: 692–699
421. Brewer N.T., Hallman W.K.: Subjective and objective risk as predictors of influenza
vaccination during the vaccine shortage of 2004–2005. Clin. Infect. Dis., 2006; 43:
1379–1386
422. Santibanez T.A., Mootrey G.T., Euler G.L., et al.: Behavior and beliefs about influenza
vaccine among adults aged 50–64 years. Am. J. Health Behav., 2010; 34: 77–89
423. CDC. Early release of selected estimates based on data from the January–September
2007 National Health Interview Survey. Hyattsville, MD: US Department of Health and
Human Services, CDC, National Center for Health Statistics, 2008
424. Hebert P.L., Frick K.D., Kane R.L., et al.: The causes of racial and ethnic differences
in influenza vaccination rates among elderly Medicare beneficiaries. Health Serv. Res.,
2005; 40: 517–537
425. Winston C.A., Wortley P.M., Lees K.A.: Factors associated with vaccination of medicare
beneficiaries in five U.S. communities: results from the racial and ethnic adult disparities
in immunization initiative survey, 2003. J. Am. Geriatr. Soc., 2006; 54: 303–310
426. Fiscella K., Dressler R., Meldrum S., et al.: Impact of influenza vaccination disparities
on elderly mortality in the United States. Prev. Med., 2007; 45: 83–87
427. Bardenheier B.H., Wortley P., Ahmed F., et al.: Influenza immunization coverage among
residents of long-term care facilities certified by CMS, 2005–2006: the newest MDs
quality indicator. J. Am. Med. Dir. Assoc., 2010; 11: 59–69
428. CDC. Influenza vaccination coverage among children with asthma – United States,
2004–2005 influenza season. MMWR, 2007; 56: 193–196
429. CDC. Influenza vaccination coverage among children aged 6–23 months – United States,
2007–08 influenza season. MMWR, 2009; 58: 1063–1066
430. CDC. Influenza vaccination coverage among children aged 6 months–18 years – eight immunization
information system sentinel sites, United States, 2008–09 influenza season.
MMWR, 2009; 58: 1059–1062
431. Nowalk M.P., Zimmerman R.K., Lin C.J., et al.: Parental perspectives on influenza immunization
of children aged 6 to 23 months. Am. J. Prev. Med., 2005; 29: 210–214
432. Gnanasekaran S.K., Finkelstein J.A., Hohman K., et al.: Parental perspectives on influenza
vaccination among children with asthma. Public Health Rep., 2006; 121: 181–188
433. Gaglani M., Riggs M., Kamenicky C., et al.: A computerized reminder strategy is effective
for annual influenza immunization of children with asthma or reactive airway disease.
Pediatr. Infect. Dis. J., 2001; 20: 1155–1160
434. Allison M.A., Daley M.F., Barrow J., et al.: High influenza vaccination coverage in children
with high-risk conditions during a vaccine shortage. Arch. Pediatr. Adolesc. Med., 2009;
163: 426–431
435. National Foundation for Infectious Diseases. Call to action: influenza immunization
among health-care workers, 2003. Available at http://www.nfid.org/pdf/publications/calltoaction.pdf. Accessed July 12, 2010
436. Poland G.A., Tosh P., Jacobson R.M.: Requiring influenza vaccination for health care
workers: seven truths we must accept. Vaccine, 2005; 23: 2251–2255
437. CDC. Influenza vaccination of health-care personnel: recommendations of the Healthcare
Infection Control Practices Advisory Committee (HICPAC) and the Advisory Committee
on Immunization Practices (ACIP). MMWR, 2006; 55 (No. RR-2)
438. CDC. Interim results: influenza A (H1N1) 2009 monovalent vaccination coverage – United
States, October–December 2009. MMWR, 2010; 59: 44–48
439. Ofstead C.L., Tucker S.J., Beebe T.J., et al.: Influenza vaccination among registered nurses:
information receipt, knowledge, and decision-making at an institution with a multifaceted
educational program. Infect. Control Hosp. Epidemiol., 2008; 29: 99–106
440. Yeager D.P., Toy E.C., Baker B. 3rd.: Influenza vaccination in pregnancy. Am. J. Perinatol.,
1999; 16: 283–286
441. Gonik B., Jones T., Contreras D., et al.: The obstetrician-gynecologist's role in vaccine-preventable
diseases and immunization. Obstet. Gynecol., 2000; 96: 81–84
442. CDC. National Influenza Vaccination Week – November 26–December 2, 2007. MMWR,
2007; 56: 1216–1217
443. Zimmerman R.K., Raymund M., Janosky J.E., et al.: Sensitivity and specificity of patient
self-report of influenza and pneumococcal polysaccharide vaccinations among elderly
outpatients in diverse patient care strata. Vaccine, 2003; 21: 1486–1491
444. CDC. Prevention and control of seasonal influenza with vaccines: recommendations
of the Advisory Committee on Immunization Practices (ACIP), 2009. MMWR, 2009; 58 (No.
RR-8).
445. Iuliano A.D., Reed C., Guh A., et al.: Notes from the field: outbreak of 2009 pandemic
influenza A (H1N1) virus at a large public university in Delaware, April–May 2009. Clin.
Infect. Dis., 2009; 49: 1811–1820
446. Miller E., Hoschler K., Hardelid P., et al.: Incidence of 2009 pandemic influenza A H1N1 infection
in England: a cross-sectional serological study. Lancet, 2010; 375: 1100–1108
447. CDC. Hospitalized patients with novel influenza A (H1N1) virus infection – California,
April–May, 2009. MMWR, 2009; 58: 536–541
448. Food and Drug Administration. Influenza virus vaccine 2010–2011 season. Available
at http://www.fda.gov/BiologicsBloodVaccines/GuidanceComplianceRegulatoryInfor
mation/Post-MarketActivities/LotReleases/ucm202 750.htm. Accessed July 12, 2010
449. Basta N.E., Chao D.L., Halloran M.E., et al.: Strategies for pandemic and seasonal influenza
vaccination of schoolchildren in the United States. Am. J. Epidemiol., 2009; 170:
679–686
450. Dagan R., Hall C.B.: Influenza A virus infection imitating bacterial sepsis in early infancy.
Pediatr. Infect. Dis., 1984; 3: 218–221
451. Anonymous. Prevention of influenza: recommendations for influenza immunization
of children, 2007–2008. Pediatrics, 2008; 121: e1016–e1031
452. Talbot T.R., Bradley S.E., Cosgrove S.E., et al.: Influenza vaccination of healthcare workers
and vaccine allocation for healthcare workers during vaccine shortages. Infect.
Control Hosp. Epidemiol., 2005; 26: 882–890
453. Polgreen P.M., Chen Y., Beekmann S., et al.: Elements of influenza vaccination programs
that predict higher vaccination rates: results of an emerging infections network survey.
Clin. Infect. Dis., 2008; 46: 14–19
454. Polgreen P.M., Septimus E.J., Parry M.F., et al.: Relationship of influenza vaccination
declination statements and influenza vaccination rates for healthcare workers in 22 US
hospitals. Infect. Control Hosp. Epidemiol., 2008; 29: 675–677
455. CDC. Interventions to increase influenza vaccination of health-care workers – California
and Minnesota. MMWR, 2005; 54: 196–199
456. Ajenjo M.C., Woeltje K.F., Babcock H.M., et al.: Influenza vaccination among healthcare
workers: ten-year experience of a large healthcare organization. Infect. Control. Hosp.
Epidemiol., 2010; 31: 233–240
457. Pavia A.T.: Mandate to protect patients from health care-associated influenza. Clin.
Infect. Dis., 2010; 50: 465–467
458. Babcock H.M., Gemeinhart N., Jones M., et al.: Mandatory influenza vaccination of health
care workers: translating policy to practice. Clin. Infect. Dis., 2010; 50: 459–464
459. Stewart A.M.: Mandatory vaccination of health care workers. N. Engl. J. Med., 2009;
361: 2015–2017
460. Infectious Diseases Society of America. Pandemic and seasonal influenza: principles for
U.S. action. Arlington, VA, Infectious Diseases Society of America, 2007
461. Parmet W.E.: Pandemic vaccines – the legal landscape. N. Engl. J. Med., 2010; 362:
1949–1952
462. Joint Commission on Accreditation of Healthcare Organizations. New infection control
requirement for offering influenza vaccination to staff and licensed independent practitioners.
Jt. Comm. Perspect., 2006; 26: 10–11
463. Stewart A.C., Cox M., Rosenbaum S.: The epidemiology of U.S. immunization law: immunization
requirements for staff and residents of long-term care facilities under state
laws/regulations. Washington, DC, George Washington University, 2005
464. Lindley M.C., Horlick G.A., Shefer A.M., et al.: Assessing state immunization requirements
for healthcare workers and patients. Am. J. Prev. Med., 2007; 32: 459–465
465. CDC. State immunization laws for healthcare workers and patients. Available at http://www2a.cdc.gov/nip/stateVaccApp/StateVaccsApp/default.asp. Accessed July 12, 2010
466. CDC. Guidelines for environmental infection control in health-care facilities.
Recommendations of CDC and the Healthcare Infection Control Practices Advisory
Committee (HICPAC). MMWR, 2003; 52 (No. RR-10)
467. Halasa N., Englund J.A., Nachman S.: Safety of live attenuated influenza vaccine in mild
to moderately immunocompromised children with cancer [Abstract]. Presented at the annual
meeting of the Pediatric Academic Societies, April 30–May 3, 2010; Vancouver,
British Columbia, Canada
468. Huber V.C., McCullers J.A.: Live attenuated influenza vaccine is safe and immunogenic
in immunocompromised ferrets. J. Infect. Dis., 2006; 193: 677–684
469. CDC. Recommended adult immunization schedule – United States, 2009. MMWR, 2009;
57: Q1–Q4
470. Miller J.M., Tam T.W., Maloney S., et al.: Cruise ships: high-risk passengers and the global
spread of new influenza viruses. Clin. Infect. Dis., 2000; 31: 433–438
471. Uyeki T.M., Zane S.B., Bodnar U.R., et al.: Large summertime influenza A outbreak among
tourists in Alaska and the Yukon Territory. Clin. Infect. Dis., 2003; 36: 1095–1102
472. Mutsch M., Tavernini M., Marx A., et al.: Influenza virus infection in travelers to tropical
and subtropical countries. Clin. Infect. Dis., 2005; 40: 1282–1287
473. CDC. Licensure of a high-dose inactivated influenza vaccine for persons aged .65 years
(Fluzone High-Dose) and guidance for use – United States, 2010. MMWR, 2010; 59:
485–486
474. CDC. Expansion of use of live attenuated influenza vaccine (FluMist(r)) to children aged
2–4 years and other FluMist changes for the 2007–08 influenza season. MMWR, 2007;
56: 1217–1219
475. Nolan T., Bernstein D.I., Block S.L., et al.: Safety and immunogenicity of concurrent
administration of live attenuated influenza vaccine with measles-mumps-rubella and
varicella vaccines to infants 12 to 15 months of age. Pediatrics, 2008; 121: 508–516
476. Kerzner B., Murray A.V., Cheng E., et al.: Safety and immunogenicity profile of the concomitant
administration of ZOSTAVAX and inactivated influenza vaccine in adults aged
50 and older. J. Am. Geriatr. Soc., 2007; 55: 1499–1507
477. Black S., Eskola J., Siegrist C.A., et al.: Importance of background rates of disease in
assessment of vaccine safety during mass immunisation with pandemic H1N1 influenza
vaccines. Lancet, 2009; 374: 2115–2122
478. Gross P.A., Russo C., Dran S., et al.: Time to earliest peak serum antibody response to
influenza vaccine in the elderly. Clin. Diagn. Lab. Immunol., 1997; 4: 491–492
479. Brokstad K.A., Cox R.J., Olofsson J., et al.: Parenteral influenza vaccination induces a rapid systemic and local immune response. J. Infect. Dis., 1995; 171: 198–203
480. Nichol K.L., Mac Donald R., Hauge M.: Factors associated with influenza and pneumococcal
vaccination behavior among high-risk adults. J. Gen. Intern. Med., 1996; 11:
673–677
481. Ashby-Hughes B., Nickerson N.: Provider endorsement: the strongest cue in prompting
high-risk adults to receive influenza and pneumococcal immunizations. Clin. Excell.
Nurse Pract., 1999; 3: 97–104
482. Lawson F., Baker V., Au D., et al.: Standing orders for influenza vaccination increased
vaccination rates in inpatient settings compared with community rates. J. Gerontol.
A. Biol. Sci. Med. Sci., 2000; 55: M522–M526
483. Jacobson V.J., Szilagyi P.: Patient reminder and patient recall systems to improve immunization
rates. Cochrane Database Syst. Rev., 2005; (3): CD003 941
484. CMS. Medicare and Medicaid programs; conditions of participation: immunization standards
for hospitals, long-term care facilities, and home health agencies. Final rule with
comment period. Fed. Regist., 2002; 67: 61 808–61 814
485. Centers for Medicare and Medicaid Services. Emergency update to the 2007 Medicare
Physician Fee Schedule Database (MPFSDB). Available at http://www.cms.hhs.gov/MLNMattersArticles/downloads/MM5459.pdf. Accessed July 12, 2010
486. Centers for Medicare and Medicaid Services. 2006–2007 influenza (flu) season
resources for health care professionals. Available at http://www.cms.hhs.gov/MLNMattersArticles/downloads/SE0667.pdf. Accessed July 12, 2010
487. CDC. Use of standing orders programs to increase adult vaccination rates. MMWR, 2000;
49 (No. RR-1): 15–26
488. Rue-Cover A., Iskander J., Lyn S., et al.: Death and serious illness following influenza
vaccination: a multidisciplinary investigation. Pharmacoepidemiol. Drug Saf., 2009; 18:
504–511
489. Stefanacci R.G.: Creating artificial barriers to vaccinations. J. Am. Med. Dir. Assoc., 2005;
6: 357–358
490. CDC. Outbreaks of 2009 pandemic influenza A (H1N1) among long-term-care facility
residents – three states, 2009. MMWR, 2010; 59: 74–77
491. CMS. Medicare and Medicaid programs; condition of participation: immunization standard
for long term care facilities. Final rule. Fed. Regist., 2005; 70: 58 833–58 852
492. Effler P.V., Chu C., He H., et al.: Statewide school-located influenza vaccination program
for children 5–13 years of age, Hawaii, USA. Emerg. Infect. Dis., 2010; 16: 244–250
493. Carpenter L.R., Lott J., Lawson B.M., et al.: Mass distribution of free, intranasally administered
influenza vaccine in a public school system. Pediatrics, 2007; 120: e172–e178
494. Office of Inspector General. Memorandum report: 2009 H1N1 school-located vaccination
program implementation, OIE 04-10-00 020. Available at http://oig.hhs.gov/oei/reports/oei-04-10-00 020.pdf
495. Simonsen L., Reichert T.A., Viboud C., et al.: Impact of influenza vaccination on seasonal
mortality in the US elderly population. Arch. Intern. Med., 2005; 165: 265–272
496. Nichol K.L., Nordin J., Mullooly J.: Influence of clinical outcome and outcome period
definitions on estimates of absolute clinical and economic benefits of influenza vaccination
in community dwelling elderly persons. Vaccine, 2006; 24: 1562–1568
497. Council of State and Territorial Epidemiologists. Interim position statement. Atlanta, GA,
Council of State and Territorial Epidemiologists, 2007
498. World Health Organization. Update: WHO-confirmed human cases of avian influenza A (H5N1) infection, November 2003–May 2008. Wkly Epidemiol. Rec., 2008; 83:
415–420
499. Kandun I.N., Wibisono H., Sedyaningsih E.R., et al.: Three Indonesian clusters of H5N1
virus infection in 2005. N. Engl. J. Med., 2006; 355: 2186–2194
500. Oner A.F., Bay A., Arslan S. et al.: Avian influenza A (H5N1) infection in eastern Turkey
in 2006. N. Engl. J. Med., 2006; 355: 2179–2185
501. Areechokchai D., Jiraphongsa C., Laosiritaworn Y., et al.: Investigation of avian influenza
(H5N1) outbreak in humans – Thailand, 2004. MMWR, 2006; 55 (supl. 1): 3–6
502. Dinh P.N., Long H.T., Tien N.T. et al.: Risk factors for human infection with avian influenza A H5N1, Vietnam, 2004. Emerg. Infect. Dis., 2006; 12: 1841–1847
503. Gilsdorf A., Boxall N., Gasimov V., et al.: Two clusters of human infection with influenza
A/H5N1 virus in the Republic of Azerbaijan, February–March 2006. Euro. Surveill., 2006;
11: 122–126
504. WHO. Update: WHO-confirmed human cases of avian influenza A(H5N1) infection, 25
November 2003–24 November 2006. Wkly Epidemiol. Rec., 2007; 82: 41–48
505. Kandun I.N., Tresnaningsih E., Purba W.H., et al.: Factors associated with case fatality
of human H5N1 virus infections in Indonesia: a case series. Lancet, 2008; 372:
744–749
506. Yu H., Gao Z., Feng Z., et al.: Clinical characteristics of 26 human cases of highly pathogenic
avian influenza A (H5N1) virus infection in China. PLoS ONE, 2008; 3: e2985
507. Uyeki T.M.: Human infection with highly pathogenic avian influenza A (H5N1) virus:
review of clinical issues. Clin. Infect. Dis., 2009; 49: 279–290
508. Abdel-Ghafar A.N., Chotpitayasunondh T., Gao Z., et al.: Update on avian influenza A (H5N1) virus infection in humans. N. Engl. J. Med., 2008; 358: 261–273
509. Brooks W.A., Alamgir A.S., Sultana R., et al.: Avian influenza virus A (H5N1), detected
through routine surveillance, in child, Bangladesh. Emerg. Infect. Dis., 2009; 15:
1311–1313
510. Vong S., Ly S., Van Kerkhove M.D., et al.: Risk factors associated with subclinical human
infection with avian influenza A (H5N1) virus – Cambodia, 2006. J. Infect. Dis., 2009;
199: 1744–1752
511. Wang H., Feng Z., Shu Y., et al.: Probable limited person-to-person transmission of highly
pathogenic avian influenza A (H5N1) virus in China. Lancet, 2008; 371: 1427–1434
512. Monto A.S.: The threat of an avian influenza pandemic. N. Engl. J. Med., 2005; 352:
323–325
513. Maines T.R., Chen L.M., Matsuoka Y., et al.: Lack of transmission of H5N1 avian-human
reassortant influenza viruses in a ferret model. Proc. Natl. Acad. Sci. U. S. A., 2006; 103:
12 121–12 126
514. CDC. Updated interim guidance for laboratory testing of persons with suspected infection
with highly pathogenic avian influenza A (H5N1) virus in the United States, 2009.
Available at http://www.cdc.gov/flu/avian/professional/guidance-labtesting.htm
.Accessed July 12, 2010
515. CDC. Interim guidance for follow-up of contacts of persons with suspected infection
with highly pathogenic avian influenza A (H5N1) virus in the United States. Available
at http://www.cdc.gov/flu/avian/professional/guidance-followup.htm. Accessed July 12,
2010
516. World Health Organization. Summary of human infection with highly pathogenic avian
influenza A (H5N1) virus reported to WHO, January 2003–March 2009: cluster-associated
cases. Wkly Epidemiol. Rec., 2010; 85: 13–20
517. Nguyen-Van-Tam J.S., Nair P., Acheson P. et al.: Outbreak of low pathogenicity H7N3
avian influenza in UK, including associated case of human conjunctivitis. Euro. Surveill.,
2006; 11: E060 504 2
518. Kurtz J., Manvell R.J., Banks J.: Avian influenza virus isolated from a woman with conjunctivitis.
Lancet, 1996; 348: 901–902
519. Peiris M., Yuen K.Y., Leung C.W., et al.: Human infection with influenza H9N2. Lancet,
1999; 354: 916–917
520. CDC. Update: influenza activity – United States and worldwide, 2003–04 season, and
composition of the 2004–05 influenza vaccine. MMWR, 2004; 53: 547–552
521. Uyeki T.M., Chong Y.H., Katz J.M., et al.: Lack of evidence for human-to-human transmission
of avian influenza A (H9N2) viruses in Hong Kong, China 1999. Emerg. Infect. Dis.,
2002; 8: 154–159
522. Yuanji G.: Influenza activity in China: 1998–1999. Vaccine, 2002; 20 (supl. 2): S28–S35
523. Editorial Team, Eurosurveillance Editorial Office. Avian influenza A/(H7N2) outbreak
in the United Kingdom. Euro. Surveill., 2007; 12: E070 531 2
524. Fouchier R.A., Schneeberger P.M., Rozendaal F.W., et al.: Avian influenza A virus (H7N7)
associated with human conjunctivitis and a fatal case of acute respiratory distress
syndrome. Proc. Natl. Acad. Sci. U. S. A., 2004; 101: 1356–1361
525. Koopmans M., Wilbrink B., Conyn M., et al.: Transmission of H7N7 avian influenza A virus
to human beings during a large outbreak in commercial poultry farms in the Netherlands.
Lancet, 2004; 363: 587–593
526. World Health Organization. Update on human cases of highly pathogenic avian influenza A (H5N1) infection: 2009. Wkly Epidemiol. Rec., 2010; 85: 49–51
527. Olsen C.W.: The emergence of novel swine influenza viruses in North America. Virus Res.,
2002; 85: 199–210
528. Ma W., Vincent A.L., Gramer M.R., et al.: Identification of H2N3 influenza A viruses from
swine in the United States. Proc. Natl. Acad. Sci. U. S. A., 2007; 104: 20 949–20 954
529. Myers K.P., Olsen C.W., Setterquist S.F., et al.: Are swine workers in the United States
at increased risk of infection with zoonotic influenza virus? Clin. Infect. Dis., 2006; 42:
14–20
530. Dowdle W.R., Hattwick M.A.: Swine influenza virus infections in humans. J. Infect. Dis.,
1977; 136 (supl.): S386–S389
531. Myers K.P., Olsen C.W., Gray G.C.: Cases of swine influenza in humans: a review of the literature.
Clin. Infect. Dis., 2007; 44: 1084–1088
532. Newman A.P., Reisdorf E., Beinemann J., et al.: Human case of swine influenza A (H1N1)
triple reassortant virus infection, Wisconsin. Emerg. Infect. Dis., 2008; 14: 1470–1472
533. Dacso C.C., Couch R.B., Six H.R., et al.: Sporadic occurrence of zoonotic swine influenza
virus infections. J. Clin. Microbiol., 1984; 20: 833–835
534. Gray G.C., McCarthy T., Capuano A.W., et al.: Swine workers and swine influenza virus
infections. Emerg. Infect. Dis., 2007; 13: 1871–1878
535. CDC. Update: influenza activity – United States and worldwide, May 20–September
15, 2007. MMWR, 2007; 56: 1001–1004
536. Shinde V., Bridges C.B., Uyeki T.M., et al.: Triple-reassortant swine influenza A (H1)
in humans in the United States, 2005–2009. N. Engl. J. Med., 2009; 360: 2616–2625
537. Olsen C.W., Brammer L., Easterday B.C., et al.: Serologic evidence of H1 swine Influenza
virus infection in swine farm residents and employees. Emerg. Infect. Dis., 2002; 8:
814–819
538. CDC. Interim guidance for protection of persons involved in U.S. avian influenza outbreak
disease control and eradication activities. Available at: http://www.cdc.gov/flu/avian/professional/protect-guid.htm. Accessed July 12, 2010
539. Occupational Safety and Health Administration. OSHA guidance update on protecting
employees from avian flu (avian influenza) viruses. Available at: http://www.osha.gov/OshDoc/data_AvianFlu/avian_flu_guidance_english.pdf. Accessed July 12, 2010
540. CDC. Antiviral treatment options, including intravenous peramivir, for treatment of
influenza in hospitalized patients for the 2009–2010 season. Available at: http://www.cdc.gov/H1N1flu/EUA/peramivir_recommendations.htm. Accessed July 12, 2010
541. Dharan N.J., Gubareva L.V., Meyer J.J., et al.: Infections with oseltamivir-resistant influenza
A(H1N1) virus in the United States. JAMA, 2009; 301: 1034–1041
542. Lackenby A., Thompson C.I., Democratis J.: The potential impact of neuraminidase
inhibitor resistant influenza. Curr. Opin. Infect. Dis., 2008; 21: 626–638
543. Meijer A., Lackenby A., Hungnes O., et al.: Oseltamivir-resistant influenza virus A (H1N1),
Europe, 2007–08 Season. Emerg. Infect. Dis., 2009; 15: 552–560
544. World Health Organization. Update on oseltamivir-resistant influenza A (H1N1) 2009
influenza virus: January 2010. Wkly Epidemiol. Rec., 2010; 85: 37–40
545. CDC. Oseltamivir-resistant novel influenza A (H1N1) virus infection in two immunosuppressed
patients – Seattle, Washington, 2009. MMWR, 2009; 58: 893–896
546. CDC. Oseltamivir-resistant 2009 pandemic influenza A (H1N1) virus infection in two
summer campers receiving prophylaxis – North Carolina, 2009. MMWR, 2009; 58:
969–972
547. Gaur A.H., Bagga B., Barman S., et al.: Intravenous zanamivir for oseltamivir-resistant
2009 H1N1 influenza. N. Engl. J. Med., 2010; 362: 88–89
548. Le Q.M., Wertheim H.F., Tran N.D., et al.: A community cluster of oseltamivir-resistant
cases of 2009 H1N1 influenza. N. Engl. J. Med., 2010; 362: 86–87
549. Memoli M.J., Hrabal R.J., Hassantoufighi A., et al.: Rapid selection of a transmissible
multidrug-resistant influenza A/H3N2 virus in an immunocompromised host. J. Infect.
Dis., 2010; 201: 1397–1403
550. Harper S.A., Bradley J.S., Englund J.A., et al.: Seasonal influenza in adults and children-diagnosis,
treatment, chemoprophylaxis, and institutional outbreak management: clinical
practice guidelines of the Infectious Diseases Society of America. Clin. Infect. Dis, 2009;
DOI:10.1086/598 513
551. World Health Organization. WHO guidelines for pharmacological management of pandemic
(H1N1) 2009 influenza and other influenza viruses. Available at http://www.who.int/csr/resources/publications/swineflu/h1n1_use_antivirals_20 090 820/en/index.html.Accessed July 12, 2010
552. World Health Organization. Clinical management of human infection with pandemic
(H1N1) 2009: revised guidance. Available at http://www.who.int/csr/resources/publications/swineflu/clinical_management/en/index.html. Accessed July 12, 2010

























