Wprowadzenie
W krajach rozwijających się malaria (p. tab.) jest szóstą pod względem częstości przyczyną zgonów, a czwartą wśród przyczyn zakaźnych (po zakażeniach dolnych dróg oddechowych, biegunkach i HIV/AIDS). Dla porównania wypadki drogowe, do których – jako przyczyny zgonów – polski Czytelnik jest bardziej przyzwyczajony, plasują się dopiero na 10. miejscu w tym niechlubnym rankingu.1 Szacuje się, że w 2016 roku na całym świecie odnotowano 216 mln przypadków malarii w 91 krajach, w tym 445 000 śmiertelnych. Wśród nich około 2/3 (290 000) dotyczyło dzieci <5. roku życia, co daje średnio 800 zgonów najmłodszych dzieci dziennie (specyfika malarii u dzieci – p. ramka). 90% przypadków malarii i 91% zgonów dotyczyło Regionu Afrykańskiego, w którym dominuje zarodziec sierpowy Plasmodium falciparum.2
W kontekście powyższych danych nie dziwi więc fakt, że od dawna podejmuje się próby opracowania skutecznej szczepionki przeciwko zarodźcom wywołującym zimnicę. Zadanie to jest dużym wyzwaniem, ponieważ wszystkie dotychczas opracowane szczepionki chronią przed bakteriami lub wirusami, a więc czynnikami patogenetycznymi o znacznie prostszej budowie niż należące do eukariotycznych organizmów jądrowych Plasmodium spp. Ekspozycja na zarodźce malarii nie zapewnia ochrony przed ponownym zachorowaniem, a nabyta w ten sposób odporność jest tylko częściowa.3-5 Ze względu na bardzo złożony cykl życiowy zarodźców, ich wieloantygenowość, wewnątrzkomórkowe bytowanie przez większość etapów rozwoju w organizmie człowieka oraz zróżnicowane odpowiedzi immunologiczne wobec zarodźców, prace nad większością szczepionek kończyły się fiaskiem. Do tej pory zapobieganie malarii polegało zatem na stosowaniu klasycznych środków chroniących przed ekspozycją na ukąszenia komarów, takich jak zawieszanie nad łóżkami moskitier nasączonych insektycydami, rozpylanie insektycydów wewnątrz pomieszczeń mieszkalnych (indoor residual spraying – IRS) oraz stosowanie chemioprofilaktyki malarii (leki przeciwmalaryczne). Szacuje się, że od 2000 roku dzięki stosowaniu kombinacji metod profilaktycznych uniknięto 663 milionów zachorowań na malarię, przy czym najważniejszą rolę odegrały moskitiery nadłóżkowe (68%).6 Mimo to opisane metody nawet nie pozwalają myśleć o eradykacji zimnicy. Ostatnio ukończono jednak prace nad nową szczepionką przeciwko zimnicy, która ma szansę wpłynąć – przynajmniej częściowo – na statystykę zachorowań na malarię wywoływaną przez Plasmodium falciparum.
| Tabela. Etiologia i patogeneza zachorowań na malarię | |
|---|---|
| definicja | ogólnoustrojowa choroba pasożytnicza wywołana przez pierwotniaki z rodzaju Plasmodium |
| gatunki | P. falciparum (zarodziec sierpowy), P. vivax (zarodziec ruchliwy), P. ovale (zarodziec owalny), P. malariae (zarodziec pasmowy), rzadko P. knowlesi (zarodziec małpi) |
| wektor i żywiciel ostateczny | samica komara widliszka (Anopheles) – faza płciowa cyklu rozwojowego |
| inne (rzadkie) źródła zakażenia | transfuzje krwi, zakłucie sprzętem medycznym, droga przezłożyskowa |
| żywiciel pośredni | człowiek – faza bezpłciowa cyklu rozwojowego |
| zdolność do wywoływania choroby przewlekłej/nawrotowej | P. vivax i P. ovale (tworzenie hipnozoitów w wątrobie) |
| zimnica tropikalna/zimnica złośliwa | najcięższa postać malarii wywoływana przez P. falciparum |
| okres wylęgania | P. falciparum – 12 dni, P. vivax – 13 dni, P. ovale – 17 dni, P. malariae – 28 dni |
| cykl rozwojowy | faza przederytrocytarna: po wniknięciu do organizmu SPOROZOITY
przemieszczają się do wątroby i atakują hepatocyty, w których
przekształcają się w postać SCHIZONTA (P. vivax i P. ovale ma również
zdolność do przekształcania części schizontów w wewnątrzkomórkowe
HIPNOZOITY). Schizonty namnażają się w wątrobie, a następnie
uwalniane są z nich MEROZOITY zdolne do inwazji na krwinki
czerwone. Faza erytrocytarna: merozoity wnikają do erytrocytów, namnażają się w nich (TROFOZOITY›SCHIZONTY KRWINKOWE), prowadząc do rozpadu erytrocytu i zainfekowania kolejnych krwinek czerwonych. Zsynchronizowany rozpad erytrocytów skutkuje pojawieniem się cyklicznej gorączki (co 48 h [trzeciaczka] – P. vivax i P. ovale; co 72 h [czwartaczka] – P. malariae; tor nieregularny – P. falciparum; co 24 h – P. knowlesi). Po kilku lub kilkunastu cyklach powstają GAMETOCYTY, które są inwazyjne dla komarów. Podczas żerowania komary zarażają się, a w ich organizmach zachodzi faza płciowa cyklu rozwojowego Plasmodium15 (p. ryc.). |
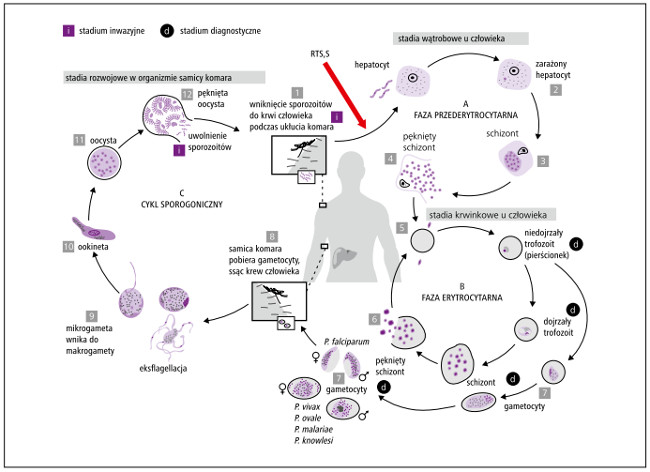
Ryc. 1. Cykl rozwojowy zarodźca malarii. Czerwoną strzałką zaznaczono fazę cyklu
rozwojowego, w której działa szczepionka RTS,S/AS01 przeciwko Plasmodium falciparum.
Specyfika malarii u dzieci
Ok. 90% przypadków malarii wywołanej przez P. falciparum występuje w regionie Afryki Subsaharyjskiej, a niemal wszystkie przypadki kończące się zgonem dotyczą dzieci <5. rż. Najbardziej podatne na ciężki przebieg malarii są dzieci między 6. mż. a 5. rż., które utraciły już ochronę odmatczyną, a nie wytworzyły jeszcze swojej własnej odporności immunologicznej wobec P. falciparum. U dzieci w tym wieku objawy malarii rozwijają się bardzo szybko, nierzadko w sposób piorunujący. Mogą być również nieswoiste i przypominać inne choroby infekcyjne, co prowadzi do opóźnienia prawidłowego rozpoznania i wdrożenia leczenia przeciwpierwotniakowego. Malaria może dawać objawy nieżytu żołądkowo-jelitowego lub zapalenia płuc. Bywa też mylnie rozpoznawana jako posocznica lub zapalenie opon mózgowo-rdzeniowych. U dzieci rzadko obserwuje się charakterystyczny dla tej choroby nawrotowy tor gorączki (<25% przypadków), zresztą podwyższenie temperatury w przebiegu zarażenia P. falciparum może być nieregularne z definicji i pojawiać się co kilka lub kilkanaście godzin. Z drugiej strony u dzieci chorych na malarię częściej występuje bardzo wysoka gorączka (>40°C).
Objawy ze strony przewodu pokarmowego – zwłaszcza wymioty – utrudniają wdrożenie leczenia doustnego, którego w niektórych regionach Afryki Subsaharyjskiej nie można zastąpić leczeniem dożylnym ze względu na ograniczony dostęp do opieki medycznej. Do ciężkiego przebiegu malarii predysponują również współistniejące stany kliniczne, takie jak niedożywienie, niedokrwistość i zaburzenia odporności (w tym zakażenie HIV), którego częstość występowania jest największa właśnie w Afryce Subsaharyjskiej. U dzieci często współwystępują najcięższe powikłania zimnicy – malaria mózgowa, ciężka anemia malaryczna, niewydolność oddechowa i hipoglikemia.21,22
Prace nad szczepionkami przeciwko malarii
Pierwsze prace nad szczepionkami przeciwko malarii rozpoczęto w latach 30. XX wieku – wypróbowano wówczas najprostszy i najbardziej oczywisty pomysł, a więc szczepionkę zawierającą zabite pierwotniaki Plasmodium.7 Szczepionka ta nie wywoływała jednak oczekiwanej odpowiedzi. Od tego czasu podjęto wiele prób znalezienia materiału antygenowego, który byłby wystarczająco immunogenny. Bardzo interesująca i unikatowa w świecie wakcynologii była nowatorska droga administracji materiału antygenowego Plasmodium zaproponowana w latach 70. XX wieku przez Clyde i wsp. – wprowadzanie napromieniowanych sporozoitów do organizmu ludzkiego poprzez kontrolowane ukłucia komarów.8 Metoda ta okazała się jednak niepraktyczna i nieskuteczna w aspekcie długofalowym.
Podstawową niewiadomą dla zespołów zajmujących się rozwojem szczepionek było to, która faza cyklu rozwojowego zarodźca malarii (p. ryc.) będzie najlepszym celem dla potencjalnych szczepionek. Antygeny fazy przederytrocytarnej, czyli białka znajdujące się na formach sporozoitów lub schizontów wątrobowych, wydają się dobrym celem potencjalnej szczepionki przeciwko malarii, ponieważ inaktywacja tych form pierwotniaka zapobiegałaby rozwojowi objawów klinicznych. Z drugiej strony sporozoity są obecne w krwioobiegu bardzo krótko (kilka minut), dlatego ich uchwycenie przez układ immunologiczny jest dużym wyzwaniem. Trudno dostępne dla odpowiedzi humoralnej i komórkowej są także bytujące wewnątrzkomórkowo schizonty. W związku z tym prowadzone badania dotyczą szczepionki skierowanej przeciwko całym hepatocytom zainfekowanym schizontami.9 Jako punkt uchwytu szczepionki przeciwmalarycznej rozważa się także antygeny fazy erytrocytarnej (przede wszystkim merozoitów), jednak słabym punktem tej koncepcji jest to, że w tym czasie inwazja pasożyta jest już dokonana i występują kliniczne objawy malarii. Antygeny fazy erytrocytarnej nie byłyby również dobrym rozwiązaniem w potencjalnych szczepionkach przeciwko Plasmodium vivax i P. ovale, które potrafią się przekształcać w fazie przederytrocytarnej w wewnątrzwątrobową formę hipnozoita, czyli „usypiać” na jakiś czas i potem wywoływać nawroty malarii.
Ciekawa jest również koncepcja szczepionek blokujących transmisję – skierowanych przeciwko gametocytom, a więc ostatniej formie pierwotniaka obecnej w organizmie człowieka oraz kolejnym stadiom płciowym w organizmie komara. Takie szczepionki nazywane są „alturistycznymi”, ponieważ ich rola nie polegałaby na redukcji objawów klinicznych u zaszczepionej osoby, tylko na jej wykluczeniu jako rezerwuaru zarodźców dla komarów, które w przyszłości żywiłyby się jej krwią, albo wręcz na jej potraktowaniu jako źródła przeciwciał, które będą działać dopiero w ciele wektora na dalsze stadia płciowe zarodźca. Rezultatem działania takich szczepionek byłoby zmniejszenie populacji bezobjawowych lub „submikroskopowych” nosicieli malarii w rejonach endemicznych, a więc redukcja narażenia na zarażenie innych członków populacji oraz zmniejszenie liczebności zarażonych komarów. Przypomina to zjawisko odporności zbiorowiskowej wykorzystywane w innych szczepionkach.4,9-11
W ostatnich latach prowadzone są liczne badania dotyczące różnych innych potencjalnych mechanizmów działania szczepionek wobec Plasmodium falciparum:
- inhibicja żywotności/ruchliwości sporozoitów – 5 badań klinicznych (w fazie I lub II oraz 1, które ukończyło fazę III – RTS,S [p. dalej])
- niszczenie zarażonych hepatocytów – 6 badań (I lub II faza)
- inhibicja inwazji merozoitami – 6 badań (głównie I faza)
- blokowanie transmisji – 4 badania (faza I lub II).9
Trwają również badania przedkliniczne nad szczepionką zapobiegającą zachorowaniom na malarię wrodzoną wywołaną przez P. falciparum (zapobieganie przezłożyskowej transmisji Plasmodium) oraz pojedyncze badania przedkliniczne i badania I fazy dotyczące Plasmodium vivax.7
Szczepionka RTS,S/AS01 przeciwko Plasmodium falciparum
RTS,S/AS01 jest jedyną szczepionką przeciwko zimnicy, która ukończyła III fazę badań klinicznych. Jest to szczepionka podjednostkowa, zawierająca białko PfCSP (Plasmodium falciparum circumsporozoite protein) obecne na powierzchni sporozoitów.12,13 W złożonym cyklu rozwojowym zarodźca sierpowego sporozoity są tymi formami pierwotniaka, które są „wstrzykiwane” do krwioobiegu człowieka podczas żerowania komara widliszka. Szczepionka wywołuje odpowiedź ze strony limfocytów T CD4 oraz indukuje wytwarzanie przeciwciał (odporność humoralna) przeciwko sporozoitom. Jej działanie polega więc na neutralizowaniu sporozoitów, zmniejszaniu ich ruchliwości i hamowaniu zdolności do inwazji na hepatocyty oraz ich dalszego wewnątrzwątrobowego rozwoju.7 W związku z tym rezultatem działania szczepionki (nawet przy założeniu jej częściowej skuteczności) jest redukcja „ładunku” merozoitów opuszczających wątrobę i następnie infekujących krwinki czerwone. Spodziewanym efektem klinicznym RTS,S działającej w tzw. fazie przederytrocytarnej, czyli bezobjawowej lub skąpoobjawowej, jest więc zmniejszenie lub całkowita redukcja objawów wynikających z pasożytowania zarodźców na krwinkach czerwonych w kolejnej fazie erytrocytarnej. To właśnie faza erytrocytarna cyklu rozwojowego P. falciparum i występująca w jej przebiegu hemoliza jest przyczyną zaburzeń homeostazy, które z kolei odpowiadają za występowanie ciężkich objawów malarii – niedokrwistości hemolitycznej, zaburzeń metabolicznych (hipoglikemia, kwasica, duże stężenie mleczanów), a w rezultacie rozwoju zaburzeń oddychania, obrzęku płuc, objawów neurologicznych (zaburzenia świadomości, drgawki – tzw. malaria mózgowa), ostrego uszkodzenia nerek, ciężkich krwawień i wstrząsu.14
Jak już wspomniano, za większość przypadków ciężkiej malarii na świecie odpowiada zakażenie P. falciparum. Wynika to z jego zdolności do zajmowania wszystkich stadiów erytrocytów (P. vivax i ovale atakuje wyłącznie retikulocyty i młode erytrocyty, a P. malariae starsze krwinki), produkowania bardzo dużej liczby merozoitów z jednego schizonta (nawet do 30 000; w przypadku P. vivax i ovale jest ich 2–3-krotnie mniej, a w przypadku P. malariae 15-krotnie mniej) oraz bardzo dużego odsetka zajmowanych krwinek czerwonych (nawet kilka do kilkunastu procent, przy czym odsetek >5% uznawany jest za stan zagrożenia życia; w przypadku innych zarodźców odsetek zarażanych krwinek zazwyczaj wyrażany jest w promilach, w przypadku P. vivax lub ovale może maks. sięgnąć 1–2%).15 Mimo to zdolność do wywoływania malarii o ciężkim przebiegu (choć znacznie rzadziej) mają również gatunki P. vivax i P. knowlesi (bardzo rzadkie występowanie). Ponieważ białko PfCSP jest specyficzne gatunkowo dla zarodźca sierpowego, szczepionka RTS,S nie będzie działała przeciwko tym dwóm gatunkom zarodźca.4
W celu wzmocnienia odpowiedzi poszczepiennej antygen białka PfCSP zawarty w szczepionce RTS,S połączono z antygenem powierzchniowym wirusa HBV (HBsAg) jako nośnikiem. Co ciekawe, wstępne badania wskazują, że szczepionka indukuje również wytwarzanie dużego stężenia przeciwciał anty-HBs,16 co być może będzie miało znaczenie dla epidemiologii HBV.
Nazwę „RTS,S” utworzono z pierwszych liter
następujących wyrazów lub fraz:
R – central Repeat region of P. falciparium circumsporozoite
protein (CSP) – centralny region
powtórzeń dla białka CSP
T – epitopy T-komórkowe CSP
S – antygen powierzchniowy HBsAg
S – wolne białko „S”.
Natomiast skrót AS01 to nazwa systemu adiuwantowego szczepionki. Całość układa się w ciąg liter RTS,S/AS01, który stanowi naukową nazwę szczepionki. Nazwa handlowa to MosquirixTM (producent GSK).17
Skuteczność i bezpieczeństwo RTS,S
Trzecią fazę badań klinicznych nad RTS,S przeprowadzono w 7 krajach Afryki Subsaharyjskiej.18 Do badań zakwalifikowano 15 000 dzieci w wieku 5–17 miesięcy. Dzieci przydzielono losowo do jednej z trzech zaślepionych grup, w których stosowano:
- trzy dawki szczepienia podstawowego oraz dawkę przypominającą szczepionki RTS,S – schemat 3+1 (0, 1, 2, 20 mies.)
- trzy dawki szczepionki RTS,S oraz dawkę szczepionki kontrolnej w 20. miesiącu – schemat 3+0 (0, 1, 2 mies.)
- szczepionkę kontrolną w podobnych odstępach czasu.
Pacjentów zakwalifikowanych do badania obserwowano średnio przez 48 miesięcy.
Stwierdzono, że schemat 4-dawkowy był istotnie klinicznie skuteczniejszy od schematu 3-dawkowego. Niemniej jednak skuteczność schematu 3+1 i tak pozostawiała wiele do życzenia. W 4-letnim okresie obserwacji dzieci w wieku 5–17 miesięcy, które zaszczepiono w schemacie 3+1, skuteczność RTS,S w zapobieganiu jakimkolwiek zachorowaniom na klinicznie objawową malarię wyniosła 39% (95% CI: 20–74), a w zapobieganiu ciężkim postaciom malarii 29% (95% CI: 19–46).
U dzieci w wieku 6–12 miesięcy skuteczność RTS,S była jeszcze mniejsza i wyniosła odpowiednio 21% (95% CI: 19–37) i 19% (95% CI: 14–24). Stwierdzono również istotne zmniejszenie liczby wykonanych transfuzji z powodu malarii (o 29%) oraz zmniejszenie liczby hospitalizacji.5,7,19
Jak widać, skuteczność szczepionki RTS,S jest daleka od spektakularnej. Jednak problem z malarią na świecie jest tak poważny, że choć zazwyczaj od szczepionek oczekuje się skuteczności na poziomie co najmniej 70–80%, to w przypadku szczepionki przeciwko malarii jej stosowanie uzasadniają nawet wartości w zakresie 30–50%. Profil bezpieczeństwa szczepionki RTS,S jest porównywalny z bezpieczeństwem innych szczepionek ochronnych, z wyjątkiem większego ryzyka wystąpienia drgawek gorączkowych u starszych dzieci w okresie do 7 dni po podaniu szczepienia (zazwyczaj trzeciej dawki).18,19
Pilotażowy program wprowadzenia RTS,S w warunkach rzeczywistych
W związku z dość obiecującymi wynikami III fazy badań, w najbliższych czasie (początek 2019 r.) zaplanowano rozpoczęcie pilotażowego programu szczepień przeciwko malarii z zastosowaniem RTS,S w 3 krajach Afryki – w Ghanie, Kenii i Malawi. Państwa te wybrano spośród 10 krajów zainteresowanych udziałem w programie, ponieważ najlepiej spełniały one ustalone warunki, takie jak: satysfakcjonujący stopień stosowania innych metod zapobiegania malarii, dobra realizacja innych szczepień ochronnych, umiarkowany lub wysoki stopień transmisji malarii (mimo dobrego stosowania innych metod profilaktycznych) oraz wystarczająca liczba małych dzieci zamieszkujących obszary występowania malarii. Szacuje się, że w ramach programu rocznie szczepionkę otrzyma 360 000 dzieci w schemacie 4-dawkowym (3 dawki w miesięcznych odstępach, począwszy od ukończenia 5. mż. oraz czwarta dawka ok. 2. rż.). Według ustaleń program szczepień będzie kontynuowany do 2022 roku. Po upływie tedgo czasu zaplanowano natomiast ocenić realne korzyści wynikające z implementacji szczepionki RTS,S w rzeczywistych warunkach oraz jej wpływ na przeżycie najmłodszych dzieci.20
Podsumowanie
Wprowadzenie nowej szczepionki RTS,S jest niewątpliwie ważnym momentem w historii profilaktyki malarii. Niemniej jednak trudno oczekiwać, że jej stosowanie przyczyni się do całkowitej eradykacji zachorowań wywołanych przez Plasmodium falciparum. Prawdopodobnie nie będzie ona również odgrywać istotnej roli w medycynie podróży – przemawia za tym jej ograniczona skuteczność oraz konieczność stosowania wielu dawek w stosunkowo długim przedziale czasu. Na razie ta szczepionka jest przeznaczona wyłącznie do stosowania u osób zamieszkujących Afrykę, a jej ewentualne wprowadzenie do użytku na innych kontynentach będzie wymagało przeprowadzenia dodatkowych badań klinicznych. Choć naukowcy zajmujący się malarią z niecierpliwością będą oczekiwać na rezultaty pilotażowego programu szczepień RTS,S, na pewno konieczne jest równoległe kontynuowanie prac nad innymi szczepionkami przeciwko malarii oraz szukanie nowych rozwiązań walce z tą chorobą.
Piśmiennictwo:
1. The Top 10 causes of Death. WHO, 2017. www.who.int/mediacentre/factsheets/fs310/en2. Global Malaria Programme. World Malaria Report 2017. WHO, 2017. www.who.int/malaria/publications/world-malaria-report-2017/report/en/
3. Arama C., Troye-Blomberg M.: The path of malaria vaccine development: challenges and perspectives. J. Intern. Med., 2014; 275: 456–466
4. Hoffman S.L., Vekemans J., Richie T.L., Duffy P.E.: The march toward malaria vaccines. Am. J. Prev. Med., 2015; 49 (supl. 4): 319–333
5. Birkett A.J.: Status of vaccine research and development of vaccines for malaria. Vaccine, 2016; 34: 2915–2920
6. Bhatt S., Weiss D.J., Cameron E. i wsp.: The effect of malaria control on Plasmodium falciparum in Africa between 2000 and 2015. Nature, 2015; 526: 207–211
7. Ouattara A., Laurens M.B.: Vaccines against malaria. Clin. Infect. Dis., 2015; 60: 930–936
8. Clyde D.F., Most H., Mccarthy V.C., Vanderberg J.P.: Immunization of man against sporozite-induced falciparum malaria. Am. J. Med. Sci., 1973; 266: 169–177
9. Draper S.J., Sack B.K., King C.R. i wsp.: Malaria vaccines: recent advances and new horizons. Cell Host Microbe., 2018; 24: 43–56
10. Thera M.A., Plowe C.V.: Vaccines for malaria: how close are we? Annu. Rev. Med., 2012; 63: 345–357
11. Healer J., Cowman A.F., Kaslow D.C., Birkett A.J.: Vaccines to accelerate malaria elimination and eventual eradication. Cold Spring Harb. Perspect. Med., 2017; 7. pii: a025627
12. Agnandji S.T., Lell B., Fernandes J.F. i wsp.: A phase 3 trial of RTS,S/AS01 malaria vaccine in African infants. N. Engl. J. Med., 2012; 367: 2284–2295
13. Casares S., Brumeanu T.D., Richie T.L.: The RTS,S malaria vaccine. Vaccine, 2010; 28: 4880–4894
14. CDC: Malaria – about malaria. www.cdc.gov/malaria/about/index.html
15. Cianciara J., Juszczyk J. Choroby zakaźne i pasożytnicze. Wyd. 2., Lublin, Wydawnictwo Czelej, 2012
16. Malaria vaccines. (W:) Plotkin S.A., Orenstein W.A., Offit P.A. (red.): Vaccines. Wyd. 7., Elsevier, 2017
17. Wilby K.J., Lau T.T., Gilchrist S.E., Ensom M. H. Mosquirix (RTS,S): A novel vaccine for the prevention of Plasmodium falciparum malaria. Ann. Pharmacother., 2012; 46: 384–393
18. Partnership SCT. Efficacy and safety of the RTS,S/AS01 malaria vaccine during 18 months after vaccination: a phase 3 randomized, controlled trial in children and young infants at 11 African sites. PLoS Med., 2014; 11 (7): e1001685
19. World Health Organization. Malaria vaccine: WHO position paper – January 2016. Wkly. Epidemiol. Rec., 2016; 91: 33–51
20. World Health Organization: Q&A on the malaria vaccine implementation programme. 2018. www.who.int/malaria/media/malaria-vaccine-implementation-qa/en/
21. Marsh K., Forster D., Waruiru C. i wsp.: Indicators of life-threatening malaria in African children. N. Engl. J. Med., 1995; 332: 1399–1404
22. Crawley J., Chu C., Nosten F., Mtove G.: Malaria in children. Lancet, 2010; 375: 1468–1481
23. Chandy C.J., Idro I.R.: Cerebral malaria in children. Infect. Med., 2003; 20: 53–58