Narzędzia w rękach nowoczesnego wakcynologa
Tłumaczyła lek. Monika Mach-Tomalska
Skróty: APC – komórka prezentująca antygen, LPS – lipopolisacharyd, MLPA – monofosforylolipid A, OMV – pęcherzyki błony zewnętrznej, O/W – emulsja „olej w wodzie”, PRR – receptory rozpoznające wzorce molekularne, TLR – receptor Toll-podobny
Pediatric Vaccine Adjuvants. Components of the Modern Vaccinologist’s Toolbox, David J. Dowling, Ofer Levy, The Pediatric Infectious Disease Journal, 2015; 34 (12): 1395–1398, with permission from Wolters Kluwer/Lippincott Williams & Wilkins. Copyright © 2015 Wolters Kluwer Health, Inc. Wolters Kluwer Health and its Societies take no responsibility for the accuracy of the translation from the published English original and are not liable for any errors which may occur.
Szczepienie ma na celu wywołanie odpowiedzi immunologicznej, która będzie ochronić organizm przed zakażeniami lub chorobami.1 Aż do końca XX wieku nauka o adiuwantach ograniczała się do użycia soli glinu (ałunu).2 W ciągu ostatnich 20 lat uzyskano ogromną liczbę informacji na temat receptorów rozpoznających wzorce molekularne, zwanych również receptorami rozpoznającymi patogen (pattern recognition receptors – PRR), które dzięki możliwości aktywacji leukocytów wzmacniają odpowiedź immunologiczną.3 Jednocześnie, wydłużająca się lista adiuwantów, czyli substancji wzmacniających odpowiedź na antygen szczepionkowy, obecnie staje się dostępna dla immunologów i wakcynologów. Jednak odporność nie ma charakteru statycznego, lecz zmienia się z wiekiem.4 W niniejszym artykule podsumowano wiedzę o adiuwantach wykorzystywanych obecnie w praktyce klinicznej oraz nowych, będących na etapie opracowywania, a także możliwości i korzyści zastosowania tych „narzędzi wspomagających” do tworzenia innowacyjnych szczepionek stosowanych na wczesnych etapach życia.5
Kluczowa rola adiuwantów w wakcynologii
Słowo adiuwant pochodzi od łacińskiego słowa adiuvare, oznaczającego „pomagać”.6 Adiuwantów używa się w celu wzmocnienia odpowiedzi na szczepienie, zwiększenia średniego miana przeciwciał i/lub zwiększenia odsetka populacji uodpornionej w sposób zabezpieczający przed zachorowaniem. U zarania wakcynologii większość szczepionek zawierała żywe, atenuowane drobnoustroje, które dzięki ekspresji immunostymulujących fragmentów miały właściwości „autoadiuwacyjne” („samowzmacniające”). Od kiedy w wakcynologii zaczęto stosować narzędzia nowoczesnej biotechnologii, obszar działań przesunął się w kierunku tworzenia preparatów szczepionkowych zawierających określone antygeny lub cząsteczki, takich jak szczepionki inaktywowane, podjednostkowe czy zawierające oczyszczone, rekombinowane białka i peptydy. Takie podejście nie tylko poprawiło bezpieczeństwo szczepionek i zmniejszyło ich reaktogenność, ale także spowodowało utratę wielu nieokreślonych stymulatorów immunologicznych, niezbędnych do wywołania wydajnej odpowiedzi układu odpornościowego. Co za tym idzie, wykorzystanie testowanych empirycznie adiuwantów stało się ważnym, choć nie w pełni rozumianym narzędziem stymulującym nieswoistą odpowiedź immunologiczną.7
Opracowanie coraz to pełniej scharakteryzowanych preparatów szczepionkowych stało się głównym celem wielu wakcynologów i firm farmaceutycznych.8 Należy tu uwzględnić: (1) fizykochemiczną charakterystykę preparatu, (2) chemiczną strukturę adiuwanta, (3) drogę podania, (4) stabilność krótko- i długotrwałą.9 Kluczową, wspólną cechą obecnych i innowacyjnych adiuwantów jest zdolność do kształtowania odporności swoistej poprzez oddziaływanie na komórki prezentujące antygen (antigen-presenting cells – APC). Jedną z funkcji komórek dendrytycznych jako komórek APC jest integracja informacji pochodzących z obcych źródeł (takich jak fragmenty drobnoustroju czy składniki szczepionek) i przetworzenie tych sygnałów na odpowiednio regulowaną swoistą odpowiedź immunologiczną.10 Tak więc, odkrycie adiuwantów i ich podawanie w szczepionkach, z jednoczesnym postępem w odkrywaniu antygenów i rosnącą wiedzą na temat odpowiedzi immunologicznej człowieka, są kluczowymi technologicznymi osiągnięciami napędzającymi trwającą rewolucję w tworzeniu szczepionek.11
Aktualnie używa się 9 adiuwantów jako składników zarejestrowanych szczepionek. Można je podzielić na 5 klas: sole glinu (3 będące w użyciu), emulsje (4 w użyciu), naturalnego pochodzenia monofosforylolipid A (MPLA) uzyskany z Salmonella minnesota oraz wirosomy (ryc.). Adiuwanty można łączyć (jest to 5. klasa stosowanych aktualnie adiuwantów – przyp. tłum.). I faktycznie, 2 systemy adiuwantowe AS03 i AS04 są składowymi szczepionek zarejestrowanych przez amerykańską Food and Drug Administration do stosowania u ludzi.
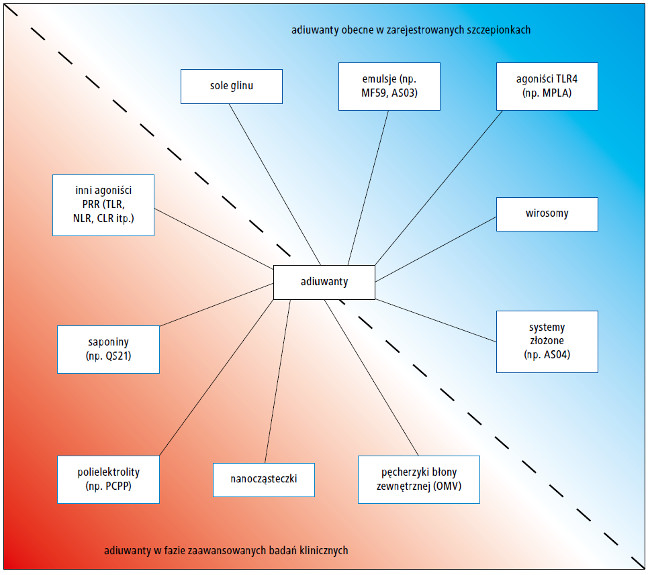
Ryc. Klasy adiuwantów
wykorzystywanych w praktyce
klinicznej oraz będących w fazie badań
Adiuwanty będące składowymi zarejestrowanych preparatów szczepionkowych
Sole glinu
Soli gliny (ałunu) używano jako składników szczepionek dla ludzi od początku XX wieku. Takie adiuwanty, na przykład wodorotlenek glinu, fosforan glinu czy wodorofosforan glinu, mają charakter drobnocząsteczkowy, do nich adsorbuje się antygeny szczepionkowe, zwiększając w ten sposób stabilność tego antygenu. Mechanizmy molekularne, poprzez które sole glinu oddziałują na ludzki układ immunologiczny, nadal są przedmiotem badań i obejmują liczne, pośrednie i bezpośrednie szlaki. Sole glinu usprawniają dostarczanie antygenu do komórek APC, a preparaty szczepionkowe zawierające taki adiuwant łatwiej wchodzą w interakcję z komórkami dendrytycznymi oraz makrofagami niż preparaty zawierające same rozpuszczalne formy antygenów.12 Krystaliczne sole glinu wiążą lipidy powierzchniowe komórek dendrytycznych i wyzwalają kaskadę reakcji aktywujących, prowadząc tym samym do zapoczątkowania odpowiedzi immunologicznej, jednak bez jego internalizacji do komórki.13 Poza tym, sole glinu mogą pośrednio lub bezpośrednio wzbudzać wrodzoną, nieswoistą odporność poprzez aktywację inflamasomu (wewnątrzkomórkowy, białkowy kompleks prozapalny – przyp. tłum.), niezbędnego do dojrzewania interleukiny-1, rodziny prozapalnych cytokin. W procesie tym najprawdopodobniej pośredniczy receptor podobny do domeny oligomeryzacyjnej wiążącej nukleotyd (nucleotide-binding oligomerization domain-like receptor, NOD-like receptor – NLR), ponieważ efekt adiuwantowy soli glinu nie zostaje zaburzony u myszy genetycznie pozbawionych MyD88 oraz TRIF – kluczowych białek adaptorowych zależnych od receptora Toll-podobnego (TLR), odpowiedzialnych za przekaźnictwo sygnału (białka adaptorowe biorą udział w odpowiedzi komórkowej – przyp. red.). I wreszcie, śmierć komórki wywołana przez sole glinu wydaje się wpływać na otoczenie, tak aby poprawić stymulację odporności swoistej. Uwolnienie cząsteczek związanych z uszkodzeniem komórki, takich jak kwas moczowy czy dwuniciowy DNA, działa jak autologiczny autoadiuwant.14 Sole glinu mają pewne ograniczenia, na przykład szczepionki zawierające takie adiuwanty często wymagają podawania wielu dawek w celu uzyskania ochrony4 i sprzyjają odpowiedzi Th2-zależnej, a nie Th1-zależnej. Aktualnie dostępnych i zarejestrowanych jest wiele szczepionek stosowanych u dzieci, takich jak szczepionki przeciwko błonicy, tężcowi czy wirusowemu zapaleniu wątroby, dla których sole glinu są niezbędne do wywołania odpowiedzi pod postacią ochronnego stężenia przeciwciał. Istnieją także antygeny szczepionkowe, dla których dodanie soli glinu może nie być konieczne do uzyskania właściwej immunogenności. Sole glinu usunięto na przykład ze składu szczepionki przeciwko Neisseria meningitidis grupy A, C, Y i W-135 (MenACWY) firmy GlaxoSmithKline (nazwa handlowa Menveo), ponieważ w badaniach klinicznych przeprowadzonych u niemowląt nie wykazano zdolności tego adiuwanta do zwiększenia miana przeciwciał bakteriobójczych.15
Emulsje
Różne emulsje typu „woda w oleju”, z których najlepiej znany jest niekompletny adiuwant Freunda (adiuwant opracowany przez Julesa Freunda w latach 30. XX wieku w trakcie prac nad szczepionką przeciwko gruźlicy, emulsja samego oleju parafinowego lub mineralnego – przyp. tłum.), pierwotnie oceniono w badaniach klinicznych z udziałem ludzi w połowie XX wieku.16 Te zawieszone w ciągłej fazie oleju mineralnego kropelki wody zostały szybko wycofane z komercyjnego obrotu z powodu nadmiernej reaktogenności (zwiększone ryzyko torbieli w miejscu podania) i braku powtarzalności produkcyjnej. To doprowadziło do opracowania emulsji „olej w wodzie” (O/W), w których to kropelki tłuszczu zawieszone są w ciągłej fazie wodnej. Zazwyczaj produkowane z wykorzystaniem technik mikroprzepływowych emulsje O/W zawierają cząsteczki kroplopodobne o wymiarach 100–200 nm naturalnie występujących tłuszczów, tj. podlegających metabolizmowi skwalenów i czasem niejonowe detergenty, takie jak Tween 80 i Span 85. Przez ostatnie 20 lat emulsje O/W pozostają popularnymi adiuwantami wzmacniającymi produkcję przeciwciał, obecnymi w różnych szczepionkach przeciwko grypie sezonowej i pandemicznej, zatwierdzonych przez European Medicines Agency (EMA).17 Jako adiuwantów użyto w nich MF59 (Fluid, Focetria), AS03 (Pandemrix) i AF03 (Humenza).16
W przeciwieństwie do soli glinu emulsje O/W nie wydają się zwiększać stabilności antygenu. Mechanizm ich działania po podaniu domięśniowo jest niezależny od receptorów TLR, a opiera się na stworzeniu „immunokompetentnego środowiska” w obrębie mięśnia. MF59, na przykład, nie stymuluje bezpośrednio komórek APC, ale raczej wyzwala produkcję chemokin i białek modulujących przez monocyty, makrofagi, granulocyty i komórki mięśniowe, co pośrednio nasila migrację komórek APC do i z miejsca iniekcji w kierunku drenującego węzła chłonnego. Ta rekrutacja komórkowa jest silniejsza niż ta wywoływana przez sole glinu. MF59 może także kierować różnicowaniem obwodowych monocytów w komórki dendrytyczne i prawdopodobnie powodować uwolnienie endogennych agonistów receptorów TLR. Dlatego też główną zaletą adiuwantów O/W jest możliwość redukcji dawki antygenu.17 Warto dodać, że AS03 zawiera również α-tokoferol, formę witaminy E, której aktywność stymulująca układ immunologiczny pozostaje nadal obiektem badań.16
Agoniści receptora TLR4 i systemy złożone
Wytwarzanie nowych adiuwantów rozwinęło się częściowo dzięki ciągłemu odkrywaniu oraz opisywaniu komórkowych receptorów PRR. Na czele tej grupy stoją pozbawione właściwości toksycznych kongenery (spokrewnione ze względu na budowę, strukturę lub funkcje substancje chemiczne – przyp. tłum.) endotoksyn, stymulujące receptory TLR4.18 Receptory TLR4, będące powierzchniowymi receptorami PRR komórki, rozpoznają kilka związanych z drobnoustrojem wzorców cząsteczkowych, w tym lipopolisacharydy (LPS) zewnętrznej błony komórkowej bakterii Gram-ujemnych, i stanowią cel adiuwanta MPLA. Naturalny MPLA szczepionkowej klasy jest wytwarzany najczęściej poprzez poddanie LPS bakterii S. minnesota kolejno następującym po sobie procesom kwasowej i zasadowej hydrolizy. Efektem tych reakcji są formy defosforylowane, ze znacząco zredukowaną toksycznością i zdolnością do wywoływania gorączki (w przybliżeniu 1000-krotnie mniejszą), ale zachowaną silną aktywnością adiuwantową. Do dzisiaj agoniści receptora TLR4 w połączeniu z solami glinu pozostają składowymi zarejestrowanych preparatów szczepionkowych. Najbardziej znany jest złożony system adiuwantowy AS04, zawierający 3-deacylo-MPLA (jeszcze mniej pirogenny dzięki łagodnej hydrolizie zasadowej) z fosforanem glinu, obecny w 2 szczepionkach: Cervarix (przeciwko wirusowi brodawczaka ludzkiego [HPV]) oraz Fendrix (przeciwko wirusowemu zapaleniu wątroby [WZW] typu B [szczepionka przeznaczona dla osób z niewydolnością nerek, w Polsce niedostępna w sprzedaży – przyp. red.]).
Z uwagi na możliwe trudności produkcyjne w pozyskiwaniu MLPA, dzięki chemicznej syntezie stworzono sztuczne analogi MPLA. I tak, adiuwant glukopiranozylolipidowy (glucopyranosyl lipid adjuvant – GLA) jest syntetyczną formą MPLA, zawierającą 6 łańcuchów acylowych, opartą na LPS Escherichia coli, a nie S. minnesota. GLA oceniono w badaniach klinicznych I i II fazy w licznych zastosowaniach, m.in. w szczepionce przeciwko trzewnej postaci leiszmaniozy. Podobny MPLA zawierający 6 łańcuchów acylowych – adiuwant RC529 – jest składnikiem szczepionki przeciwko WZW typu B zarejestrowanej w Argentynie (SuperVax), w której jako adiuwant wykorzystano także sole glinu.16 Przedmiotem analiz są także kombinacje wspomnianych wyżej klas adiuwantów. Oba systemy, AS01 i AS02, złożone z MPLA oraz oczyszczonego ekstraktu kory roślin/saponiny QS21, wchodzą w skład preparatu Mosquirix (RTS,S), szczepionki przeciwko zimnicy.16,19
Wirosomy
Wirosomy są liposomalnymi cząsteczkami wirusopodobnymi i działają zarówno jako system nośnikowy szczepionki, jak i adiuwant. Standardowo produkowane z odtwarzanych pustych otoczek wirusa grypy, zyskują swą funkcję przez adsorpcję (lub wpakowanie) antygenów białkowych na(w) ich błony liposomalne. Chociaż sposób ich działania nadal pozostaje przedmiotem analiz, przypuszcza się, że wirosomy mogą stymulować odporność humoralną i komórkową poprzez wiązanie z makrofagami oraz komórkami APC.16 W Europie są zarejestrowane wirosomalne szczepionki przeciwko grypie (preparat Inflexal), a także szczepionka przeciwko WZW typu A (Epaxal) wykorzystująca wirosomy jako adiuwant.
Nowe klasy adiuwantów w zaawansowanych badaniach klinicznych
Istnieje kilka innych adiuwantów będących w trakcie zaawansowanych badań klinicznych, które nie podlegają kategoryzacji do żadnej z powyższych klas. Ta jeszcze niezamknięta lista obejmuje: (1) różnie zdefiniowanych agonistów receptorów PRR, (2) saponiny, (3) polielektrolity, (4) pęcherzyki błony zewnętrznej (outer membrane vesicles – OMV) i (5) nanocząsteczki (ryc.).
Adiuwantowi agoniści receptorów PRR
Oprócz adiuwantów będących agonistami receptora TLR4, w badaniach klinicznych z udziałem ludzi oceniono wiele innych adiuwantowych agonistów receptorów PRR. Ich celem jest nieswoista odpowiedź immunologiczna, a w szczególności receptory: TLR, NOD-podobne, lektynowe typu C (C-type lectin receptors – CLR) oraz RIG-podobne (RLR). Właściwości adiuwantowe wykazują agoniści dla następujących receptorów TLR: TLR3 (dwuniciowe RNA), TLR5 (białko bakteryjne zwane flagelliną), TLR7 i TLR8 (jednoniciowe RNA bogate w urydynę, podobnie jak wirusowe RNA) i TLR9 (bakteryjne DNA i syntetyczne, jednoniciowe oligonukleotydy z fragmentami zawierającymi demetylowane sekwencje cytozyna–fosforan–guanina [CpG]). Adiuwanty dla endosomalnych receptorów TLR 7, 8 i 9 wykazują silne właściwości adiuwantowe. Podana na skórę jako miejscowy adiuwant aktywujący receptor TLR7 mała, syntetyczna cząsteczka imidazolochinolowa – imikwimod – wzmacnia odpowiedź na szczepionkę przeciwko grypie podawaną śródskórnie.16 Agoniści receptorów TLR7/8, jak imidazolochinolony, silnie aktywują leukocyty noworodków, co daje możliwość wykorzystania ich jako adiuwantów w szczepionkach przeznaczonych dla noworodków.4 Ponadto w niedawno przeprowadzonym badaniu klinicznym III fazy stwierdzono, że szczepionka przeciwko WZW typu B firmy Dynavax (Heplisav) powodowała wytworzenie zabezpieczającego stężenia przeciwciał przy mniejszej liczbie wykonanych szczepień. W tym preparacie jako adiuwant aktywujący receptor TLR9 użyto 1018-ISS, zawierający bogate w CpG sekwencje DNA o właściwościach immunostymulujących.
Adiuwanty oparte na saponinach
Saponiny są trójterpenowymi cząsteczkami ze złożonym rdzeniem sacharydowym, pozyskiwanymi z różnorodnych roślin.16 Najlepiej opisano saponinę (określaną jako Quil-A) pozyskiwaną z kory południowoamerykańskiego drzewa Quillaja saponaria Molina (mydłodrzew właściwy – przyp. tłum.), używaną od lat 70. XX wieku jako adiuwant w szczepionkach weterynaryjnych. Saponina Quil-A wykazuje u ludzi zbyt dużą toksyczność. Naukowcy wykorzystali zatem jej silne powinowactwo do cholesterolu i stworzyli kompleks cholesterolowo-saponinowy, który przy zachowaniu silnych właściwości adiuwantowych jest mniej reaktogenny niż saponina macierzysta.16 Dodatkowo przy produkcji na dużą skalę stosuje się zwykłe dodanie antygenu zamiast koniugacji. Na przykład, adiuwant Iscomatrix powstaje z połączenia częściowo oczyszczonych saponin Quil-A z cholesterolem i fosfolipidami. Stworzoną w ten sposób małą (wym. 50–60 nm), porowatą cząsteczkę Iscomatrix następnie miesza się z potrzebnym antygenem.
Najbardziej zaawansowanym kompleksem cholestrolowo-saponinowym jest kompleks QS21, wyizolowany i oczyszczony składnik Quil-A. Dzięki połączeniu z liposomami zawierającymi cholesterol, QS21 zyskuje bardzo dużą stabilność i małą reaktogenność. Jak już wspomniano, adiuwantowe systemy łączone AS01 i AS02, obecne w doświadczalnej szczepionce przeciwko zimnicy RTS,S, zawierają MPLA i QS21. Chociaż dokładny mechanizm działania QS21 nie został poznany, ich nanocząsteczkowy rozmiar może być powodem preferowanego oddziaływania na komórki dendrytyczne i tworzenia porów w ich bogatych w cholesterol błonach komórkowych.16
Polielektrolity
Polielektrolity to rozpuszczalne w wodzie wielkocząsteczkowe polimery złożone z rdzenia fosforo-azotowego i bocznych grup organicznych. Zestawienie takich polimerów z różnymi antygenami szczepionkowymi wykazało ich istotne właściwości immunostymulacyjne, możliwość zmniejszenia dawki antygenu oraz akceptowalny próg bezpieczeństwa w trakcie badań in vivo u zwierząt i ludzi. Do tej grupy zaliczamy na przykład syntetyczny polielektrolit polifosfazenowy (fosfazeny – grupa związków o budowie łańcuchowej lub cyklicznej, w których atom fosforu jest połączony kowalencyjnie z atomem azotu, do atomu azotu mogą być przyłączone różne podstawniki, np. chlor lub brom i to od nich zależą właściwości danego fosfazenu – przyp. tłum.) – poli (di [karboksylofenoksy] fosfazen) (PCPP).20 Podobnie jak sole glinu, PCPP jest zdolny wywołać śmierć komórki dendrytycznej in vitro. Co ważne, PCPP przez oddziaływania kowalencyjne lub niekowalencyjne może tworzyć rozpuszczalne w wodzie wielopodjednostkowe kompleksy z antygenem i przez to poprawiać termostabilność, która jest podstawowym kryterium dla preparatów szczepionkowych. Warto wspomnieć, że polielektrolitowy polimer, polioksydonium, jest adiuwantem znajdującym się w zarejestrowanej w Rosji szczepionce przeciwko grypie – Grippol – rutynowo podawanej dzieciom i dorosłym.
Adiuwanty nanocząsteczkowe i systemy nośnikowe
W przeszłości cząsteczkowe właściwości substancji używanych w wielu preparatach szczepionkowych odkrywano na drodze doświadczalnej, często z powodu konieczności stabilizacji antygenu (np. adsorpcja do soli glinu). Biodegradowalny, syntetyczny kopolimer kwasu mlekowego i glikolowego (poli [D,L-lactic-co-glycolic acid] – PLGA) jest nanocząsteczką o właściwościach adiuwantowych, szeroko badaną pod kątem kontrolowanego i skutecznego dostarczania antygenów szczepionkowych, w tym syntetycznych peptydów. Systemy nośnikowe wytwarzane są zwykle jako zwarte cząsteczki blokowe o wymiarach 50–500 nm, z antygenami uwięzionymi wewnątrz lub adsorbowanymi na ich powierzchni.21 Postęp, jaki się dokonał w ostatnim czasie w dziedzinie inżynierii immunologicznej, rozwijającej się równolegle z wakcynologią, zaczął wyznaczać kierunek projektowania preparatów szczepionkowych.9,22 Szczepionkowe systemy nośnikowe zaczęto tak konstruować, aby naśladowały rozmiar, kształt oraz chemiczną strukturę powierzchniową drobnoustroju,12 czego odzwierciedleniem jest wyrażenie cząsteczki „patogenowopodobne” (pathogen-like particles). Systemy nośnikowe można też konstruować w taki sposób, aby celowały w wybrane podklasy komórek układu immunologicznego, na przykład komórki dendrytyczne, lub też w wybrane struktury/organelle komórkowe. Na przykład, blokowe kopolimery – glikol polietylenowy i poli(siarczek propylenu) (poly [ethylene glycol-bl-propylene sulfide] – PEG-PPS) – są innowacyjnymi, amfifilowymi (tj. posiadającymi właściwości hydrofilne i hydrofobowe – przyp. red.) makrocząsteczkami zdolnymi w trakcie rozpuszczania w wodzie przybierać różnorodne kształty, takie jak kuliste lub cylindryczne micele, czy pęcherzyki przypominające liposomy i określane mianem polimersomów.9
Pęcherzyki błony zewnętrznej
Pęcherzyki błony zewnętrznej (outer membrane vesicles – OMV) zawierające agonistów receptora TLR4 stosuje się w niektórych szczepionkach przeciwko meningokokom grupy B (MenB). OMV powstają przez „pączkowanie” (uwypuklenie, a następnie oderwanie w formie kulistej struktury) błon żywych szczepów bakterii Gram-ujemnych w trakcie wzrostu w warunkach in vitro. Są one użytecznymi składnikami szczepionek, ponieważ reprezentują immunostymulujące składniki błony meningokoków (tłuszcze, białka, LPS itp.).23 Szczepionki przeciwko MenB oparte na OMV zwykle zawierają także rekombinowane białka E. coli. 4-składnikowa szczepionka przeciwko MenB z adiuwantem glinowym (wodorotlenek glinu – przyp. red.) firmy Novartis (Bexsero), zatwierdzona przez EMA, zawiera OMV pozyskiwane z użyciem detergentów oraz 3 rekombinowane białka Neisseria meningitidis. Ekstrakcja OMV z wykorzystaniem detergentów oraz modyfikacje genetyczne są zabiegami zmniejszającymi toksyczność LPS i zapobiegającymi nadmiernej reaktogenności.
Przyspieszenie prac nad adiuwantami dla najmłodszych niemowląt
Większość obowiązujących na świecie programów szczepień koncentruje się na szczepieniu dzieci. Jednak wyboru większości adiuwantów ocenianych w programachw badawczych nie dokonuje się pod kątem ich zastosowania na wczesnych etapach życia. Wiele z wyżej wymienionych grup adiuwantów wywołuje odmienną i przypuszczalnie suboptymalną odpowiedź immunologiczną u najmłodszych dzieci, dlatego kluczowe znaczenie ma zrozumienie, w jaki sposób dzięki adiuwantom można poprawić skuteczność szczepionek, uwzględniając wczesne etapy ontogenezy układu immunologicznego.4,11
Określenie adiuwantów aktywnych u młodych niemowląt
Poświęcanie coraz większej uwagi osobniczemu rozwojowi układu immunologicznego może przynieść informacje niezbędne w racjonalnym opracowaniu preparatów szczepionkowych dla dzieci. Wiedza o specyfice wiekowej układu immunologicznego może pozwolić producentom szczepionek na pełne wykorzystanie tradycyjnych narzędzi farmaceutycznych, takich jak1 wysoce wydajne przeszukiwanie baz małych cząsteczek wykazujących aktywność w kierunku leukocytów u dzieci,2 chemia medyczna do projektowania i syntezy składników uwzględniających odmienność immunologiczną we wczesnym okresie życia3 czy metody obliczeniowe do wyjaśniania związków struktura–aktywność i udoskonalania kandydatów na adiuwanty.24 Takie podejście może także przynieść odległe korzyści ekonomiczne i legislacyjne (związane z rejestracją produktu leczniczego). Na przykład użycie modeli zwierzęcych do oceny aktywności preparatów szczepionkowych u dzieci może być kosztowne i nieprzewidywalne (np. różnice w odpowiedzi pomiędzy gatunkami czy odmienna immunologiczna ontogeneza), czy kosztowny, a preferowany udział ssaków naczelnych w końcowych fazach badań klinicznych. Przedmiotem badań są również platformy in vitro, które mogą odzwierciedlać aktywność in vivo, do precyzyjniejszego przewidywania funkcji immunologicznych in vitro. Są to między innymi systemy mikrofizjologiczne wykorzystujące głównie ludzkie tkanki czy leukocyty.4
Optymalizacja bezpieczeństwa przy jednoczesnym zmniejszeniu reaktogenności
Kluczową kwestią w pracach nad adiuwantami szczepionkowymi jest reaktogenność, czyli zdolność preparatu do wywołania ostrej reakcji zapalnej, miejscowej (np. rumień, tkliwość), czy też systemowej, na przykład gorączki. Istotne jest, że adiuwantów szczepionkowych nie rejestruje się jako oddzielne substancje, a są one raczej elementami składowymi zarejestrowanych preparatów szczepionkowych. Dlatego też adiuwanty muszą podlegać podwójnej ocenie: jako substancje samodzielne i jako składniki szczepionek. Optymalizacja adiuwanta może obejmować1 modyfikacje jego właściwości farmakokinetycznych wpływających na dystrybucję biologiczną (np. ograniczenie dostępności systemowej przez kowalencyjne wiązanie grup hydrofobowych),2 czy ułatwienie interakcji z preparatami zaprojektowanymi w celu ukierunkowanego, jednoczesnego dostarczenia antygenu i składników immunostymulujących (np. zamykanie w nanocząsteczkach). Niezwykle pożądane byłoby użycie in vitro markerów biologicznych odzwierciedlających właściwości adiuwantowe i reaktogenne w warunkach in vivo. Jak dotąd w większości badań wykorzystywano ocenę produkcji cytokin Th-zależnych, a także zależną od adiuwanta produkcję PGE225 – markera biologicznego wytwarzanego in vitro przez ludzkie komórki linii Mono mac (linia komórek monocyta pozyskiwana z krwi obwodowej chorych na białaczkę monoblastyczną – przyp. tłum.), co u królików korelowało z aktywnością pirogenną. Możliwości wykorzystania tego faktu do przewidywania reaktogenności u dzieci wymagają wyjaśnienia.
Podsumowanie
Badania translacyjne nad adiuwantami przeznaczonymi dla noworodków i młodych niemowląt stanowią wyzwanie z uwagi na przejściowy charakter tych etapów życia i nieodłączne przeszkody logistyczne wynikające z małej masy ciała dzieci oraz ich odmiennej pozycji społecznej. Jednak utrzymujące się ogólnoświatowe obciążenie chorobami zakaźnymi u najmłodszych niemowląt, a co za tym idzie, potrzeba posiadania szczepionek bezpiecznych i skutecznych u najmłodszych dzieci, stanowi niepodważalne uzasadnienie dalszego prowadzenia podstawowych i translacyjnych badań mających na celu odkrywanie i udoskonalanie adiuwantów. Aby sprostać tym wyzwaniom, konieczna będzie kontynuacja badań nad immunologią człowieka na wczesnych etapach jego życia oraz badań translacyjnych aktualnie stosowanych i innowacyjnych adiuwantów.
Konflikt interesów: O.L. otrzymał wsparcie od US National Institutes of Health (NIH) w postaci grantu 1R01AI100 135-01, od National Institutes of Allergy and Infectious Diseases (NIAID), NIH, Department of Health and Human Services w ramach Adjuvant Discovery Program Contract No. HHSN272201400052C. Otrzymał również nagrody Fundacji Billa i Mellindy Gates – Global Health (OPPGH5284) i Grand Challenges Explorations (OPP1 035 192). Levy Laboratory otrzymało wsparcie finansowe na prace badawcze od VentiRx Pharmaceuticals, 3M Drug Delivery Systems, Med- Immune and Crucell (Johnson & Johnson). D.J.D. nie zgłasza konfliktu interesów.
Piśmiennictwo:
1. Levy O., Goriely S., Kollmann T.R.: Immune response to vaccine adjuvants during the first year of life. Vaccine, 2013; 31: 2500–25052. Rappuoli R., Mandl C.W., Black S., et al.: Vaccines for the twenty-first century society. Nat. Rev. Immunol., 2011; 11: 865–872
3. O’Neill L.A., Golenbock D., Bowie A.G.: The history of Toll-like receptors – redefining innate immunity. Nat. Rev. Immunol., 2013; 13: 453–460
4. Dowling D.J., Levy O.: Ontogeny of early life immunity. Trends Immunol., 2014; 35: 299–310
5. PrabhuDas M., Adkins B., Gans H., et al.: Challenges in infant immunity: implications for responses to infection and vaccines. Nat. Immunol., 2011; 12: 189–194
6. Levitz S.M., Golenbock D.T.: Beyond empiricism: informing vaccine development through innate immunity research. Cell, 2012; 148: 1284–1292
7. Plotkin S.A., Plotkin S.L.: The development of vaccines: how the past led to the future. Nat. Rev. Microbiol., 2011; 9: 889–893
8. Brito L.A., Malyala P., O’Hagan D.T.: Vaccine adjuvant formulations: a pharmaceutical perspective. Semin. Immunol., 2013; 25: 130–145
9. Swartz M.A., Hirosue S., Hubbell J.A.: Engineering approaches to immunotherapy. Sci. Transl. Med., 2012; 4: 148–149
10. Pulendran B., Ahmed R.: Immunological mechanisms of vaccination. Nat. Immunol., 2011; 12: 509–517
11. Koff W.C., Burton D.R., Johnson P.R., et al.: Accelerating next-generation vaccine development for global disease prevention. Science, 2013; 340: 1 232 910
12. Bachmann M.F., Jennings G.T.: Vaccine delivery: a matter of size, geometry, kinetics and molecular patterns. Nat. Rev. Immunol., 2010; 10: 787–796
13. Flach T.L., Ng G., Hari A., et al.: Alum interaction with dendritic cell membrane lipids is essential for its adjuvanticity. Nat. Med., 2011; 17: 479–487
14. Marichal T., Ohata K., Bedoret D., et al.: DNA released from dying host cells mediates aluminum adjuvant activity. Nat. Med., 2011; 17: 996–1002
15. Snape M.D., Perrett K.P., Ford K.J., et al.: Immunogenicity of a tetravalent meningococcal glycoconjugate vaccine in infants: a randomized controlled trial. JAMA, 2008; 299: 173–184
16. Plotkin S.A., Orenstein W.A., Offit P.A.: Vaccines. 6th Ed. Philadelphia, PA: Saunders; 2012
17. Reed S.G., Orr M.T., Fox C.B.: Key roles of adjuvants in modern vaccines. Nat. Med., 2013; 19: 1597–1608
18. Duthie M.S., Windish H.P., Fox C.B., et al.: Use of defined TLR ligands as adjuvants within human vaccines. Immunol. Rev., 2011; 239: 178–196
19. Rappuoli R., Aderem A.: A 2020 vision for vaccines against HIV, tuberculosis and malaria. Nature, 2011; 473: 463–469
20. Palmer C.D., Ninković J., Prokopowicz Z.M., et al.: The effect of stable macromolecular complexes of ionic polyphosphazene on HIV Gag antigen and on activation of human dendritic cells and presentation to T-cells. Biomaterials, 2014; 35: 8876–8886
21. Azmi F., Ahmad Fuaad A.A., Skwarczynski M., et al.: Recent progress in adjuvant discovery for peptide-based subunit vaccines. Hum. Vaccin. Immunother., 2014; 10: 778–796
22. Hubbell J.A., Thomas S.N., Swartz M.A.: Materials engineering for immunomodulation. Nature, 2009; 462: 449–460
23. Sanders H., Kaaijk P., van den Dobbelsteen G.P.: Preclinical evaluation of MenB vaccines: prerequisites for clinical development. Expert Rev. Vaccines, 2013; 12: 31–42
24. Flower D.R.: Systematic identification of small molecule adjuvants. Expert Opin. Drug Discov., 2012; 7: 807–817
25. Mastelic B., Garçon N., Del Giudice G., et al.: Predictive markers of safety and immunogenicity of adjuvanted vaccines. Biologicals, 2013; 41: 458–468















