Skróty: ACIP – Advisory Committee on Immunization Practices, dTpa – szczepionka zawierająca toksoid tężcowy oraz zmniejszoną dawkę toksoidu błoniczego i bezkomórkowych komponentów krztuśca, IChP – inwazyjna choroba pneumokokowa, NIZP-PZH – Narodowy Instytut Zdrowia–Państwowy Zakład Higieny, POChP – przewlekła obturacyjna choroba płuc, PChN – przewlekła choroba nerek, PCV-13 – 13-walentna skoniugowana szczepionka przeciwko pneumokokom, PChW – przewlekła choroba wątroby, PPSV-23 – 23-walentna polisacharydowa szczepionka przeciwko pneumokokom, WZW – wirusowe zapalenie wątroby
Osiągnięcie wieku dorosłego nie oznacza, że nie
jest już konieczne stosowanie profilaktyki za pomocą
szczepień. W przypadku niektórych szczepień
niezbędne jest podawanie dawek przypominających. U osób dorosłych, zwłaszcza w starszym
wieku, występuje szereg różnych chorób stwarzających
zwiększone ryzyko zakażeń, którym można
zapobiegać poprzez szczepienia. Pewien odsetek
dorosłych jest nadal nieodporny na choroby wirusowe
typowe dla wieku dziecięcego (ospa wietrzna,
odra, różyczka), które u dorosłych mogą mieć
cięższy przebieg (również u osób nieobciążonych
chorobami przewlekłymi) lub stwarzać dodatkowe
zagrożenia (np. zakażenie w czasie ciąży). I wreszcie
uzupełnienie szczepień może być konieczne w związku z podróżami zagranicznymi (p. także
Szczepienia przed podróżą do krajów „nietropikalnych”).
Problem szczepień dorosłych jest często zaniedbywany
przez lekarzy. Również sami pacjenci
często nie są świadomi, że nadal podlegają takiej
profilaktyce.1 Według danych amerykańskich, w 2013 roku odsetek zaszczepionych skoniugowaną i polisacharydową szczepionką przeciwko
pneumokokom w populacji osób w wieku 19–64 lat z grupy ryzyka inwazyjnej choroby pneumokokowej
(IChP) wyniósł tylko 21,2%, podobnie jak w roku 2012. Natomiast odsetek osób >19. roku
życia, którym w ciągu ostatnich 10 lat podano
szczepionkę zawierającą toksoid tężcowy, mieścił
się w zakresie 56,4–64%.2 W polskiej populacji
sztandarowym przykładem zaniedbania problemu
szczepień dorosłych jest bardzo mały wskaźnik
wyszczepialności przeciwko grypie, który w całej
populacji nie przekracza 5%. Niestety, w Polsce
szczepienia przewidziane dla osób dorosłych
uwzględnione są zwykle w programie szczepień
zalecanych, czyli odpłatnych, co na pewno stanowi
jedną z przeszkód w prawidłowej realizacji szczepień w tej grupie pacjentów.
Epidemiologia chorób, którym można zapobiegać za pomocą szczepień
Według danych Narodowego Instytutu Zdrowia–Państwowego Zakładu Higieny (NIZP-PZH) w Polsce w 2014 roku zarejestrowano 13 564 zachorowania
na ospę wietrzną u osób >20. roku
życia.3 Z tego 6204 (64%) przypadki odnotowano w populacji kobiet w wieku 20–44 lat, czyli w wieku
rozrodczym. Ryzyko ciężkiego przebiegu ospy
wietrznej zwiększa się wraz z wiekiem, a czynnikiem
ryzyka ciężkiego przebiegu jest również
ciąża. Powikłanie w postaci zapalenia płuc obserwowano u 10–20% ciężarnych chorych na ospę. Zakażenie
wirusem ospy wietrznej i półpaśca może
być również przyczyną embriopatii ospowej, której
częstość szacuje się na około 0,4% przy zakażeniu
przed 13. tygodniem oraz 2% w 13.–20. tygodniu
ciąży. Ponadto zachorowanie w okresie okołoporodowym
może być przyczyną uogólnionej ospy u noworodka.4
Wśród 110 zachorowań na odrę zgłoszonych w 2014 roku 45 (41%) dotyczyło osób >20. roku
życia. Nie stwierdzono żadnego zachorowania u osób >50. roku życia.3 Znacznie gorzej prezentuje
się sytuacja epidemiologiczna różyczki. U osób >20. roku życia odnotowano 1256 zachorowań,
najwięcej (508, tj. 40%) u mężczyzn w wieku
20–24 lat, a 391 (31%) przypadków dotyczyło
kobiet w wieku 20–44 lat3. Wiąże się to z faktem,
że powszechne szczepienia dzieci obojga płci wprowadzono
dopiero w 2004 roku. Zgodnie z danymi
European Centre for Disease Prevention and Control
(ECDC) prawie 94% z 2427 przypadków różyczki
odnotowanych w krajach Unii Europejskiej w okresie od października 2014 roku do września
2015 roku zgłosiła Polska.5 Należy jednak zaznaczyć,
że tylko u 26 chorych rozpoznanie potwierdzono
laboratoryjnie, a różyczkę łatwo pomylić z innymi chorobami zakaźnymi przebiegającymi z osutką, czy z osutkami polekowymi. Zakażenie
wirusem różyczki jest szczególnie niebezpieczne u kobiet ciężarnych, ponieważ może być przyczyną
embriopatii różyczkowej – ryzyko zależy od czasu
zakażenia i wynosi od 40–60% w przypadku zakażenia w pierwszych 4 tygodniach ciąży do 5% w 16. tygodniu ciąży.6 W Polsce w ostatnich kilkunastu
latach zgłaszano jedynie pojedyncze przypadki
zespołu różyczki wrodzonej.
Po wprowadzeniu powszechnych szczepień
przeciwko śwince w Polsce odnotowano znamienne
zmniejszenie zapadalności na tę chorobę.
Dane NIZP-PZH wskazują, że w 2014 roku odnotowano
2508 zachorowań (możliwych, prawdopodobnych,
potwierdzonych) na świnkę, a wskaźnik
zapadalności wyniósł 6,3/100 000 osób. Z powodu
świnki hospitalizowano 1,56% chorych.3 Najwięcej
zachorowań obserwuje się w populacji w wieku
15–24 lat (11,3/100 000 osób), a najmniej w grupie
wiekowej 25–44 lat (1,94/100 000 osób), częściej u mężczyzn niż u kobiet.7 Powikłania świnki częściej
obserwuje się u dorosłych niż dzieci i mogą
one wystąpić w każdym okresie choroby. Do najczęstszych
powikłań u młodych mężczyzn należy
zapalenie jądra i najądrza (30–40% chorych), a u kobiet – zapalenie jajnika (5–7% chorych).
Może również dojść do zapalenia trzustki (<10%
chorych) oraz zapalenia opon mózgowo-rdzeniowych i mózgu (2/100 000 zachorowań).8
Zapadalność na grypę w populacji ogólnej dorosłych
zależy od intensywności sezonu epidemicznego i może wahać się od 1000 do 11 000/100 000
osób. Na grypę potwierdzoną laboratoryjnie w ciągu
sezonu epidemicznego choruje średnio 2,4% dorosłych
(zapadalność 2400/100 000 osób). Ryzyko
hospitalizacji i zgonu z powodu grypy i jej powikłań
może być znacznie większe u osób w wieku
15–64 lat z grupy ryzyka niż w populacji ogólnej
bez dodatkowych czynników ryzyka odpowiednio:
4–6-krotnie i 6–18-krotnie. U zdrowych osób dorosłych w wieku 15–64 lat (z wyjątkiem ciężarnych)
wskaźnik hospitalizacji z powodu grypy waha
się w przedziale 9–16/100 000/rok, a wskaźnik
umieralności z powodu grypy – 23–56/1000 hospitalizowanych.9 Spośród wszystkich dostępnych i zweryfikowanych naukowo metod zapobiegania
zachorowaniom na grypę (np. higienia rąk i kaszlu,
maseczki na twarz i inne metody „barierowe”)
najskuteczniejsze jest coroczne szczepienie.
Zapadalność na wirusowe zapalenie wątroby
(WZW) typu B istotnie się zmniejszyła
dzięki szczepieniom i usprawnieniu kontroli zakażeń
wirusem zapalenia wątroby typu B (HBV) w placówkach opieki zdrowotnej. W 2012 roku zapadalność
na WZW typu B wyniosła 4,11/100 000
(1583 przypadki, w tym postać ostra – 4,9%). Inwazyjne
procedury diagnostyczne lub lecznicze
nadal uznaje się za czynnik ryzyka zakażenia
HBV, inne czynniki to m.in. bliski kontakt z chorym,
wielu partnerów seksualnych oraz narażenie
zawodowe.10
Polska jest krajem o małej endemiczności WZW
typu A. W 2014 roku odnotowano 65 przypadków.3
Ryzyko zachorowania wiąże się przede wszystkim z podróżą do krajów endemicznego występowania
WZW typu A (basen Morza Śródziemnego, kraje
rozwijające się).
W ostatnich latach w wielu krajach, w tym w Polsce, obserwuje się ponowne zwiększanie liczby
zachorowań na krztusiec, na co istotny wpływ
ma m.in. zmniejszanie się wraz z upływem czasu
skuteczności bezkomórkowych szczepionek przeciwko
krztuścowi.11,12 Największą zachorowalność
obserwuje się u niemowląt i małych dzieci. Krztusiec
często pomija się w diagnostyce różnicowej
przewlekłego kaszlu u dorosłych, dlatego też zapadalność
na tę chorobę w populacji dorosłych może
być niedoszacowana.7,13 W Polsce obserwuje się
coraz więcej zachorowań na krztusiec m.in. w populacji
dorosłych i młodzieży >15. roku życia – zapadalność zwiększyła się z 1,8 w 2007 roku
do 7,6/100 000 osób w 2012 roku. U dorosłych
chorych na krztusiec mogą się rozwinąć powikłania,
takie jak: nietrzymanie moczu, zapalenie płuc,
złamania żeber. Chorzy dorośli mogą być również
źródłem transmisji krztuśca na niemowlęta.15
Ogólna zapadalność na inwazyjną chorobę
meningokokową (IChM) w Polsce jest na niskim
poziomie europejskim. Wprawdzie największą
zapadalność stwierdza się u niemowląt, ale
największy (33,3%) współczynnik śmiertelności w latach 2010–2014 odnotowano u osób >75. roku
życia, przy ogólnym współczynniku wynoszącym
około 10%.16
Zakażenia Streptococcus pneumoniae występują
powszechnie na całym świecie. S. pneumoniae
jest najczęstszą przyczyną pozaszpitalnego
zapalenia płuc u dorosłych – zachorowalność w Polsce szacuje się na około 200/100 000/rok.17
Według raportu ECDC, w 2012 roku kraje Unii Europejskiej/
Europejskiego Obszaru Gospodarczego
zgłosiły 20 785 potwierdzonych przypadków IChP.
Ogólną zapadalność oszacowano na 5/100 000, a największą zapadalność odnotowano wśród osób
>65. roku życia (15,4) i niemowląt (11,9).18 W Polsce w 2014 roku zarejestrowano 555 przypadków
IChP. Największy współczynnik śmiertelności – 46,5 i 41,7% – odnotowano w grupach wiekowych
odpowiednio 45–64 i ≥65 lat.19
Szczepienie osób ≥65. roku życia
Z uwagi na zwiększającą się oczekiwaną długość życia, osoby ≥65. roku życia stanowią coraz większy odsetek populacji wielu krajów. Współistnienie chorób przewlekłych i związane z wiekiem pogorszenie funkcjonowania układu odpornościowego sprawiają, że zakażenia wirusowe i bakteryjne stanowią duży problem kliniczny w tej grupie pacjentów – ryzyko powikłań, w tym zgonu, jest znacznie większe niż w populacji ogólnej. Niektórym takim chorobom można zapobiegać poprzez szczepienia ochronne, dlatego towarzystwa naukowe oraz eksperckie, w tym American Geriatrics Society, wskazują, że osoby w starszym wieku mogą odnieść najwięcej korzyści ze szczepień ochronnych.
Szczepienie przeciwko grypie
Szacuje się, że w Stanach Zjednoczonych rocznie
dochodzi do prawie 23 000 zgonów związanych z zachorowaniem na grypę, z czego 90% dotyczy
osób w wieku 65 lat i starszych.20 W 2003 roku
Thompson i wsp. oszacowali, że wskaźnik umieralności z powodu m.in. grypy lub zapalenia płuc w Stanach Zjednoczonych w latach 1990–1999
był największy w populacji osób ≥65. roku życia,
wynosząc, niezależnie od szczepu wirusa grypy,
22,1/100 000 osób/rok. Dla porównania, wskaźnik
ten w młodszych grupach wiekowych wahał się
od 0,2 do 1,3/ 100 000 osób/rok.21 Wraz z wiekiem
zwiększa się również wskaźnik hospitalizacji z powodu
grypy, osiągając w populacji osób po 65. roku
życia nawet 628,6/100 000 osób/rok.22
Głównym celem szczepienia przeciwko grypie
osób ≥65. roku życia jest zmniejszenie ryzyka powikłań
grypy, w tym ryzyka zgonu. Skuteczność
inaktywowanej szczepionki przeciwko grypie (IIV) w zapobieganiu zachorowaniom, czy powikłaniom
grypy oceniono w wielu badaniach. W sezonach
epidemicznych grypy, w których większość krążących w populacji wirusów była podobna do tych
uwzględnionych w składzie szczepionki na dany
rok, skuteczność IIV w populacji osób starszych
(>60. rż.) w zapobieganiu grypie potwierdzonej serologicznie
wyniosła 58%, a rozpoznanej na podstawie
objawów klinicznych – 47%.23 Podobną skuteczność
szczepionki przeciwko grypie odnotowano w zapobieganiu infekcyjnemu zapaleniu dróg
oddechowych, zachorowaniom na zapalenie płuc,
hospitalizacjom z powodu grypy oraz zgonom z powodu
grypy lub zapalenia płuc – odpowiednio: 56,
53, 50 oraz 68%.24 Ponadto osoby po 65. roku życia
szczepione przeciwko grypie rzadziej chorowały
na grypę lub zapalenie płuc wymagające wizyty lekarskiej,
jak również obserwowano u nich zmniejszenie
ryzyka zgonu z powodu grypy lub zapalenia
płuc w trakcie hospitalizacji.25 W metaanalizie
Jeffersona i wsp., w analizie uwzględniającej tylko
badania z randomizacją oszacowano, że szczepienie
przeciwko grypie zapobiegało zachorowaniom
na grypę w 58%.26
W niektórych krajach, m.in. w Stanach Zjednoczonych,
dostępna jest również inaktywowana
szczepionka przeciwko grypie zawierająca 4-krotnie
większą dawkę antygenów (60 µg) każdego z 3 szczepów uwzględnionych w jej składzie. Przeznaczono
ją do stosowania u osób ≥65. roku życia.
Jednak dodatkowe korzyści z podania szczepionki o dużej dawce antygenu, w porównaniu ze standardową,
odnotowano jedynie w wyodrębnionej
podgrupie osób >85. roku życia.27 W Polsce dostępne
są tylko inaktywowane szczepionki przeciwko
grypie zawierające standardowe dawki antygenów.
Szczepienie przeciwko pneumokokom
W Stanach Zjednoczonych S. pneumoniae odpowiada
za prawie 35 000 zachorowań na IChP w ciągu roku oraz prawie 4000 zgonów, z których
większość dotyczy osób starszych.28
W badaniach obserwacyjnych wykazano skuteczność
23-walentnej polisacharydowej szczepionki
przeciwko pneumokokom (PPSV-23) wobec
IChP, wahającą się od około 50 do 80% wśród
immunokompetentnych osób w starszym wieku
oraz u dorosłych chorych przewlekle bez względu
na wiek, uzasadniając zalecenie stosowania
PPSV-23 w profilaktyce IChP. Jednak badania
skuteczności i efektywności PPSV-23 w odniesieniu
do zapobiegania zachorowaniom na pneumokokowe
zapalenie płuc bez towarzyszącej bakteriemii
dały sprzeczne wyniki.29-32 W metaanalizie, w której uwzględniono 22 badania i łączną
populację ponad 100 000 dorosłych, wykazano,
że skuteczność PPSV-23 m.in. w zapobieganiu zachorowaniom
na zapalenie płuc o prawdopodobnej
pneumokokowej etiologii wyniosła 36%, a na zapalenie
płuc bez względu na przyczynę 27%.32
W latach 2008–2013 w badaniu CAPiTA (z randomizacją i placebo) oceniono skuteczność PCV-13 w zapobieganiu zachorowaniom na zapalenie płuc u dorosłych ≥65. roku życia. Uzyskane wyniki
wskazują, że PCV-13 w 45,6% zapobiega zachorowaniom
na zapalenie płuc wywołane przez typy
serologiczne uwzględnione w szczepionce i w 45%
zachorowaniom na zapalenie płuc bez towarzyszącej
bakteriemii spowodowane przez typy serologiczne
uwzględnione w szczepionce. Natomiast
skuteczność szczepionki w zapobieganiu IChP wywołanej
przez typy szczepionkowe wyniosła 75,0%
(p. Med. Prakt. Szczepienia 2/2015, s. 68–72).33
Zalecenia
Szczepienia szczególnie wskazane u osób ≥65. roku życia to szczepienie przeciwko grypie i pneumokokom – optymalnie szczepionką PCV-13 i PPSV-23 (p. tab. 1.). Według PSO 2016 są to szczepienia odpłatne.34
| Tabela 1. Szczepienie osób >65. roku życia | |
|---|---|
| Szczepionka przeciwko | Czy jest wskazane? |
| grypie | Tak. Szczepienie należy wykonać corocznie, najlepiej jesienią, jeszcze przed rozpoczęciem sezonu epidemicznego grypy. |
| pneumokokom (PCV-13, PPSV-23) | Tak. Osoby w wieku ≥65 lat powinni otrzymać PCV-13 i PPSV-23. Jeżeli to możliwe, PCV-13 należy podać w pierwszej kolejności. Szczepienie przypominające PPSV-23 nie jest konieczne |
| WZW typu A | Może. Wskazaniem do szczepienia jest zwiększone ryzyko zachorowania na WZW typu A. |
| WZW typu B | Może. Wskazaniem do szczepienia jest zwiększone ryzyko zakażenia wirusem zapalenia wątroby typu B. |
| MMR | Może. Osoby nieuodpornione powinny otrzymać 2 dawki MMR (w odstępie min. 4 tyg.). Nie stosować u osób w immunosupresji. |
| dTpa, Td | Może. Dorośli zaszczepieni podstawowo powinni otrzymywać co 10 lat szczepienie przypominające Td. Jedną taką dawkę warto zastąpić dTpa, szczególnie u osób mających kontakt, również zawodowy, z noworodkami i niemowlętami. Osoby, które nie otrzymały ≥3 dawek szczepionki zawierającej toksoid tężcowy i błoniczy, wymagają uzupełnienia szczepienia podstawowego. Szczepienie może być konieczne w razie zranienia i zabrudzenia rany. |
| poliomyelitis (IPV) | Może. Szczepienie zaleca się osobom nieszczepionym w ramach szczepień obowiązkowych, szczególnie wyjeżdżającym na obszary endemiczne choroby. |
| ospie wietrznej | Może. Osoby, które nie chorowały na ospę lub które nie były szczepione przeciwko ospie, powinny otrzymać 2 dawki szczepionki w odstępie ≥6 tygodni. Nie stosować u osób w immunosupresji. |
| meningokokom (MCV-C, MCV-4, białkowa przeciwko meningokokom grupy B) | Może. Według ChPL brakuje danych o stosowaniu szczepionek przeciwko meningokokom w tej grupie wiekowej. Szczepienie można rozważyć przy dużym ryzyku zachorowania. |
| HPV | Nie. Szczepienie nie jest zalecane w tej grupie wiekowej. |
| dTpa – szczepionka zawierająca toksoid tężca i zmniejszone dawki toksoidu błonicy i bezkomórkowych komponentów krztuśca, HPV – ludzki wirus brodawczaka, IPV – inaktywowana szczepionka przeciwko poliomyelitis, MCV-C – skoniugowana szczepionka przeciwko meningokokom grupy C, MCV-4 – 4-walentna skoniugowana szczepionka przeciwko meningokokom, MMR – szczepionka przeciwko odrze, śwince i różyczce, PCV-13 – 13-walentna skoniugowana szczepionka przeciwko pneumokokom, PPSV-23 – 23-walentna polisacharydowa szczepionka przeciwko pneumokokom, Td – szczepionka przeciwko tężcowi i błonicy, WZW – wirusowe zapalenie wątroby | |
American Geriatrics Society oraz Advisory
Committee on Immunization Practices (ACIP)
wskazują populację osób >65. roku życia jako
grupę dużego ryzyka ciężkiego przebiegu grypy
oraz jej powikłań.35,36
Optymalnym schematem szczepienia przeciwko
pneumokokom jest podanie PCV-13 w pierwszej kolejności, a po upływie co najmniej roku – PPSV-23.
Obu tych szczepionek nie należy podawać podczas
jednej wizyty. W przypadku niezamierzonego podania
PPSV-23 we wcześniejszym terminie nie
należy powtarzać szczepienia PPSV-23 (p. ryc.)37.
PPSV-23 lub PCV-13 można podawać podczas tej
samej wizyty razem ze szczepionką przeciwko
grypie (osobne wstrzyknięcie w drugie ramię), co
nie zwiększa ryzyka niepożądanych odczynów poszczepiennych i nie upośledza odpowiedzi immunologicznej
na szczepienie. Szczepienie przeciwko
grypie należy powtarzać każdego roku (1 dawka)
szczepionką aktualną na dany sezon epidemiczny.
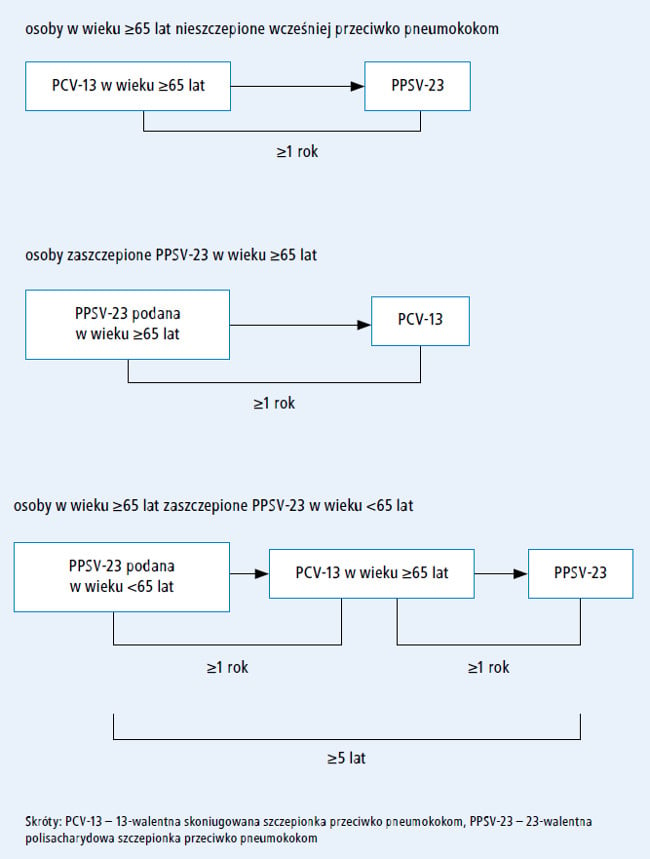
Ryc. Zalecane odstępy
między szczepionkami w schemacie obejmującym
podanie PCV-13 i PPSV-23 u dorosłych w wieku ≥65 lat
bez niedoboru odporności
(ACIP, Stany Zjednoczone)
Szczepienie dorosłych chorych na cukrzycę
U chorych na cukrzycę stwierdza się zwiększone
ryzyko zakażeń, m.in. infekcyjnego zapalenia dolnych
dróg oddechowych.38 Zakażenia u chorych
na cukrzycę mogą mieć cięższy przebieg oraz stanowić
przyczynę dekompensacji cukrzycy.39 Tacy
pacjenci są również narażeni na większe ryzyko
przedwczesnego zgonu z powodu chorób infekcyjnych.40
Nie jest zatem zaskakujące, że różne towarzystwa
uwzględniają szczepienia ochronne w swoich
wytycznych postępowania w cukrzycy. Na szczególną
uwagę zasługuje szczepienie przeciwko grypie,
pneumokokom i WZW typu B.
Szczepienie przeciwko grypie
W porównaniu z osobami niechorującymi na cukrzycę,
osoby na nią chorujące są narażone
na większe ryzyko hospitalizacji związanej z grypą. W skali roku oznaczało to 6 dodatkowych
hospitalizacji chorych na cukrzycę na 1000
osób. Takie wyniki uzyskali Lau i wsp., którzy
przeprowadzili badanie kohortowe obejmujące
ponad 56 000 chorych na cukrzycę oraz nieco
ponad 110 000 osób nieobciążonych tą chorobą. W podsumowaniu autorzy napisali, że wyniki badania
uzasadniają zalecenia dotyczące szczepień
przeciwko grypie osób chorujących na cukrzycę
(p. Med. Prakt. Szczepienia 3/2014, s. 67).41 Ci
sami autorzy na podstawie oceny skuteczności
rzeczywistej szczepionki przeciwko grypie (zmniejszenie o 43% ryzyka hospitalizacji z powodu grypy i zapalenia płuc oraz o 28% ryzyko hospitalizacji z jakiegokolwiek powodu) stwierdzili, że korzyści
szczepienia przeciwko grypie osób w wieku produkcyjnym
chorych na cukrzycę były podobne
do korzyści obserwowanych u osób po 65. roku
życia (p. Med. Prakt. Szczepienia 3/2014, s. 68).42 W przeglądzie systematycznym opublikowanym w 2015 roku, analizującym korzyści ze szczepienia
przeciwko grypie chorych na cukrzycę,
uwzględniono 11 badań obserwacyjnych obejmujących
prawie 171 000 osób.43 Na podstawie
tych badań, w grupie wiekowej 18–64 lat zbiorczą
skuteczność rzeczywistą szczepionek przeciwko
grypie w zapobieganiu hospitalizacjom (niezależnie
od przyczyny) oszacowano na 58% (95% CI:
6–81), a hospitalizacjom z powodu grypy lub zapalenia
płuc na 43%, natomiast nie stwierdzono
wpływu na umieralność i zachowania na chorobę
grypopodobną. U osób w starszym wieku (≥65. rż.)
skuteczność rzeczywista w zapobieganiu tym czterem
zmiennym wyniosła odpowiednio 23, 45, 38 i 13%. Autorzy zwrócili uwagę, że liczba danych
odnoszących się do takich pacjentów jest mała i są
one niskiej jakości. Nie zidentyfikowano żadnych
badań oceniających bezpieczeństwo szczepionek
przeciwko grypie u chorych na cukrzycę, jednak
dane zgromadzone w trakcie wieloletniego stosowania
tych szczepionek wskazują na ich korzystny
profil bezpieczeństwa u dorosłych.26,44 W opublikowanym w późniejszym okresie badaniu z randomizacją
obejmującym 105 chorych na cukrzycę
typu 2 oraz 108 osób z grupy kontrolnej tolerancja
IIV oceniana w ciągu 7 dni od szczepienia była
dobra, nie stwierdzono żadnych ciężkich zdarzeń
niepożądanych.45
Dane z badań obserwacyjnych dotyczących
skuteczności szczepienia przeciwko grypie chorych na cukrzycę oraz z badań w innych grupach
ryzyka, dane o bezpieczeństwie tego szczepienia u dorosłych oraz jego mały koszt były podstawą
do zalecenia szczepień przeciwko grypie chorych
na cukrzycę przez różne towarzystwa naukowe i grupy eksperckie.
Szczepienie przeciwko WZW typu B
Według danych amerykańskich dorośli chorzy
na cukrzycę narażeni są na około 2-krotnie większe
ryzyko zachorowania na ostre WZW typu B
niż osoby niechorujące na cukrzycę.46 Należy pamiętać,
że u dorosłych wskaźniki seroprotekcji
po szczepieniu 3 dawkami szczepionki przeciwko
WZW typu B zmniejszają się wraz z wiekiem, a także w przypadku palenia papierosów, otyłości,
immunosupresji oraz obecności chorób przewlekłych,
np. cukrzycy. Według danych CDC, wśród
dorosłych chorych na cukrzycę bez innych chorób
przewlekłych odsetek osób wytwarzających przeciwciała
anty-HBs w ochronnym stężeniu (≥10
IU/l) po podaniu 3 dawek szczepionki przeciwko
WZW typu B różni się w zależności od wieku i wynosi
≥90%, 80%, 65% i <40% odpowiednio w grupach
wiekowych ≤40, 41–59, 60–69 i ≤70 lat.46
Na temat bezpieczeństwa szczepień przeciwko
WZW typu B pozytywne stanowisko wyraził amerykański
Institute of Medicine (działający w ramach
National Academies of Sciences, Engineering
and Medicine) w swoim raporcie o zdarzeniach niepożądanych
występujących po szczepieniach.47
Szczepienie przeciwko pneumokokom
Cukrzyca stanowi jeden z czynników ryzyka inwazyjnej choroby pneumokokowej. W 2015 roku Torres i wsp. podsumowali dane na temat ryzyka pneumokokowego zapalenia płuc i IChP w różnych populacjach dorosłych – ryzyko to było istotnie większe u chorych na cukrzycę, przewlekłe choroby układu oddechowego i choroby układu sercowo-naczyniowego niż u osób nieobciążonych takimi chorobami.48 W artykule uwzględniono badania dostępne w bazie PubMed opublikowane w latach 2004–2014. U chorych na cukrzycę obserwowano nawet 4-krotne zwiększenie ryzyka IChP i pneumokokowego zapalenia płuc (p. tab. 2.).
| Tabela 2. Czynniki ryzyka związane chorobą pneumokokowąa | ||
|---|---|---|
| Czynnik ryzyka | Zakres ryzyka | |
| Badania kohortoweb | Badania kliniczno-kontrolnec | |
| pneumokokowe zapalenie płuc | ||
| przewlekła choroba układu oddechowego | 3,7–9,8 | – |
| przewlekła choroba układu sercowo-naczyniowego | 3,8–5,1 | – |
| cukrzyca | 1,5–3,1 | – |
| inwazyjna choroba pneumokokowa | ||
| przewlekła choroba układu oddechowego | 2,5–7,7 | 1,3–4,7 |
| przewlekła choroba układu sercowo-naczyniowego | 2,9–3,9 | 1,7–9,9 |
| cukrzyca | 1,5–3,9 | 1,5–1,7 |
| a Na podstawie Torres A., Blasi F., Dartois N. i wsp.: Which individuals are at increased risk of pneumococcal disease and why? Impact of COPD, asthma, smoking, diabetes, and/or chronic heart disease on community-acquired pneumonia and invasive pneumococcal disease. Thorax, 2015; 70: 984–989 b ryzyko wyrażone jako wskaźniki współczynników zapadalności c ryzyko wyrażone jako iloraz szans (OR) | ||
Zalecenia
W Polsce szczepienia chorych na cukrzycę należą
do szczepień zalecanych (odpłatnych), a szczególnie
wskazane u osób chorych na cukrzycę to szczepienie
przeciwko WZW typu B, grypie i pneumokokom
(p. tab. 3.).34
Polski PSO zaleca rewakcynację chorych na cukrzycę,
którzy po szczepieniu podstawowym przeciwko
WZW typu B nie wytworzyli przeciwciał
anty-HBs w stężeniu ≥10 IU/l. Należy pamiętać,
że wraz z upływem czasu od szczepienia podstawowego
stężenie przeciwciał anty-HBs ulega zmniejszeniu,
nawet u osób, które prawidłowo odpowiedziały
na szczepienie. Dlatego ocenę odpowiedzi
poszczepiennej najlepiej przeprowadzić 1–2 miesięcy
po zakończeniu schematu podstawowego, co
pozwoli na wiarygodną interpretację wyniku.
| Tabela 3. Szczepienie dorosłych chorych na cukrzycę | |
|---|---|
| Szczepionka przeciwko | Czy jest wskazane? |
| WZW typu B | Tak. Szczepienie należy wykonać u osób wcześniej nieszczepionych lub u których nie ukończono szczepienia. |
| grypie | Tak. Szczepienie należy wykonać corocznie, najlepiej jesienią, jeszcze przed rozpoczęciem sezonu epidemicznego grypy. |
| pneumokokom (PCV-13, PPSV-23) | Tak. Chorzy na cukrzycę powinni otrzymać PPSV-23. Osobom, które nie ukończyły 65 lat, koniecznie trzeba podać drugą dawkę w wieku ≥65 lat – co najmniej 5 lat od ostatniego szczepienia PPSV-23. Chorzy z niedoborem odporności oraz osoby w wieku ≥65 lat powinni otrzymać również PCV-13. Jeżeli wskazane są obie szczepionki, PCV-13 należy podać w pierwszej kolejności. |
| WZW typu A | Może. Wskazaniem do szczepienia jest zwiększone ryzyko zachorowania na WZW typu A. |
| HPV | Może. Szczepienie u dorosłych kobiet rozważa się indywidualnie. |
| MMR | Może. Osoby nieuodpornione powinny otrzymać 2 dawki MMR (w odstępie min. 4 tyg.). Nie stosować u osób w immunosupresji. |
| meningokokom (MCV-C, MCV-4, białkowa przeciwko meningokokom grupy B) | Może. Szczepienie zaleca się osobom z wybranymi chorobami przewlekłymi, wyjeżdżającym w rejony endemiczne choroby meningokokowej lub narażonym na większe ryzyko zachorowania ze względu na miejsce pracy. |
| dTpa, Td | Może. Dorośli zaszczepieni podstawowo powinni otrzymywać co 10 lat szczepienie przypominające Td. Jedną taką dawkę warto zastąpić dTpa, szczególnie u osób mających kontakt, również zawodowy, z noworodkami i niemowlętami. Osoby, które nie otrzymały ≥3 dawek szczepionki zawierającej toksoid tężcowy i błoniczy, wymagają uzupełnienia szczepienia podstawowego. Szczepienie może być konieczne w razie zranienia i zabrudzenia rany. |
| poliomyelitis (IPV) | Może. Szczepienie zaleca się osobom nieszczepionym w ramach szczepień obowiązkowych, szczególnie wyjeżdżającym na obszary endemiczne choroby. |
| ospie wietrznej | Może. Osoby, które nie chorowały na ospę lub które nie były szczepione przeciwko ospie, powinny otrzymać 2 dawki szczepionki w odstępie ≥6 tygodni. Nie stosować u osób w immunosupresji. |
| dTpa – szczepionka zawierająca toksoid tężca i zmniejszone dawki toksoidu błonicy i bezkomórkowych komponentów krztuśca, HPV – ludzki wirus brodawczaka, IPV – inaktywowana szczepionka przeciwko poliomyelitis, MCV-C – skoniugowana szczepionka przeciwko meningokokom grupy C, MCV-4 – 4-walentna skoniugowana szczepionka przeciwko meningokokom, MMR – szczepionka przeciwko odrze, śwince i różyczce, PCV-13 – 13-walentna skoniugowana szczepionka przeciwko pneumokokom, PPSV-23 – 23-walentna polisacharydowa szczepionka przeciwko pneumokokom, Td – szczepionka przeciwko tężcowi i błonicy, WZW – wirusowe zapalenie wątroby | |
ACIP zaleca szczepienie przeciwko grypie chorym
na cukrzycę już od wielu lat49. Takich pacjentów
uwzględniają również zalecenia ACIP dotyczące
szczepień przeciwko pneumokokom. Dorośli chorzy
na cukrzycę powinni otrzymać PPSV-23,50 a w przypadku
osób, które ukończyły 65. rok życia, istnieje
również wskazanie do podania PCV-13 (p. tab. 1.).
Szczepienia ochronne uwzględniono również w zaleceniach Polskiego Towarzystwa Diabetologicznego
(PTD). Dzieci chore na cukrzycę należy
szczepić zgodnie z programem szczepień. PTD zaleca
coroczne szczepienie przeciwko grypie osobom
>6. miesiąca życia.
PTD wskazuje również, że konieczne jest aktywne
wychwytywanie osób (niezależnie od wieku)
nieszczepionych przeciwko WZW typu B i uzupełnienie
szczepień zgodnie ze schematem 0, 1, 6 miesięcy, a także zachęcanie do szczepień przeciwko
ospie wietrznej, ponieważ choroba ta może być
przyczyną poważnej dekompensacji cukrzycy.51
Szczepienie dorosłych chorych na przewlekłą chorobę nerek
U osób z przewlekłą chorobą nerek (PChN) stwierdza
się złożone zaburzenia układu odpornościowego,
m.in. limfopenię i upośledzenie funkcji
limfocytów B, T, neutrofili i monocytów. Wiąże
się to ze zwiększonym ryzykiem zakażeń oraz
zmniejszoną immunogennością szczepionek.52,53
Szczególnie wrażliwą populację stanowią osoby
dializowane oraz po przeszczepieniu nerki.
Dializoterapia dodatkowo upośledza mechanizmy
odporności nieswoistej poprzez przerwanie bariery
skórnej.
Zgodnie z danymi amerykańskimi zakażenia
były przyczyną 20,2% hospitalizacji chorych
na PChN ≥66. roku życia (w 23,3% przypadków
przyczyną były objawy ze strony układu sercowo-naczyniowego, a w 56,5% inne przyczyny). W 2013 roku wskaźnik hospitalizacji w tej grupie
wiekowej (niezależnie od stopnia zaawansowania
choroby nerek) wyniósł około 140/1000 pacjentów.
Dla porównania u osób nieobciążonych PChN
wskaźnik ten wyniósł około 55/1000.54
Szczepienie przeciwko grypie
Chorzy na PChN i biorcy przeszczepu nerek należą
do grupy ryzyka ciężkiego przebiegu grypy, w tym
wywołanej przez wirusa A/H1N1pdm2009.49,55
Chorzy na PChN po szczepieniu mogą wytworzyć
przeciwciała w mianie uznanym za ochronne,
choć odpowiedź na szczepienie jest u nich gorsza
niż u zdrowych osób. Takie wnioski wyciągnięto w kilku badaniach oceniających immunogenność
szczepionek przeciwko grypie u osób z PChN. Nie
stwierdzono też dodatkowych korzyści z podawania
dawek przypominających.56 Dane na temat
skuteczności rzeczywistej szczepionek przeciwko
grypie u chorych ze schyłkową niewydolnością
nerek nie są liczne.58 U pacjentów dializowanych
otrzewnowo, którzy otrzymali szczepienie przeciwko
grypie, obserwowano mniejsze ryzyko hospitalizacji
lub zgonu.57 Podobne wnioski wyciągnęli
Wang i wsp., stwierdzając u chorych poddanych
hemodializie, zaszczepionych przeciwko grypie,
mniejsze ryzyko hospitalizacji z powodu zapalenia
płuc lub grypy, hospitalizacji na oddziale intensywnej
terapii i zgonu niż u chorych nieszczepionych.59
Szczepienie przeciwko WZW typu B
Chorzy z PChN wymagającą dializoterapii należą
do grupy zwiększonego ryzyka zakażenia
HBV. Zakażeniu wirusami przenoszonymi drogą
krwiopochodną sprzyja częsty kontakt z placówkami
opieki zdrowotnej, jak również sama dializoterapia.
Szczepienie przeciwko WZW typu B najlepiej
przeprowadzić jeszcze przed progresją choroby
do stadium schyłkowej niewydolności nerek. Wynika
to z gorszych wskaźników seroprotekcji u osób
wymagających dializoterapii (50–85%) w porównaniu z osobami immunokompetentnymi.60 U pacjentów ze schyłkową niewydolnością nerek
stwierdza się również mniejsze szczytowe stężenia przeciwciał anty-HBs i szybsze zmniejszanie
się ich stężenia. Po podaniu 4 podwójnych dawkach
szczepionki przeciwko WZW typu B (40 µg) u chorych z mniej zaawansowaną chorobą nerek
(stężenie kreatyniny 1,5–3 mg/dl) serokonwersję
stwierdzono u 100% zaszczepionych, natomiast u chorych z umiarkowaną (kreatynina 3–6 mg/dl) i ciężką chorobą nerek (kreatynina >6 mg/dl) wartości
te wyniosły odpowiednio 77 i 36,4%. Wyniki
badań na temat optymalnego schematu szczepienia
przeciwko WZW typu B u chorych na PChN
niewymagających jeszcze dializoterapii nie są
spójne, lecz raczej wskazują na większe wskaźniki
seroprotekcji po podaniu większych dawek
szczepionki.
Szczepienie przeciwko pneumokokom
Przewlekła choroba nerek jest jednym z czynników ryzyka IChP. U chorych dializowanych i biorców przeszczepu nerek obserwowano dobrą odpowiedź na szczepienie PPSV-23, jednak stężenie swoistych przeciwciał w surowicy szybko się zmniejszało. Dane o korzyściach szczepień przeciwko pneumokokom u chorych na PChN są ograniczone. W jednym z badań wykazano nieznaczne zmniejszenie umieralności u pacjentów hemodializowanych zaszczepionych przeciwko pneumokokom i grypie.61
Zalecenia
Osobom z PChN szczególnie zaleca się szczepienie przeciwko WZW typu B, grypie i pneumokokom (p. tab. 4.).
| Tabela 4. Szczepienie dorosłych chorych na przewlekłe choroby nerek | |
|---|---|
| Szczepionka przeciwko | Czy jest wskazane? |
| WZW typu B | Tak. Szczepienie jest szczególnie zalecane osobom z niewydolnością nerek i chorym dializowanym. |
| grypie | Tak. Szczepienie należy wykonać corocznie, najlepiej jesienią, jeszcze przed rozpoczęciem sezonu epidemicznego grypy. |
| pneumokokom (PCV-13, PPSV-23) | Tak. Osoby z niewydolnością nerek powinny otrzymać PCV-13 i PPSV-23. Obowiązuje szczepienie przypominające PPSV-23 – co najmniej 5 lat od ostatniego szczepienia PPSV-23. PCV-13 należy podać w pierwszej kolejności. |
| WZW typu A | Może. Wskazaniem do szczepienia jest zwiększone ryzyko zachorowania na WZW typu A. |
| HPV | Może. Szczepienie u dorosłych kobiet rozważa się indywidualnie. |
| MMR | Może. Osoby nieuodpornione powinny otrzymać 2 dawki MMR (w odstępie min. 4 tyg.). Nie stosować u osób w immunosupresji. |
| meningokokom (MCV-C, MCV-4, białkowa przeciwko meningokokom grupy B) | Może. Szczepienie zaleca się osobom z wybranymi chorobami przewlekłymi, wyjeżdżającym w rejony endemiczne choroby meningokokowej lub narażonym na większe ryzyko zachorowania ze względu na miejsce pracy. |
| dTpa, Td | Może. Dorośli zaszczepieni podstawowo powinni otrzymywać co 10 lat szczepienie przypominające Td. Jedną taką dawkę warto zastąpić dTpa, szczególnie u osób mających kontakt, również zawodowy, z noworodkami i niemowlętami. Osoby, które nie otrzymały ≥3 dawek szczepionki zawierającej toksoid tężcowy i błoniczy, wymagają uzupełnienia szczepienia podstawowego. Szczepienie może być konieczne w razie zranienia i zabrudzenia rany. |
| poliomyelitis (IPV) | Może. Szczepienie zaleca się osobom nieszczepionym w ramach szczepień obowiązkowych, szczególnie wyjeżdżającym na obszary endemiczne choroby. |
| ospie wietrznej | Może. Osoby, które nie chorowały na ospę lub które nie były szczepione przeciwko ospie, powinny otrzymać 2 dawki szczepionki w odstępie ≥6 tygodni. Nie stosować u osób w immunosupresji. |
| dTpa – szczepionka zawierająca toksoid tężca i zmniejszone dawki toksoidu błonicy i bezkomórkowych komponentów krztuśca, HPV – ludzki wirus brodawczaka, IPV – inaktywowana szczepionka przeciwko poliomyelitis, MCV-C – skoniugowana szczepionka przeciwko meningokokom grupy C, MCV-4 – 4-walentna skoniugowana szczepionka przeciwko meningokokom, MMR – szczepionka przeciwko odrze, śwince i różyczce, PCV-13 – 13-walentna skoniugowana szczepionka przeciwko pneumokokom, PPSV-23 – 23-walentna polisacharydowa szczepionka przeciwko pneumokokom, Td – szczepionka przeciwko tężcowi i błonicy, WZW – wirusowe zapalenie wątroby | |
Szczepienie przeciwko WZW typu B najlepiej
przeprowadzić jeszcze przed progresją choroby
do stadium schyłkowej niewydolności nerek.
Zgodnie z PSO 2016 obowiązkowym (bezpłatnym)
szczepieniem przeciwko WZW typu B są objęte
osoby z filtracją kłębuszkową <30 ml/min oraz osoby
dializowane. Osoby z mniej zaawansowaną chorobą
nerek uwzględniono w programie szczepień
zalecanych (płatnych). Szczepienie podstawowe
zaleca się przeprowadzić zgodnie ze schematem
podanym przez producenta.34 Według ChPL Engerix
B u osób od 16. roku życia z niewydolnością
nerek (w tym również dializowanych) należy podać
podwójną dawkę szczepionki (2 × 20 µg) w schemacie
0, 1, 2, 6 miesięcy. W ChPL Euvax B wskazano,
że u chorych poddawanych hemodializie konieczne
może być podanie dodatkowych dawek.62 Po zakończeniu
schematu podstawowego (1–2 mies.
po ostatniej dawce) należy oznaczyć stężenie
przeciwciał anty-HBs w celu oceny odpowiedzi
na szczepienie. Jeżeli stężenie wyniesie <10 IU/l,
należy powtórzyć cały schemat podstawowy i ponownie
oznaczyć stężenie anty-HBs 1–2 miesiące
po ostatniej dawce. Jeżeli po dwóch seriach szczepienia
podstawowego nie uzyska się zabezpieczającego
stężenia anty-HBs, nie należy podawać
kolejnych dawek szczepionki. Takich pacjentów
uznaje się za osoby nieodpowiadające na szczepienie
przeciwko WZW typu B. Zgodnie z PSO 2016
stężenie przeciwciał anty-HBs należy monitorować
co 6–12 miesięcy, a w razie stężenia <10 IU/l
wykonać szczepienie przypominające. U biorców
przeszczepu nerek zaleca się utrzymanie stężenia
≥100 IU/l oraz kontrolę stężenia anty-HBs co 6 miesięcy.
Osobom z PChN zaleca się również szczepienie
przeciwko grypie i pneumokokom (szczepienia odpłatne). W przypadku szczepień przeciwko pneumokokom
warto odnieść się do wytycznych ACIP, w których osobom z przewlekłą niewydolnością
nerek zalecono zarówno szczepienie PCV-13, jak i PPSV-23 (≥8 tyg. po PCV-13), z podaniem dawki
przypominającej PPSV-23 po 5 latach. Osobom zaszczepionym
wcześniej PPSV-23 szczepionkę skoniugowaną
można podać po upływie co najmniej
roku.50 Szczepionkę przeciwko grypie i PCV-13
lub PPSV-23 można podać podczas jednej wizyty, w osobne okolice anatomiczne.
Szczepienie dorosłych z przewlekłymi chorobami układu sercowo-naczyniowego
Szczepienie przeciwko grypie
Grypa może być czynnikiem wyzwalającym zawał
serca i ostry zespół wieńcowy. Wśród korzyści
szczepienia przeciwko grypie u osób z chorobami
układu sercowo-naczyniowego wymienia się
zmniejszenie ryzyka epizodów niedokrwienia mięśnia
sercowego wymagających hospitalizacji u chorych na chorobę wieńcową (badania FLUVACS i FLUCAD) oraz zmniejszenie ryzyka wystąpienia
poważnych zdarzeń sercowo-naczyniowych u osób z grupy dużego ryzyka tych zdarzeń.63-65 W niedawno
opublikowanej metaanalizie wykazano
również, że szczepienie przeciwko grypie o 56%
zmniejsza ryzyko zgonu z przyczyn sercowo-naczyniowych w ciągu roku wśród pacjentów z potwierdzoną
chorobą wieńcową.66 Autorzy metaanalizy
stwierdzili również, że szczepienie było
bezpieczne – w porównaniu z grupą kontrolną
po szczepieniu nie zaobserwowano istotnej różnicy w zakresie ciężkich zdarzeń niepożądanych w ciągu 4 tygodni.
Już na podstawie wyników badań FLUVACS i FLUCAD American Heart Association oraz European
Society of Cardiology zaleciły szczepienie
przeciwko grypie pacjentów z chorobą wieńcową w ramach wtórnej profilaktyki kardiologicznej.
Późniejsze publikacje stały się kolejnymi argumentem
wzmacniającymi siłę zaleceń szczepień
przeciwko grypie.
Szczepienie przeciwko pneumokokom
Szczepienie przeciwko pneumokokom szczepionką
polisacharydową zaleca się od wielu lat osobom z przewlekłymi chorobami układu sercowo-naczyniowego.
Tacy chorzy są narażeni na większe
ryzyko pozaszpitalnego zapalenia płuc, pneumokokowego
zapalenia płuc i IChP (p. tab. 2.).48 Pozaszpitalne
zapalenie płuc może być przyczyną
powikłań ze strony układu krążenia, na przykład
ostrych zespołów wieńcowych.67
Szczepienie PPSV-23 może zmniejszyć ryzyko
wystąpienia zdarzeń sercowo-naczyniowych i umieralności. Efekt ten jest niewielki, ale lepiej
wyrażony u osób >65. roku życia i osób z grupy
dużego ryzyka takich zdarzeń. To wnioski z przeglądu
systematycznego z metaanalizą obejmującego
13 badań (łącznie ponad 332 000 pacjentów).68 W porównaniu z osobami nieszczepionymi, u osób
zaszczepionych PPSV-23 stwierdzono o 14% mniejsze
ryzyko zdarzeń sercowo-naczyniowych i o 8%
mniejsze ryzyko umieralności. U osób z grupy dużego
ryzyka zdarzeń sercowo-naczyniowych ryzyko
takich zdarzeń było mniejsze o 8%, a u osób w starszym wieku o 20%. W odniesieniu do zawału
serca i udaru nie stwierdzono efektu ochronnego w zbiorczej analizie, lecz w grupie osób >65. roku
życia ryzyko udaru było o 14% mniejsze.
Zalecenia
Zalecenie szczepień osób z przewlekłymi chorobami
układu sercowo-naczyniowego (p. tab. 5.)
przeciwko pneumokokom i grypie znajdziemy zarówno w polskim PSO,34 jak i w wytycznych amerykańskich
(ACIP)50 i brytyjskich (Green Book).69
ACIP uznaje takich pacjentów za osoby z prawidłową
odpornością i zaleca wyłącznie szczepienie
PPSV-23. Schemat PCV-13–PPSV-23 wskazany
jest u osób >65. roku życia (p. tab. 1. i ryc.). Zalecenie
szczepień PPSV-23 nie dotyczy pacjentów z nadciśnieniem tętniczym, bez innych chorób
układu krążenia. Szczepienie przeciwko grypie
należy wykonywać corocznie, najlepiej przed rozpoczęciem
sezonu epidemicznego.
Zgodnie z polskim PSO, szczepienia dorosłych
przeciwko grypie i pneumokokom są odpłatne.
PPSV-23 i szczepionkę przeciwko grypie można
podać w trakcie jednej wizyty, w osobne okolice
anatomiczne.
| Tabela 5. Szczepienie dorosłych z chorobami układu sercowo-naczyniowego | |
|---|---|
| Szczepionka przeciwko | Czy jest wskazane? |
| grypie | Tak. Szczepienie należy wykonać corocznie, najlepiej jesienią, jeszcze przed rozpoczęciem sezonu epidemicznego grypy. |
| pneumokokom (PCV-13, PPSV-23) | Tak. Osoby z chorobami układu krążenia (ale nie z nadciśnieniem tętniczym) powinny otrzymać PPSV-23. Osobom, które nie ukończyły 65 lat, koniecznie trzeba podać drugą dawkę w wieku ≥65 lat – co najmniej 5 lat od ostatniego szczepienia PPSV-23. Chorzy z niedoborem odporności oraz osoby w wieku ≥65 lat powinni otrzymać również PCV-13. Jeżeli wskazane są obie szczepionki, PCV-13 należy podać w pierwszej kolejności. |
| WZW typu A | Może. Wskazaniem do szczepienia jest zwiększone ryzyko zachorowania na WZW typu A. |
| WZW typu B | Może. Wskazaniem do szczepienia jest zwiększone ryzyko zakażenia wirusem zapalenia wątroby typu B. |
| HPV | Może. Szczepienie u dorosłych kobiet rozważa się indywidualnie. |
| MMR | Może. Osoby nieuodpornione powinny otrzymać 2 dawki MMR (w odstępie min. 4 tyg.). Nie stosować u osób w immunosupresji. |
| meningokokom (MCV-C, MCV-4, białkowa przeciwko meningokokom grupy B) | Może. Szczepienie zaleca się osobom z wybranymi chorobami przewlekłymi, wyjeżdżającym w rejony endemiczne choroby meningokokowej lub narażonym na większe ryzyko zachorowania ze względu na miejsce pracy. |
| dTpa, Td | Może. Dorośli zaszczepieni podstawowo powinni otrzymywać co 10 lat szczepienie przypominające Td. Jedną taką dawkę warto zastąpić dTpa, szczególnie u osób mających kontakt, również zawodowy, z noworodkami i niemowlętami. Osoby, które nie otrzymały ≥3 dawek szczepionki zawierającej toksoid tężcowy i błoniczy, wymagają uzupełnienia szczepienia podstawowego. Szczepienie może być konieczne w razie zranienia i zabrudzenia rany. |
| poliomyelitis (IPV) | Może. Szczepienie zaleca się osobom nieszczepionym w ramach szczepień obowiązkowych, szczególnie wyjeżdżającym na obszary endemiczne choroby. |
| ospie wietrznej | Może. Osoby, które nie chorowały na ospę lub które nie były szczepione przeciwko ospie, powinny otrzymać 2 dawki szczepionki w odstępie ≥6 tygodni. Nie stosować u osób w immunosupresji. |
| dTpa – szczepionka zawierająca toksoid tężca i zmniejszone dawki toksoidu błonicy i bezkomórkowych komponentów krztuśca, HPV – ludzki wirus brodawczaka, IPV – inaktywowana szczepionka przeciwko poliomyelitis, MCV-C – skoniugowana szczepionka przeciwko meningokokom grupy C, MCV-4 – 4-walentna skoniugowana szczepionka przeciwko meningokokom, MMR – szczepionka przeciwko odrze, śwince i różyczce, PCV-13 – 13-walentna skoniugowana szczepionka przeciwko pneumokokom, PPSV-23 – 23-walentna polisacharydowa szczepionka przeciwko pneumokokom, Td – szczepionka przeciwko tężcowi i błonicy, WZW – wirusowe zapalenie wątroby | |
Szczepienia chorych na przewlekłe choroby wątroby
Zapobieganie zakażeniom za pomocą szczepień jest ważnym elementem opieki nad chorymi na przewlekłe choroby wątroby (PChW). Arvatini i wsp. wykazali, że u pacjentów z marskością wątroby zakażenie bakteryjne wiąże się z 30% umieralnością w ciągu 30 dni, która w ciągu kolejnych 12 miesięcy zwiększa się o kolejne 30%.70 Umieralność i ryzyko powikłań zwiększają również towarzyszące marskości wątroby zakażenia wirusowe, na przykład grypa, WZW typu A lub B.71
Szczepienie przeciwko grypie
Osoby chore na PChW należą do grup dużego ryzyka
powikłań grypy, w tym zgonu.36
Ocena skuteczności szczepienia przeciwko
grypie u chorych na PChW opiera się głównie
na badaniach oceniających immunogenność. Ich
wyniki wskazują, że szczepienie przeciwko grypie
jest skuteczne w zakresie indukcji wytwarzania
przeciwciał w ochronnym mianie, ale wskaźniki
seroprotekcji są mniejsze niż u zdrowych osób. Odpowiedź
immunologiczną na szczepienie przeciwko
grypie uzyskuje się średnio u 42–100% pacjentów z PChW (m.in. u osób z niewyrównaną marskością
wątroby w przebiegu zakażenia WZW typu B
lub C, z przewlekłym WZW typu B lub C leczonych
interferonem).72,73 W niektórych badaniach wykazano,
że podanie drugiej dawki szczepionki zwiększało
szansę na uzyskanie adekwatnej odpowiedzi
na szczepienie,74 nie ma jednak oficjalnych zaleceń
dotyczących takiego postępowania. Co ważne, w powyższych badaniach wykazano również,
że w grupie pacjentów leczonych przeciwwirusowo
lub immunosupresyjnie szczepienie przeciwko grypie
(szczepionką inaktywowaną) było bezpieczne. U chorych na PChW nie zaobserwowano także, aby
szczepienie przeciwko grypie zwiększało ryzyko
ostrego odrzucenia przeszczepu lub zwiększenia
aktywności aminotransferaz w surowicy krwi.75
Chociaż brakuje badań ukierunkowanych na ocenę
korzyści ze szczepienia przeciwko grypie przy
współistniejącej PChW, to nie stanowi to wskazania
do zaniechania szczepienia przeciwko grypie w tej grupie dużego ryzyka powikłań.
Szczepienie przeciwko pneumokokom
Zakażenia pneumokokowe u chorych na PChW mogą zaostrzyć przebieg choroby podstawowej, komplikować proces leczenia lub przygotowania do przeszczepienia wątroby. W opisie serii przypadków z Wielkiej Brytanii zaobserwowano zwiększoną umieralność z powodu zakażenia pneumokokami u pacjentów z marskością wątroby.76 Brakuje jednak badań na temat immunogenności i skuteczności szczepionek przeciwko pneumokokom w tej grupie chorych. W przypadku chorych z marskością wątroby szczepionych szczepionką polisacharydową, w jednym małym badaniu zaobserwowano szybkie zanikanie swoistych przeciwciał po szczepieniu,76 w innym natomiast immunogenność szczepionki była podobna do immunogenności u osób zdrowych.77
Szczepienie przeciwko WZW typu B
Pacjentom z niezaawansowanymi PChW szczepionkę przeciwko WZW typu B można podać w standardowym schemacie (0, 1, 6 mies.). Dostępne dane dotyczące skuteczności szczepienia przeciwko WZW typu B u pacjentów z PChW wskazują jednak, że u takich chorych istnieje większe ryzyko niewytworzenia przeciwciał anty-HBs w ochronnym stężeniu. U osób z marskością wątroby podwójna dawka (40 µg) szczepionki przeciwko WZW typu B zwiększa jej immunogenność, natomiast na standardową dawkę (20 µg) odpowiada nieznaczny odsetek szczepionych – około 20%.78-80 U tych chorych można zatem rozważyć podanie podwójnej dawki szczepionki. W 2 badaniach oceniających szczepienie podwójną dawką szczepionki w przyspieszonym schemacie (0, 1, 2 mies., ew. dodatkowe dawki), seroprotekcję uzyskano u 42–55% chorych na marskość wątroby. W jednym z badań zastosowanie podwójnej dawki szczepionki przeciwko WZW typu B w schemacie przyspieszonym (0, 2 tyg., 4 tyg., 6 mies.) wiązało się z uzyskaniem seroprotekcji u 87% osób z marskością wątroby oczekujących na przeszczepienie.81 Wśród chorych szczepionych po zabiegu przeszczepienia wątroby odsetek ten był jednak znacznie mniejszy. Dlatego u pacjentów z zaawansowanymi PChW oraz po przeszczepieniu wątroby należy ocenić odpowiedź poszczepienną i w razie potrzeby (anty HBs <10 mIU/ml) powtórzyć cały schemat szczepienia. Można również zastosować podwójną dawkę szczepionki. Jeżeli pacjent nie odpowiedział właściwie na szczepienie przeciwko WZW typu B przed zabiegiem przeszczepienia, a ze względu na brak czasu nie można wykonać powtórnego szczepienia przed zabiegiem, należy rozważyć podanie szczepionki w podwójnej dawce (ze względu na leczenie immunosupresyjne), zazwyczaj 4–6 miesięcy po przeszczepieniu.81
Szczepienie przeciwko WZW typu A
Dostępne dane wskazują, że u nosicieli antygenu
anty-HBs i chorych na PChW ryzyko zgonu z powodu ostrego WZW typu A może być ponad
20-krotnie większe.82 Immunogenność szczepionek
przeciwko WZW typu A może być zmniejszona u chorych z zaawansowaną PChW.83 Jednak
tacy pacjenci mogą odnieść największe korzyści
ze szczepienia przeciwko WZW typu A i nie należy
rezygnować z takiej profilaktyki. Korzystne
może się okazać oznaczenie stężenia przeciwciał w celu oceny odpowiedzi na szczepienie. Takiego
postępowania nie zaleca się u chorych na PChW o łagodnym przebiegu. Chorych na PChW najlepiej
szczepić przeciwko WZW typu A zanim dojdzie
do dekompensacji czynności wątroby – zwiększa
to szansę na uzyskanie zadowalającej odpowiedzi
na szczepienie.81
Nie potwierdzono, aby stosowanie skojarzonych
szczepionek przeciwko WZW typu A i B
było korzystniejsze niż stosowanie preparatów
nieskojarzonych.81 Poza tym za pomocą szczepionek
skojarzonych nie można wykonać szczepienia
przeciwko WZW typu B podwójną dawką antygenu
HBs, która może być skuteczniejsza u osób z zaawansowaną
marskością wątroby.
Zalecenia
Szczepienia szczególnie wskazane u osób chorych na PChW (p. tab. 6.) to szczepienie przeciwko WZW typu A, WZW typu B, grypie i pneumokokom50 – PPSV-23 i, w razie współistnienia niedoboru odporności, PCV-13 (optymalnie PPSV-23 ≥8 tyg. po PCV-13). Szczepienie przeciwko WZW typu A i B najlepiej wykonać zanim dojdzie do dekompensacji czynności wątroby.
| Tabela 6. Szczepienie dorosłych chorych na przewlekłe choroby wątroby | |
|---|---|
| Szczepionka przeciwko | Czy jest wskazane? |
| WZW typu A | Tak. U osób z przewlekłymi chorobami wątroby ryzyko ciężkich powikłań WZW typu A jest zwiększone. |
| WZW typu B | Tak. Szczepienie jest konieczne u osób z przewlekłymi chorobami wątroby. |
| grypie | Tak. Szczepienie należy wykonywać corocznie, najlepiej jesienią, jeszcze przed rozpoczęciem sezonu epidemicznego grypy. |
| pneumokokom (PCV-13, PPSV-23) | Tak. Osoby z przewlekłymi chorobami wątroby powinny otrzymać PPSV-23. Osobom, które nie ukończyły 65 lat, koniecznie trzeba podać drugą dawkę w wieku ≥65 lat – co najmniej 5 lat od ostatniego szczepienia PPSV-23. Przy współistniejącym niedoborze odporności oraz osobom w wieku ≥65 lat należy podać również PCV-13. Jeżeli wskazane są obie szczepionki, PCV-13 należy podać w pierwszej kolejności. |
| HPV | Może. Szczepienie u dorosłych kobiet rozważa się indywidualnie. |
| MMR | Może. Osoby nieuodpornione powinny otrzymać 2 dawki MMR (w odstępie min. 4 tyg.). Nie stosować u osób w immunosupresji. |
| meningokokom (MCV-C, MCV-4, białkowa przeciwko meningokokom grupy B) | Może. Szczepienie zaleca się osobom z wybranymi chorobami przewlekłymi, wyjeżdżającym w rejony endemiczne choroby meningokokowej lub narażonym na większe ryzyko zachorowania ze względu na miejsce pracy. |
| dTpa, Td | Może. Dorośli zaszczepieni podstawowo powinni otrzymywać co 10 lat szczepienie przypominające Td. Jedną taką dawkę warto zastąpić dTpa, szczególnie u osób mających kontakt, również zawodowy, z noworodkami i niemowlętami. Osoby, które nie otrzymały ≥3 dawek szczepionki zawierającej toksoid tężcowy i błoniczy, wymagają uzupełnienia szczepienia podstawowego. Szczepienie może być konieczne w razie zranienia i zabrudzenia rany. |
| poliomyelitis (IPV) | Może. Szczepienie zaleca się osobom nieszczepionym w ramach szczepień obowiązkowych, szczególnie wyjeżdżającym na obszary endemiczne choroby. |
| ospie wietrznej | Może. Osoby, które nie chorowały na ospę lub które nie były szczepione przeciwko ospie, powinny otrzymać 2 dawki szczepionki. Nie stosować u osób w immunosupresji. |
| dTpa – szczepionka zawierająca toksoid tężca i zmniejszone dawki toksoidu błonicy i bezkomórkowych komponentów krztuśca, HPV – ludzki wirus brodawczaka, IPV – inaktywowana szczepionka przeciwko poliomyelitis, MCV-C – skoniugowana szczepionka przeciwko meningokokom grupy C, MCV-4 – 4-walentna skoniugowana szczepionka przeciwko meningokokom, MMR – szczepionka przeciwko odrze, śwince i różyczce, PCV-13 – 13-walentna skoniugowana szczepionka przeciwko pneumokokom, PPSV-23 – 23-walentna polisacharydowa szczepionka przeciwko pneumokokom, Td – szczepionka przeciwko tężcowi i błonicy, WZW – wirusowe zapalenie wątroby | |
Zgodnie z PSO 201634 osoby zakażone wirusem
zapalenia wątroby typu C są objęte obowiązkowym,
bezpłatnym szczepieniem przeciwko WZW
typu B. Pozostałe szczepienia są odpłatne. Polski
program szczepień wyszczególnia również chorych
na PChW wśród populacji, którym należy zalecić
szczepienie przeciwko meningokokom. Warto pamiętać,
że bezpłatne szczepienie przeciwko WZW
typu B przysługuje osobom mającym styczność z osobami zakażonymi HBV (np. domownikom).
Aktualne wytyczne American Association for
the Study of Liver Diseases (AASLD) zalecają
szczepienie przeciwko WZW typu A wszystkich
chorych na przewlekłe WZW typy B lub C.84 Również
według ACIP szczepienie przeciwko WZW
typy A należy do standardów opieki nad wszystkimi
chorymi na PChW.
Biorcy przeszczepu narządów
Wskazane jest, aby osoba zakwalifikowana do przeszczepienia
narządu (nerki, wątroby, serca) posiadała
aktualne szczepienia. Należy pamiętać, że nie
zaleca się podawania szczepionek „żywych” w okresie 4 tygodni poprzedzających planowany zabieg
przeszczepienia. U biorców przeszczepów można
podawać szczepionki inaktywowane. Nie zaleca
się jednak wykonywania szczepień w okresie intensywnego
leczenia immunosupresyjnego (w tym w ciągu pierwszych 2 mies. po zabiegu), co jest
uwarunkowane małym prawdopodobieństwem uzyskania
zadowalającej odpowiedzi immunologicznej.
Na ogół szczepienia wznawia się po upływie 6 miesięcy.
Biorcom przeszczepów nie należy podawać
MMR ani szczepionki przeciwko ospie wietrznej85
(p. www.mp.pl/szczepienia/artykuly/wytyczne).
U biorców przeszczepu zaleca się utrzymanie
stężenia przeciwciał anty-HBs >100 IU/l oraz
kontrolę stężenia tych przeciwciał co 6 miesięcy.34
Szczepienie dorosłych z przewlekłymi chorobami płuc
Chorzy na przewlekłe choroby płuc wymagają szczególnej ochrony przed grypą i chorobą pneumokokową.
Szczepienie przeciwko grypie
Istotnym elementem kontroli przewlekłej obturacyjnej
choroby płuc (POChP) jest kontrola
zaostrzeń, do których prowadzi m.in. infekcyjne
zapalenie dróg oddechowych, w tym grypa. Korzyści
ze szczepienia przeciwko grypie u pacjentów z POChP obserwowano od dawna. W analizie
danych retrospektywnych z 3 kolejnych sezonów
epidemicznych grypy wykazano, że u chorych na
POChP ≥65. roku życia szczepienie przeciwko grypie
zmniejszyło o 70% ryzyko zgonu i o 52% ryzyko
hospitalizacji z powodu zapalenia płuc lub grypy, w porównaniu z grupą nieszczepioną.86 Z kolei w metaanalizie zespołu autorów Cochrane Collaboration z 2006 roku uwzględniającej 11 badań z randomizacją (6 dotyczyło chorych na POChP)
wykazano, że szczepienie przeciwko grypie sezonowej
zmniejsza liczbę zaostrzeń POChP średnio o 37 epizodów/100 pacjentów w ciągu roku.87
Zakażenia dróg oddechowych, zwłaszcza wirusowe,
mogą wyzwalać napady i zaostrzenia astmy.
Szczepienie przeciwko grypie chorych na astmę
jest bezpieczne (m.in. nie zwiększa ryzyka zaostrzeń), a chorzy odnoszą z niego przynajmniej
taką samą korzyść, jak ich zdrowi rówieśnicy.88 W nielicznych badaniach z randomizacją (1 u dzieci i młodzieży, 2 u dorosłych) nie potwierdzono
jednoznacznie skuteczności inaktywowanych
szczepionek przeciwko grypie sezonowej w zapobieganiu
zaostrzeniom astmy i hospitalizacji z tego powodu. W badaniu u dzieci i młodzieży
zauważono jednak, że – w porównaniu z placebo –
na każdych 100 pacjentów zaszczepionych przeciwko
grypie, 4 unikało zaostrzenia astmy w sezonie
zachorowań na grypę.88,89 Szczepienie przeciwko
grypie nieznacznie zmniejszało codzienne nasilenie objawów w tym okresie. Na korzystny wpływ
szczepienia przeciwko grypie na ryzyko zaostrzeń
astmy wskazują wyniki niektórych badań obserwacyjnych.90
Szczepienie przeciwko pneumokokom
Szczepienie przeciwko pneumokokom szczepionką
polisacharydową zaleca się od wielu lat osobom z przewlekłymi chorobami układu oddechowego
ze względu na zwiększone ryzyko pozaszpitalnego
zapalenia płuc, pneumokokowego zapalenia płuc i IChP48 (p. tab. 2.). Osoby z takimi chorobami
mogą odnieść co najmniej takie korzyści ze szczepienia,
jak osoby nieobciążone takimi chorobami. W różnych badaniach wykazano pewną skuteczność
kliniczną i rzeczywistą u chorych na przewlekłe
choroby płuc.
W hiszpańskim badaniu z randomizacją obejmującym
prawie 600 chorych na POChP odnotowano,
że skuteczność PPSV-23 w zapobieganiu pozaszpitalnemu
zapaleniu płuc u osób do 65. roku
życia wyniosła 76%, a w podgrupie pacjentów
do 65. roku życia, z dużym (FEV1 <40%) ograniczeniem
przepływu powietrza przez drogi oddechowe
– 91%. Nie stwierdzono natomiast korzyści u osób >65. roku życia.91 W przeglądzie systematycznym
Cochrane nie potwierdzono skuteczności
klinicznej PPSV-23 u chorych na POChP w zapobieganiu
zaostrzeniom choroby podstawowej i zapobieganiu pozaszpitalnemu zapaleniu płuc
ani w zmniejszeniu umieralności i zgonu z powodu
zaburzeń układu sercowo-naczyniowego.92
Korzyści ze szczepień PPSV-23 u chorych
na przewlekłe choroby płuc wykazano natomiast w niektórych badaniach obserwacyjnych. W badaniu
kliniczno-kontrolnym przeprowadzonym
na grupie 304 pacjentów (w tym 113 z POChP) w wieku ≥50 lat skuteczność rzeczywistą (efektywność) w zapobieganiu pneumokokowemu zapaleniu
płuc oszacowano na 48%.93 W innym badaniu
kliniczno-kontrolnym obejmującym również chorych
na POChP skuteczność rzeczywista PPSV-23 w zapobieganiu hospitalizacjom z powodu pozaszpitalnego
zapalenia płuc u osób >65. roku życia
wyniosła 24%.94 W innych badaniach nie obserwowano
wpływu PPSV-23 na zachorowania na pozaszpitalne
zapalenie płuc95 ani na umieralność.96
Zalecenia
Szczepienia przeciwko grypie i pneumokokom osób z przewlekłymi chorobami płuc uwzględniono w szczepieniach zalecanych w PSO 201634 (p. tab. 7.). Szczepienia te są odpłatne. Szczepienie przeciwko grypie należy wykonywać corocznie, optymalnie jeszcze przed rozpoczęciem sezonu epidemicznego. W kwestii schematu szczepienia można się odnieść do zaleceń ACIP, zgodnie z którymi chorzy na przewlekłe choroby płuc, którzy nie ukończyli 65. roku życia, powinni otrzymać PPSV-23.50 Osoby >65. roku życia należy zaszczepić PCV-13 i PPSV-2337 (p. tab. 1. i ryc.).
| Tabela 7. Szczepienie dorosłych z chorobami płuc | |
|---|---|
| Szczepionka przeciwko | Czy jest wskazane? |
| grypie | Tak. Szczepienie należy wykonać corocznie, najlepiej jesienią, jeszcze przed rozpoczęciem sezonu epidemicznego grypy. |
| pneumokokom (PCV-13, PPSV-23) | Tak. Osoby z przewlekłymi chorobami płuc (np. astmą) powinny otrzymać PPSV-23. Osobom, które nie ukończyły 65 lat, koniecznie trzeba podać drugą dawkę w wieku ≥65 lat – co najmniej 5 lat od ostatniego szczepienia PPSV-23. Chorzy z niedoborem odporności oraz osoby w wieku ≥65 lat powinni otrzymać również PCV-13. Jeżeli wskazane są obie szczepionki, PCV-13 należy podać w pierwszej kolejności. |
| WZW typu A | Może. Wskazaniem do szczepienia jest zwiększone ryzyko zachorowania na WZW typu A. |
| WZW typu B | Może. Wskazaniem do szczepienia jest zwiększone ryzyko zakażenia wirusem zapalenia wątroby typu B. |
| HPV | Może. Szczepienie u dorosłych kobiet rozważa się indywidualnie. |
| MMR | Może. Osoby nieuodpornione powinny otrzymać 2 dawki MMR (w odstępie min. 4 tyg.). Nie stosować u osób w immunosupresji. |
| meningokokom (MCV-C, MCV-4, białkowa przeciwko meningokokom grupy B) | Może. Szczepienie zaleca się osobom z wybranymi chorobami przewlekłymi, wyjeżdżającym w rejony endemiczne choroby meningokokowej lub narażonym na większe ryzyko zachorowania ze względu na miejsce pracy. |
| dTpa, Td | Może. Dorośli zaszczepieni podstawowo powinni otrzymywać co 10 lat szczepienie przypominające Td. Jedną taką dawkę warto zastąpić dTpa, szczególnie u osób mających kontakt, również zawodowy, z noworodkami i niemowlętami. Osoby, które nie otrzymały ≥3 dawek szczepionki zawierającej toksoid tężcowy i błoniczy, wymagają uzupełnienia szczepienia podstawowego. Szczepienie może być konieczne w razie zranienia i zabrudzenia rany. |
| poliomyelitis (IPV) | Może. Szczepienie zaleca się osobom nieszczepionym w ramach szczepień obowiązkowych, szczególnie wyjeżdżającym na obszary endemiczne choroby. |
| ospie wietrznej | Może. Osoby, które nie chorowały na ospę lub które nie były szczepione przeciwko ospie, powinny otrzymać 2 dawki szczepionki w odstępie ≥6 tygodni. Nie stosować u osób w immunosupresji. |
| dTpa – szczepionka zawierająca toksoid tężca i zmniejszone dawki toksoidu błonicy i bezkomórkowych komponentów krztuśca, HPV – ludzki wirus brodawczaka, IPV – inaktywowana szczepionka przeciwko poliomyelitis, MCV-C – skoniugowana szczepionka przeciwko meningokokom grupy C, MCV-4 – 4-walentna skoniugowana szczepionka przeciwko meningokokom, MMR – szczepionka przeciwko odrze, śwince i różyczce, PCV-13 – 13-walentna skoniugowana szczepionka przeciwko pneumokokom, PPSV-23 – 23-walentna polisacharydowa szczepionka przeciwko pneumokokom, Td – szczepionka przeciwko tężcowi i błonicy, WZW – wirusowe zapalenie wątroby | |
ACIP zaleca szczepienie przeciwko grypie i pneumokokom wszystkim chorym na przewlekłe
choroby płuc.50 W zaleceniach brytyjskich (Green
Book)69 chorym na astmę szczepienie przeciwko
pneumokokom zalecono tylko w przypadku ciężkiego
przebiegu choroby, tj. przy częstym stosowaniu
glikokortykosteroidów systemowo.
Zalecenia dotyczące szczepienia przeciwko grypie i pneumokokom chorych na POChP uwzględniają
również wytyczne Global Initiative for Obstructive
Lung Disease (GOLD).97
Szczepienia ciężarnych
Kobiety ciężarne są narażone na większe ryzyko zakażeń, co może wynikać z fizjologicznych zmian funkcji układu odpornościowego zachodzących w okresie ciąży. Szczepienie w czasie ciąży może zapewnić ochronę nie tylko samej zaszczepionej, ale również jej dziecku dzięki przezłożyskowemu transportowi swoistych przeciwciał po szczepieniu.98 Należy jednak pamiętać, że „żywe” szczepionki przeciwwirusowe lub przeciwbakteryjne są przeciwwskazane w czasie ciąży, istnieje bowiem teoretyczne ryzyko wywołania zakażenia u płodu. Jednak jak wskazują liczne doniesienia, przypadkowe podanie atenuowanej szczepionki kobiecie ciężarnej (tj. w sytuacji, gdy kobieta nie wiedziała o ciąży w momencie szczepienia) nie wiązało się z zakażeniem płodu, wadami wrodzonymi lub powikłanym przebiegiem ciąży. Szczepionki, które są przeciwwskazane w okresie ciąży, można w razie konieczności stosować (z wyjątkiem niedostępnej w Polsce szczepionki przeciwko ospie prawdziwej) w okresie poporodowym i w trakcie karmienia piersią. Szczepionki inaktywowane można podawać kobietom ciężarnym, które miały kontakt z wirusem zapalenia wątroby typu A lub B, chorobą meningokokową lub innymi chorobami zakaźnymi, albo nie będą mogły tego kontaktu uniknąć.99
Szczepienie przeciwko krztuścowi
Szczepionki zawierające toksoid tężcowy oraz
zmniejszoną dawkę toksoidu błoniczego i bezkomórkowych
komponentów krztuśca (dTpa) zaleca
się ciężarnym w ramach szczepień przypominających w celu ochrony ich nowo narodzonych dzieci
przed krztuścem do momentu, kiedy nie wytworzą
one zadowalającej odpowiedzi po szczepieniach
wykonanych w wieku niemowlęcym. Członkowie
Global Pertussis Initiative podkreślają, że ciężarne
powinny być szczepione przeciwko krztuścowi w trakcie każdej ciąży. Wynika to z faktu, że już
rok po szczepieniu dochodzi do znacznego zmniejszenia
stężenia swoistych przeciwciał u matki.
Dwa lata po szczepieniu stężenie to jest zbyt małe,
aby móc zapewnić ochronę niemowlęciu.100
Jednym z krajów, w którym rutynowo szczepi
się ciężarne przeciwko krztuścowi, jest Wielka
Brytania. W badaniu obserwacyjnym oceniającym
efekty tego programu stwierdzono, że największą
(prawie o 80%) redukcję liczby przypadków krztuśca
odnotowano u niemowląt <3. miesiąca życia
(tj. u dzieci urodzonych przez kobiety, którym
przysługiwało szczepienie dTpa w czasie ciąży).
Skuteczność rzeczywista dTpa podanej ciężarnej
≥7 dni przed porodem w zapobieganiu krztuścowi u dziecka do 3. lub 2. miesiąca życia wyniosła odpowiednio
91% i 90%.101 Podobne wyniki uzyskano w badaniu obejmującym populację ciężarnych z Anglii i Walii, w którym skuteczność rzeczywistą
szczepionki dTpa w profilaktyce zachorowania
dziecka w pierwszych 2 miesiącach życia na krztusiec
oszacowano na 93%.102
Bezpieczeństwo szczepień przeciwko krztuścowi u ciężarnych oceniono w różnych badaniach
obserwacyjnych. Nie wykazano, aby szczepienie
to zwiększało ryzyko powikłań ciąży (m.in. wewnątrzmaciczny
zgon płodu, stan przedrzucawkowy
lub rzucawka, poród przedwczesny), zgonu
dziecka w ciągu pierwszych 7 dni życia ani urodzeniowej
masy ciała za małej w stosunku do wieku
płodowego.103-105 Szczepienie dTpa w czasie ciąży
nie wpłynęło również niekorzystnie na przebieg
ciąży niezależnie od odstępu pomiędzy dTpa a wcześniejszym szczepieniem przeciwko tężcowi.106
Szczepienie przeciwko grypie
W dostępnych badaniach dobrze udokumentowano
zwiększone ryzyko ciężkiego przebiegu grypy
sezonowej i pandemicznej u kobiet ciężarnych.107
Dodatkowo zachorowanie na grypę w czasie ciąży
stwarza ryzyko dla płodu – obserwowano większą
częstość porodów przedwczesnych, a u noworodków
mniejszą urodzeniową masę ciała i większe
ryzyko masy ciała za małej w stosunku do wieku
płodowego.108 Jednocześnie wiele publikacji przemawia
za bezpieczeństwem szczepień ciężarnych
przeciwko grypie. W przeglądzie systematycznym z metaanalizą 7 badań obserwacyjnych, obejmującym
prawie 150 000 ciężarnych, nie stwierdzono zwiększonego ryzyka urodzenia martwego
dziecka i poronienia samoistnego czy poronienia
po podaniu szczepionki przeciwko grypie pandemicznej
2009. Co więcej, ryzyko urodzenia martwego
dziecka było o 23% mniejsze w grupie kobiet
szczepionych jakąkolwiek szczepionką przeciwko
grypie.109
Szczepienie ciężarnych przeciwko grypie może
również zmniejszyć zachorowalność na grypę i jej powikłania wśród dzieci, które nie ukończyły
6. miesiąca życia (a zatem nie można ich jeszcze
zaszczepić przeciwko grypie, a stosowanie leków
przeciwwirusowych nie jest wskazane) – poprzez
zmniejszenie ryzyka zachorowania kobiety na grypę
po porodzie, zmniejsza się ryzyko transmisji
choroby z matki na dziecko, a dodatkową ochronę
zapewnia przezłożyskowy transport swoistych
przeciwciał przeciwko wirusowi grypy.110
Zalecenia
Do szczepień, które rutynowo zaleca się wszystkim ciężarnym, należy szczepienie przeciwko krztuścowi oraz szczepienie przeciwko grypie (p. tab. 8.)
| Tabela 8. Szczepienie kobiet ciężarnych | |
|---|---|
| Szczepionka przeciwko | Czy jest wskazane? |
| grypie | Tak. Szczepienie należy wykonywać corocznie, najlepiej jesienią, jeszcze przed rozpoczęciem sezonu epidemicznego grypy. Szczepienie w czasie ciąży jest bezpieczne. |
| dTpa, Td | Tak. Szczepienie dTpa zaleca się ciężarnym, najlepiej po 28. tygodniu ciąży. Osoby, które nie otrzymały ≥3 dawek szczepionki zawierającej toksoid tężcowy i błoniczy, wymagają uzupełnienia szczepienia podstawowego. Szczepienie może być konieczne w razie zranienia i zabrudzenia rany. |
| WZW typu A | Może. Wskazaniem do szczepienia jest zwiększone ryzyko zachorowania na WZW typu A. |
| WZW typu B | Może. Wskazaniem do szczepienia jest zwiększone ryzyko zakażenia wirusem zapalenia wątroby typu B. Szczepienie w czasie ciąży jest bezpieczne. |
| meningokokom (MCV-C, MCV-4, białkowa przeciwko meningokokom grupy B) | Może. Szczepienie można wykonać w razie dużego ryzyka zachorowania na inwazyjną chorobę meningokokową. |
| pneumokokom (PCV-13, PPSV-23) | Może. Szczepienie zaleca się osobom z wybranymi chorobami przewlekłymi, np. niedoborem odporności. Szczepienie na ogół wykonuje się po zakończeniu ciąży. |
| poliomyelitis (IPV) | Może. Szczepienie można wykonać u nieuodpornionych ciężarnych, przy dużym ryzyku zachorowania (np. wyjazd na obszary endemiczne poliomyelitis). |
| HPV | Nie. Nie zaleca się szczepienia kobiet w ciąży przeciwko HPV, ale przypadkowe podanie tej szczepionki w czasie ciąży nie stanowi zagrożenia dla płodu i ciężarnej. Szczepienie u dorosłych kobiet rozważa się indywidualnie. |
| MMR | Nie. Nie należy szczepić ciężarnych MMR ze względu na teoretyczne ryzyko przeniesienia wirusa szczepionkowego na płód. Przypadkowe zaszczepienie MMR w czasie ciąży lub niedługo przed zajściem w ciążę nie jest jednak wskazaniem do przerwania ciąży. U nieuodpornionych kobiet szczepienie MMR należy uzupełnić po porodzie (2 dawki w odstępie min. 4 tyg.). |
| ospie wietrznej | Nie. Nie należy podawać szczepionki przeciwko ospie wietrznej w czasie ciąży. Kobietom nieodpornym na ospę wietrzną szczepionkę należy podać po porodzie (2 dawki w odstępie min. 6 tyg.). |
| dTpa – szczepionka zawierająca toksoid tężca i zmniejszone dawki toksoidu błonicy i bezkomórkowych komponentów krztuśca, HPV – ludzki wirus brodawczaka, IPV – inaktywowana szczepionka przeciwko poliomyelitis, MCV-C – skoniugowana szczepionka przeciwko meningokokom grupy C, MCV-4 – 4-walentna skoniugowana szczepionka przeciwko meningokokom, MMR – szczepionka przeciwko odrze, śwince i różyczce, PCV-13 – 13-walentna skoniugowana szczepionka przeciwko pneumokokom, PPSV-23 – 23-walentna polisacharydowa szczepionka przeciwko pneumokokom, Td – szczepionka przeciwko tężcowi i błonicy, WZW – wirusowe zapalenie wątroby | |
Szczepienie ciężarnych przeciwko krztuścowi
szczepionką dTpa zaleca American College of Obstetricians
and Gynecologists (ACOG)111, ACIP
(między 27. a 34. tyg. ciąży), brytyjski Joint Comittee
on Vaccination112, a także Global Pertussis
Initiative.100 Szczepienia ciężarnych przeciwko krztuścowi są obecnie rekomendowane w wielu
krajach. W Stanach Zjednoczonych ACIP wydał
takie zalecenia już w 2011 roku, a podobne przyjęto
m.in. w Argentynie, Belgii, Izraelu, Nowej
Zelandii oraz Wielkiej Brytanii, a od tego roku
również w Polsce34. Zgodnie z PSO na 2016 rok,
szczepienie przeciwko krztuścowi szczepionką
dTpa zalecane jest wszystkim kobietom planującym
ciążę lub będącym w ciąży (po 28. tyg. ciąży).
Szczepienie ciężarnych przeciwko grypie zaleca
się m.in. w Polsce (PSO 2016)34, w Stanach
Zjednoczonych36 i w Wielkiej Brytanii (Green
Book).69 Jednak pomimo dowodów na bezpieczeństwo i skuteczność szczepienia ciężarnych przeciwko
grypie oraz mimo zaleceń wielu towarzystw
naukowych i eksperckich, szczepienie to nie cieszy
się popularnością. W Polsce na szczepienie przeciwko
grypie decyduje się niewiele ciężarnych. Szakówcuje się, że w Stanach Zjednoczonych przeciwko
grypie szczepi się co druga ciężarna.113
Zalecenia ogólne
Za dowód odporności na odrę, świnkę i różyczkę
uznaje się zachorowanie na daną chorobę potwierdzone
laboratoryjnie lub obecność we krwi
swoistych przeciwciał lub otrzymanie co najmniej 1 dawki (różyczka) lub 2 dawek (odra, świnka)
szczepionki zawierającej odpowiednie wirusy –
szczepienie powinno być udokumentowane i prawidłowo
przeprowadzone (pierwsza dawka nie
wcześniej niż w wieku 12 mies., min. 4 tyg. odstępu
pomiędzy dawkami). Jeżeli dorosły nie spełnia
przynajmniej jednego z tych kryteriów, zaleca
się wykonanie kompletnego szczepienia MMR lub
uzupełnienie zaległej dawki, jeżeli nie stwierdza
się przeciwwskazań do podania tej szczepionki.114
Podobnie nieuodpornionym osobom zaleca się
szczepienie przeciwko ospie wietrznej – kompletny
schemat obejmuje podanie 2 dawek w odstępie
≥6 tygodni. Za dowód odporności na ospę wietrzną
uznaje się przechorowanie ospy (potwierdzone
przez lekarza, wpis w dokumentacji medycznej)
lub obecność swoistych przeciwciał we krwi, lub
właściwie udokumentowane, prawidłowo przeprowadzone
szczepienie 2 dawkami szczepionki.115
U nieodpornych kobiet w wieku rozrodczym
powyższe szczepienie najlepiej przeprowadzić jak
najszybciej, aby uniknąć zakażenia wirusem ospy
wietrznej i półpaśca lub różyczki w czasie ciąży.
Szczególnym wskazaniem do szczepień przeciwko
meningokokom jest wyjazd w rejony endemiczne
choroby meningokokowej, zawodowa
ekspozycja na N. meningitidis (personel pracowni
mikrobiologicznych, pracownicy placówek opieki
zdrowotnej narażeni na bezpośredni kontakt z chorymi), osoby z niedoborem odporności (anatomiczny
lub czynnościowy brak śledziony, niedobór w układzie dopełniacza [C5-C9] i properdyny).116
Szczepienie przeciwko HPV u kobiet >18. roku
życia należy rozważyć indywidualnie. Wiadomo,
że największą korzyść ze szczepienia odnoszą
młodsze nastolatki, które nie miały kontaktu z wirusem. U kobiet >18. roku życia obserwowano
umiarkowaną lub małą skuteczność szczepienia w zapobieganiu śródnabłonkowej neoplazji szyjki
macicy. U kobiet z tej grupy wiekowej, niezakażonych
HPV, można się jednak spodziewać indywidualnych
korzyści ze szczepienia.117 W Polsce
nie ma zaleceń dotyczących szczepienia mężczyzn.
Piśmiennictwo:
1. Bridges C.B., Hurley L.P., Williams W.W. i wsp.: Meeting the challenges of immunizing adults. Am. J. Prev. Med., 2015; 49 (6 supl 4): S455–642. Williams W.W., Lu P.J., O’Halloran A. i wsp.:Vaccination coverage among adults, excluding influenza vaccination – United States, 2013. MMWR Morb. Mortal. Wkly Rep., 2015; 64: 95–102
3. Narodowy Instytut Zdrowia–Państwowy Zakład Higieny. Choroby zakaźne i zatrucia w Polsce. wwwold.pzh.gov.pl/oldpage/epimeld/index_p.html
4. European Centre for Disease Prevention and Control. Varicella vaccination in the European Union. Sztokholm, ECDC, 2015
5. ECDC. Measles and rubella monitoring. ecdc.europa.eu/en/publications/surveillance_reports/vpd/Pages/emmo.aspx
6. Szenborn L.: Różyczka w Polsce – między planem eliminacji choroby a praktyką w gabinetach lekarskich. Med. Prakt. Szczepienia 3/2012, s. 27–29
7. ECDC, Annual epidemiological report Vaccine-preventable diseases 2014, http://ecdc.europa.eu/en/publications/Publications/AER-2014-VPD-FINAL.pdf
8. Świnka (nagminne zapalenie przyusznic). W: Interna Szczeklika 2015. Kraków, Medycyna Praktyczna, 2015: 2310–2312
9. Mrukowicz J.: Grypa i jej czynna profilaktyka u dorosłych. Med. Prakt., 2015; 11: 102
10. Choroby układu pokarmowego. W: Interna Szczeklika 2015. Medycyna Praktyczna, Kraków, 2015: 1112–1115
11. Wei S.C., Tatti K., Cushing K., i wsp.: Effectiveness of adolescent and adult tetanus, reduced-dose diphtheria, and acellular pertussis vaccine against pertussis. Clin. Infect. Dis., 2010; 51: 315–321
12. Sheridan S.L., McCall B.J., Davis C.A. i wsp.: Acellular pertussis vaccine effectiveness for children during the 2009–2010 pertussis epidemic in Queensland. Med. J. Aust., 2014; 200: 334–338
13. Paisley R.D., Blaylock J., Hartzell J.D.: Whooping cough in adults: an update on a reemerging infection. Am. J. Med., 2012; 125: 141–143
14. Paradowska-Stankiewicz I., Rudowska J. Pertussis in Poland in 2012. Przegl. Epidemiol., 2014; 68: 205–207
15. von König C.H., Halperin S., Riffelmann M., Guiso N.: Pertussis of adults and infants. Lancet Infect. Dis., 2002; 2: 744–750
16. Profilaktyka inwazyjnej choroby meningokokowej u dzieci, młodzieży i dorosłych. Medycyna Praktyczna Pediatria WS 3/2015
17. Zapalenia płuc wywołane przez określony czynnik etiologiczny. W: Interna Szczeklika 2015. Kraków, Medycyna Praktyczna, 2015: 717
18. ECDC. Surveillance of invasive bacterial diseases in Europe, 2012. ecdc.europa.eu/en/publications/Publications/Surveillance%20of%20IBD%20in%20Europe%202012.pdf
19. Krajowy Ośrodek Referencyjny ds. Diagnostyki Zakażeń Ośrodkowego Układu Nerwowego (KOROUN). Inwazyjna choroba pneumokokowa w Polsce w 2014 roku. www.koroun.edu.pl/pdf/ICHP_2014.pdf
20. CDC. Estimates of deaths associated with seasonal influenza – United States, 1976–2007. MMWR Morb. Mortal Wkly. Rep. 2010; 59: 1057–1062
21. Thompson W.W., Shay D.K., Weintraub E. i wsp.: Mortality associated with influenza and respiratory syncytial virus in the United States. JAMA, 2003; 289: 179–186
22. Thompson W.W., Shay D.K., Weintraub E. i wsp.: Influenza-associated hospitalizations in the United States. JAMA, 2004; 292: 1333–40
23. Govaert T.M., Thijs C.T., Masurel N. i wsp.: The efficacy of influenza vaccination in elderly individuals: a randomized double-blind placebo-controlled trial. JAMA, 1994; 272: 1661–1665
24. Gross P.A., Hermogenes A.W., Sacks H.S. i wsp.: The efficacy of influenza vaccine in elderly persons a meta-analysis and review of the literature. Ann. Intern. Med., 1995; 23: 518–527
25. Vu T., Farish S., Jenkins M., Kelly H. A meta-analysis of effectiveness of influenza vaccine in persons aged 65 years and over living in the community. Vaccine, 2002; 20: 1831–1836
26. Jefferson T., Di Pietrantonj C,. Al-Ansary L.A. i wsp.: Vaccines for preventing influenza in the elderly. Cochrane Database Syst. Rev., 2010; 17: CD004 876.
27. Richardson M.D. Medvedeva E.L., Roberts C.B. i wsp.: Comparative effectiveness of high-dose versus standard-dose influenza vaccination in community-dwelling veterans. Clin. Infect. Dis., 2015, doi: 10.1093/cid/civ261
28. CDC: Active Bacterial Core Surveillance (ABCs) Report Emerging Infections Program Network Streptococcus pneumoniae, 2013. www.cdc.gov/abcs/reports-findings/survreports/spneu13.pdf
29. World Health Organization: 23valent pneumococcal polysaccharide vaccine. WHO position paper. Wkly. Epidemiol. Rec., 2008; 83: 373–384
30. Watson L., Wilson B.J., Waugh N. Pneumococcal polysaccharide vaccine: a systematic review of clinical effectiveness in adults. Vaccine, 2002; 20: 2166–2173
31. Moberley S.A., Holden J., Tatham D.P., Andrews R.M. Vaccines for prevention pneumococcal infections in adults. Cochrane Library Database Syst. Rev., 2008; 1: CD000 423
32. Huss A. Scott P., Stuck A.E. i wsp.: Efficacy of pneumococcal polysaccharide vaccination in adults: a metaanalysis. CMAI, 2009; 180: 48–58
33. Bonten M.J.M., Huijts S.M., Bolkenbaas M. i wsp.: Polysaccharide conjugate vaccine against pneumococcal pneumonia in adults. N. Engl. J. Med., 2015; 372: 1114–1125
34. Załącznik do komunikatu Głównego Inspektora Sanitarnego z dnia 16 października 2015 r. w sprawie Programu Szczepień Ochronnych na rok 2016. Dziennik Urzędowy Ministra Zdrowia, poz. 63 (19 października 2015 r.)
35. Pilkinto A.M., Talbot H.K. Update on vaccination guidelines for older adults. J. Am. Geriatr. Soc., 2015; 63: 584–588
36. Prevention and control of influenza with vaccines: recommendations of the Advisory Committee on Immunization Practices (ACIP), 2009. MMWR Morb. Mortal. Wkly Rep., 2010; 59: 1–64
37. Kobayashi M., Bennett N.M., Gierke R. i wsp.: PPSV-23 Intervals between PCV13 and PPSV23 vaccines: recommendations of the Advisory Committee on Immunization Practices (ACIP). Morb. Mortal. Wkly. Rep., 2015; 64: 944–947
38. Muller L.M., Gorter K.J., Hak E. i wsp.: Increased risk of common infections in patients with type 1 and type 2 diabetes mellitus. Clin. Infect. Dis., 2005; 41: 281–8
39. Gupta S., Koirala J., Khardori R. i wsp.: Infections in diabetes mellitus and hyperglycemia. Infect. Dis. Clin. North Am., 2007; 21: 617–38
40. Seshasai S.R., Kaptoge S., Thompson A. i wsp.: Diabetes mellitus, fasting glucose, and risk of cause-specific death. N. Engl. J. Med., 2011; 364: 829–41
41. Lau D., Eurich D.T., Majumdar S.R. i wsp.: Working age adults with diabetes experience greater susceptibility to seasonal influenza: a population based cohort study. Diabetologia, 2014; 57: 690–698
42. Lau D., Eurich D.T., Majumdar S.R. i wsp.: Effectiveness of influenza vaccination in working-age adults with diabetes: a population-based cohort study. Thorax, 2013; 68: 658–63
43. Remschmidt C., Wichmann O., Harder T.: Vaccines for the prevention of seasonal influenza in patients with diabetes: systematic review and meta-analysis. BMC Med., 2015; 13: 53
44. Demicheli V., Jefferson T., Al-Ansary L.A. i wsp.: Vaccines for preventing influenza in healthy adults. Cochrane Database Syst, Rev., 2014; 3: CD001 269
45. Seo Y.B., Baek J.H., Lee J i wsp.: Long-term immunogenicity and safety of a conventional influenza vaccine in patients with type 2 diabetes. Clin. Vaccine Immunol., 2015; 22: 1160–5
46. Use of hepatitis B vaccination for adults with diabetes mellitus: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Morb. Mortal. Wkly Rep., 2011; 60: 1709–1711
47. Institute of Medicine. Board on Population Health and Public Health Practice. Adverse effects of vaccines: evidence and causality. Washington, DC, National Academies Press, 2012
48. Torres A., Blasi F., Dartois N. i wsp.: Which individuals are at increased risk of pneumococcal disease and why? Impact of COPD, asthma, smoking, diabetes, and/or chronic heart disease on community-acquired pneumonia and invasive pneumococcal disease. Thorax, 2015; 70: 984–989
49. Grohskopf L.A., Sokolow L.Z., Olsen S.J. i wsp.: Prevention and control of influenza with vaccines: recommendations of the Advisory Committee on Immunization Practices, United States, 2015–16 influenza season. MMWR Morb. Mortal. Wkly Rep., 2015; 64: 818–825
50. CDC. Use of 13-valent pneumococcal conjugate vaccine and 23-valent pneumococcal polysaccharide vaccine for adults with immunocompromising conditions: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR, 2012; 61: 816–819
51. Polskie Towarzystwo Diabetologiczne. Zalecenia kliniczne dotyczące postępowania u chorych na cukrzycę 2015. Diab. Klin., 2015: 4 (supl. A)
52. Vandecasteele S.J., Ombelet S., Blumental S. i wsp.: The ABC of pneumococcal infections and vaccination in patients with chronic kidney disease. Clin. Kidney J., 2015; 8: 318–324
53. Esposito S., Mastrolia M.V., Prada E. i wsp.: Vaccine administration in children with chronic kidney disease. Vaccine, 2014; 32: 6601–6606
54. United States Renal Data System. www.usrds.org/2015/view/v1_03.aspx (cyt. 29.01.2016)
55. Van Kerkhove M.D., Vandemaele K.A., Shinde V. i wsp.: Risk factors for severe outcomes following 2009 influenza A (H1N1) infection: a global pooled analysis. PLoS Med., 2011; 8: e1 001 053
56. Janus N., Vacher L-V., Karie S. i wsp.: Vaccination and chronic kidney disease. Nephrol. Dial. Transplant, 2008; 23: 800–807
57. Gilbertson D.T., Unruh M., McBean A.M. i wsp.: Influenza vaccine delivery and effectiveness in end-stage renal disease. Kidney Int., 2003; 63: 738–743
58. Remschmidt C., Wichmann O., Harder T.: Influenza vaccination in patients with end-stage renal disease: systematic review and assessment of quality of evidence related to vaccine efficacy, effectiveness, and safety. BMC Med., 2014; 12: 244
59. Wang I.K., Lin C.L., Lin P.C. i wsp.: Effectiveness of influenza vaccination in patients with end-stage renal disease receiving hemodialysis: a population-based study. PLoS One, 2013; 8: e58 317
60. Grzegorzewska A.E. i wsp.: Hepatitis B vaccination in chronic kidney disease: review of evidence in non-dialyzed patients. Hepat. Mon., 2012; 12: e7359
61. Gilbertson D.T., Guo H., Arneson T.J. i wsp.: The association of pneumococcal vaccination with hospitalization and mortality in hemodialysis patients. Nephrol. Dial. Transplant., 2011; 26: 2934–2939
62. Charakterystyki produktów leczniczych: Engerix B, Euvax B
63. Gurfinkel E., de la Fuente R., Mendiz O.: Influenza vaccine pilot study in acute coronary syndromes and planned percutaneous coronary interventions: the FLU Vaccination Acute Coronary Syndromes (FLUVACS) Study. Circulation, 2002; 105: 2143–2147
64. Ciszewski A., Bilinska Z., Brydak L. i wsp.: Influenza vaccination in secondary prevention from coronary ischemic events in coronary artery disease: FLUCAD study. Eur. Heart J., 2008; 29 (11): 1350–1358
65. Udell J.A., Zawi R., Bhatt L. i wsp.: Association between influenza vaccination and cardiovascular outcomes in high-risk patients – a meta-analysis. JAMA, 2013; 310: 1711–1720
66. Clar C., Oseni Z., Flowers N. i wsp.: Influenza vaccines for preventing cardiovascular disease. Cochrane Database of Systematic Reviews.2015; 5: CD005 050
67. Corrales-Medina V.F., Suh K.N., Rose G. i wsp.: Cardiac complications in patients with community-acquired pneumonia: a systematic review and meta-analysis of observational studies. PLoS Med., 2011; 8: e1 001 048
68. Vlachopoulos C.V., Terentes-Printzios D.G., Aznaouridis K.A. i ws.: Association between pneumococcal vaccination and cardiovascular outcomes: a systematic review and meta-analysis of cohort studies. Eur. J. Prev. Cardiol., 2015; 22: 1185–99
69. www.gov.uk/government/collections/immunisation-against-infectious-disease-the-green-book
70. Arvaniti V., D’Amico G., Fede G. i wsp.: Infections in patients with cirrho-sis increase mortality four-fold and should be used in determining prognosis., Gastroenterol., 2010; 139: 1246–56, 1256 e1241-1245
71. Krogsgaard K., Wantzin P., Mathiesen L., Ring-Larsen H. Chronic evolution of acute hepatitis B: the significance of simultaneous infections with hepatitis C and D. Copenhagen Hepatitis Acuta Programme. Scand. J. Gastroenterol., 1991; 26: 275–280
72. Gaeta G.B., Stornaiuolo G., Precone D.F. i wsp.: Immunogenicity and safety of an adjuvanted influenza vaccine in patients with decompensated cirrhosis. Vaccine, 2002; 20 (supl. 5): B33–5
73. Gaeta G.B., Pariani E., Amendola A. i wsp.: Influenza vaccination in patients with cirrhosis and in liver transplant recipients. Vaccine, 2009; 27: 3373–5
74. Soesman N.M., Rimmelzwaan G.F., Nieuwkoop N.J. i wsp.: Efficacy of influenza vaccination in adult liver transplant recipients. J. Med. Virol., 2000; 61: 85–93
75. Lawal A., Basler C., Branch A. i wsp.: Influenza vaccination in orthotopic liver transplant recipients: absence of post administration ALT elevation. Am. J. Transplant., 2004; 4: 1805–1809
76. McCashland T.M., Preheim L.C., Gentry M.J. Pneumococcal vaccine response in cirrhosis and liver transplantation. J. Infect. Dis., 2000; 181: 757–60
77. Pirovino M., Lydick E., Grob P.J. i wsp.: Pneumococcal vaccination: the response of patients with alcoholic liver cirrhosis. Hepatology, 1984; 4: 946
78. van Thiel D.H., El-Ashmawy L., Love K. i wsp.: Response to hepatitis B vaccination by liver transplant candidates. Dig. Dis. Sci., 1992; 37: 1245–1249
79. Mendenhall C., Roselle G.A., Lybecker L.A. i wsp.: Hepatitis B vaccination. Response of alcoholic with and without liver injury. Dig. Dis Sci., 1988; 33: 263–269
80. Chalasani N., Smallwood G., Halcomb J. i wsp.: Isvaccination against hepatitis B infection indicated in patients wait- ing for or after orthotopic liver transplantation? Liver Transplant. Surg., 1998; 4: 128–132
81. Leise M.D., Talwalkar J.A.: Immunizations in chronic liver disease: what should be done and what is the evidence. Curr. Gastroenterol. Rep., 2013; 15: 300
82. Keeffe E.B. Is hepatitis A more severe in patients with chronic hepatitis B and other chronic liver diseases? Am. J. Gastroenterol. 1995; 90: 201–205
83. Arguedas M.R., Johnson A., Eloubeidi M.A., Fallon M.B. Immunogenicity of hepatitis A vaccination in decompensated cirrhotic patients. Hepatology, 2001; 34: 28–31
84. Lok A.S., McMahon B.J. Chronic hepatitis B: update 2009. Hepatology, 2009; 50: 661–662 Ghany M.G., Strader D.B., Thomas D.L., Seeff L.B. Diagnosis, management, and treatment of hepatitis C: an update. Hepatology, 2009; 49: 1335–1374
85. Rubin L.G., Levin M.J., Ljungman P. i wsp.: 2013 IDSA Clinical Practice Guideline for vaccination of the immunocompromised host. Clin. Infect. Dis., 2014; 58: 309–318. www.mp.pl/szczepienia/artykuly/wytyczne/
86. Nichol K.L., Baken L., Nelson A.: Relation between influenza vaccination and outpatient visits, hospitalization, and mortality in elderly persons with chronic lung disease. Ann. Intern. Med. 1999; 130: 397–403
87. Poole P.J., Chacko E., Wood-Baker R.W. i wsp.: Influenza vaccine for patients with chronic obstructive pulmonary disease. Cochrane Database Syst. Rev. 2006; 25: CD002 733
88. Cates C.J., Rowe B.H.: Vaccines for preventing influenza in people with asthma. Cochrane Database Syst. Rev. 2013; 2: CD000 364
89. Bueving H.J., Bernsen R.M., de Jongste J.C. i wsp.: Influenza vaccination in children with asthma: randomized double-blind placebo-controlled trial. Am. J. Respir. Crit. Care Med. 2004; 169: 488–493
90. Kramarz P., DeStefano F., Gargiullo P.M. i wsp.: Does influenza vaccination prevent asthma exacerbations in children? J. Pediatr., 2001; 138: 306–310
91. Alfageme I., Vazquez R., Reyes N. i wsp.: Clinical efficacy of anti-pneumococcal vaccination in patients with COPD. Thorax, 2006; 61: 189–195
92. Walters J.A., Smith S., Poole P. i wsp.: Injectable vaccines for preventing pneumococcal infection in patients with chronic obstructive pulmonary disease. Cochrane Database Syst. Rev., 2010; 11: CD001 390
93. Vila-Corcoles A., Salsench E., Rodriguez-Blanco T. i wsp.:. Clinical effectiveness of 23-valent pneumococcal polysaccharide vaccine against pneumonia in middle-aged and older adults: a matched case-control study. Vaccine, 2009; 27: 1504–1510
94. Dominguez A., Izquierdo C., Salleras L. i wsp.: Working group for the study of prevention of CAP in the elderly. Effectiveness of the pneumococcal polysaccharide vaccine in preventing pneumonia in the elderly. Eur. Respir. J., 2010; 36: 608–614
95. Ochoa-Gondar O., Vila-Corcoles A., Ansa X. i wsp.: Effectiveness of pneumococcal vaccination in older adults with chronic respiratory diseases: results of the EVAN-65 study. Vaccine, 2008; 26: 1955–1962
96. Schembri S., Morant S., Winter J.H. i wsp.: Influenza but not pneumococcal vaccination protects against all-cause mortality in patients with COPD. Thorax, 2009; 64: 567–572
97. Global Initiative for Chronic Obstructive Lung Disease Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2015 update. www.goldcopd.org/uploads/users/files/GOLD_Report_2015_Apr2.pdf
98. Keller-Stanislawski B., Englund J.A., Kang G. i wsp.: Safety of immunization during pregnancy: a review of the evidence of selected inactivated and live attenuated vaccines. Vaccine, 2014; 32: 7057–7064
99. Munoz F.M.: Maternal immunization: an update for pediatricians. Pediatr.Ann., 2013; 42: 153–158
100. Forsyth K., Plotkin S., Tan T. i wsp.: Strategies to decrease pertussis transmission to infants. Pediatrics, 2015; 135: e1475–1482
101. Amirthalingam G., Andrews N., Campbell H. i wsp: Effectiveness of maternal pertussis vaccination in England: an observational study. Lancet, 2014; 384: 1521–1528
102. http://www.mp.pl/szczepienia/przeglad/blonicakrztusiectezec/
103. Dabrera G., Amirthalingam G., Andrews N.i wsp.: A case-control study to estimate the effectiveness of maternal pertussis vaccination in protecting newborn infants in England and Wales, 2012–2013. Clini. Infect. Dis., 2015; 60: 333–337
104. http://www.mp.pl/szczepienia/przeglad/blonicakrztusiectezec/
105. Donegan K, King B., Bryan P.: Safety of pertussis vaccination in pregnant women in UK: observational study. BMJ, 2014; 349: g4219
106. http://www.mp.pl/szczepienia/przeglad/blonicakrztusiectezec/show.html?id=117227
107. Kharbanda E.O., Vazquez-Benitez G., Lipkind H.S. i wsp.: Evaluation of the association of maternal pertussis vaccination with obstetric events and birth outcomes. JAMA, 2014; 312: 1897–1904
108. Kharbanda E.O., Vazquez-Benitez G., Lipkind H.S. i wsp.: Maternal Tdap vaccination: Coverage and acute safety outcomes in the Vaccine Safety Datalink, 2007–2013. Vaccine, 2016; 34: 968–973
109. Sukumaran L., McCarthy N.L., Kharbanda E.O. i wsp.: Association of Tdap vaccination with acute events and adverse birth outcomes among pregnant women with prior tetanus-containing immunizations. JAMA, 2015; 314: 1581–1587
110. Meijer W.J., van Noortwijk A.G., Bruinse H.W. i wsp.: Influenza virus infection in pregnancy: a review. Acta Obstet. Gynecol. Scand., 2015; 94: 797–819
111. Ahrens K.A., Louik C., Kerr S. i wsp.: Seasonal influenza vaccination during pregnancy and the risks of preterm delivery and small for gestational age birth. Paediatr. Perinat. Epidemiol., 2014; 28: 498–509
112. Bratton K.N., Wardle M.T., Orenstein W.A. i wsp.:Maternal influenza immunization and birth outcomes of stillbirth and spontaneous abortion: a systematic review and meta-analysis. Clin. Infect. Dis., 2015; 60: e11–19
113. Zaman K., Roy E., Arifeen S.E. i wsp.: Effectiveness of maternal influenza immunization in mothers and infants. N. Engl. J. Med., 2008; 359: 1555–1564
114. Update on immunization and pregnancy: tetanus, diphtheria, and pertussis vaccination www.acog.org/Resources_And_Publications/Committee_Opinions/Committee_on_Obstetric_Practice/Update_on_Immunization_and_Pregnancy_Tetanus_Diphtheria_and_Pertussis_Vaccination
115. www.gov.uk/government/publications/whooping-cough-vaccination-programme-for-pregnant-women-extension-to-2014
116. Ding H., Black C.L., Ball S. i wsp.: Influenza vaccination coverage among pregnant women – United States, 2014–15 influenza season. MMWR Morb. Mortal.Wkly Rep., 2015; 64: 1000–1005
117. McLean H.Q., Fiebelkorn A.P., Temte J.L. i wsp.: Prevention of measles, rubella, congenital rubella syndrome, and mumps, 2013: summary recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm. Rep., 2013; 62: 1–34
118. Immunization of health-care personnel. Recommendations of the Advisory Committee on Immunization Practices oraz Prevention (ACIP). MMWR Recomm. Rep., 2011; 60: 1–45
119. Profilaktyka inwazyjnej choroby meningokokowej u dzieci, młodzieży i dorosłych. WS Pediatria 3/2015
120. Apter D., Wheeler C.M., Paavonen J. i wsp.: Efficacy of human of papillomavirus 16 and 18 (HPV-16/18) AS04-adjuvanted vaccine against cervical infection and precancer in young women: final event-driven analysis of the randomised, double-blind PATRICIA trial. Clin. Vaccine Immunol., 2015; 22: 361–373 www.mp.pl/szczepienia/przeglad/hpv/

























