Epidemiologia
Drogi zakażeniaDo zakażenia wirusem zapalenia wątroby typu A (HAV) dochodzi głównie drogą oralno–fekalną w wyniku kontaktu bezpośredniego z chorą osobą lub spożycia skażonej żywności, lub wody. Możliwe jest również, choć zdarza się to bardzo rzadko, zakażenie w wyniku przetoczenia preparatu krwi uzyskanej od dawcy w okresie wiremii HAV.
Znaczenie dzieci w szerzeniu się zakażenia
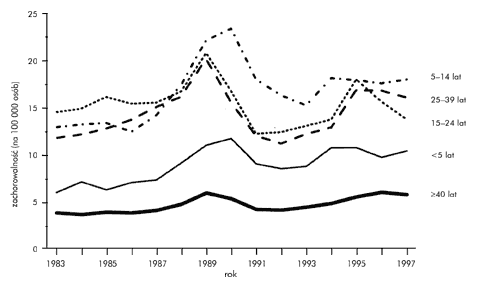
Zakażenie HAV u większości dzieci – w odróżnieniu od osób dorosłych – przebiega bezobjawowo lub skąpoobjawowo, dlatego stanowią one ważne ródło zakażenia i odgrywają podstawową rolę w szerzeniu się tego wirusa. Zachorowalność na wirusowe zapalenie wątroby typu A (WZW A) jest największa w wieku 5–14 lat (rys. 1.) – prawie 1/3 wszystkich zachorowań dotyczy dzieci do 15. roku życia.
Grupy zwiększonego ryzyka zachorowania na WZW A
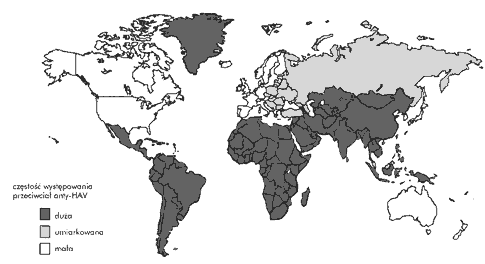
Osoby wyjeżdżające do krajów o zwiększonej zapadalności na WZW A. Obywatele państw uprzemysłowionych podróżujący do krajów rozwijających się o dużym wskaźniku zachorowań na WZW A (rys. 2.) są szczególnie narażeni na zakażenie HAV. Do grupy tej należą turyści, wojskowi i osoby wyjeżdżające do pracy lub podejmujące naukę. Ryzyko zakażenia zależy od kraju, do którego wyjeżdżamy, oraz długości pobytu; badania prospektywne wykazały, że wśród osób, którym nie podano profilaktycznie immunoglobuliny (gammaglobuliny), ryzyko zwiększa się w trakcie każdego miesiąca pobytu o 0,3–0,5%. Chorują nawet te osoby, które przestrzegają podstawowych zasad zapobiegania zakażeniom szerzącym się drogą oralno–fekalną i przebywają tylko w rejonach miejskich, i(lub) luksusowych hotelach. W USA około 1/3 takich zachorowań dotyczy dzieci.
Chorzy na hemofilię i inne dziedziczne niedobory czynników krzepnięcia. W latach 1992–1993 wystąpiło w Europie kilka epidemii WZW A wśród chorych na hemofilię, którzy otrzymali koncentraty czynnika VIII przygotowane z osocza poddawanego w procesie produkcji działaniu rozpuszczalnych detergentów, a pobranego prawdopodobnie od dawców w okresie inkubacji WZW A. W latach 1995–1996 epidemie takie opisano także w USA wśród chorych leczonych koncentratami czynnika VIII lub IX (również poddanych tylko obróbce chemicznej).
Chorzy na przewlekłe choroby wątroby. Chociaż zachorowalność na WZW A w tej grupie nie jest zwiększona, znacznie zwiększa się ryzyko wystąpienia piorunującego zapalenia wątroby w razie zakażenia HAV.
Inne okoliczności zwiększające ryzyko zakażenia HAV. Do grupy zwiększonego ryzyka zachorowania na WZW A należą także narkomani, mężczy ni utrzymujący kontakty homoseksualne oraz osoby zajmujące się małpami naczelnymi urodzonymi na wolności (zwierzęta te są wrażliwe na zakażenie HAV i mogą stanowić ródło zakażenia).
Uzasadnienie zapobiegania zachorowaniom na WZW A poprzez rutynowe szczepienia
Zachorowalność na WZW A w USA (a także wielu innych krajach wysoko rozwiniętych – przyp. red.) znacznie się zmniejszyła w ciągu kilku minionych dziesięcioleci, głównie w wyniku poprawy warunków sanitarnych i higieny społeczeństwa (lepsza czystość wody pitnej, nowoczesne systemy kanalizacji i oczyszczania ścieków, kontrola nad skażeniem żywności, mniejsze zagęszczenie ludności, itp.). Niemniej jednak WZW A jest nadal jedną z najczęściej występujących w USA chorób, którym można zapobiegać poprzez szczepienia, a okresowe wybuchy epidemii dowodzą, że jest to nadal poważny problem zdrowia publicznego.
Dostępność skutecznych i bezpiecznych szczepionek przeciwko WZW A stwarza możliwość znacznego zmniejszenia zachorowalności, a prawdopodobnie także całkowitej eliminacji (eradykacji) zakażeń. Charakterystyki epidemiologiczne WZW A i nagminnego porażenia dziecięcego (poliomyelitis) są podobne, co pozwala przypuszczać, że zachorowalność na WZW A będzie można znamiennie ograniczyć, jeśli masowe szczepienia ochronne obejmą tę grupę wiekową populacji, w której wskaźnik zachorowań jest największy, i które są głównym ródłem zakażeń. Zwiększenie populacji odpornej na zakażenie ograniczy zachorowalność na WZW A oraz liczbę osób wydalających HAV w stolcu, co pozwoli zmniejszyć ryzyko zakażenia podatnych osób.
Ze względu na duży wskaźnik zachorowalności i podstawowe znaczenie w szerzeniu się zakażenia HAV, program szczepień ochronnych powinien obejmować przede wszystkim dzieci. Rutynowe szczepienie dzieci przeciwko WZW A pozwoli: a) ograniczyć zachorowania w grupie o największym wskaźniku zachorowalności; b) wyeliminować podstawowe ródło zakażenia starszych dzieci i niektórych dorosłych; c) w przyszłości, gdy zaszczepione dzieci wejdą w dorosłe życie, zapobiegać także zakażeniom u dorosłych osób, ponieważ szczepienie zapewnia długotrwałą odporność.
Nie opracowano jeszcze odpowiedniej szczepionki ani schematu szczepienia, które można byłoby skutecznie stosować u dzieci do ukończenia 2. roku życia, dlatego rutynowymi szczepieniami należy objąć dzieci, które ukończyły 2 lata.
Szczepionki przeciwko WZW A
W większości krajów (w tym także w Polsce – przyp. red.) dostępne są wyłącznie inaktywowane szczepionki przeciwko WZW A, gdyż tylko takie preparaty poddano ocenie w badaniach klinicznych z grupą kontrolną. Zawierają one inaktywowane formaliną i adsorbowane na wodorotlenku glinu (adjuwant) cząsteczki szczepów HAV, które zaadaptowano do replikacji w hodowli fibroblastów ludzkich, a po namnożeniu oczyszczono na drodze ultrafiltracji i chromatografii. Dostępne preparaty oraz schemat szczepienia przedstawiono w tabeli 1.
Immunogenność. Zarejestrowane inaktywowane szczepionki charakteryzują się dużą immunogennością u dorosłych i dzieci. Ochronne miano swoistych przeciwciał 1 miesiąc po pierwszej dawce szczepienia można stwierdzić u 94–100% dorosłych osób i 97–100% dzieci w wieku 2–18 lat, natomiast u wszystkich dochodzi do wytworzenia dużego miana swoistych przeciwciał po szczepieniu przypominającym (druga dawka).
Przeciwciała neutralizujące wykryto u 54–62% dorosłych osób już 2 tygodnie po podaniu pierwszej dawki, a 1 miesiąc po zaszczepieniu stwierdzono je u 94–100%. Szczepionki są również wystarczająco immunogenne u niemowląt i dzieci w wieku poniemowlęcym, u których nie występują nabyte biernie od matki przeciwciała anty–HAV. Przeciwciała te mogą znamiennie osłabić odpowied na szczepienie dzieci w tym wieku, dlatego zaleca się, aby dzieci szczepić dopiero po ukończeniu 2 lat.
Skuteczność. W badaniu z randomizowaną grupą kontrolną przeprowadzonym metodą podwójnie ślepej próby z placebo, którym objęto 40 000 dzieci (1.–16. rż.) mieszkających w Tajlandii w rejonach o dużej zachorowalności na WZW A, wykazano, że dwie dawki szczepionki Havrix (360 j. ELISA [EL.U] każda) zabezpieczyły przed zachorowaniem na WZW A 94% dzieci (95% przedział ufności [95% CI]: 79–99%).
Taką samą metodę zastosowano w badaniu przeprowadzonym w Nowym Jorku, w populacji o dużym wskaźniku zachorowań na WZW A. Objęto nim 1000 dzieci w wieku 2–16 lat, które zaszczepiono jedną dawką (25 j.) preparatu Vaqta. Względne zmniejszenie ryzyka (RRR) zachorowania na WZW A wynosiło 100% (dolna granica 95% CI: 87%).
Jedno badanie przeprowadzone we Włoszech wykazało, że szczepienie po kontakcie domowym z chorym na WZW A zmniejsza ryzyko zakażenia HAV o 79% (95% CI: 7–95% [p. Med. Prakt. Ped. 2/2000, s. 43–45 – przyp. red.]). Badaniem objęto jednak zbyt małą populację, a 95% CI był bardzo duży, dlatego nie można jeszcze zalecić stosowania tej metody profilaktyki po narażeniu na zakażenie. Nie wiadomo również, czy szczepienie po kontakcie z chorym jest skuteczniejsze niż standardowo zalecane wstrzyknięcie gammaglobuliny.
Wyniki wielu badań dowodzą, że szczepienie dzieci w wieku 2–16 lat jest skuteczną metodą opanowywania epidemii WZW A w populacjach o dużym i umiarkowanym wskaźniku zachorowań. Dalszego wyjaśnienia wymaga jednak odpowied na pytanie, czy samo szczepienie (tzn. bez stosowania gammaglobuliny) może być metodą opanowania epidemii WZW A w przedszkolach.
Czas utrzymywania się odporności poszczepiennej. Badania kinetyki stężenia swoistych przeciwciał anty–HAV wykazały, że ochronne miano przeciwciał może się utrzymywać nawet przez ponad 20 lat po szczepieniu. Nie wiadomo, czy inne mechanizmy, takie jak odporność komórkowa, również mają znaczenie w długotrwałym zabezpieczeniu przed zachorowaniem. Jednoznacznych dowodów trwałości odporności poszczepiennej dostarcza jednak tylko długotrwała obserwacja po szczepieniu. Badania, którymi objęto dzieci, świadczą, że WZW A nie występuje do 7 lat po szczepieniu. Kontynuacja tych obserwacji pozwoli na określenie, czy konieczne będzie szczepienie przypominające.
Wymienne stosowanie szczepionek przeciwko WZW A. Wyniki przeprowadzonych dotychczas badań świadczą, że preparaty Havrix i Vaqta można stosować u dorosłych zamiennie, bez ryzyka niekorzystnego wpływu na uzyskiwane po szczepieniu miano przeciwciał anty–HAV. Optymalnie należy przestrzegać schematu szczepienia zalecanego przez producenta, ale badania immunogenności obu preparatów dowodzą, że pod tym względem są one równoważne.
Czynniki zmniejszające immunogenność. Immunogenność szczepionek przeciwko WZW A jest znamiennie mniejsza u niemowląt, u których stwierdza się przeciwciała anty–HAV nabyte od matki. Natomiast gammaglobulina wstrzykniętą i.m. w inne miejsce niż szczepionka nie zmniejsza wprawdzie odsetka dorosłych osób wytwarzających swoiste przeciwciała anty–HAV, ale powoduje, że ich miano 1 miesiąc po szczepieniu jest znamiennie mniejsze niż u osób, którym nie podano gammaglobuliny. Miano to jest jednak 100 razy większe niż miano ochronne, dlatego wydaje się, że efekt ten nie ma praktycznego znaczenia.
Miano przeciwciał anty–HAV po szczepieniu jest również mniejsze u nosicieli HIV, pacjentów z przewlekłą chorobą wątroby oraz zdrowych osób po 40. roku życia.
Równoczesne stosowanie innych szczepionek. Badania przeprowadzone u dorosłych nie wykazały, aby istniała niekorzystna interakcja między szczepieniem przeciwko WZW A a innymi równocześnie stosowanymi szczepionkami, takimi jak szczepionki przeciwko: WZW B, błonicy, poliomyelitis (doustna [OPV] i inaktywowana [IPV]), tężcowi, durowi brzusznemu (doustna i domięśniowa), wściekli nie i żółtej gorączce. Równoczesne stosowanie tych preparatów nie zwiększa również ryzyka wystąpienia niepożądanych odczynów poszczepiennych.
Niepożądane odczyny poszczepienne. Nie zaobserwowano poważnych odczynów poszczepiennych znamiennie związanych z inaktywowanymi szczepionkami przeciwko WZW A. Najczęściej zgłaszane niepożądane odczyny u dzieci i dorosłych, to dolegliwości w miejscu wstrzyknięcia (ból, zaczerwienienie, stwardnienie, obrzęk) i ból głowy, które występują do 3 dni po szczepieniu.
Przeciwwskazania. Szczepionek przeciwko WZW A nie powinno się stosować u osób uczulonych na składniki preparatu (należy zapoznać się ze szczegółowym składem preparatu podanym w ulotce producenta) lub tych, u których wystąpił poważny odczyn po pierwszej dawce. Nie oceniono bezpieczeństwa stosowania inaktywowanych szczepionek u kobiet ciężarnych, dlatego w tych przypadkach należy zachować szczególną ostrożność – można wykonać szczepienie, jeśli w uznaniu lekarza korzyści będą większe niż ryzyko szczepienia (które w przypadku inaktywowanego preparatu jest teoretycznie małe).
Badanie serologiczne przed szczepieniem. Nie zaleca się wykonywania przesiewowego badania przeciwciał anty–HAV w surowicy u dzieci przed szczepieniem. Postępowanie to zwiększa koszt, gdyż u większości dzieci, które nie chorowały na WZW A lub nie były szczepione, nie stwierdza się swoistych przeciwciał, a zaszczepienie tych, które są już odporne (chorowały na WZW A lub były szczepione), nie powoduje niekorzystnych odczynów poszczepiennych. Ocena anty–HAV w surowicy może być natomiast przydatna u niektórych dorosłych osób (np. >40. rż., mieszkających na obszarze o dużym wskaźniku zachorowań na WZW A), jeśli koszt badania jest znacznie mniejszy niż koszt serii szczepienia.
Wskazania do szczepienia
Zaleca się rutynowe szczepienie przeciwko WZW A następujących grup:
- dzieci mieszkających w regionach o dużej (>=20/100 000/rok) i umiarkowanej (10–20/100 000/rok) zachorowalności na WZW A; (w Polsce w 1997 roku wskaźnik zachorowalności wynosił 10,47/100 000; w nowym kalendarzu szczepień obowiązującym w Polsce od 25 lipca 2000 r. szczepienie dzieci przeciwko WZW A – najlepiej przed rozpoczęciem nauki w szkole podstawowej – znalazło się w grupie szczepień zalecanych niefinansowanych z puli Ministerstwa Zdrowia – przyp. red.);
- osób wyjeżdżających do krajów o dużym wskaźniku zachorowań na WZW A (rys. 2.);
- pacjentów z przewlekłą chorobą wątroby (z wykluczeniem przewlekłych nosicieli HBV i HCV, u których nie doszło do poważnego uszkodzenia wątroby);
- chorych na hemofilię (szczególnie leczonych preparatami czynników krzepnięcia poddanych w procesie produkcji wyłącznie obróbce chemicznej);
- narkomanów;
- mężczyzn utrzymujących stosunki homoseksualne (w tym młodzieży).
Szczepienie przed wyjazdem zagranicznym. Szczepienie odpowiednią dla wieku dawką (tab. 1.) jest preferowaną metodą zapobiegania zachorowaniom na WZW A u osób wyjeżdżających do krajów o dużej zapadalności na tę chorobę (rys. 2.). Pierwsze szczepienie należy wykonać co najmniej 4 tygodnie przed planowanym wyjazdem, aby osiągnąć wystarczające uodpornienie. Dwa tygodnie po pierwszej dawce aż 40–45% osób nie wytwarza jeszcze przeciwciał neutralizujących i nie przeprowadzono dotychczas badań dowodzących, że jest to wystarczający czas, aby maksymalnie zmniejszyć ryzyko zachorowania w trakcie wyjazdu.
Dlatego wszystkim osobom, które są szczepione pó niej niż 4 tygodnie przed wyjazdem, wraz podaniem pierwszej dawki szczepionki należy wstrzyknąć domięśniowo gammaglobulinę, ale w inne miejsce niż szczepionkę (tab. 2.). Drugie szczepienie wykonuje się zgodnie ze schematem zalecanym przez producenta. Wstrzyknięcie gammaglobuliny (tab. 2.) jest podstawową metodą profilaktyki stosowaną przed wyjazdem u dzieci do 2. roku życia, u osób uczulonych na składniki szczepionki lub odmawiających zgody na szczepienie.
Tabela 1. Niektóre szczepionki przeciwko WZW A oraz zalecany schemat szczepienia
| Preparat | Wiek (lata) | Dawka | Objętość (ml) | Wstrzyknięcie | Liczba dawek | Odstęp między dawkami (mies.) |
| Havrix | 2–18 >18 |
720 EL.U 1440 EL.U |
0,5 1 |
i.m. i.m. |
2 2 |
6–18 6 |
| Vaqta | 2–17 >17 |
25 U 50 U |
0,5 1 |
i.m. i.m. |
2 2 |
6–12 6 |
| Avaxim* | >15 | 160 j. antygenowych |
0,5 | i.m. | 2 | 6 |
*od Redakcji
EL.U.–jednostki ELISA, U–jednostki, i.m.–domięśniowo
Tabela 2. Zalecane dawkowanie gammaglobuliny w zapobieganiu zachorowaniom na WZW A przed i po narażeniu
| Rodzaj profilaktyki | Czas utrzymywania się uodpornienia (mies.) | Dawka (ml/kg)1 | Wstrzyknięcie2 |
| przed narażeniem3 | 1–2 3–5 |
0,02 0,064 |
i.m. i.m. |
| po narażeniu5 | – | 0,02 | i.m. |
1 Kobietom ciężarnym oraz niemowlętom należy podawać preparaty niezawierające tiomersalu.
2 Przeciwciała anty–HAV znajdują się również w preparatach dożylnych immunoglobulin, jednak nie stosuje się ich rutynowo w zapobieganiu zachorowaniom na WZW A.
3 U osób, które wyjeżdżają do krajów o dużej zapadalności na WZW A.
4 Gdy pobyt trwa dłużej, dawkę należy powtarzać co 5 miesięcy.
5 Gammaglobulina wstrzyknięta wrażliwej osobie do 2 tygodni po narażeniu na zakażenie (kontakcie z chorym) zmniejsza o 85% ryzyko zachorowania. Skuteczność jest tym większa, im wcześniej po kontakcie z chorym podano preparat. Postępowanie to zaleca się przede wszystkim nieszczepionym osobom po kontakcie domowym lub w przedszkolu, jeśli u chorego, który mógł być ródłem zakażenia, potwierdzono rozpoznanie WZW A (obecność IgM anty–HAV w surowicy).
(w oryginale 161 pozycji piśmiennictwa)
Opracował dr med. Jacek Mrukowicz















