Tłumaczyła lek. Iwona Rywczak
Konsultowała dr n. med. Hanna Czajka, Kierownik Poradni Chorób Zakaźnych w Wojewódzkim Specjalistycznym Szpitalu dziecięcym
im. św. Ludwika w Krakowie
Skróty: ACIP – Advisory Committee on Immunization Practices, IChP – inwazyjna choroba pneumokokowa, PCV-7 – 7-walentna skoniugowana szczepionka przeciwko pneumokokom, PCV-13 – 13-walentna skoniugowana szczepionka przeciwko pneumokokom, OPA – test opsonofagocytozy, PPSV-23 – 23-walentna polisacharydowa szczepionka przeciwko pneumokokom, PZP – pozaszpitalne zapalenie płuc
Jakie zalecenia obowiązywały do tej pory?
W 2010 r. ACIP zatwierdził poprawione zalecenia dotyczące szczepienia wszystkich osób >65. rż. szczepionką PPSV-23. W 2012 r. ACIP wydał zalecenia dotyczące stosowania szczepionki PCV-13 i PPSV-23 u dorosłych >19. rż. z niedoborami odporności.
Dlaczego zmieniono obecne zalecenia?
W 2011 r. FDA zatwierdził PCV-13 do stosowania u dorosłych ≥50 lat. W czerwcu 2014 r. ACIP otrzymał wyniki badania z randomizacją i placebo, w którym oceniono skuteczność PCV-13 w zapobieganiu zachorowaniom na pozaszpitalne zapalenie płuc u ok. 85 000 dorosłych >65. rż. Jakość danych dotyczących szczepień dorosłych szczepionką PCV-13 oceniono zgodnie z systemem GRADE, przypisując im typ 2 (umiarkowana jakość danych), a zaleceniu siłę kategorii A (tzn. zalecenie do powszechnego przestrzegania w tej grupie pacjentów – przyp. red.).
Jakie są nowe zalecenia?
Wszystkie osoby ≥65. rż. należy rutynowo szczepić przeciwko pneumokokom zarówno szczepionką PCV-13, jak i PPSV-23. Zalecenia dotyczące rutynowych szczepień PCV-13 w tej grupie wiekowej zostaną ponownie ocenione w 2018 r., a w razie konieczności ulegną modyfikacji. Zalecenia ACIP dotyczące rutynowych szczepień PCV-13 dorosłych >19. rż. z niedoborami odporności, czynnościowym lub anatomicznym brakiem śledziony, wyciekiem płynu mózgowo-rdzeniowego lub z wszczepionym implantem ślimakowym nie zmieniają się.
13 sierpnia 2014 roku amerykański Advisory Committee on Immunization Practices (ACIP) wydał zalecenie rutynowego stosowania 13-walentnej skoniugowanej szczepionki przeciwko pneumokokom (PCV-13 [Prevnar 13, Wyeth Pharmaceuticals, Inc., filia Pfizer, Inc.]; w Polsce dostępny jest preparat Prevenar 13 zarejestrowany u dzieci od 6. tyg.ż. i dorosłych – przyp. red.) u dorosłych w wieku ≥65 lat. PCV-13 należy stosować łącznie z 23-walentną polisacharydową szczepionką przeciwko pneumokokom (PPSV-23 [Pneumovax 23, Merck & Co., Inc.]; w Polsce dostępny jest preparat Pneumo 23 – przyp. red.), aktualnie zalecaną pacjentom z tej grupy wiekowej. Decyzją Food and Drug Administration (FDA) PCV-13 dopuszczono do użytku u dorosłych >50. roku życia pod koniec 2011 roku. W czerwcu 2014 roku ACIP otrzymał wyniki badania z randomizacją (przeprowadzonego metodą podwójnie ślepej próby – przyp. red.) i placebo, w którym oceniono skuteczność PCV-13 w zapobieganiu zachorowaniom na pozaszpitalne zapalenie płuc (PZP) u około 85 000 osób w wieku ≥65 lat wcześniej nieszczepionych przeciwko pneumokokom (badanie CAPiTA).1 Jakość danych dotyczących szczepienia dorosłych szczepionką PCV-13 oceniono zgodnie z systemem Grading of Recommendations, Assessment, Development, and Evaluation (GRADE), przypisując im typ 2 (umiarkowana jakość danych), a zaleceniu siłę kategorii A (tzn. zalecenie do powszechnego przestrzegania w tej grupie pacjentów – przyp. red.).2 W niniejszym dokumencie przedstawiono nowe zalecenia ACIP dotyczące stosowania PCV-13, wyjaśniono zalecenia dotyczące stosowania szczepionek PCV-13 i PPSV-23 u dorosłych w wieku ≥65 lat oraz podsumowano dane uwzględnione przez ACIP w procesie opracowywania zaleceń.
Epidemiologia choroby pneumokokowej u osób >65. roku życia
W Stanach Zjednoczonych Streptococcus pneumoniae (pneumokok) jest najczęstszym czynnikiem infekcyjnym wywołującym ciężkie zachorowania, takie jak bakteriemia, zapalenie opon mózgowo-rdzeniowych i zapalenie płuc. Wprowadzenie w 2000 roku szczepień dzieci skoniugowaną szczepionką 7-walentną (PCV-7), a w 2010 roku szczepionką PCV-13 zmniejszyło zapadalność na zakażenia pneumokokowe wśród dzieci objętych szczepieniami, a na drodze pośrednich mechanizmów (odporność zbiorowiskowa – przyp. red.) także u pozostałych dzieci i dorosłych. Do 2013 roku zapadalność na inwazyjną chorobę pneumokokową (IChP) wywołaną przez typy serologiczne uwzględnione w PCV-13 u osób >65. roku życia zmniejszyła się o około 50% w porównaniu z rokiem 2010, kiedy w programie szczepień dzieci szczepionkę PCV-7 zastąpiono preparatem PCV-13.3 Jednak zgodnie z obliczeniami dotyczącymi epidemiologii IChP, w 2013 roku u dorosłych w wieku ≥65 lat wystąpiło 13 500 zachorowań3. Typy serologiczne uwzględnione w PCV-13 wywołują u dorosłych >65. roku około 20–25% zachorowań na IChP i 10% zachorowań na PZP. Profilaktyka tych zachorowań jest możliwa poprzez zastosowanie w tej populacji szczepionki 13-walentnej.3,4
PCV-13 u dorosłych
30 grudnia 2011 roku PCV-13 zarejestrowano do stosowania u dorosłych w wieku ≥50 lat w celu zapobiegania zachorowaniom na zapalenie płuc i IChP wywołane przez typy serologiczne S. pneumoniae objęte tą szczepionką (w aktualnej ChPL szczepionki dostępnej w Polsce we wskazaniach do stosowania u dorosłych wymienia się tylko zapobieganie chorobie inwazyjnej. W styczniu br. European Medicines Agency wydała pozytywną opinię o rozszerzeniu wskazań o profilaktykę zapalenia płuc wywołanego przez typy szczepionkowe – przyp. red.). FDA zmienił wskazania do stosowania preparatu Prevnar 13 zgodnie z przyspieszoną procedurą. Umożliwia ona wcześniejszą rejestrację produktów leczniczych, które dają istotnie większe korzyści w leczeniu ciężkich i zagrażających życiu chorób niż dostępne metody terapeutyczne.5 FDA zdefiniował „istotnie większe korzyści od dostępnych metod terapeutycznych” jako ochronę dorosłych w wieku ≥50 lat przed pneumokokowym zapaleniem płuc bez bakteriemii lub pneumokokowym zapaleniem płuc bez bakteriemii wraz z ochroną przed IChP.7 W czerwcu 2012 roku ACIP zalecił rutynowe szczepienia PCV-13 osób >19. roku życia z niedoborami odporności, bez śledziony (brak czynnościowy lub anatomiczny), z wyciekiem płynu mózgowo-rdzeniowego lub z wszczepionym implantem ślimakowym6 (p. Med. Prakt. Szczepienia 1/2013, s. 29–34 – przyp. red.). Decyzję o zaleceniu szczepień PCV-13 dorosłym >65. roku życia ACIP odroczył do czasu uzyskania danych na temat wpływu szczepienia dzieci szczepionką 13-walentną na występowanie choroby pneumokokowej u dorosłych (pośredni efekt szczepień) oraz skuteczności PCV-13 w zapobieganiu nieinwazyjnym zachorowaniom dorosłych na pneumokokowe zapalenie płuc. Zgodnie z wymogami przyspieszonej procedury rejestracyjnej, w latach 2008–2013 w Holandii przeprowadzono badanie z randomizacją i z placebo (badanie CAPiTA) w grupie około 85 000 osób w wieku ≥65 lat w celu weryfikacji i zebrania nowych informacji o klinicznych korzyściach PCV-13 w zapobieganiu pneumokokowemu zapaleniu płuc.1 Zgodnie z wynikami badania CAPiTA, u dorosłych w wieku ≥65 lat skuteczność PCV-13 w zapobieganiu zachorowaniom na zapalenie płuc wywołane przez typy serologiczne uwzględnione w szczepionce wyniosła 45,6% (95% CI: 21,8–62,5), a w zapobieganiu zachorowaniom na zapalenie płuc spowodowane przez typy serologiczne uwzględnione w szczepionce bez towarzyszącej bakteriemii – 45,0% (95% CI: 14,2–65,3). Natomiast skuteczność szczepionki w zapobieganiu IChP wywołanej przez typy szczepionkowe wyniosła 75,0% (95 CI: 41,4–90,8).1
W 2 wieloośrodkowych badaniach z randomizacją przeprowadzonych w Stanach Zjednoczonych i Europie oceniono immunogenność PCV-13. Wyniki badań wykazują, że odpowiedź immunologiczna na szczepienie PCV-13 była u starszych dorosłych co najmniej tak samo dobra jak odpowiedź na PPSV-23 lub nawet lepsza.7,8 Funkcjonalność przeciwciał oceniono miesiąc po szczepieniu na podstawie testu opsonofagocytozy (OPA). U osób w wieku 60–64 lat nieszczepionych wcześniej przeciwko pneumokokom, po szczepieniu PCV-13 średnia geometryczna mian przeciwciał (GMT) przeciwko 12 typom serologicznym uwzględnionym w PCV-13 i PPSV-23 była porównywalna do wartości po podaniu samej PPSV-23 lub większa.7 U osób >70. roku życia, które ≥5 lat przed kwalifikacją do badania zaszczepiono 1 dawką PPSV-23, odpowiedź na PCV-13 oceniona w teście OPA była podobna do odpowiedzi na PPSV-23 w odniesieniu do 2 typów serologicznych i większa w odniesieniu do 10 serotypów.8
W badaniach oceniających odpowiedź immunologiczną na szczepionki PCV-7 i PPSV-23 podawane w ramach jednego schematu szczepień stwierdzono lepszą odpowiedź, kiedy jako pierwszą podano PCV-7.9-12 Stwierdzono również, że osoby, którym w pierwszej kolejności podano PPSV-23, a po roku PCV-13, wytworzyły po drugim szczepieniu słabszą odpowiedź immunologiczną ocenioną za pomocą testu OPA niż osoby, którym w ramach pierwszego szczepienia podano PCV-13, niezależnie od wyjściowego wyniku testu OPA po szczepieniu PPSV-23.9 W badaniach oceniono także odpowiedź na szczepienie polegające na podaniu PCV-7 lub PCV-13, a następnie PPSV-23 w odstępie 2, 6 i 12 miesięcy lub 3–4 lat. Miano przeciwciał po podaniu PPSV-23 było większe od wyjściowego miana przed szczepieniem PCV i nie było mniejsze od miana uzyskanego po szczepieniu PCV.9-12 W żadnym z tych badań nie oceniono optymalnego odstępu pomiędzy poszczególnymi dawkami szczepionek.
Bezpieczeństwo PCV-13 oceniono w grupie około 6000 dorosłych >50. roku życia zarówno szczepionych, jak i nieszczepionych w przeszłości szczepionką PPSV-2313. Ogólna częstość ciężkich zdarzeń niepożądanych zarejestrowanych w ciągu miesiąca po podaniu pierwszej dawki PCV-13 lub PPSV-23 była porównywalna dla obu szczepionek i mieściła się w zakresie 0,2–1,7%. W ciągu 1–6 miesięcy po wykonaniu pierwszego szczepienia ogólna częstość takich zdarzeń wyniosła 1,2–5,8% w grupie zaszczepionej PCV-13 i 2,4–5,5% w grupie zaszczepionej PPSV-23. W badaniach obejmujących osoby wcześniej nieszczepione PPSV-23 oraz szczepione w przeszłości szczepionką PPSV-23, uzyskano podobne wyniki w zakresie częstości ciężkich zdarzeń niepożądanych. Po szczepieniu PCV-13 często obserwowano ból, zaczerwienie, obrzęk w miejscu wstrzyknięcia, ograniczenie ruchomości kończyny, w którą podano szczepionkę, męczliwość, ból głowy i stawów, dreszcze, zmniejszone łaknienie oraz uogólniony ból mięśni. Podobne objawy zaobserwowano u dorosłych zaszczepionych PPSV-23.13
Jeśli pośrednie efekty szczepień dzieci PCV-13 będą podobne do efektów obserwowanych po wprowadzeniu szczepień PCV-7, u dorosłych można się spodziewać dalszego zmniejszenia obciążeń związanych z chorobą pneumokokową wywołaną przez typy serologiczne uwzględnione w PCV-13. Wstępna analiza opierająca się na modelu probabilistycznym wykazała, że dodanie PCV-13 do PPSV-23 podawanej zgodnie z aktualnymi zaleceniami dla osób >65. roku życia przyniesie dodatkowe korzyści zdrowotne.14 Szacunkowo, w pojedynczej kohorcie dorosłych >65. roku życia taka strategia może zapobiec 230 przypadkom zachorowań na IChP i około 12 000 przypadkom zachorowań na PZP w ciągu całego życia, jeżeli uwzględnimy aktualnie obserwowane pośrednie efekty programu szczepień dzieci i aktualny odsetek dorosłych >65. roku życia zaszczepionych PPSV-23 (ok. 60%). Natomiast jeżeli założymy maksymalną wartość efektu pośredniego i taki sam poziom wyszczepialności PPSV-23 w grupie wiekowej ≥65 lat, oczekiwane korzyści z wprowadzenia PCV-13 prawdopodobnie będą mniejsze (mniejsza liczba zachorowań na IChP i PZP – odpowiednio 160 i 4500 [podane wartości bezwzględne dotyczą populacji amerykańskiej – przyp. red.]).14
CDC będzie oceniać realizację zaleceń dotyczących szczepień dorosłych preparatem 13-walentnym oraz ich wpływ. W ocenie tej zostanie uwzględniony m.in. odsetek zaszczepionych oboma typami szczepionek przeciwko pneumokokom oraz efekt szczepień PCV-13 w odniesieniu do epidemiologii zakażeń wywołanych przez typy serologiczne objęte PCV-13 (IChP i PZP). Monitorowanie trendów epidemiologicznych choroby pneumokokowej wśród dorosłych niezaszczepionych PCV-13 może pomóc w oszacowaniu pośredniego wpływu szczepień i długookresowej użyteczności rutynowych szczepień dorosłych PCV-13. W ciągu najbliższych 3 lat ACIP będzie stale aktualizować dane na temat obciążeń związanych z IChP i PZP u dorosłych, aby w razie potrzeby zmodyfikować zalecenia dotyczące szczepień dorosłych PCV-13.
PPSV-23 u dorosłych
W Stanach Zjednoczonych dorosłym >65. roku życia zaleca się rutynowe szczepienie pojedynczą dawką PPSV-23.15 W badaniach potwierdzono efektywność PPSV-23 w zapobieganiu zachorowaniom na IChP u dorosłych, lecz dane dotyczące zapobiegania nieinwazyjnemu pneumokokowemu zapaleniu płuc w grupie wiekowej ≥65. roku życia nie są spójne. PPSV-23 zawiera antygeny tych samych 12 serotypów co PCV-13 oraz dodatkowych 11 serotypów. W 2013 roku typy serologiczne uwzględnione wyłącznie w PPSV-23 były odpowiedzialne za 38% zachorowań na IChP wśród dorosłych >65. roku życia.3 Biorąc pod uwagę duży odsetek przypadków inwazyjnych zakażeń typami objętymi wyłącznie przez PPSV-23, oczekuje się, że dzięki szczepieniom PCV-13 łącznie z PPSV-23 możliwe będzie uzyskanie szerszej ochrony. Ustalając optymalny odstęp pomiędzy PCV-13 i PPSV-23, ACIP uwzględnił różne czynniki, takie jak: immunogenność, bezpieczeństwo, czas konieczny do uzyskania ochrony poszczepiennej przed chorobą wywołaną przez serotypy wyłączne dla PPSV-23, a także czas przeprowadzenia kolejnej wizyty w celu szczepień.
Zalecenia dotyczące stosowania PCV-13 i PPSV-23 u dorosłych
U wszystkich dorosłych w wieku ≥65 lat należy rutynowo przeprowadzić szczepienie przeciwko pneumokokom za pomocą obu rodzajów szczepionek – PCV-13 i PPSV-23 (p. ryc.).
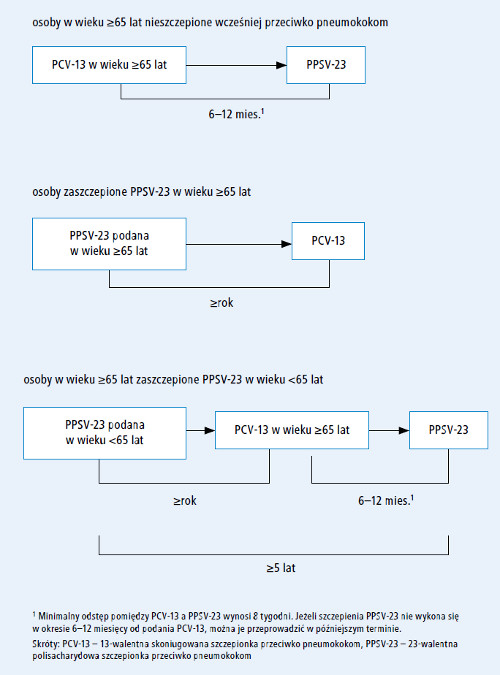
Ryc. Schemat szczepienia dorosłych w wieku ≥65 lat szczepionkami PCV-13 i PPSV-23 wg ACIP
Osoby nieszczepione wcześniej przeciwko pneumokokom
Dorośli w wieku ≥65 lat, którzy nie byli wcześniej szczepieni przeciwko pneumokokom lub których historia szczepień jest nieznana, powinni w pierwszej kolejności otrzymać 1 dawkę PCV-13, a 6–12 miesięcy później – PPSV-23. Jeżeli w tym czasie nie można podać PPSV-23, szczepienie należy przeprowadzić w późniejszym terminie, na najbliższej możliwej wizycie. Szczepionki skoniugowanej i polisacharydowej nie można podawać równocześnie (tj. podczas tej samej wizyty), a minimalny odstęp pomiędzy PCV-13 a PPSV-23 wynosi 8 tygodni.
Osoby zaszczepione wcześniej PPSV-23
Dorośli w wieku ≥65 lat zaszczepieni w przeszłości ≥1 dawką PPSV-23 powinni również otrzymać 1 dawkę PCV-13, jeżeli do tej pory nie byli szczepieni taką szczepionką. PCV-13 należy podać nie wcześniej niż 1 rok od ostatniego szczepienia PPSV-23. Jeżeli wskazane jest podanie dodatkowej dawki PPSV-23, szczepienie to należy przeprowadzić 6–12 miesięcy po podaniu PCV-13 i ≥5 lat po podaniu ostatniej dawki PPSV-23.15
Możliwe ograniczenia czasowe stosowania rutynowych szczepień PCV-13 w grupie wiekowej ≥65 lat
Niniejsze zalecenia ACIP zostaną ponownie ocenie w 2018 roku, a w razie konieczności ulegną modyfikacji.
Zalecenia ACIP dotyczące rutynowych szczepień PCV-13 dorosłych >19. roku życia z niedoborami odporności, czynnościowym lub anatomicznym brakiem śledziony, wyciekiem płynu mózgowo-rdzeniowego lub z wszczepionym implantem ślimakowym nie zmieniają się.6
Równoczesne stosowanie z innymi szczepionkami
PCV-13 podana podczas tej samej wizyt z 3-walentną inaktywowaną szczepionką przeciwko grypie (TIV) jest immunogenna i bezpieczna. PCV-13 można stosować równocześnie z TIV w ramach realizacji programu szczepień dorosłych. Jednak w badaniu z randomizacją przeprowadzonym metodą podwójnie ślepej próby u dorosłych >65. roku życia zaszczepionych równocześnie szczepionką PCV-13 i TIV stwierdzono nieznacznie mniejsze wartości GMT swoistej dla serotypów oraz mniejszy odsetek uczestników, u których w teście hamowania hemaglutynacji uzyskano ≥4-krotne zwiększenie miana przeciwciał przeciwko jednemu z trzech podtypów wirusa grypy (A/H3N2), w porównaniu z osobami zaszczepionymi tylko PCV-13 lub tylko TIV.16 Obecnie nie dysponujemy danymi dotyczącymi jednoczesnego szczepienia dorosłych szczepionką PCV-13 i innymi szczepionkami (np. przeciwko błonicy, tężcowi i krztuścowi [dTpa] lub półpaścowi).
Przeciwwskazania i sytuacje wymagające zachowania szczególnej ostrożności
Przed podaniem PCV-13 osoba wykonująca szczepienie powinna się zapoznać z podanymi w ulotce informacjami o sytuacjach wymagających zachorowania szczególnej ostrożności, ostrzeżeniach i przeciwwskazaniach. Szczepienie PCV-13 jest przeciwwskazane u osób, u których w przeszłości wystąpiła ciężka reakcja alergiczna (np. anafilaksja) na jakikolwiek składnik PCV-13 lub PCV-7, lub na jakąkolwiek szczepionkę zawierającą toksoid błoniczy (antygeny pneumokoków zawarte w PCV-13 skoniuOsoby gowano z białkiem CRM197, nietoksyczną pochodną toksoidu błoniczego – przyp. red.). (…)
Piśmiennictwo:
1. Bonten M., Bolkenbaas M., Huijts S., et al.: Community acquired pneumonia immunization trial in adults (CAPiTA). Abstract no. 0541. Pneumonia 2014; 3: 95 Available at www.pneumonia.org.au2. Advisory Committee on Immunization Practices. GRADE tables: 2014. Atlanta, GA, US Department of Health and Human Services, CDC, 2014. Available at www.cdc. gov
3. Active Bacterial Core Surveillance (ABCs): Emerging Infections Program Network. Unpublished data (2013). Atlanta, GA, US Department of Health and Human Services, CDC, 2013
4. Grijalva C., Wunderink R., Williams D., et al.: Distribution of pneumococccal serotypes detected through urine analysis among US adults hospitalized with pneumonia after introduction of PCV-13. Proceedings of the International Symposium on Pneumococci and Pneumococcal Diseases 2014, Hyderabad, India. Available at www2.kenes. com
5. Food and Drug Administration. FDA expands use of Prevnar 13 vaccine for people ages 50 and older. Silver Spring, MD, US Department of Health and Human Services; Food and Drug Administration; 2011. Available at http://www.fda.gov/newsevents/newsroom/ pressannouncements/ucm285431.htm
6. CDC. Use of 13-valent pneumococcal conjugate vaccine and 23-valent pneumococcal polysaccharide vaccine for adults with immunocompromising conditions: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR, 2012; 61: 816–819
7. Jackson L.A., Gurtman A., van Cleeff M., et al.: Immunogenicity and safety of a 13-valent pneumococcal conjugate vaccine compared to a 23-valent pneumococcal polysaccharide vaccine in pneumococcal vaccine-naive adults. Vaccine, 2013; 31: 3577–3584
8. Jackson L.A., Gurtman A., Rice K., et al.: Immunogenicity and safety of a 13-valent pneumococcal conjugate vaccine in adults 70 years of age and older previously vaccinated with 23-valent pneumococcal polysaccharide vaccine. Vaccine, 2013; 31: 3585–3593
9. Greenberg R.N., Gurtman A., Frenck R.W., et al.: Sequential administration of 13-valent pneumococcal conjugate vaccine and 23-valent pneumococcal polysaccharide vaccine in pneumococcal vaccine–naive adults 60–64 years of age. Vaccine, 2014; 32: 2364–2374
10. Jackson L.A., Gurtman A., van Cleeff M., et al.: Influence of initial vaccination with 13-valent pneumococcal conjugate vaccine or 23-valent pneumococcal polysaccharide vaccine on anti-pneumococcal responses following subsequent pneumococcal vaccination in adults 50 years and older. Vaccine, 2013; 31: 3594–3602
11. Goldblatt D., Southern J., Andrews N., et al.: The immunogenicity of 7-valent pneumococcal conjugate vaccine versus 23-valent polysaccharide vaccine in adults aged 50–80 years. Clin. Infect. Dis., 2009; 49: 1318–1325
12. Miernyk K.M., Butler J.C., Bulkow L.R., et al.: Immunogenicity and reactogenicity of pneumococcal polysaccharide and conjugate vaccines in Alaska Native adults 55–70 years of age. Clin. Infect. Dis., 2009; 49: 241–248
13. Food and Drug Administration. Vaccines and Related Biological Products Advisory Committee (VRBPAC) adult indication briefing document: Prevnar 13. Silver Spring, MD, US Department of Health and Human Services, Food and Drug Administration, 2011. Available at www.fda.gov
14. Stoecker C.: Incremental cost-effectiveness of modifying PPSV and PCV recommendations for adults age 50 and over. Presented at the Advisory Committee on Immunization Practices June 25, 2014 meeting, Atlanta, GA, 2014. Available at www.cdc.gov/ vaccines/acip/meetings/downloads/slides-2014-06/PCV-13-02-stoecker.pdf
15. CDC. Updated recommendations for prevention of invasive pneumococcal disease among adults using the 23-valent pneumococcal polysaccharide vaccine (PPSV23). MMWR, 2010; 59: 1102–1106
16. Schwarz T.F., Flamaing J., Rümke H.C., et al.: A randomized, double-blind trial to evaluate immunogenicity and safety of 13-valent pneumococcal conjugate vaccine given concomitantly with trivalent influenza vaccine in adults aged ≥65 years. Vaccine, 2011; 29: 5195–5202
Komentarz
dr n. med. Hanna Czajka
Kierownik Poradni Chorób Zakaźnych w Wojewódzkim
Specjalistycznym Szpitalu dziecięcym im. św. Ludwika w Krakowie
Co już wiadomo na ten temat?
Zakażenia Streptococcus pneumoniae u dorosłych powodują rocznie 500 000 zachorowań na zapalenie płuc oraz 40 000 zgonów, najczęściej u pacjentów z przewlekłą obturacyjną chorobą płuc.
W 2001 roku infekcje dróg oddechowych stanowiły czwartą pod względem częstości występowania przyczynę zgonów w krajach rozwiniętych, a 3-krotnie częściej dotyczyły one chorych >65. roku życia. Zakażenie bakterią S. pneumoniae jest najczęściej identyfikowaną przyczyną zachorowań na pozaszpitalne zapalenie płuc (PZP) nie tylko w Stanach Zjednoczonych, ale także w Europie (19,3% wszystkich zachorowań na PZP)1. Inwazyjna choroba pneumokokowa (IChP) najczęściej występuje u dzieci <5. roku życia oraz u dorosłych >65. roku życia. Zapadalność na IChP wśród osób >65 lat wynosiła: w Belgii 36/100 000, w Danii 64/100 000, a w Norwegii 62/100 000.2 Zapadalność na tę samą chorobę w Stanach Zjednoczonych wynosi 60/100 000.
Przyczyną tego stanu był niski poziom realizacji szczepień w tej grupie wiekowej (wg danych za rok 2007: Wielka Brytania – 12,2%, Niemcy – 10,3%, Szwajcaria – 8,7%). Na podstawie tych obserwacji stwierdzono, że konieczna jest popularyzacja szczepień w tej grupie wiekowej. W tym celu rozpoczęto akcję wsparcia merytorycznego lekarzy (internistów i geriatrów).
Zagrożenia związane z zakażeniami pneumokokowymi u dorosłych >60. roku życia sprawiły, iż zarówno w Stanach Zjednoczonych, jak i w innych krajach rozwiniętych, w tym w Unii Europejskiej (UE), od kilku lat wydawane są wytyczne dotyczące rutynowych szczepień przeciwko pneumokokom szczepionką polisacharydową (PPSV-23).
Wprowadzenie w 2000 roku w Stanach Zjednoczonych masowych szczepień dzieci preparatem PCV-7 spowodowało znaczące zmniejszenie liczby zachorowań na IChP, także wśród dorosłych >65. roku życia. W zakresie zakażeń wywoływanych przez typy serologiczne uwzględnione w PCV-7 spadek ten wynosił 92%, a w odniesieniu do wszystkich serotypów inwazyjnych liczba zachorowań na IChP zmniejszyła się o 37%.3
Do 2014 roku dorosłym >65. roku życia zalecano podawanie PPSV-23, choć od grudnia 2011 roku dla osób >50. roku życia dostępna jest szczepionka PCV-13. Zalecenie dotyczące stosowania szczepionki PCV-13 u pacjentów >65. roku życia wydano na podstawie wyników badań, w których oceniono skuteczności tego leku w grupie 85 000 osób w podeszłym wieku (badanie CAPiTA). Wykazano w nim, że skuteczność PCV-13 w zapobieganiu zachorowaniom wywołanym przez typy serologiczne uwzględnione w szczepionce, tj. PZP i IChP, wyniosła odpowiednio 45,6 i 75,0%.4
W krajach europejskich brakuje ujednoliconych zaleceń dotyczących szczepień przeciwko pneumokokom, a zalecenia brytyjskie zawarte w „Green Book”5 nadal wskazują PPSV-23 jako szczepionkę przeznaczoną dla osób w wieku >65 lat.
Czego jeszcze nie wiadomo?
Zalecenia Advisory Committee on Immunization Practices (ACIP) będą poddawane okresowej ocenie i ewentualnej weryfikacji. Nie wiadomo bowiem, jak będą realizowane szczepienia przeciwko zakażeniom pneumokokowym w grupie seniorów, w jakim procencie ogólnych szczepień stosowana będzie szczepionka PCV-13, a następnie po 6–12 miesiącach szczepionka PPSV-23. Tym samym nie sposób ustalić, w jakim zakresie wprowadzenie PCV-13 oraz kontynuowanie uodpornienia szczepionką PPSV-23 będzie wpływać na zmniejszenie liczby zachorowań na PZP lub IChP.
Czy wytyczne są wiarygodne i jakie mają znaczenie dla praktyki klinicznej?
Badania stanowiące podstawę do komentowanych zaleceń ACIP przeprowadzono u wielu pacjentów w badaniach z randomizacją i placebo, co pozwala uznać je za rzetelne. Wykazano w nich, że u starszych dorosłych odpowiedź immunologiczna na PCV-13 była co najmniej tak samo dobra lub nawet lepsza jak na szczepienie preparatem PPSV-23 w odniesieniu do 12 typów serologicznych wspólnych dla obu szczepionek. Wykazano także, że PCV-13 chroni osoby >65. roku życia nie tylko przed zachorowaniem na IChP, ale także na zapalenie płuc, co aktualnie jest przedmiotem postępowania rejestracyjnego prowadzonego przez European Medicines Agency.6 Do tej pory w tej grupie wiekowej zalecano stosowanie jedynie szczepionki polisacharydowej PPSV-23. Zgodnie z rozszerzonymi wskazaniami oraz obowiązującym w Polsce Programem Szczepień Ochronnych (PSO), szczepionkę PCV-13 należy stosować nie tylko u dzieci, ale także u seniorów. Sprawą otwartą pozostaje jednak nadal finansowanie tych szczepień, gdyż obecnie obowiązujący PSO ogranicza dostępność PCV-13 dla osób starszych o niskich dochodach. Wydaje się jednak, że PCV-13 należy stosować u osób w wieku podeszłym, gdyż korzyści z jej podawania przeważają koszty jej zakupu. Wobec dyskutowanej obecnie potrzeby wprowadzenia powszechnych szczepień dzieci przeciwko zakażeniom pneumokokowym należałoby objąć tą profilaktyką także naszych seniorów.
Piśmiennictwo do komentarza:
1. Woodhead M.: Community-acquired pneumonia in Europe: causative pathogens and resistance patterns. Eur. Respir. J., 2002; 20 (supl. 36): 20S–27S2. Fedson D.S., Musher D.M.: Pneumococcal polisacharide vaccine. Vaccines, 4th ed., 2004: 529–588
3. Pickering L.K., Baker C.J., Kimberlin D.W., Long S.S. (eds.): Red Book: 2012 Report of the Committee on Infectious Diseases. 29th ed. Elk Grove Village, IL, American Academy of Pediatrics, 2012
4. Charakterystyka Produktu Leczniczego (ChPL) Prevenar 13
5. Immunisation against infectious disease – Public Health England, 11 September 2013, last updated: 2 September 2014, Chapter 25th https://www.gov.uk/government/collections/ immunisation-against-infectious-disease-the-greenbook
6. European Medicines Agency – Committee for Medical Products for Human Use (CHMP) Summary of opinion (post authorisation) Prevenar 13 – pneumococcal polysaccharide conjugate vaccine EMEA/CHMP/39 942/2015 22 Jan 2015

























