Tłumaczyła dr med. Agnieszka Matkowska-Kocjan
Skróty: ACIP – amerykański Komitet Doradczy ds. Szczepień Ochronnych, BJK – białka jaja kurzego, PCV-13 – 13-walentna skoniugowana szczepionka przeciwko pneumokokom, TIV – trójwalentna inaktywowana szczepionka przeciwko grypie
W 2010 roku amerykański Komitet Doradczy ds. Szczepień Ochronnych (Advisory Committee on Immunization Practices – ACIP) po raz pierwszy zalecił coroczne szczepienie przeciwko grypie wszystkich osób >6. miesiąca życia zamieszkujących w Stanach Zjednoczonych.1 Zalecenie to utrzymano w kolejnych latach. W aktualnych zaleceniach ACIP:
- opisano szczepy wirusa grypy zawarte w szczepionce przeciwko grypie obowiązującej w sezonie epidemicznym 2012/2013;
- przedstawiono zalecenia dotyczące stosowania szczepionek przeciwko grypie w sezonie 2012/2013, w tym zaktualizowany schemat szczepień dla dzieci w wieku od 6 miesięcy do ukończenia 9. roku życia, opisano dostępne preparaty oraz wskazania do ich stosowania;
- przeanalizowano ryzyko wystąpienia drgawek gorączkowych związanych ze stosowaniem szczepionki przeciwko grypie oraz 13-walentnej skoniugowanej szczepionki przeciwko pneumokokom (PCV-13);
- przedstawiono zalecenia dotyczące szczepień u osób z alergią na białka jaja kurzego (BJK) w wywiadzie;
- omówiono wprowadzenie 4-walentnej szczepionki przeciwko grypie w kolejnych sezonach epidemicznych.
Pozostałe zagadnienia dotyczące szczepień przeciwko grypie, których nie uwzględniono w niniejszej aktualizacji, są dostępne w wytycznych ACIP (p. Zapobieganie zachorowaniom na grypę za pomocą szczepień. Aktualne [2010] zalecenia amerykańskiego Komitetu Doradczego ds. Szczepień Ochronnych [ACIP]) oraz w innych aktualizacjach.1,2
Metodologię opracowywania corocznych zaleceń ACIP dotyczących szczepień opisano już we wcześniejszych dokumentach.1 Grupa Robocza ACIP ds. grypy spotyka się regularnie co 2–4 tygodnie przez cały rok. W jej skład wchodzi kilku członków ACIP mających prawo głosu oraz przedstawicieli organizacji partnerskich ACIP. Spotkania mają charakter telekonferencji, w trakcie których poruszane są takie zagadnienia, jak zapadalność na grypę, skuteczność i bezpieczeństwo szczepień, odsetki zaszczepionych osób w populacjach, którym zaleca się szczepienie przeciwko grypie, możliwość realizacji programów szczepień przeciwko grypie, opłacalność kosztowa szczepień i oczekiwane zapotrzebowanie na szczepionki. Uczestnicy spotkań przedstawiają prezentacje, a następnie dyskutują na temat opublikowanych i nieopublikowanych jeszcze danych. Centers for Disease Control and Prevention (CDC) przedstawia dane dotyczące nadzoru epidemiologicznego, a także informacje dotyczące oporności wirusa grypy na leki przeciwwirusowe, bezpieczeństwa i efektywności szczepionek oraz ich dystrybucji i zużycia.
Skład szczepionki przeciwko grypie w sezonie epidemicznym 2012/2013
Szczepionki przeciwko grypie przygotowane na sezon epidemiczny 2012/2013 zawierają antygeny szczepów spokrewnionych ze szczepami A/California/7/2009 (H1N1), A/Victoria/361/2011 (H3N2) oraz B/Wisconsin/1/2010 (z linii Yamagata). Antygeny grypy A(H3N2) oraz B różnią się od antygenów szczepów wirusa użytych w szczepionkach obowiązujących w sezonach 2010/2011 oraz 2011/2012.3 Szczep wirusa grypy A(H1N1) uzyskano ze szczepu wirusa A(H1N1)pdm09 (2009[H1N1]), który był zawarty w monowalentnej szczepionce przeciwko grypie pandemicznej 2009 (H1N1v) oraz w szczepionkach przeciwko grypie sezonowej obowiązujących w sezonach epidemicznych 2010/2011 i 2011/2012.
Zalecenia dotyczące szczepień przeciwko grypie
Coroczne rutynowe szczepienie przeciwko grypie zaleca się wszystkim osobom >6. miesiąca życia. Aby doszło do wytworzenia ochronnego stężenia przeciwciał,4,5 optymalnie szczepienie należy wykonać przed rozpoczęciem aktywności wirusa grypy w danej populacji. Szczepienie należy zatem proponować, gdy tylko szczepionka obowiązująca w danym sezonie będzie dostępna. Szczepienie przeciwko grypie powinno się proponować przez cały sezon zachorowań na grypę (tzn. tak długo, jak wirusy grypy krążą w danej populacji).
Dawkowanie szczepionki przeciwko grypie u dzieci w wieku od 6 miesięcy do ukończenia 9. roku życia
W celu optymalizacji odpowiedzi poszczepiennej, wszystkim dzieciom w wieku od 6 miesięcy do ukończenia 9. roku życia, które są szczepione po raz pierwszy przeciwko grypie, należy podać 2 dawki szczepionki przeciwko grypie (zachowując 4-tygodniowy odstęp). W badaniu dzieci w wieku 5–8 lat, które po raz pierwszy w życiu otrzymały trójwalentną szczepionkę inaktywowaną przeciwko grypie (TIV), istotnie większe stężenie swoistych przeciwciał stwierdzono w grupie dzieci zaszczepionych 2 dawkami szczepionki, w porównaniu z grupą, która otrzymała tylko 1 dawkę szczepionki.6 W kilku badaniach wykazano, że odstęp czasu pomiędzy dwiema wstępnymi dawkami szczepienia (od 4 tygodni do roku) tymi samymi antygenami nie ma wielkiego znaczenia.7-9 Jednak ze względu na obecność nowego antygenu wirusa grypy pandemicznej 2009 (H1N1), który prawdopodobnie nadal będzie krążył w sezonie 2012/2013, przy podejmowaniu decyzji dotyczącej liczby zalecanych dawek szczepionki należy uwzględnić wywiad dotyczący ekspozycji na ten antygen w przeszłości. Dzieci, które po raz ostatni zostały zaszczepione TIV przed sezonem 2010/2011 i nie otrzymały szczepionki zawierającej antygeny wirusa grypy 2009 (H1N1) (a więc szczepionki przeciwko grypie sezonowej, począwszy od lipca 2010 r., lub monowalentnej szczepionki przeciwko grypie pandemicznej 2009 [H1N1]), nie były eksponowane na ten antygen. W nadchodzącym sezonie epidemicznym dzieciom tym należy podać 2 dawki szczepionki przeciwko grypie sezonowej, nawet jeśli przed sezonem 2010/2011 zastosowano u nich już 2-dawkowy schemat szczepień przeciwko grypie. Ustalając liczbę dawek szczepionki u dzieci w wieku od 6 miesięcy do ukończenia 9. roku życia, można zatem skorzystać z jednego z dwóch akceptowanych schematów (ryc. 1.).
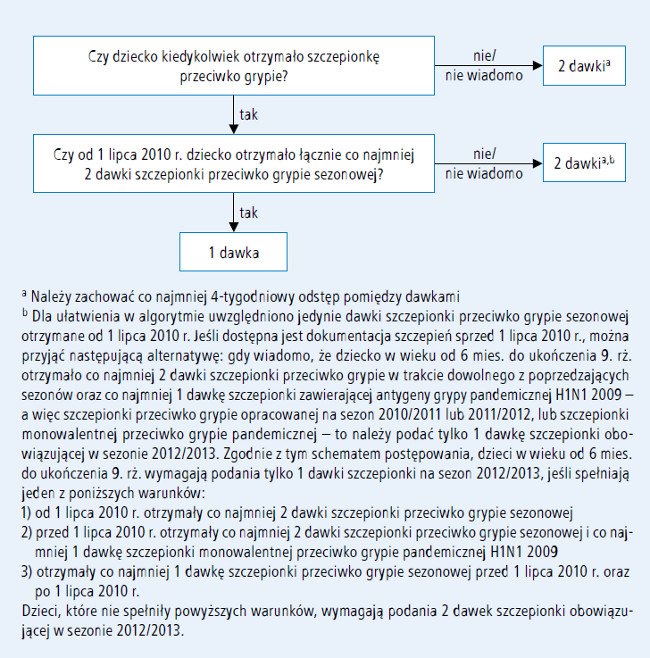
Ryc. 1. Algorytm dawkowania szczepionki przeciwko grypie u dzieci w wieku od 6 miesięcy do ukończenia 9. roku życia
- W pierwszym schemacie należy uwzględnić jedynie dawki szczepionki przeciwko grypie sezonowej podane po 1 lipca 2010 roku. Taka metoda jest zgodna z zaleceniami Amerykańskiej Akademii Pediatrii (AAP).10 Jej zaletą jest prostota, zwłaszcza jeśli zebranie wiarygodnych danych na temat historii szczepień sprzed sezonu 2010/2011 jest utrudnione. Według tego schematu, w sezonie zachorowań 2012/2013 u dzieci w wieku od 6 miesięcy do ukończenia 9. roku życia stosuje się tylko 1 dawkę szczepionki, pod warunkiem że od 1 lipca 2010 roku otrzymały łącznie co najmniej 2 dawki szczepionki przeciwko grypie sezonowej. Natomiast dzieciom, które od 1 lipca 2010 roku nie otrzymały łącznie co najmniej 2 dawek szczepionki przeciwko grypie sezonowej, należy podać 2 dawki szczepionki opracowanej na sezon 2012/2013.
- Jeśli dostępna jest dokumentacja szczepień
danego pacjenta sprzed sezonu 2010/2011,
można zastosować drugi sposób obliczania dawek
szczepionki. Zgodnie z nim, jeśli wiadomo,
że dziecko w wieku od 6 miesięcy do ukończenia
9. roku życia otrzymało co najmniej 2 dawki
szczepionki przeciwko grypie w trakcie dowolnego z poprzedzających sezonów oraz co
najmniej 1 dawkę szczepionki zawierającej
antygeny wirusa grypy H1N1 2009 (a więc
szczepionki przeciwko grypie sezonowej na sezon
2010/2011 lub 2011/2012, lub szczepionki
monowalentnej przeciwko grypie pandemicznej),
to należy mu podać tylko 1 dawkę szczepionki
na sezon 2012/2013. Zgodnie z tym schematem
postępowania, dzieci w wieku od 6 miesięcy
do ukończenia 9. roku życia wymagają tylko
jednej dawki szczepionki na sezon 2012/2013,
jeśli spełniają jeden z poniższych warunków:
a) od 1 lipca 2010 roku otrzymały co najmniej 2 dawki szczepionki przeciwko grypie sezonowej
b) przed 1 lipca 2010 roku otrzymały co najmniej 2 dawki szczepionki przeciwko grypie sezonowej i co najmniej 1 dawkę szczepionki monowalentnej 2009 (H1N1)
c) otrzymały co najmniej 1 dawkę szczepionki przeciwko grypie sezonowej przed 1 lipca 2010 roku oraz po 1 lipca 2010 roku.
Dzieciom, które nie spełniają powyższych warunków, należy podać 2 dawki szczepionki na sezon 2012/2013.
Dostępne szczepionki przeciwko grypie i wskazania do ich stosowania
W sezonie 2012/2013 na rynku dostępne będą różne preparaty szczepionek przeciw grypie o tym samym składzie antygenowym (tab.).
W celu uzyskania aktualnych informacji o dodatkowych składnikach, wskazaniach, przeciwwskazaniach i środkach ostrożności należy się zapoznać z ulotką producenta dołączoną do opakowania. TIV należy podawać domięśniowo, z wyjątkiem preparatów przeznaczonych do wstrzykiwania śródskórnego (w Polsce dostępna jest szczepionka IDflu – przyp. red.). Preferowanym miejscem wkłucia u dorosłych i starszych dzieci (>2. rż. – przyp.red.) jest mięsień naramienny, a u niemowląt i młodszych dzieci przednioboczna część uda. Szczegółowe zalecenia dotyczące miejsca podania szczepionki oraz długości igły stosowanej do wstrzyknięć domięśniowych można znaleźć w aktualnych ogólnych wytycznych ACIP dotyczących szczepień.11
Dzieciom w wieku 6–35 miesięcy TIV podaje się w dawce 0,25 ml, natomiast u dzieci w wieku ≥36 miesięcy stosuje się dawkę 0,5 ml (tab.). Szczepionkę śródskórną podaje się w pojedynczej dawce za pomocą strzykawki z systemem do mikrowstrzyknięć. Preferowanym miejscem wkłucia jest mięsień naramienny.
Poszczególne preparaty TIV są zalecane dla różnych grup wiekowych. Wszystkie preparaty TIV zawierają taką samą dawkę hemaglutyniny (15 µg na każdy szczep wirusa/0,5 ml, łącznie 45 µg), z wyjątkiem szczepionki Fluzone Intradermal i Fluzone High-Dose (Sanofi Pasteur [niedostępne w Polsce, na rynku polskim dostępna jest szczepionka IDflu w postaci preparatu zawierającego łącznie 27 µg hemaglutyniny/0,1 ml, przeznaczonego dla osób w wieku 18–59 lat, oraz preparatu zawierającego 45 µg hemaglutyniny/0,1 ml dla osób ≥60. rż.– przyp. red.]). (…) ACIP nie zaleca konkretnego preparatu TIV w poszczególnych grupach wiekowych. (…)
Drgawki gorączkowe związane z podawaniem TIV i PCV-13
Drgawki gorączkowe są częstym zjawiskiem u małych dzieci. Około 2–5% z nich przechodzi co najmniej jeden epizod takich drgawek. Prawie wszystkie dzieci po ustąpieniu tego zaburzenia szybko zdrowieją i nie stwierdza się u nich żadnych niekorzystnych następstw.12 Przed sezonem epidemicznym 2010/2011 w Stanach Zjednoczonych nie obserwowano zwiększonego ryzyka drgawek gorączkowych po podaniu TIV.13,14 W trakcie sezonu 2010/2011 CDC oraz amerykański Urząd ds. Żywności i Leków (FDA) zarządzili wnikliwe monitorowanie występowania drgawek gorączkowych po szczepieniu przeciwko grypie ze względu na zgłaszane wcześniej w Australii zwiększone ryzyko gorączki i drgawek gorączkowych u małych dzieci po szczepionce (CSL Biotherapies) stosowanej w 2010 roku na Półkuli Południowej (do 9 przypadków drgawek gorączkowych na 1000 dawek szczepionki).15 W związku z obserwacjami poczynionymi w Australii, ACIP nie zaleca stosowania szczepionki Afluria firmy CSL Biotherapies (preparat niedostępny w Polsce – przyp. red.) u dzieci <9. roku życia (tab.).2,16
W sezonie 2010/2011 do systemu nadzoru nad szczepionkami przeciwko grypie zarejestrowanymi w Stanach Zjednoczonych zgłaszano występowanie drgawek gorączkowych po podaniu TIV.17,18 Na podstawie dalszych analiz ustalono, że zwiększone ryzyko drgawek występuje w dniu szczepienia oraz dzień później (okres ryzyka 0–1 dni) i dotyczy dzieci w wieku od 6 miesięcy do 4 lat. Ryzyko to zwiększało się, jeśli dziecko otrzymywało jednocześnie (tzn. podczas tej samej wizyty) PCV-13 i było największe dla dzieci w wieku około 16 miesięcy.18 Nie stwierdzono zwiększonego ryzyka wystąpienia drgawek gorączkowych po podaniu TIV u dzieci w wieku ≥5 lat ani po przyjęciu „żywej” donosowej szczepionki przeciwko grypie (niedostępnej w Polsce – przyp. red.) u dzieci w każdym wieku. Jednak ryzyko wystąpienia drgawek gorączkowych u dzieci w Stanach Zjednoczonych (<1/1000 zaszczepionych dzieci) było istotnie mniejsze niż ryzyko obserwowane w 2010 roku u dzieci w Australii.15
Po przeanalizowaniu danych dotyczących występowania drgawek gorączkowych w sezonie 2010/2011 oraz uwzględnieniu bilansu korzyści i ryzyka szczepień nie wprowadzono żadnych zmian w zaleceniach dotyczących stosowania TIV i PCV-13 w sezonie 2011/2012.16,19,20 Wyniki obserwacji dotyczących występowania drgawek gorączkowych po szczepieniu przeciwko grypie w sezonie 2011/2012 były takie same jak w sezonie 2010/2011 (ten sam skład szczepionki w obu sezonach [CDC, nieopublikowane dane, 2012]). W sezonie 2012/2013 również nie wprowadzono żadnych zmian w zaleceniach dotyczących stosowania TIV oraz PCV-13. (…) Jak wspomniano wcześniej, ACIP nie zaleca stosowania preparatu Afluria (CSL Biotherapies) u dzieci <9. roku życia.2,16
Tabela. Szczepionki przeciwko grypie dostępne w Polsce w sezonie 2012/2013 (od Redakcji)
| Nazwa handlowa | Producent | Postać leku | Opakowanie | Zawartość tiomersalu | Wskazania |
| IDflu | Sanofi Pasteur | zaw. do wstrzyknięćd | 1 ampułkostrzykawka 0,1 ml z systemem mikrowstrzykiwania + mikroigła (dawka 9 µg/szczep) | nie zawiera | dorośli do 59. rż. |
| IDflu | Sanofi Pasteur | zaw. do wstrzyknięćd | 1 ampułkostrzykawka 0,1 ml z systemem mikrowstrzykiwania + mikroigła (dawka 15 µg/szczep) | nie zawiera | dorośli ≥60. rż. |
| Influvac | Abbott | zaw. do wstrzyknięća | 10 ampułkostrzykawek 0,5 ml + igła | nie zawiera | >6. mż.b,c |
| Influvac | Abbott | zaw. do wstrzyknięća | 1 ampułkostrzykawka 0,5 ml + igła | nie zawiera | >6. mż.b,c |
| Vaxigrip | Sanofi Pasteur | zaw. do wstrzyknięća | 1 ampułkostrzykawka 0,5 ml | nie zawiera | >6. mż.b,c |
| Vaxigrip Junior | Sanofi Pasteur | zaw. do wstrzyknięća | 1 ampułkostrzykawka 0,25 ml | nie zawiera | 6.–35. mż.b |
| a do podawania domięśniowo lub głęboko podskórnie b Algorytm dawkowania szczepionki przeciwko grypie u dzieci w wieku od 6 miesięcy do ukończenia 9. rż. przedstawiono na ryc. 1. c dzieciom w wieku >6. mż. do 35. mż. można podać dawkę 0,25 ml lub 0,5 ml d do podawania śródskórnego | |||||
Szczepienie przeciwko grypie osób z alergią na białko jaja kurzego
Ciężkie reakcje alergiczne i anafilaktyczne mogą wystąpić w odpowiedzi na różne składniki szczepionki przeciwko grypie, jednak obserwuje się je rzadko. W procesie produkcji wszystkich obecnie dostępnych szczepionek przeciwko grypie używa się wirusów namnażanych na zarodkach jaj kurzych. ACIP dokonał niedawno przeglądu danych dotyczących szczepień przeciwko grypie u osób z alergią na białka jaj kurzego (BJK) w wywiadzie.16 Zgodnie z zaleceniami ACIP na sezon 2011/2012 osoby z alergią na BJK, u których po ekspozycji na jajo kurze występują jedynie reakcje skórne (pokrzywka), mogą otrzymać TIV, pod warunkiem że zostaną zachowane opisane poniżej dodatkowe zasady bezpieczeństwa. Ostatni przegląd danych dostępnych w amerykańskim systemie zgłaszania działań niepożądanych po szczepieniu (Vaccine Adverse Event Reporting System – VAERS) wykazał, że w sezonie 2011/2012 nie zgłoszono nadmiernej liczby przypadków alergii lub anafilaksji po szczepieniu przeciwko grypie.21 Zalecenia ACIP na sezon 2012/2013 przedstawiono poniżej.
- Osoby z alergią na BJK w wywiadzie, u których po ekspozycji na jajo kurze występują
tylko reakcje skórne (pokrzywka),
mogą otrzymać szczepionkę przeciwko
grypie, pod warunkiem że zostaną zachowane
następujące zasady bezpieczeństwa
(ryc. 2.): (…)
a) szczepionkę powinien podawać personel zaznajomiony z objawami alergii na BJK
b) po każdym podaniu szczepionki pacjenta należy obserwować co najmniej przez 30 minut.
Nie zaleca się podawania szczepionki w dawkach podzielonych ani wykonywania testów skórnych ze szczepionką.22 - Wystąpienie ciężkich reakcji systemowych lub anafilaktycznych po ponownej ekspozycji na BJK jest bardziej prawdopodobne u osób, u których w przeszłości po ekspozycji na BJK wystąpiły takie objawy, jak obrzęk naczynioruchowy, objawy ze strony układu oddechowego (duszność), zawroty głowy lub nawracające wymioty, a także u osób, które wymagały podania adrenaliny lub innej pilnej interwencji medycznej, zwłaszcza jeśli objawy wystąpiły w krótkim czasie po ekspozycji (w ciągu kilku minut lub godzin). Przed zaszczepieniem takie osoby należy skierować do specjalisty w dziedzinie chorób alergicznych w celu oceny ryzyka szczepienia (ryc. 2.).
- Wszystkie szczepionki należy podawać w placówkach, których personel jest wyszkolony w szybkim rozpoznaniu i leczeniu anafilaksji oraz które dysponują odpowiednim sprzętem. ACIP zaleca, aby wszystkie osoby wykonujące szczepienia były zaznajomione z algorytmem postępowania w stanach nagłych.11
- Niektóre osoby, które w wywiadzie podają alergię na BJK, mogą nie być na nie uczulone. Osoby, które mogą jeść lekko ścięte jaja (np. jajecznicę) bez żadnej reakcji, raczej nie są uczulone. Osoby uczulone na BJK mogą tolerować pieczone produkty zawierające jaja (np. chleb, ciasto). Tolerancja pokarmów zawierających jaja nie wyklucza jednak istnienia alergii na BJK.23 Alergię na jaja kurze można potwierdzić na podstawie szczegółowego wywiadu dotyczącego objawów niepożądanych po spożyciu jaj, produktów zawierających jaja kurze oraz na podstawie testów skórnych i/lub oznaczenia swoistych przeciwciał klasy IgE w surowicy.
- Ciężka reakcja alergiczna po poprzednim szczepieniu przeciwko grypie, niezależnie od składnika podejrzanego o wywołanie reakcji, jest przeciwwskazaniem do ponownego szczepienia przeciwko grypie.
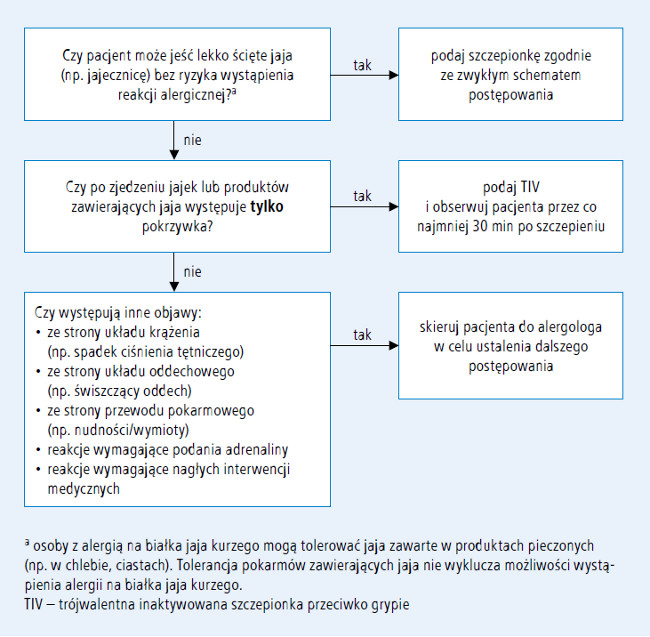
Ryc. 2. Algorytm szczepienia przeciwko grypie osób z alergią na białka jaja kurzego w wywiadzie zgodny z zaleceniami ACIP w sezonie epidemicznym 2012/2013
Czterowalentne szczepionki przeciwko grypie
Wszystkie dostępne obecnie szczepionki przeciwko grypie są trójwalentne i zawierają antygeny wirusów A (H1N1), A (H3N2) i B. Istnieją dwie linie wirusów grypy B różniące się antygenowo, które określone są jako linia Victoria oraz Yamagata.24 Zaszczepienie przeciwko jednemu rodzajowi wirusów grypy B daje ograniczoną ochronę krzyżową przed wirusami drugiego rodzaju.25 Z tego powodu oraz ze względu na trudności w określeniu, która linia wirusów B będzie dominować w danym sezonie zachorowań, zaproponowano, aby do składu szczepionek przeciwko grypie sezonowej włączono także drugi szczep wirusa grypy B. W niedawno przeprowadzonej analizie wykazano, że wprowadzenie takiej czterowalentnej szczepionki skutkowałoby niewielką redukcją zachorowań, hospitalizacji i zgonów związanych z grypą. Zależałoby to od dostępności szczepionki, odsetka zaszczepionej populacji, efektywności (skuteczności rzeczywistej) szczepionki oraz częstości występowania grypy wywołanej przez dwie linie wirusa B.26
W lutym 2012 roku FDA zatwierdził nową „żywą”, donosową czterowalentną szczepionkę przeciwko grypie sezonowej (LAIV) – FluMist Quadrivalent (MedImmune). Szczepionka ta będzie dostępna w Stanach Zjednoczonych dopiero w sezonie 2013/2014, kiedy to zastąpi obecnie dostępną trójwalentną „żywą” szczepionkę donosową. Trwają prace nad rozwojem czterowalentnych inaktywowanych szczepionek przeciwko grypie. Szczepionki te zostaną uwzględnione w zaleceniach ACIP po przeprowadzeniu rejestracji i wprowadzeniu do sprzedaży.
Piśmiennictwo:1. CDC. Prevention and control of influenza with vaccines: recommendations 1. of the Advisory Committee on Immunization Practices (ACIP), 2010. MMWR, 2010; 59 (No. RR/8)
2. CDC. Update: recommendations of the Advisory Committee on Immunization Practices (ACIP) regarding use of CSL seasonal influenza vaccine (Afluria) in the United States during 2010–11. MMWR, 2010; 59: 989–992
3. Food and Drug Administration. Summary minutes: Vaccines and Related Biological Products Advisory Committee, February 28–29, 2012. Silver Spring, MD, US Department of Health and Human Services, Food and Drug Administration; 2012. http://www.fda.gov/downloads/advisorycommittees/committeesmeetingmaterials/bloodvaccines andotherbiologics/vaccinesandrelatedbiologicalproductsadvisory committee/ucm296 193.pdf (cyt. 10.08.2012)
4. Gross P.A., Russo C., Dran S., et al.: Time to earliest peak serum antibody response to influenza vaccine in the elderly. Clin. Diagn. Lab. Immunol., 1997; 4: 491–492
5. Brokstad K.A., Cox R.J., Olofsson J., et al.: Parenteral influenza vaccination induces a rapid systemic and local immune response. J. Infect. Dis., 1995; 171: 198–203
6. Neuzil K.M., Jackson L.A., Nelson J., et al.: Immunogenicity and reactogenicity of 1 versus 2 doses of trivalent inactivated influenza vaccine in vaccine-naive 5–8 year-old children. J. Infect. Dis., 2006; 194: 1032–1039
7. Englund J.A., Walter E.B., Fairchok M.P., et al.: A comparison of 2 influenza vaccine schedules in 6- to 23-month-old children. Pediatrics, 2005; 115: 1039–1047
8. Walter E .B., Neuzil K.M., Zhu Y., et al.: Influenza vaccine immunogenicity in 6- to 23-month-old children: are identical antigens necessary for priming? Pediatrics, 2006; 118: e570–e578
9. Englund J.A., Walter E.B., Gbadebo A., et al.: Immunization with trivalent inactivated influenza vaccine in partially immunized toddlers. Pediatrics, 2006; 118: e579–e585
10. American Academy of Pediatrics. Recommendations for the prevention and control of influenza in children, 2012–2013. Pediatrics, 2012 (w druku)
11. CDC. General recommendations on immunization: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR, 2011; 60 (No. RR-2)
12. Steering Committee on Quality Improvement and Management, Subcommittee on Febrile Seizures, American Academy of Pediatrics. Febrile seizures: clinical practice guideline for the long-term management of the child with simple febrile seizures. Pediatrics, 2008; 121: 1281–1286
13. Hambidge S.J., Glanz J.M., France E.K., et al.: Safety of trivalent inactivated influenza vaccine in children 6 to 23 months old. JAMA, 2006; 296: 1990–1997
14. Greene S.K., Kulldorff M., Lewis E.M., et al.: Near real-time surveillance for influenza vaccine safety: proof-of-concept in the Vaccine Safety Datalink Project. Am. J. Epidemiol., 2010; 171: 177–188
15. Australian Government Department of Health and Ageing, Therapeutic Goods Administration. Investigation into febrile reactions in young children following 2010 seasonal trivalent influenza vaccination. Woden, Australian Capital Territory: Australian Government Department of Health and Ageing; 2010. http://www.tga.gov.au/pdf/ alerts-medicine-seasonal-flu-100 702.pdf (cyt. 10.08.2012)
16. CDC. Prevention and control of influenza with vaccines: recommendations of the Advisory Committee on Immunization Practices (ACIP), 2011. MMWR, 2011; 60: 1128–1132
17. Leroy Z., Broder K., Menschik D., et al.: Febrile seizures after 2010–2011 influenza vaccine in young children, United States: a vaccine safety signal from the vaccine adverse event reporting system. Vaccine, 2012; 30: 2020–2023
18. Tse A., Tseng H.F., Greene S.K., et al.: Signal identification and evaluation for risk of febrile seizures in children following trivalent inactivated influenza vaccine in the Vaccine Safety Datalink Project, 2010–2011. Vaccine, 2012; 30: 2024–2031
19. Advisory Committee on Immunization Practices. General recommendations: febrile seizures. Influenza session. Presented at the Advisory Committee on Immunization Practices meeting, Atlanta, GA, June 2011
20. CDC. Prevention of pneumococcal disease among infants and children – use of 13-valent pneumococcal conjugate vaccine and 23-valent pneumococcal polysaccharide vaccine: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR, 2010; 59 (No. RR-11)
21. Advisory Committee on Immunization Practices. Update on influenza vaccine safety monitoring. Presented at the Advisory Committee on Immunization Practices meeting, Atlanta, GA; June 2012. http://www.cdc.gov/vaccines/acip/meetings/live-mtg-jun-2012.html (cyt. 10.08.2012)
22. Kelso J.M., Greenhawt M.J., Li J.T.: Adverse reactions to vaccines practice parameter 2012 update. J. Allergy Clin. Immunol., 2012; 130: 25–43
23. Erlewyn-Lajeunesse M., Brathwaite N., Lucas J.S., Warner J.O.: Recommendations for the administration of influenza vaccine in children allergic to egg. BMJ, 2009; 339: 912–915
24. McCullers J.A., Saito T., Iverson A.R.: Multiple genotypes of influenza B virus circulated between 1979 and 2003. J. Virol., 2004; 78: 12 817–12 828
25. Belshe R.B., Coelingh K., Ambrose C.S., et al.: Efficacy of live attenuated influenza vaccine in children against influenza B viruses by lineage and antigenic similarity. Vaccine, 2010; 28: 2149–2156
26. Reed C., Meltzer M.I., Finelli L., Fiore A.: Public health impact of including two lineages of influenza B in a quadrivalent seasonal influenza vaccine. Vaccine, 2012; 30: 1993–1998















