Opracowali na podstawie tłumaczenia dr med. Małgorzaty Wójcik: lek. Iwona Rywczak, dr med. Jacek Mrukowicz
Komentarze: prof. dr hab. med. Jerzy Kruszewski, prof. dr hab. med. Cezary Pałczyński, dr med. Hanna Czajka
Skróty: BJK – białka jaja kurzego, NOP – niepożądany odczyn poszczepienny, TIV – trójwalentna inaktywowana szczepionka przeciwko grypie
Cel i metodyka wytycznych
Cel
- przedstawienie praktycznego postępowania w przypadku podejrzenia wystąpienia reakcji alergicznej na szczepionkę lub innych niepożądanych odczynów poszczepiennych (NOP) oraz zasad realizacji szczepień u pacjentów z wcześniej rozpoznaną alergią lub innymi chorobami, które mogą stanowić przeciwwskazanie do szczepienia lub wymagać zachowania szczególnej ostrożności podczas kwalifikacji i realizacji szczepień;
- ograniczenie niepotrzebnego opóźniania lub rezygnacji ze szczepień u osób z podejrzewaną alergią na szczepionki;
- ograniczenie niepotrzebnego opóźniania lub rezygnacji ze szczepienia przeciwko grypie u osób z rozpoznaną lub podejrzewaną alergią na białka jaja kurzego (BJK);
- przypomnienie, że tylko niektóre NOP stanowią przeciwwskazanie do podania kolejnej dawki szczepionki.
Odbiorcy
Specjaliści w dziedzinie alergologii i immunologii, lekarze innych specjalności wykonujący szczepienia.
Metodyka
Zalecenia opracował Joint Task Force on Practice Parameters (JTFPP), reprezentujący American Academy of Allergy, Asthma and Immunology (AAAAI), American College of Allergy, Asthma and Immunology (ACAAI), oraz Joint Council of Allergy, Asthma and Immunology. Za opracowanie tych zaleceń odpowiadają wspólnie AAAAI oraz ACAAI. JTFPP zapewnia, że zalecenia kliniczne zostały opracowane na podstawie oceny wiarygodności danych, bez żadnych wpływów komercyjnych. Wiarygodność danych stanowiących podstawę stwierdzeń i zaleceń zawartych w dokumencie oceniono zgodnie z kryteriami przedstawionymi w ramce. Proces opracowywania zaleceń podlegał wieloetapowym ocenom. Powołano grupę roboczą odpowiedzialną za przygotowanie wstępnej wersji zaleceń, którą ocenił zespół recenzentów. O recenzję poproszono także członków poszczególnych towarzystw naukowych uczestniczących w projekcie.
|
Ramka. Klasyfikacja jakości danych i siły zaleceń Kategorie jakościowe danych Ia – dane pochodzące z metaanalizy badań z randomizacją Ib – dane pochodzące co najmniej z jednego badania z randomizacją IIa – dane pochodzące co najmniej z jednego badania z grupą kontrolną, bez randomizacji IIb – dane pochodzące co najmniej z jednego badania quasi-eksperymentalnego innego typu III – dane pochodzące z badań nieeksperymentalnych, opisowych (np. badań porównawczych) IV – dane pochodzące z raportów zespołów ekspertów, doświadczenia klinicznego uznanych autorytetów lub z obu tych źródeł Siła zaleceń A – oparte bezpośrednio na danych kategorii I B – oparte bezpośrednio na danych kategorii II lub ekstrapolowane z danych kategorii I C – oparte bezpośrednio na danych kategorii III lub ekstrapolowane z danych kategorii I lub II D – oparte bezpośrednio na danych kategorii IV lub ekstrapolowane z danych kategorii I, II lub III E – oparte na konsensusie opracowanym przez Joint Task Force on Practice Parameters |
Zalecenia i stwierdzenia
1. Łagodne odczyny miejscowe i uogólnione (np. gorączka), które często obserwuje się po szczepieniach, nie są przeciwwskazaniem do podania kolejnych dawek szczepionki, po dobnie jak rzadko występujące reakcje nadwrażliwości typu opóźnionego na składniki szczepionki, które mogą powodować powstanie guzka w miejscu wstrzyknięcia (C).
U osób, które przebyły kontaktowe zapalenie skóry w wyniku nadwrażliwości na neomycynę, w miejscu wstrzyknięcia szczepionki zawierającej neomycynę (tab. 1.) może przejściowo pojawić się wykwit grudkowy. Nie stanowi to jednak przeciwwskazania do podania kolejnych dawek takiej szczepionki.
| Tabela 1. Substancje pomocnicze zawarte w szczepionkacha | ||
|---|---|---|
| Nazwa substancji | Szczepionka | |
| neomycyna | przeciwko grypie (IDflu, Vaxigrip, Vaxigrip Junior) | MMR (Priorix, M-M-RvaxPro) | przeciwko ospie wietrznej (Varilrix) | przeciwko poliomyelitis (Imovax Polio, Polio Sabin – oral) | szczepionki wysoce skojarzone (Pentaxim, Infanrix-IPV+Hib, Infanrix hexa) |
| polimyksyna B | przeciwko poliomyelitis (Imovax Polio, Polio Sabin – oral) | |
| szczepionki wysoce skojarzone (Pentaxim, Infanrix-IPV+Hib, Infanrix hexa) | ||
| żelatyna | MMR (M-M-RvaxPro) | |
| tiomersal | D – szczepionka błonicza adsorbowana, d – szczepionka błonicza adsorbowana | |
| T – szczepionka tężcowa adsorbowana, TT – szczepionka tężcowa adsorbowanab | ||
| DT – szczepionka błoniczo-tężcowa adsorbowana, Td – szczepionka tężcowo-błonicza adsorbowanac | ||
| DTP – szczepionka błoniczo-tężcowo-krztuścowa adsorbowana | ||
| białka drożdży | przeciwko WZW typu B, monowalentne i skojarzone (Engerix B, Euvax B, HBvaxPro, Hepavax Gene TF, Twinrix, Infanrix hexa) | |
| przeciwko HPV (Silgard) | ||
| polisorbat 80 | przeciwko HPV (Silgard) | |
| przeciwko grypie (Influvac) | ||
| przeciwko rotawirusom (RotaTeq) | ||
| dTpa (Boostrix) | ||
| przeciwko pneumokokom (Prevenar 13) | ||
| lateks | przeciwko meningokokom (Menveo) | |
| a Opracowano na podstawie Charakterystyki Produktu Leczniczego (ChPL), uwzględniając szczepionki dostępne w Polsce. Pełny wykaz substancji pomocniczym podano w ChPL w pkt. 6.1 – przyp. red. b wycofana z produkcji, preparat ten zastąpiła szczepionka Tetana, która nie zawiera tiomersalu jako środka konserwującego, ale może zawierać jego śladową ilość jako pozostałość po procesie produkcyjnym – przyp. red. c wycofana z produkcji, preparat ten zastąpiła szczepionka Clodivac, która nie zawiera tiomersalu jako środka konserwującego, ale może zawierać jego śladową ilość jako pozostałość po procesie produkcyjnym – przyp. red. dTpa – szczepionka zawierająca toksoid tężcowy, zmniejszoną dawkę toksoidu błoniczego i bezkomórkowe komponenty pałeczki krztuśca, HPV – ludzki wirus brodawczaka, MMR – szczepionka skojarzona przeciwko odrze, śwince i różyczce, WZW – wirusowe zapalenie wątroby | ||
U pacjentów z dodatnim wynikiem testów płatkowych z tiomersalem rzadko obserwowano duże miejscowe reakcje po szczepieniu preparatem zawierającym ten konserwant. Takie reakcje oraz dodatnie wyniki testów płatkowych z tiomersalem nie są jednak przeciwwskazaniem do podania kolejnych dawek szczepionek zawierających tiomersal.
Po podaniu szczepionek zawierających glin rzadko obserwowano powstawanie trwałych guzków w miejscu wstrzyknięcia, których przyczyną mogła być reakcja nadwrażliwości typu opóźnionego lub innego rodzaju reakcja immunologiczna na glin.
2. Częstość reakcji anafilaktycznych po szczepieniach szacuje się na około 1 przypadek na milion dawek (B).
Reakcje anafilaktyczne po szczepieniach występują bardzo rzadko (p. także Reakcje anafilaktyczne po szczepieniu występowały bardzo rzadko). Na podstawie amerykańskich danych z monitorowania bezpieczeństwa szczepień ryzyko wystąpienia reakcji anafilaktycznej oszacowano – w zależności od preparatu – na 0,65–1,53 na milion dawek. Zgony spowodowane reakcją anafilaktyczną na szczepionkę są jednak niezmiernie rzadkie.
3. Zalecamy zgłaszanie wszystkich ciężkich zdarzeń niepożądanych po szczepieniu do oficjalnego systemu nadzoru, nawet jeśli lekarz nie ma pewności, że miały one związek przyczynowy ze szczepieniem (C).
Każde zgłoszenie podlega następnie ocenie w celu ustalenia ewentualnego związku przyczynowego ze szczepieniem (w Polsce zgłoszenia podejrzenia NOP kieruje się do właściwego terenowo Państwowego Powiatowego Inspektora Sanitarnego – przyp. red.).
4. Zalecamy oznaczenie stężenia swoistych przeciwciał IgG przeciwko antygenom drobnoustroju zawartego w szczepionce podejrzewanej o spowodowanie ciężkiego NOP, co może pomóc w ustaleniu wskazań (potrzeby) do podania kolejnych dawek szczepionki (B).
Jeżeli schemat szczepienia nie został zakończony, a w badaniach serologicznych stwierdzono ochronne stężenie lub miano przeciwciał IgG przeciwko antygenom drobnoustroju zawartego w szczepionce (tab. 2.), można rozważyć rezygnację z podania kolejnych dawek szczepionki. Jednak w porównaniu z kompletnym schematem szczepienia, czas utrzymywania się ochrony poszczepiennej może być krótszy.
| Tabela 2. Ochronne stężenia swoistych przeciwciał po szczepieniu | ||
|---|---|---|
| Choroba/drobnoustrój | Najmniejsze ochronne stężenie przeciwciał (IgG) | |
| błonica | 0,1 IU/ml | |
| Haemophilus influenzae typu b | 0,15 µg/ml | |
| WZW typu A | 10 mIU/ml | |
| WZW typu B, przeciwciała anty-HBs | 10 mIU/ml | |
| odra | miano 120 w teście PRN | |
| wirus poliomyelitis typu 1, 2, 3 | miano przeciwciał neutralizujących 1:8 | |
| wścieklizna | 0,5 IU VNA/ml | |
| różyczka | 10 IU/ml | |
| tężec | 0,1 IU/ml | |
| żółta gorączka | 0,7 IU/ml | |
| IU – jednostki międzynarodowe, mIU – mili jednostki międzynarodowe, PRN – test neutralizacji łysinkowej, VNA – przeciwciała neutralizujące wirusa | ||
5. Zalecamy przeprowadzenie diagnostyki w każdym przypadku podejrzenia reakcji anafilaktycznej na szczepionkę w celu zidentyfikowania alergenu odpowiedzialnego za tę reakcję (B).
Orzeczenie o przeciwwskazaniu do podawania kolejnych dawek szczepionki bez przeprowadzenia dodatkowej diagnostyki nie jest właściwym postępowaniem. Może prowadzić do niepotrzebnej rezygnacji ze szczepionek, na które pacjent w rzeczywistości nie jest uczulony, albo które można bezpiecznie podawać mimo potwierdzenia alergii. Ponadto niezidentyfikowanie składnika szczepionki, na który pacjent jest uczulony, wiąże się z ryzykiem wystąpienia reakcji po podaniu innej szczepionki zawierającej ten składnik.
6. Reakcje IgE-zależne częściej wywołują dodatkowe składniki szczepionki (np. żelatyna) niż antygeny drobnoustrojów zawartych w szczepionce (B).
Wykazano, że przyczyną reakcji anafilaktycznej może być zawarta w szczepionkach żelatyna, którą dodaje się do niektórych preparatów jako stabilizator antygenu (tab. 1.). Przed podaniem jakiejkolwiek szczepionki zawierającej żelatynę należy zebrać wywiad w kierunku objawów alergicznych po spożyciu żelatyny, jednak brak takich objawów nie wyklucza ryzyka wystąpienia reakcji alergicznej na żelatynę zawartą w szczepionce. Do produkcji szczepionek używa się żelatyny wołowej lub wieprzowej, mogących wywoływać reakcje krzyżowe. Niektórzy pacjenci uczuleni na mięso wołowe lub wieprzowe są również uczuleni na żelatynę wołową lub wieprzową, zatem ryzyko reakcji na szczepionki zawierające żelatynę może być u takich osób zwiększone.
Do produkcji niektórych szczepionek „żywych” (np. przeciwko odrze, śwince i różyczce [MMR]) używa się wirusów namnażanych w hodowli komórkowej fibroblastów zarodków kurzych. Szczepionki te zawierają zaledwie śladową ilość BJK lub nie zawierają ich wcale. Można je stosować u osób uczulonych na BJK, a wykonywanie testów skórnych przed szczepieniem nie jest konieczne. Większa dawka BJK znajduje się w szczepionkach przeciwko żółtej gorączce oraz grypie (przygotowanych z wirusów namnażanych na zarodkach kurzych – przyp. red.) i może wywołać reakcję alergiczną u uczulonych osób. Jednak w wielu badaniach wykazano, że inaktywowane szczepionki przeciwko grypie (TIV), które ostatnio zawierają już tylko niewielką dawkę owoalbuminy, można – zachowując szczególną ostrożność – bezpiecznie podawać nawet pacjentom z ciężką alergią na BJK (p. dalej).
W szczepionkach przeciwko żółtej gorączce mogą być obecne także białka kurze inne niż te znajdujące się w jajku. Mogą one wywołać reakcje alergiczne u uczulonych na nie osób.
W produkcji rekombinowanych szczepionek przeciwko wirusowemu zapaleniu wątroby typu B oraz czterowalentnej szczepionki przeciwko ludzkiemu wirusowi brodawczaka wykorzystuje się drożdże piekarskie lub piwne (Saccharomyces cerevisiae). Zawartość białek drożdży w tych szczepionkach jest śladowa, a reakcje alergiczne na białka drożdży występują rzadko.
Korki gumowe zamykające ampułki ze szczepionkami lub tłoczki ampułkostrzykawek wykonuje się z lateksu uzyskanego z kauczuku naturalnego lub syntetycznego. Lateks pochodzenia naturalnego teoretycznie może wywołać reakcję alergiczną u uczulonych pacjentów. W Stanach Zjednoczonych wśród 166 000 zgłoszeń podejrzenia NOP stwierdzono jedynie 28 przypadków reakcji alergicznej typu natychmiastowego po podaniu szczepionki, której opakowanie zawierało lateks naturalny. Jednak przyczyną tych reakcji mógł być też inny składnik szczepionki. Opisano po jednym przypadku natychmiastowej reakcji alergicznej przypisywanej zawartym w szczepionkach neomycynie i tiomersalowi.
U dzieci opisano 8 przypadków reakcji anafilaktycznej w pierwszej godzinie po podaniu bezkomórkowej szczepionki przeciwko błonicy, tężcowi i krztuścowi (DTPa lub dTpa). U 6 dzieci wywiad ujawnił wcześniejsze reakcje alergiczne na mleko krowie i bardzo duże stężenie swoistych dla białek mleka krowiego przeciwciał IgE w surowicy. Te szczepionki mogły zawierać śladowe ilości (nanogramy) kazeiny z podłoża hodowlanego używanego w procesie produkcji. Jednak reakcje anafilaktyczne na DTPa lub dTpa występują bardzo rzadko i większość pacjentów z alergią na białka mleka krowiego dobrze toleruje te szczepienia. U osób z bardzo dużym stężeniem swoistych przeciwciał IgE przeciwko białkom mleka krowiego można jednak rozważyć wzmożoną i przedłużoną obserwację po szczepieniu pod kątem objawów anafilaksji.
Jeśli pacjent podaje w wywiadzie reakcję typu natychmiastowego (anafilaktycznego) na drożdże, lateks, neomycynę lub tiomersal, przed podaniem szczepionki zawierającej te składniki (tab. 1.) należy wykonać testy skórne w celu potwierdzenia tego typu reakcji (p. ryc. 1.).
7. U pacjentów z ewidentną reakcją anafilaktyczną po podaniu szczepionki zalecamy wykonanie testów skórnych w celu potwierdzenia reakcji IgE-zależnej typu natychmiastowego oraz identyfikacji odpowiedzialnego za nią składnika szczepionki (B).
W celu ustalenia, czy za wystąpienie ewidentnej reakcji anafilaktycznej u pacjenta odpowiedzialna jest szczepionka, należy wykonać testy skórne ze szczepionką (p. ryc. 1. [powinien je wykonać specjalista alergolog, mający doświadczenie w przeprowadzeniu testów skórnych – przyp. red.]). W pierwszej kolejności powinny to być testy punktowe. Do testów należy użyć szczepionki w pełnym stężeniu, szczepionkę rozcieńczoną stosuje się tylko u pacjentów, u których wystąpiła ciężka reakcja zagrażająca życiu. W razie ujemnego wyniku testu punktowego ze szczepionką w pełnym stężeniu (z prawidłowo przeprowadzoną dodatnią i ujemną próbą kontrolną), należy wykonać testy śródskórne ze szczepionką rozcieńczoną w proporcji 1:100, ponownie z użyciem odpowiednich prób kontrolnych.
Testy skórne, szczególne z preparatami niestandardaryzowanymi (takimi jak szczepionki), mogą dawać fałszywie dodanie (reakcja podrażnienia) i nieistotne klinicznie dodatnie wyniki. Możliwe jest również uzyskanie wyników fałszywie ujemnych. U niektórych pacjentów, u których potwierdzono swoiste przeciwciała IgE przeciwko różnym szczepionkom w surowicy lub za pomocą testów skórnych, nie obserwowano żadnych reakcji po podaniu tych szczepionek zgodnie ze standardowymi procedurami.
Jeśli szczepionka podejrzana o wywołanie reakcji zawiera BJK, żelatynę, lateks lub białka drożdży, u pacjenta należy wykonać testy skórne także z tymi alergenami.
Na rynku dostępne są ekstrakty zawierające BJK i drożdże do wykonywania testów skórnych oraz zestawy do oznaczania w surowicy swoistych IgE przeciwko BJK, żelatynie, lateksowi i drożdżom. Niedostępne są jednak preparaty do wykonywania testów skórnych ani zestawy do oznaczania swoistych IgE przeciwko neomycynie i tiomersalowi.
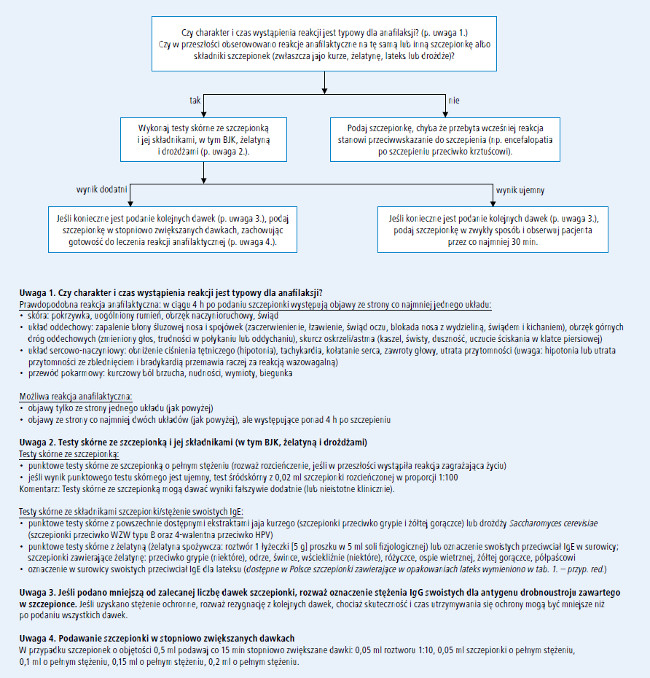
Ryc. 1. Algorytm postępowania w przypadku podejrzenia niepożądanego odczynu poszczepiennego o podłożu alergicznym
8. Zalecamy, aby szczepienie pacjentów z ujemnym wynikiem testu śródskórnego ze szczepionką przeprowadzić zgodnie ze standardowymi procedurami, ponieważ u takich pacjentów prawdopodobieństwo obecności przeciwciał IgE przeciwko jakiemukolwiek składnikowi szczepionki jest małe. Sugerujemy jednak, aby u pacjentów z podejrzeniem reakcji anafilaktycznej w wywiadzie szczepienie wykonać w obecności lekarza, z przygotowanym zestawem adrenaliny i innych leków zalecanych w leczeniu wstrząsu anafilaktycznego (B).
Testy śródskórne zaleca się w przypadku podejrzenia reakcji anafilaktycznej na szczepionkę. Pacjent z ujemnym wynikiem testu skórnego ze szczepionką i jej składnikami, zwłaszcza testu śródskórnego z roztworem szczepionki 1:100, raczej nie ma przeciwciał IgE przeciwko żadnym składnikom szczepionki i może zostać zaszczepiony w standardowy sposób. Po szczepieniu konieczna jest jednak co najmniej 30-minutowa obserwacja.
Nie ustalono natomiast formalnych kryteriów (np. wartości predykcyjnej wyniku dodatniego i ujemnego) określających przydatność testów śródskórnych w potwierdzaniu lub wykluczaniu uczulenia na szczepionkę lub jej składniki.
9. Jeżeli wywiad oraz wyniki testów skórnych wskazują na IgE-zależną reakcję na szczepionkę, a pacjent wymaga podania kolejnych dawek tej szczepionki lub innych szczepionek zawierających wspólne składniki, zalecamy rozważenie podania szczepionki pod nadzorem lekarza, w stopniowo zwiększanych dawkach (C).
Pacjentów z dodatnim wynikiem testu skórnego ze szczepionką lub jej składnikami można zaszczepić w uzasadnionych przypadkach, podając stopniowo zwiększane dawki. Jeśli pełna dawka szczepionki zawiera się w objętości 0,5 ml, pacjent powinien otrzymać najpierw 0,05 ml roztworu w stężeniu 1:10, a kolejne dawki szczepionki w pełnym stężeniu o objętościach: 0,05, 0,1, 0,15 i 0,2 ml należy podawać co 15 minut.
Taką procedurę należy przeprowadzić pod ścisłym nadzorem lekarza, zapewniając natychmiastowy dostęp do leków i sprzętu niezbędnych w leczeniu reakcji anafilaktycznej. W zależności od ciężkości reakcji, która wystąpiła w przeszłości po podaniu szczepionki, i od stanu zdrowia pacjenta, zabieg należy przeprowadzić w szpitalu lub w placówce pozaszpitalnej, a przed zabiegiem konieczne może być zabezpieczenie dostępu dożylnego.
Szczepienie przeciwko grypie u osób uczulonych na BJK
10. U osób z alergią na BJK zalecamy szczepienie inaktywowaną szczepionką przeciwko grypie (TIV), ponieważ korzyści szczepienia przeważają nad ryzykiem niepożądanych odczynów (A).
W 7 opublikowanych badaniach oceniających bezpieczeństwo TIV u pacjentów z alergią na BJK nie zaobserwowano żadnych poważnych powikłań po podaniu szczepionki, a częstość występowania reakcji poszczepiennych w grupach kontrolnych była podobna.
Każdego roku tylko w Stanach Zjednoczonych hospitalizacji z powodu grypy wymaga średnio 294 128 chorych, a średnio 23 607 umiera. Zaszczepienie większego odsetka populacji (w tym także osób z alergią na BJK) może zmniejszyć liczbę hospitalizacji i zgonów.
11. Zalecamy, aby pacjenta z podejrzeniem alergii na BJK skierować do alergologa w celu ustalenia ostatecznego rozpoznania, ale taka konsultacja nie powinna opóźniać szczepienia przeciwko grypie (A).
Diagnostyka alergologiczna powinna obejmować dokładny wywiad dotyczący charakteru i czasu wystąpienia wcześniejszych reakcji na jajko. Jeśli wywiad wskazuje na alergię na BJK, należy wykonać punktowe testy skórne z BJK lub oznaczyć w surowicy przeciwciała IgE swoiste dla BJK. Przekonujący wywiad oraz obecność swoistych przeciwciał IgE pozwalają potwierdzić rozpoznanie, choć w niektórych przypadkach konieczne lub pożądane może być przeprowadzenie testu prowokacji z doustnym podaniem alergenu.
Nie należy wstrzymywać szczepień przeciwko grypie u osób poddanych diagnostyce w kierunku alergii na BJK ani u osób z potwierdzoną alergią.
12. Wyniki coraz większej liczby badań sugerują, że szczepienie przeciwko grypie jest bezpieczne nawet u osób, które przebyły reakcję anafilaktyczną po spożyciu jajka (B).
W większości badań dotyczących szczepienia pacjentów z alergią na BJK przeciwko grypie uczestniczyły osoby z reakcją anafilaktyczną po spożyciu jaja kurzego. Zarówno pacjenci z ciężką postacią alergii, jak i pacjenci z łagodniejszymi objawami dobrze tolerowali TIV.
| Tabela 3. Zawartość owoalbuminy w szczepionkach przeciwko grypie zarejestrowanych w Polsce w 2012 rokua | ||
|---|---|---|
| Nazwa szczepionki (producent) | Dawka (ml) | Stężenie owoalbuminy (µg/dawkę)b |
| Agrippal (Novartis)c | 0,5 | <0,2 µg |
| Fluarix (GSK)c | 0,5 | ≤0,05 µg |
| ID-Flu (SanofiPasteur) | 0,1 | ≤0,05 µg |
| Influvac (Abbott) | 0,5 | <0,1 µg |
| Vaxigrip (SanofiPasteur) | 0,5 | ≤0,05 µg |
| Vaxigrip Junior (SanofiPasteur) | 0,25 | ≤0,05 µg |
| a Opracowano na podstawie Charakterystyk Produktów Leczniczych oraz informacji od producentów – przyp. red. b Zgodnie z przepisami dla szczepionek dopuszczonych do użytku na terenie Unii Europejskiej, wartość ta musi wynosić <1 µg/dawkę – przyp. red. c szczepionka niedostępna w Polsce w sezonie 2012/2013 – przyp. red. | ||
13. Nie zalecamy wykonywania testów skórnych (punktowych i/lub śródskórnych) ze szczepionką przeciwko grypie u osób z alergią na BJK (ale bez reakcji alergicznej po podaniu takiej szczepionki w przeszłości), ponieważ takie badania nie pozwalają na wiarygodną identyfikację pacjentów z grupy zwiększonego ryzyka reakcji anafilaktycznej na tę szczepionkę (A).
Testy skórne ze szczepionką przeciwko grypie są narzędziem diagnostycznym u pacjentów, którzy przebyli reakcję alergiczną po podaniu tej szczepionki. W niektórych badaniach wykonywano testy skórne ze szczepionką przeciwko grypie u osób, które podawały w wywiadzie informacje o alergii na BJK. U pacjentów z dodatnim wynikiem testu ryzyko reakcji po podaniu szczepionki nie różniło się istotnie od ryzyka obserwowanego w grupie z ujemnym wynikiem.
14. Zalecamy, aby pacjentów z alergią na BJK szczepić pełną, niepodzieloną dawką szczepionki przeciwko grypie (B).
Wyniki badań sugerują, że podawanie szczepionki przeciwko grypie w jednej, niepodzielonej dawce jest bezpieczne, nawet u osób z ciężką alergią na BJK. Centers for Disease Control and Prevention i American Academy of Pediatrics nie zalecają wykonywania testów skórnych z TIV ani dzielenia pełnej dawki szczepionki u osób, u których po ekspozycji na jajko kurze wystąpiła jedynie pokrzywka (p. ryc. 2.). Osoby z cięższymi reakcjami po spożyciu jajka (wstrząs anafilaktyczny – przyp. red.) przed podaniem TIV należy natomiast skierować do alergologa w celu ustalenia dalszego postępowania (p. Zapobieganie zachorowaniom na grypę za pomocą szczepień. Aktualne [2012] zalecenia ACIP).
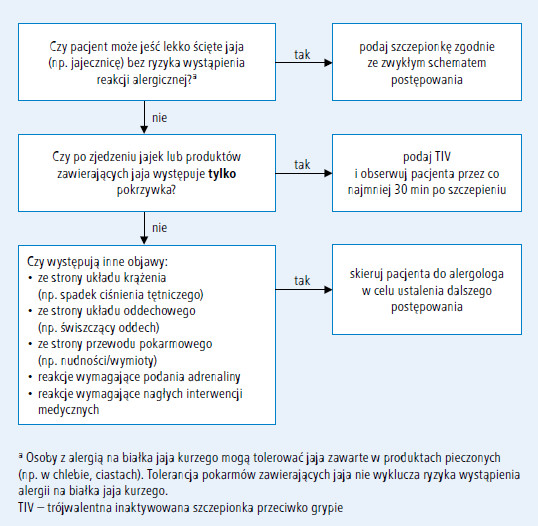
Ryc. 2. Algorytm szczepienia przeciwko grypie osób z alergią na białka jaja kurzego w wywiadzie (na podstawie: Prevention and control of influenza with vaccines: recommendations of the Advisory Committee on Immunization Practices (ACIP) – United States, 2012–13 influenza season. Morbidity and Mortality Weekly Report, 2012; 61 (32): 613–618 [p. Zapobieganie zachorowaniom na grypę za pomocą szczepień. Aktualne [2012] zalecenia ACIP])
15. Zalecamy, aby pacjentów z alergią na BJK szczepić przeciwko grypie w obecności lekarza doświadczonego w rozpoznaniu i leczeniu reakcji anafilaktycznych oraz w placówce wyposażonej w sprzęt umożliwiający natychmiastowe rozpoczęcie leczenia, a po szczepieniu obserwować pacjenta przez 30 minut (A).
Ze względu na możliwość wystąpienia reakcji alergicznej (w tym anafilaktycznej) na jakąkolwiek szczepionkę, personel wykonujący szczepienia powinien być przeszkolony w leczeniu reakcji anafilaktycznej oraz mieć zapewniony dostęp do odpowiedniego sprzętu i leków. Po szczepieniu wymagana jest 30-minutowa obserwacja. W większości badań czas obserwacji po szczepieniu wynosił 30 minut; jest to zgodne z okresem obserwacji zalecanym w trakcie immunoterapii podskórnej.
16. Zalecamy, aby pacjentów z alergią na BJK, u których po spożyciu jajka wystąpiła jedynie pokrzywka, szczepić przeciwko grypie w placówce podstawowej opieki zdrowotnej dysponującej odpowiednim sprzętem i zestawem leków, w obecności przeszkolonego personelu. Pacjentów z cięższymi objawami anafilaksji zalecamy szczepić w gabinecie alergologa lub w jego obecności (C).
Chociaż wyniki badań wskazują na bezpieczeństwo szczepień przeciwko grypie u osób z alergią na BJK, nie można wykluczyć ryzyka wystąpienia rzadkich, poważnych reakcji. W cięższych przypadkach obecność przy szczepieniu specjalisty alergologa zwiększa bezpieczeństwo pacjenta podczas zabiegu.
17. Wszystkie dostępne obecnie szczepionki przeciwko grypie zawierają jedynie niewielką dawkę owoalbuminy (tab. 3. [A]).
Stwierdzono, że szczepionki zawierające do 0,7 µg owoalbuminy w 0,5 ml nie powodowały poważnych reakcji. Nie przeprowadzono jednak analizy umożliwiającej określenie zależności pomiędzy zawartością owoalbuminy a wystąpieniem reakcji alergicznej. Nie wiadomo zatem, jakie stężenie owoalbuminy w pojedynczej dawce szczepionki może zwiększać ryzyko wystąpienia łagodnych lub poważnych reakcji.
18. Zalecamy, aby u osób z alergią na BJK stosować inaktywowaną (TIV), a nie „żywą” szczepionkę przeciwko grypie. „Żywa” szczepionka (niedostępna w Polsce – przyp. red.) zawiera małą ilość owoalbuminy, jednak we wszystkich dotychczas opublikowanych badaniach obejmujących takich pacjentów stosowano TIV (C).
19. U pacjentów, u których wystąpiła reakcja alergiczna po podaniu szczepionki przeciwko grypie, zalecamy przeprowadzenie diagnostyki obejmującej testy skórne ze szczepionką i jej składnikami. Jeżeli wynik testów skórnych jest dodatni, zalecamy rozważenie podania szczepionki w dawkach podzielonych lub rezygnacji ze szczepienia (B).
Patrz zalecenia 4–9.
(w oryginale 137 pozycji piśmiennictwa)
Komentarze
prof. dr hab. med. Jerzy Kruszewski
Konsultant Krajowy w dziedzinie alergologii, Klinika Chorób
Infekcyjnych i Alergologii Wojskowego Instytutu Medycznego w Warszawie
W artykule przedstawiono coroczne uaktualnienie stanowiska kilku amerykańskich towarzystw alergologicznych, dotyczące szczególnych sytuacji, z jakimi można się spotkać, wykonując szczepienia. W oryginalnym dokumencie problem działań niepożądanych po szczepieniach opisano na podstawie amerykańskich danych, ale w polskim opracowaniu dokonano niezbędnej selekcji informacji i uzupełnień dostosowujących je do polskich warunków. Obecnie, gdy obserwuje się w niektórych krajach rozwiniętych nieracjonalną niechęć do szczepień, publikowanie takich stanowisk jest szczególnie potrzebne dla lekarzy i pacjentów traktujących te problemy bez emocji. Wytyczne – wszechstronne i opracowane bardzo rzetelnie pod względem metodologicznym – w głównej mierze dotyczą reakcji alergicznych na szczepienia, są więc szczególnie cenne dla alergologów w naszym kraju. Chciałbym zwrócić uwagę na 2 najważniejsze aspekty tego dokumentu.
1. Wytyczne – podobnie jak poprzednie – mają bardzo praktyczny charakter. Zawierają schematy postępowania w przypadku podejrzenia reakcji niepożądanej o podłożu alergicznym po szczepieniu oraz w innych szczególnych sytuacjach, jakie się zdarzają podczas szczepienia.
2. W stanowisku uwzględniono najnowsze analizy ryzyka wykonywania szczepień u osób uczulonych na białka jaja kurzego i temu zagadnieniu poświęcono wiele miejsca. Wprawdzie niektóre dostępne na rynku szczepionki, m.in. przeciwko grypie, zawierają owoalbuminę, jednak ryzyko wystąpienia reakcji ogólnych po ich podaniu osobom uczulonym na białko jaja kurzego okazało się niewielkie. Autorzy podkreślają, że dostępne obecnie szczepionki przeciwko grypie zawierają śladowe ilości owoalbuminy, ale w przypadku osób, u których wystąpiła ciężka, uogólniona reakcja anafilaktyczna na jajo kurze decyzję o podaniu takiej szczepionki powinien podejmować alergolog.
prof. dr hab. med. Cezary Pałczyński
Klinika Alergologii i Zdrowia Środowiskowego Instytutu Medycyny
Pracy im. prof. J. Nofera w Łodzi
Lateks gumy naturalnej (natural rubber latex – NRL) należy do znanych przyczyn uczuleń zależnych od IgE, w tym rozwoju reakcji anafilaktycznych, związanych etiologicznie głównie z ekspozycją zawodową na rękawiczki gumowe.1 Ustalona częstość występowania alergii na lateks w populacji polskich krwiodawców wynosi 0,1%.2 Cytowanych danych nie można wprawdzie odnieść bezpośrednio do rozpowszechnienia tego uczulenia w polskiej populacji, to jednak odzwierciedlają one skalę problemu.
Produkty wykorzystywane w produkcji niektórych urządzeń służących do aplikacji szczepionek (korki fiolek, osłonki igieł czy też części tłoczków strzykawek) są wykonane z gumy syntetycznej (synthetic rubber) lub suchej gumy naturalnej (dry natural rubber – DNR). Uważa się, że guma syntetyczna jest absolutnie bezpieczna pod względem alergologicznym – nie zawiera NRL, a obecne w niej polimery nie mają właściwości alergizujących. Sucha guma naturalna może natomiast teoretycznie zawierać śladowe ilości alergenów lateksu. W procesie produkcji DNR stosuje się szereg technologii (np. wielokrotne płukanie materiału, chlorowanie) radykalnie zmniejszających zawartość białek w gotowym produkcie. Ryzyko ciężkiej reakcji alergicznej u osób uczulonych na NRL, związane z kontaktem z przedmiotami wykonanymi z DNR, jest więc minimalne, chociaż nie można go z całą pewnością wykluczyć.3 Dotychczas odnotowano zaledwie jeden prawidłowo udokumentowany opis przypadku anafilaksji wywołanej podaniem szczepionki z fiolki zabezpieczonej korkiem wykonanym z DNR.4
Autorzy komentowanej publikacji stwierdzili, że w przypadku zgłoszonej przez pacjenta reakcji anafilaktycznej wywołanej przez NRL nie należy podawać szczepionki, która miała kontakt z DNR w urządzeniu aplikującym. Wyjątek stanowią przypadki, gdy ryzyko rezygnacji ze szczepienia istotnie przewyższa ryzyko anafilaksji (np. podczas groźnej dla życia epidemii choroby zakaźnej). Taką szczepionkę można już jednak bezpiecznie zastosować u osób z uczuleniem kontaktowym na składniki gumy (takie jak utwardzacze i przyśpieszacze procesu wulkanizacji), ponieważ w przebiegu naturalnym alergii na te czynniki nie odnotowano przypadków wystąpienia reakcji anafilaktycznych.
Należy zwrócić uwagę na pewną niekonsekwencję autorów raportu. W oryginalnym dokumencie na rycinie 1., dotyczącej postępowania diagnostycznego w przypadku podejrzenia niepożądanej reakcji poszczepiennej o podłożu alergicznym, autorzy zalecają wykonanie testu skórnego m.in. z lateksem. Postępowanie takie wiąże się z poważnym niebezpieczeństwem wystąpienia reakcji ogólnoustrojowej u pacjenta z przebytą reakcją anafilaktyczną wywołaną przez NRL. W uwadze 2. do przedstawionego schematu zaznaczono natomiast, że należy w surowicy oznaczyć stężenie IgE swoistych dla NRL, co jest zgodne z przyjętymi zasadami postępowania – w takich przypadkach jest to bowiem badanie z wyboru.
Alergia na NRL jest nadal bardzo poważnym problemem zdrowia publicznego. Dlatego pytanie o objawy uczulenia w wyniku kontaktu z NRL stanowi istotny składnik prawidłowo zebranego wywiadu lekarskiego. Do grupy ryzyka takiego uczulenia należą nie tylko pracownicy ochrony zdrowia, ale wszystkie osoby pracujące w rękawiczkach gumowych (np. w laboratoriach, szklarniach czy zakładach fryzjerskich) lub zatrudnione w zakładach produkujących wyroby lateksowe (np. przemysł zabawkarski, tekstylny) oraz osoby z rozszczepem kręgosłupa, przepukliną oponowo-rdzeniową lub wynicowaniem pęcherza moczowego. Placówki opieki zdrowotnej są szczególnie niebezpiecznym środowiskiem dla osób z alergią na NRL. Szczepienie takich osób powinno przebiegać w warunkach bezpiecznych, tj. bez kontaktu z NRL. Należy pamiętać o możliwości wywołania wstrząsu anafilaktycznego podczas szczepienia pacjenta uczulonego na lateks szczepionką niezawierającą alergenów NRL, ale przy użyciu rękawiczek lateksowych.
Piśmiennictwo do komentarza
1. Pałczyński C., Walusiak J., Ruta U., Górski P.: Occupational allergy to latex – life threatening reactions in health care workers. Reports of three cases. Int. J. Occup. Med. Environ Health, 1997; 10: 297–301
2. Dudek W., Walusiak J., Wittczak T. i wsp.: Natural rubber latex allergy: antigen specific IgE In Polish blood donors, prevalence and risk factors – preliminary data. Int. J. Occup. Med. Environ Health, 2005; 18: 35–42
3. Scientific Committee on Medical Products and Medical Devices: Opinion on natural rubber latex allergy. European Commission, Health & Consumer Protection Directorate – General. Doc. Sanco/SCPMD/2000/0009 Final
4. Lear J.T., English J.S.: Anaphylaxis after hepatitis B vaccination. Lancet, 1995; 345: 1249
dr med. Hanna Czajka
Wojewódzka Poradnia Chorób Zakaźnych Wojewódzkiego Specjalistycznego Szpitala Dziecięcego im. św. Ludwika w Krakowie
Komentarz do wytycznych dotyczących zasad postępowania w przypadkach niepożądanych odczynów poszczepiennych (NOP) o podłożu alergicznym z punktu widzenia lekarza praktyka wymaga odwołania się do własnych doświadczeń, zebranych podczas blisko 20 lat pracy w poradni konsultacyjnej ds. szczepień ochronnych, a w szczególności do:
- analizy przyczyn skierowań pacjentów do prowadzenia szczepień w poradni lub ich kontynuacji oraz
- przyczyn obaw lekarzy i rodziców co do prowadzenia szczepień z uwagi na ryzyko wystąpienia reakcji alergicznych, zwłaszcza u dzieci z obciążającym wywiadem alergicznym.
Najczęstszą przyczyną o podłożu alergicznym, wskazywaną przez lekarzy w skierowaniach do poradni lub podkreślaną w wywiadach przez rodziców dzieci, jest wysypka po spożyciu białek jaja kurzego i wynikające z tego faktu obawy co do zastosowania szczepionki przeciwko odrze, śwince i różyczce (MMR).
Do najczęstszych przyczyn skierowań odwołujących się do NOP po wcześniej wykonanych szczepieniach należą: pokrzywka lub wysypka uogólniona o innej morfologii, odczyny miejscowe, gorączka oraz niepokój dziecka, które – podobnie jak wskazane wyżej reakcje alergiczne – nie stanowią przeciwwskazania do rozpoczęcia szczepień lub ich kontynuowania. Powyższe obserwacje pokrywają się z zaleceniem 1. komentowanych wytycznych.
Stwierdzenie 2., wskazujące na wyjątkowo rzadkie występowanie w Stanach Zjednoczonych wstrząsu anafilaktycznego jako reakcji poszczepiennej, w pełni pokrywa się z danymi polskimi, publikowanymi w corocznych raportach Państwowego Zakładu Higieny w Warszawie. Po uwzględnieniu niedoskonałości naszego systemu rejestracji NOP oraz braku dokładnych danych dotyczących ogólnej liczby podanych dawek szczepionek należy stwierdzić, że na obszarze naszego kraju rocznie obserwuje się co najwyżej kilka przypadków ostrej reakcji anafilaktycznej po szczepieniu (tab.).
Na podstawie blisko 20 lat codziennych spotkań z dziećmi z utrudnieniami w realizacji programu szczepień mogę stwierdzić, że przypadki NOP o podłożu alergicznym, mieszczące się w granicach definicji natychmiastowej reakcji alergicznej (reakcji anafilaktycznej), zdarzają się niezwykle rzadko.
| Tabela. Liczba najczęstszych NOP zarejestrowanych w Polsce w latach 2009–2011 wg danych PZH3-5 | ||||
|---|---|---|---|---|
| Rodzaj odczynu | 2009 r. | 2010 r. | 2011 r. | |
| miejscowy (ogółem) | 426 | 476 | 583 | |
| ogólny (ogółem) | 626 | 635 | 632 | |
| w tym gorączka | 327 | 354 | 341 | |
| w tym >39°C | 130 | 134 | 144 | |
| alergiczny (ogółem) | 87 | 106 | 115 | |
| w tym pokrzywka | 44 | 66 | 30 | |
| w tym wysypka uogólniona | 34 | 21 | 24 | |
| wstrząs anafilaktyczny | 4 | 3 | 0 | |
| NOP – niepożądane odczyny poszczepienne | ||||
Równie rzadko występują takie przypadki wśród pacjentów kierowanych do poradni z powodu stwierdzanych w wywiadzie poprzedzającym szczepienie objawów alergii o nasileniu spełniającym kryteria reakcji anafilaktycznej.1
Zalecenie 4., dotyczące oznaczania stężenia swoistych przeciwciał IgG przeciwko antygenom drobnoustroju zawartego w szczepionce, podejrzewanej o spowodowanie NOP, jest stosunkowo często wykorzystywane w praktyce i pozwala na podjęcie decyzji o ponownym szczepieniu lub o odroczeniu szczepienia. Przykładowo wystąpienie małopłytkowości po podaniu szczepionki MMR wymaga zachowania szczególnej ostrożności przy kwalifikacji do podania kolejnej dawki (dawniej tzw. przeciwwskazanie względne) i w takim przypadku szczególnie pomocne dla wyważenia ryzyka zachorowania w porównaniu ze stopniem zagrożenia reakcją niepożądaną po kolejnej dawce szczepionki jest określenie stężenia swoistych przeciwciał IgG przeciwko odrze. Wraz z kolejnymi dawkami szczepionki DTP lub Td zwiększa się również ryzyko wystąpienia nadmiernego odczynu miejscowego i gorączki, szczególnie odczynów obejmujących stawy sąsiadujące z miejscem podania szczepionki, wraz z towarzyszącą tym objawom wysoką gorączką. W takich przypadkach oznaczenie IgG przeciwko tężcowi i błonicy pozwala, przy dużym stężeniu tych przeciwciał, na odroczenie kolejnej dawki szczepionki.2
Należy także zauważyć, że rodzice dzieci obciążonych dużym ryzykiem wystąpienia reakcji anafilaktycznej preferują w przypadku konieczności wykonania kolejnych szczepień ich realizację w warunkach szpitalnych. Szczepienie takie poprzedzone jest pełną diagnostyką alergologiczną, testami skórnymi i badaniem swoistych przeciwciał IgE w surowicy krwi. W przypadku realizacji szczepień u pacjentów obarczonych dużym ryzykiem anafilaksji w warunkach ambulatoryjnych, standardowa obserwacja dziecka przez 30 minut po zabiegu wydaje się niewystarczająca.
Ze względu na ryzyko wystąpienia reakcji do 4 godzin po szczepieniu, pacjentów takich należy obserwować w ambulatorium co najmniej przez 4 godziny. Praktyka wskazuje, że ten sposób organizacji szczepień jest przyjmowany ze zrozumieniem i akceptowany przez rodziców dzieci.
Piśmiennictwo do komentarza
1. American Academy of Pediatrics. Hypersensitivity reactions after immunization. W: Pickering L.K., Baker C.J., Kimberlin D.W., Long S.S. (red.): Red Book: 2012 Report of the Committee on Infectious Diseases. Elk Grove Village, IL, American Academy of Pediatrics, 2012: 51–56
2. Kroger A.T., Atkinson W.L., Pickering L.K.: General immunization practices, vaccine components causing hypersensitivity. W: Plotkin S.A., Orenstein W.A., Offit P.A. (red.): Vaccines. Wyd. 6, Elsevier Saunders, 2012: 102–104
3. Narodowy Instytut Zdrowia Publicznego – Państwowy Zakład Higieny, Zakład Epidemiologii; Główny Inspektorat Sanitarny, Departament Zapobiegania oraz Zwalczania Zakażeń i Chorób Zakaźnych u Ludzi: Choroby Zakaźne i Zatrucia w Polsce w 2011 roku. Warszawa, 2012
4. Narodowy Instytut Zdrowia Publicznego – Państwowy Zakład Higieny, Zakład Epidemiologii; Główny Inspektorat Sanitarny, Departament Zapobiegania oraz Zwalczania Zakażeń i Chorób Zakaźnych u Ludzi: Choroby Zakaźne i Zatrucia w Polsce w 2010 roku. Warszawa, 2011
5. Narodowy Instytut Zdrowia Publicznego – Państwowy Zakład Higieny, Zakład Epidemiologii; Główny Inspektorat Sanitarny, Departament Zapobiegania oraz Zwalczania Zakażeń i Chorób Zakaźnych u Ludzi: Choroby Zakaźne i Zatrucia w Polsce w 2009 roku. Warszawa, 2010

























