Główne przeszkody w szybkim i szerokim udostępnieniu terapii innowacyjnych w Polsce obejmują zaległości w implementacji nowych leków, niedokładny proces szacowania efektu zdrowotnego, długi proces refundacji, a przede wszystkim niedofinansowanie systemu.

Fot. Adobe Stock
- Tylko 34% medykamentów autoryzowanych przez EMA jest dostępnych w krajach Europy Środkowo-Wschodniej UE
- Okres oczekiwania na innowacyjną terapię w tych krajach jest aż o 304 dni dłuższy niż w przypadku innych krajów Unii
- Produkty farmaceutyczne i technologie medyczne reprezentują łącznie 19,3% wszystkich polskich zgłoszeń patentowych składanych do EPO
- Polski rynek badań klinicznych jest wart około 2 mld zł, przy czym 98% z nich ma charakter komercyjny
- Konieczne jest wzmocnienie roli AOTMiT, co oznacza nie tylko stabilność dobrego finansowania jej działań, ale też maksymalne uniezależnienie od czynników politycznych
- Potrzebne jest stworzenie przejrzystych zasad eksperckiej, merytorycznej, klinicznej oraz ekonomicznej oceny nowych technologii medycznych
W opinii ekspertów projektu Polskie Zdrowie 2.0 jednym z istotnych elementów odbudowy systemu zdrowia publicznego i ograniczania długu zdrowotnego jest zapewnienie społeczeństwu możliwie szerokiego i szybkiego dostępu do innowacyjnych technologii zdrowotnych lekowych i nielekowych. – To właśnie ograniczenie dostępu do innowacyjnych terapii jest jedną z przyczyn gorszej kondycji zdrowotnej społeczeństwa Polski i innych krajów Europy Środkowo-Wschodniej. Długość życia ich mieszkańców jest o cztery lata krótsza, a umieralność z przyczyn sercowo-naczyniowych trzykrotnie większa niż w krajach tzw. „starej” Unii – czytamy w raporcie przygotowanym w ramach projektu Polskie Zdrowie 2.0.
Eksperci zaznaczyli, że obecnie pacjenci z krajów Europy Środkowo-Wschodniej UE mają dwukrotnie mniejsze szanse na otrzymanie innowacyjnej farmakoterapii. Tylko 34% medykamentów autoryzowanych przez Europejską Agencję Leków jest dostępnych w tych krajach, a okres oczekiwania na innowacyjną terapię jest aż o 304 dni dłuższy niż w przypadku innych krajów Unii. Podobnie ograniczony jest dostęp do nowoczesnych terapii sprzętowych.
Rozwój innowacyjnych technologii medycznych w Polsce
W raporcie przytoczono dane Europejskiego Urzędu Patentowego (EPO), według których technologie medyczne są wiodącą dziedziną wśród zgłoszeń patentowych z Polski. Dwa główne obszary związane z ochroną zdrowia – produkty farmaceutyczne i technologie medyczne – reprezentują łącznie 19,3% wszystkich polskich zgłoszeń patentowych składanych do EPO, w porównaniu do 15,3% w roku 2020. – Odzwierciedleniem powyższych danych są wartości dotyczące eksportu sprzętu i urządzeń medycznych z Polski, które wyniosły w 2019 r. 2,4 mld euro i były o 10% wyższe niż w poprzednim roku, gdy polscy producenci wyeksportowali sprzęt o wartości 2,2 mld euro – czytamy w raporcie.
Eksperci zaznaczają, że rośnie także znaczenie start-upów w zakresie wprowadzania nowych technologii na rynek, a raporty wskazują, że branża medtech jest jednym z najpopularniejszych obszarów ich działalności – w tej branży rozwija się ok. 13% polskich innowacyjnych spółek. Z przytoczonego w opracowaniu PAN raportu „Top Disruptors in Healthcare 2021” wynika, że ponad połowa badanych spółek działa w obszarze telemedycyny, 45% wskazuje na obszar AI/machine learning, a na trzecim miejscu są urządzenia medyczne ex aequo z obszarem danych medycznych (po 37%).
W badanej grupie start-upów 70% tworzy innowacje we współpracy ze szpitalami. W przypadku start-upów, których rozwiązania są rozwijane z wykorzystaniem sztucznej inteligencji, najczęściej wybieranymi sektorami były onkologia (22 startupy, 32% badanych), kardiologia (21 startupów, 31% badanych) oraz radiologia (19 startupów, 28% badanych)
Szczególna rola innowacyjności
W raporcie zaznaczono, że polski rynek badań klinicznych jest wart około 2 mld zł, przy czym 98% z nich ma charakter komercyjny, a niekomercyjne stanowią jedynie 2%, podczas gdy europejska średnia sięga ok. 30%. – Dowodzi to dużej dysfunkcji mechanizmów publicznych w tym zakresie i wskazuje na potrzebę zmian. Można się spodziewać, że powołanie Agencji Badań Medycznych (ABM) zmieni tę sytuację – stwierdzili eksperci.
Autorzy raportu zwracają również uwagę na ważną rolę ośrodków akademickich w procesie tworzenia innowacji w naszym kraju. Zgłoszenia uczelni lub instytutów badawczych stanowią ponad 40% wszystkich zgłoszeń z Polski złożonych w EPO – sytuacja ta jest dość wyjątkowa na tle innych krajów, gdzie wyraźnie dominuje w tym zakresie przemysł.
W raporcie podkreślono, że szczególną rolę innowacyjności dostrzegają też urzędy rejestracyjne. Amerykańska Agencja ds. Żywności i Leków (FDA) niektórym lekom nadaje status leku pierwszego w swojej klasie albo terapii przełomowej. W latach 2008-2017 FDA zarejestrowała 321 nowych technologii lekowych, z czego 46 w roku 2017. Europejska Agencja Leków wydaje rocznie średnio 87 pozytywnych opinii dotyczących wprowadzenia produktów leczniczych do obrotu, a także dopuszcza średnio 35 nowych substancji czynnych w różnych obszarach terapeutycznych. – Nie widać w tym zakresie wkładu polskiej myśli innowacyjnej, co wobec dużej dynamiki zgłoszeń patentowych może budzić wątpliwości dotyczące mechanizmów wdrażania innowacji w naszym kraju – czytamy w raporcie.
Eksperci zaznaczyli, że główne przeszkody w szybkim i szerokim udostępnieniu terapii innowacyjnych w Polsce obejmują zaległości w implementacji nowych leków, niedokładny proces szacowania efektu zdrowotnego, długi proces refundacji, a przede wszystkim niedofinansowanie systemu.
Przejrzyste zasady i szybki dostęp
Autorzy raportu wskazali, że ważne jest, aby społeczeństwo w jak najszybszym czasie otrzymało dostęp do innowacyjnych technologii w medycynie finansowanych w ramach środków finansowych przeznaczonych na publiczną opiekę zdrowotną.
W raporcie przywołano opracowany przez Agencję ds. Żywności i Leków (FDA) system kwalifikacji leków do czterech różnych grup: analiza priorytetów dostępu, przełomowa terapia, przyspieszona akceptacja i szybka ścieżka. Zaznaczono, że podobny system kwalifikacyjny powinien również obowiązywać w stosunku do innowacyjnych technologii nielekowych (sprzętowych). – Natomiast w przypadku tych technologii proces zgłaszania do AOTMiT jest inny od obowiązującego dla leków i prawdopodobnie wymaga to zmiany i ujednolicenia. Nie należy też zapominać, jak w przypadku technologii lekowych, o możliwościach wykorzystania Funduszu Medycznego – dodano.
Eksperci za konieczne uznali również stworzenie podobnego systemu dostosowanego do warunków polskich, który musi być przejrzysty, obiektywny i jednoznaczny w celu wydania oceny terapii, których wskazania obejmują niezaspokojone potrzeby medyczne. Zaznaczyli, że potrzebne jest wzmocnienie roli AOTMiT, co oznacza nie tylko stabilność dobrego finansowania jej działań, ale też maksymalne uniezależnienie od czynników politycznych.
W raporcie zaproponowano również zakup centralny leków onkologicznych lub stosowanych w tzw. chorobach sierocych na poziomie Komisji Europejskiej. – Niewątpliwie argument negocjacyjny z koncernami farmaceutycznymi przy tak dużym zakupie leków dla wielu krajów byłby ogromny. Pozwoliłoby to na obniżenie cen leków, a tym samym zwiększenie ich dostępności w krajach mniej zamożnych – stwierdzili eksperci. Dodali, że innym mechanizmem umożliwiającym dostęp do innowacji w medycynie jest zwiększenie udziału chorych na nowotwory w badaniach klinicznych (w Polsce jest to wciąż niewielka grupa chorych).
Według ekspertów kolejnym mechanizmem pomocnym przy zwiększeniu dostępu do technologii innowacyjnych w medycynie są tzw. instrumenty podziału ryzyka, które opierają się na przeniesieniu części ryzyka i kosztów na wnioskodawcę starającego się o ich finansowanie ze środków publicznych. Ich zastosowanie powinno być praktyczne klinicznie i oparte na wzajemnych korzyściach.
– Konieczna jest także personalizacja terapii w oparciu o czynnik predykcyjny (zwiększenie dostępności badań molekularnych nowotworów – molecular finger print), analizę potencjalnych działań niepożądanych terapii w odniesieniu do schorzeń współistniejących, dostosowanie do lokalizacji i dynamiki zmian chorobowych, stanu ogólnego chorych czy prognozowanego czasu przeżycia. To pozwala na kierowanie innowacyjnych terapii głównie tej do populacji pacjentów, która może odnieść rzeczywistą korzyść z zastosowanych innowacyjnych technologii – czytamy w raporcie.
Zdaniem autorów raportu potrzebne jest więc stworzenie przejrzystych zasad eksperckiej, merytorycznej, klinicznej oraz ekonomicznej oceny nowych technologii medycznych przez wzmocnienie roli już działających instytucji, jak np. AOTMiT i/lub ABM, oraz przez zaangażowanie w ten proces wiodących ośrodków medycznych w kraju. Analizy eksperckie powinny według nich opierać się na wynikach uznanych badań i opracowań naukowych, danych rejestrowych i HTA oraz opinii specjalistów, a ostateczny, a więc także polityczny, proces podejmowania decyzji w oparciu o ww. analizy powinien być przejrzysty publicznie i wyraźnie oddzielony od merytorycznej części eksperckiej.
Zintegrowanie systemu
Eksperci zaproponowali schemat wprowadzania innowacyjnych technologii medycznych (lekowych i nielekowych) w Polsce, który jest zgodny z obecnie obowiązującymi w Polsce zasadami zgłaszania innowacyjnych terapii:
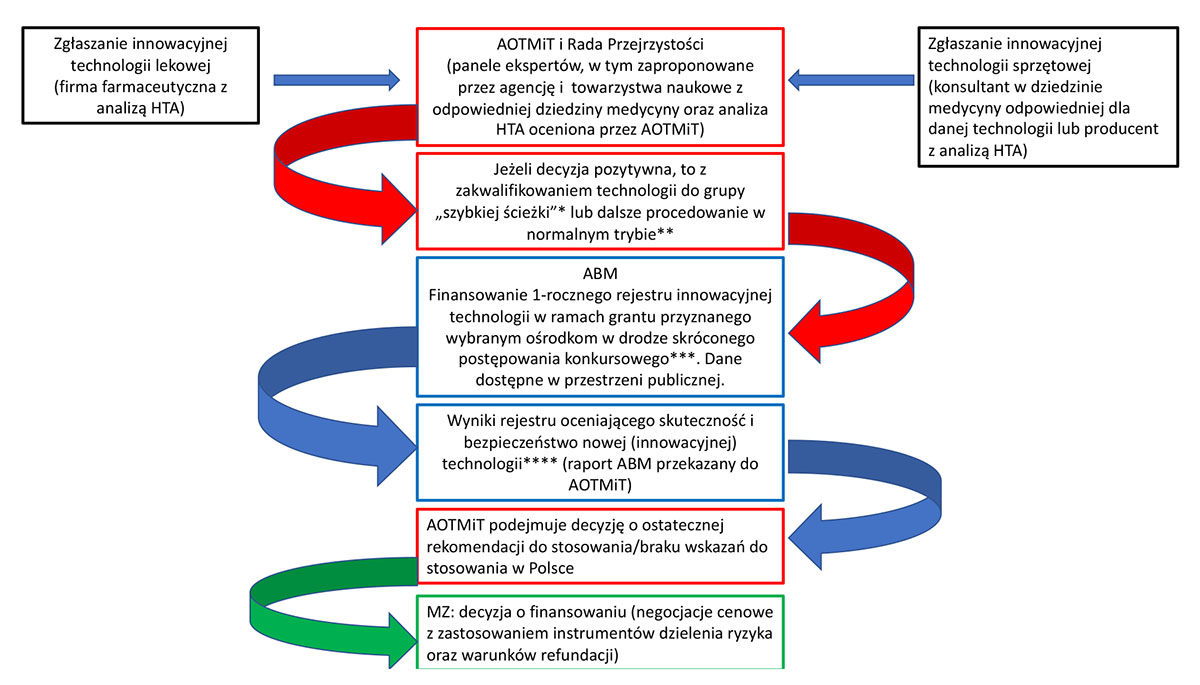
Rycina 1. Proponowany schemat wprowadzania innowacyjnych technologii medycznych w Polsce. Fot. PAN
Eksperci zaznaczyli, że w zaproponowanym modelu kluczowa jest rola szpitali mających status Państwowych Instytutów Badawczych oraz szpitali uniwersyteckich (akademickich) i innych jednostek będących regionalnymi centrami doskonałości. Dodali, że szpitale te powinny prowadzić ściśle kontrolowane, zlecone przez Ministerstwo Zdrowia i/lub Agencję Badań Medycznych rejestry nowych technologii medycznych, których wyniki pozwoliłyby na podjęcie decyzji o ewentualnym finansowaniu w kraju.
– Przy czym regionalne centra doskonałości, które powinny być powoływane na podstawie ściśle określonych kryteriów przez ministra zdrowia w porozumieniu z AOTMiT i NFZ, powinny być traktowane na równi (co najmniej ten sam poziom referencyjny) z jednostkami akademickimi, a ich rola nie powinna się ograniczać tylko do działalności usługowo-klinicznej (jako III poziom referencyjny), ale powinna obejmować również działalność badawczo-naukową przy uwzględnieniu ścisłej współpracy z jednostkami akademickimi na zasadzie partnerstwa. Jako centra doskonałości powinny prowadzić w pełnym tego słowa znaczeniu kształcenie podyplomowe w pełnym zakresie – czytamy w raporcie.
Według ekspertów konieczne jest więc zintegrowanie wprowadzania innowacji z całym, odpowiednio umocowanym i stabilnie zarządzanym systemem zdrowia publicznego w Polsce, z podziałem zadań między MZ, NFZ, AOTMiT, ABM, centra doskonałości oraz inne grupy eksperckie. Niezbędne jest również instytucjonalne centrum koordynujące (spośród instytucji już istniejących, jak np. AOTMiT czy MZ, albo stworzone de novo) o dużym poziomie niezależności i stabilnym budżecie
O projekcie Polskie Zdrowie 2.0
Projekt pt. „Ocena wybranych elementów systemu zdrowia w Polsce w oparciu o dowody naukowe i dobre praktyki innych krajów – Polskie Zdrowie 2.0” powstał z inicjatywy Komitetu Zdrowia Publicznego PAN. Działa on w ramach Wydziału V Nauk Medycznych Akademii. Naukowcy z Komitetu zaproponowali i koordynują działania w projekcie, ale grupa autorów zaangażowanych w Polskie Zdrowie 2.0 jest dużo większa.
Celem projektu jest edukacja i upowszechnianie nauki. Główną grupę docelową stanowią polscy politycy i osoby zajmujące się zdrowiem. Ekspertom zależy także na dotarciu do szerokiej opinii publicznej i dziennikarzy. Inicjatywa realizowana jest w okresie przedwyborczego przygotowywania programów dotyczących systemu ochrony zdrowia w Polsce przez główne podmioty polityczne. Autorzy liczą na wykorzystanie ich wiedzy w programach dotyczących polityki zdrowotnej w kraju.
Do przygotowania policy briefs zaproszono 64 polskich ekspertów – naukowców i doświadczonych praktyków, uczestników Systemu Opieki Zdrowia (SOZ) w Polsce.
Pełna treść dokumentu dostępna jest na stronie PAN

















