Lekarze powinni zwracać uwagę na pewne czynniki ryzyka – na to, czy ktoś w rodzinie przed 50. rż. miał zawał serca, udar mózgu, miażdżycę tętnic wieńcowych czy obwodowych, która wymagała interwencji medycznej. Najbliżsi krewni tej osoby powinni mieć wykonany lipidogram – mówi o diagnozowaniu hipercholesterolemii rodzinnej prof. Przemysław Mitkowski, prezes Polskiego Towarzystwa Kardiologicznego kadencji 2021–2023 oraz kierownik Pracowni Elektroterapii Serca w Uniwersyteckim Szpitalu Klinicznym w Poznaniu.

Prof. Przemysław Mitkowski. Fot. PTK
Jerzy Dziekoński: Co to są inhibitory konwertazy proproteinowej subtylizyny/keksyny typu 9 (PCSK9) i jak działają?
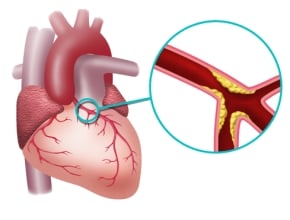
Prof. Przemysław Mitkowski: Jest to bardzo interesująca grupa leków. Są to przeciwciała przeciwko białku PCSK9, które reguluje gęstość receptorów dla lipoproteiny o małej gęstości (LDL), na powierzchni komórki wątrobowej. Wysokie stężenie białka PCSK9 powoduje, że te receptory ulegają zniszczeniu i nie wychwytują cząsteczek LDL, przez co dochodzi do zwiększenia stężenia cholesterolu we krwi, który odkłada się później w naczyniach. To jeden z patomechanizmów, który sprzyja progresji blaszki miażdżycowej.
Jaką mają postać te leki i jak się je stosuje?
Inhibitory PCSK9 to przeciwciała, podawane są drogą parenteralną. Iniekcje podskórne, w zależności od preparatu i dawki (ewolokumab, alirokumab), podaje się co dwa tygodnie albo raz w miesiącu. Natomiast mamy jeszcze jeden lek, który hamuje syntezę białka PCSK9 – inklisiran. Druga dawka inklisiranu podawana jest po trzech miesiącach od pierwszej, a kolejne co sześć miesięcy.
Czy są to leki bezpieczne i jakie są najczęstsze działania niepożądane związane z ich używaniem?
Najczęstsze działania niepożądane to odczyny w miejscu wkłucia. Jest ich rzeczywiście istotnie więcej w przypadku stosowania leku w porównaniu do placebo. Dosyć szybko przemijają, ale oczywiście powodują w ciągu krótkiego czasu pewne dolegliwości, podobnie jak w przypadku innych leków podawanych w postaci iniekcji. Jeżeli chodzi o pozostałe działania niepożądane, są one znikome i występują z podobną częstością jak w przypadku podawania placebo.
Gdzie te leki są dostępne w kraju i w jaki sposób pacjent może mieć do nich dostęp?
Są to leki wydawane na receptę, czyli można je kupić w aptekach, natomiast jest to terapia dosyć droga, na którą nie każdy mógłby sobie pozwolić bez wsparcia państwa. Koszt, optymistycznie mówiąc, to od kilkunastu do dwudziestu tysięcy złotych rocznie, niezależnie od tego, który lek wybierzemy. Jest to na pewno droga terapia, ale nie najdroższa, jeżeli chodzi o terapię hipolipemizującą. Inhibitory PCSK9 są w całości refundowane, ale tylko w ramach programu lekowego o nazwie „B101 leczenie pacjentów z zaburzeniami lipidowymi ICD 10:E78.01, I21, I22, I25)”. Oczywiście, jak w przypadku wszystkich programów lekowych, kryteria włączenia są ściśle określone. W związku z czym tylko osoby, które je spełniają, mają możliwość korzystania z tej terapii bezpłatnie.
Od 1 listopada 2022 r. Minister Zdrowia zmodyfikował na wniosek Polskiego Towarzystwa Kardiologicznego kryteria włączenia pacjentów do programu lekowego B101, a od 1 września 2023 r. zdecydował o refundacji leku lomitapid, który jest przeznaczony do leczenia chorych z homozygotyczną hipercholesterolemią rodzinną. Jest to niezwykle rzadka jednostka chorobowa – dotychczas w Polsce rozpoznano dwa przypadki. Terapia jest dramatycznie kosztowna, według danych dostępnych w internecie są to kwoty rzędu stu tysięcy złotych miesięcznie.
Dla kogo przeznaczony jest aktualnie program lekowy? Czy wiadomo, ile osób korzysta z programu, a ile teoretycznie powinno z niego korzystać?
To bardzo dobre pytanie, na które nie ma jednoznacznej odpowiedzi. Jeśli chodzi o kryteria włączenia pacjentów do programu, najnowsze obowiązują od 1 listopada 2022 r. i, jak już wspomniałem, dzięki staraniom Polskiego Towarzystwa Kardiologicznego zostały wówczas nieco zliberalizowane. Mamy w tej chwili dwa „ramiona” programu B101. Pierwsze dotyczy hipercholesterolemii rodzinnej (heterozygotycznej i homozygotycznej), czyli uwarunkowanego genetycznie defektu receptorów LDL na komórce wątrobowej, a drugie – chorych wysokiego ryzyka rozwoju miażdżycowej choroby układu sercowo-naczyniowego.
W programie są obecnie dostępne cztery leki: inhibitory białka PCSK9, czyli alirokumab i ewolokumab; trzecim lekiem jest inklisiran, mały interferujący kwas rybonukleinowy, który hamuje produkcję białka PCSK9 w komórce wątrobowej. Czwartym lekiem jest wspomniany powyżej lomitapid, należący do osobnej grupy leków (inhibitor mikrosomalnego białka transportującego triglicerydy w hepatocycie).
W przypadku heterozygotycznej hipercholesterolemii rodzinnej pacjenci muszą spełnić następujące kryteria: wiek ≥18 lat, rozpoznana heterozygotyczna postać hipercholesterolemii rodzinnej, czyli >8 punktów w tzw. skali holenderskiej (Dutch Lipid Clinic Network – DLCN) i to, co jest najważniejsze: utrzymywanie się stężenia cholesterolu LDL >100 mg/dl (>2,5 mmol/l) pomimo stosowania diety oraz intensywnego leczenia statynami w maksymalnie tolerowanych dawkach przez 3 miesiące, w tym przez miesiąc w skojarzeniu z ezetymibem w dawce 10 mg.
Nowym kryterium włączenia do programu w ramach ramienia hipercholesterolemii rodzinnej, obowiązującym od 1 listopada 2022 r., jest udokumentowany brak tolerancji co najmniej dwóch statyn – jednej w najmniejszej, początkowej dawce na dobę, a drugiej w dowolnej dawce.
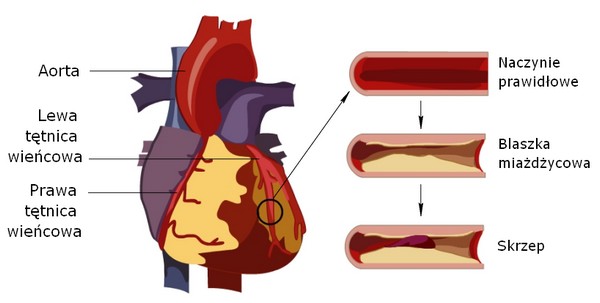
W drugim ramieniu programu leczenie obejmuje pacjentów wyłącznie w ramach prewencji wtórnej – żeby zostać włączonym do programu chory musi mieć objawową chorobę miażdżycową. Musimy potwierdzić przebyty zawał serca, który wystąpił do 24 miesięcy przed momentem kwalifikacji pacjenta do programu oraz pacjent musi mieć udokumentowane zmiany miażdżycowe w tętnicach wieńcowych w koronarografii albo w tomografii tętnic wieńcowych. Dodatkowo spełnione musi być co najmniej jedno kryterium dotyczące albo miażdżycy naczyń wieńcowych, albo miażdżycy innych tętnic (domózgowych lub kończyn dolnych). Kryteria włączenia do programu związane z naczyniami wieńcowymi są następujące: stwierdzony w wywiadzie przynajmniej jeszcze jeden zawał lub pierwszy zawał wystąpił u pacjenta w wieku <50 lat, lub został wykonany poprzednio zabieg angioplastyki wieńcowej lub pomostowania aortalno-wieńcowego w chorobie wielonaczyniowej, lub istnienie wielonaczyniowej choroby wieńcowej, którą definiujemy jako co najmniej 50% zwężenie światła naczynia w co najmniej w dwóch naczyniach.
Kryteria „nie wieńcowe” to: choroba naczyń obwodowych, czyli na przykład chromanie przestankowe objawiające się jako ból przy przejściu krótkiego dystansu, potwierdzone na przykład wartością wskaźnika kostka-ramię <0,85 albo przebytą rewaskularyzacją tętnic obwodowych lub amputacją kończyny z powodu choroby miażdżycowej. Kryterium włączającym jest też choroba tętnic mózgowych, czyli: przemijający epizod niedokrwienny (TIA), lub przebyty udar niedokrwienny, lub przebyta rewaskularyzacja tętnic dogłowowych.
Mówiąc o populacji, która może skorzystać na udziale w programie lekowym, trzeba odnosić się jednak do wszystkich wymienionych wyżej kryteriów. Obecnie po modyfikacji programu B101 w roku 2022, w jego ramach leczonych jest około 1,2 tys. chorych, z czego około tysiąc chorych z hipercholesterolemią rodzinną i jedynie niewiele ponad 200 w drugim ramieniu – tj. dotyczącym chorych po zawale serca z bardzo wysokim ryzykiem chorób układu sercowo-naczyniowego. Przewidywaliśmy, że takich chorych powinno być około 2-3 tysięcy. Musimy zdawać sobie sprawę z tego, że w naszym kraju rozpoznawanie hipercholesterolemii rodzinnej jest zdecydowanie poniżej tego, czego możemy się spodziewać po danych epidemicznych. Szacuje się, że przypadek hipercholesterolemii rodzinnej pojawia się z częstością raz na 250 osób, czyli dosyć często. Oznacza to, że w Polsce takich osób może być nawet 150 tys., a my w tej chwili leczymy około 1000 chorych. Co prawda myślę, że te oczekiwane wartości mogą być nieco zawyżone, co nie zmienia faktu, że rozpoznajemy ok. 5% przypadków hipercholesterolemii rodzinnej. W najbardziej optymistycznych szacunkach zbliżamy się do 10%. Myślę, że świadomość występowania tej jednostki chorobowej powinna być zdecydowanie większa, nie tylko wśród lekarzy, personelu ochrony zdrowia, ale także wśród pacjentów.
Jakie są wskazania do stosowania inhibitorów PCSK9 i czy pokrywają się z kryteriami włączenia do programu?
W tej chwili w kryteriach włączenia do programu granicę stężenia cholesterolu LDL ustalono na 100 mg/dl, czyli na wartość 2,5 mmol/l. Są to zdecydowanie wyższe wartości niż te, o które nam chodzi. Zalecenia towarzystw naukowych, przede wszystkim Europejskiego Towarzystwa Kardiologicznego, którego stanowisko z punktu widzenia kardiologów jest najbardziej istotne, mówią, że w prewencji wtórnej, czyli u chorego, który miał już epizod objawowej miażdżycy tętnic wieńcowych, domózgowych czy kończyn dolnych, stężenie cholesterolu LDL powinno wynosić <55 mg/dl. A w przypadku wystąpienia dwóch takich epizodów w ciągu dwóch lat lub w krótszym okresie, nawet <40 mg/dl, co odpowiednio jest równoważne wartościom 1,2 mmol/l oraz 1 mmol/l. Pamiętajmy, że wartości docelowe są często uzyskiwane już podczas leczenia statyną w dużej dawce w połączeniu z ezetymibem. W ciągu ostatniego roku bardzo intensywnie pracowaliśmy nad zwiększeniem świadomości celów leczenia hipolipemizującego w zakresie osiągania stężeń cholesterolu LDL w surowicy, przede wszystkim u chorych w prewencji wtórnej. Jeśli celu nie udaje się osiągnąć lub leczenie jest źle tolerowane, zaleca się włączenie do leczenia PCSK9. Środowisko zawnioskowało do Ministerstwa Zdrowia o obniżenie tego kryterium, aby możliwe było objęcie większej grupy pacjentów – naszym zdaniem powinno to być 70 mg/dl.
Ile ośrodków w kraju realizuje program lekowy? Czy planowane jest zwiększenie tej liczby albo poszerzenie wskazań do leczenia PCSK9 w ramach aktualnego programu lekowego?
Mamy w Polsce ok. 50 ośrodków, które realizują ten program. Trzeba przy tym wspomnieć, że w niektórych ośrodkach są dwa takie miejsca, czyli na przykład oddział kardiologiczny i poradnia, ponieważ leczenie można włączyć w warunkach szpitalnych, jak i ambulatoryjnych. W każdym województwie jest przynajmniej jeden taki ośrodek, więc dostępność jest całkiem dobra.
Jak ocenia Pan dotychczasowe wyniki programu lekowego? Czy można już pokusić się o taką ocenę?
Wiemy, że te leki na pewno działają – dołączone do standardowego leczenia dodatkowo obniżają stężenie cholesterolu LDL mniej więcej o połowę. Stosując silną statynę w dużej dawce wraz z ezetymibem możemy obniżyć stężenie cholesterolu LDL nawet o 50-65%. Dołączenie nowoczesnych leków pozwala na redukcję cholesterolu LDL o 85%. Oznacza to, że z udziałem nowych cząsteczek w przypadku przeważającej większości chorych, pokuszę się nawet o stwierdzenie: niemal u wszystkich, jesteśmy w stanie osiągnąć cel terapeutyczny.
W jaki sposób w Polsce diagnozuje się hipercholesterolemię rodzinną? Jak dużej populacji dotyczy ta choroba i jaka jest rola lekarza rodzinnego w opiece nad tą grupą chorych?
Jako takie ustrukturyzowane badania przesiewowe tym zakresie nie są wykonywane. Profil lipidowy profilaktycznie często jest oznaczany dopiero w ramach programu „Profilaktyki chorób układu krążenia (CHUK)” lub ostatnio w ramach programu „Profilaktyka 40 Plus”, a to zdecydowanie za późno. Dlatego lekarze powinni zwracać uwagę na pewne czynniki ryzyka – na to, czy ktoś w rodzinie miał w wieku <50 lat zawał serca, udar mózgu, miażdżycę tętnic wieńcowych czy obwodowych, która wymagała interwencji medycznej. Najbliżsi krewni tej osoby powinni mieć jak najszybciej wykonany lipidogram – oczywiście w przypadku, kiedy u pacjenta z przebytym epizodem niedokrwiennym stwierdzono podwyższone stężenia cholesterolu. I to niezależnie od wieku. Badanie to powinno się wykonać wówczas nawet w przypadku małych, kilkuletnich dzieci. Musimy zdawać sobie sprawę z tego, że cholesterol nie zabija od razu. To nie jest uraz komunikacyjny, że dotychczas ktoś był zdrowy i nagle coś się stało. Miażdżyca tętnic wieńcowych jest chorobą postępującą, zależną od stężenia cholesterolu oraz czasu ekspozycji na podwyższony cholesterol. Po rozpoznaniu hiperlipidemii, wdrażając terapię na każdym etapie życia, poprawimy rokowanie, zmniejszamy nachylenie krzywej prowadzącej do zawału serca, udaru mózgu czy zmian miażdżycowych w tętnicach obwodowych. Ale to, co straciliśmy przez lata, gdy choroba nie była rozpoznana, a leczenie nie podejmowane, co odłożyło się w naczyniach, nie zostanie w istotnym stopniu usunięte. Wiemy także, że obniżenie stężenia cholesterolu do wartości <55 mg/dl sprawia, że blaszka nie przyrasta, a wydaje się, że ma tendencję do regresji, przede wszystkim, jeżeli chodzi o jej tzw. ciekłe jądro lipidowe. Dodatkowo ulega pogrubieniu czapeczka łącznotkankowa nad tą blaszką. Jest to pewien mechanizm zabezpieczający przed pęknięciem blaszki, a zatem przed stworzeniem sytuacji, w której dochodzi do ostrego niedokrwienia, w tym np. do ostrego zespołu wieńcowego, który może doprowadzić do zawału mięśnia sercowego.
Gdy zatem lekarz zidentyfikuje już hiperlipidemię u osoby obciążonej wywiadem rodzinnym przedwczesnej choroby układu krążenia – co powinien zrobić dalej? Kto zajmuje się dalszą diagnostyką?
W takiej sytuacji lekarz powinien niezwłocznie rozpocząć leczenie przy użyciu powszechnie dostępnych i refundowanych leków, czyli silnej statyny. Skuteczność leczenia powinna być monitorowana po 4-6 tygodniach od eskalacji leczenia hipolipemizującego. Dodatkowo powinno się ocenić ryzyko hipercholesterlemii rodzinnej na podstawie skali DLCN oraz ryzyko epizodów miażdżycowych na podstawie skali Pol-SCORE. Oczywiście, nie ma sensu rozpoczynanie leczenia od małej dawki statyny, jeżeli na podstawie aktualnego profilu lipidowego i celu terapeutycznego musimy obniżyć stężenie cholesterolu o więcej niż 50%. Jeżeli kolejne intensyfikacje leczenia nie powodują osiągnięcia celu lipidowego lub wystąpienia cech nietolerancji statyn, lekarz powinien skierować chorego do poradni zaburzeń lipidowych.
Czy w najbliższych latach możemy spodziewać się jeszcze nowszych leków, które będzie można stosować w leczeniu hipercholesterolemii? Czy jakieś inne cząsteczki mogące obniżać cholesterol znajdują się, wedle Pańskiej wiedzy, na zaawansowanych etapach badań klinicznych?
Warto wspomnieć o kwasie bempediowym, który najprawdopodobniej na początku 2024 roku będzie dostępny również w Polsce. Jest to lek działający na nieco innej zasadzie niż statyny. Powoduje obniżenie stężenia cholesterolu nawet o dwadzieścia kilka procent. To lek podawany w postaci tabletki.
W trakcie badań klinicznych są kolejne inhibitory białka PCSK9 i wiele wskazuje na to, że będziemy mieli większy wybór preparatów w tej grupie. Natomiast „szlagierem” ostatnich miesięcy są leki zmniejszające stężenie lipoproteiny (a). Jest to lipoproteina wpływająca silnie na tworzenie i powiększanie się blaszek miażdżycowych. Do niedawna uważaliśmy, że jej stężenie wystarczy oznaczyć raz w życiu, ponieważ jest ona stosunkowo mało zmiennym markerem ryzyka. Dzisiaj wiemy, że jednak w pewnych sytuacjach powinno się ją oznaczyć co najmniej dwa razy w życiu.
Mamy pierwsze leki wpływające na stężenie lipoproteiny (a), które przeszły już próby kliniczne. Czekamy na ich pojawienie się na rynku. Dotyczy to preparatów takich jak pelakarsen, olpasiran, czy inne sirany, np. lepodisiran, którego korzyści były przedstawiane w trakcie kongresu American Heart Association w 2023 roku. Sirany to nowa grupa leków, składających się z krótkiego interferującego RNA, który blokuje syntezę odpowiedniego białka, w tym wypadku wchodzącego w skład lipoproteiny (a). Wiele firm, wykorzystując tę technologię, zaczęło produkować leki, które mają zmniejszyć stężenie lipoproteiny (a). Ryzyko chorób sercowo-naczyniowych zaczyna wzrastać jeżeli stężenie tej cząsteczki wynosi >30 mg/dl, a po przekroczeniu stężenia 50 mg/dl staje się bardzo wysokie.
Czasami przy okazji kongresów i konferencji międzynarodowych uczestniczący w nich lekarze mają możliwość oznaczenia stężenia tej lipoproteiny. Skorzystałem z takiej możliwości dwa lata temu i ku mojemu zadowoleniu mam bardzo niskie stężenie tej substancji.
Wprowadzanie nowych leków jest bardzo ważne, ale trzeba też zaznaczyć, że leczenie dostępnymi, w pełni refundowanymi preparatami jest również bardzo skuteczne. Wystarczy spojrzeć na badania dotyczące populacji objętej opieką w ramach programu KOS-Zawał, które zostały ostatnio opublikowane na łamach Kardiologii Polskiej.
Wyniki są bardzo ciekawe i pokazują, że objęcie chorego programem KOS-Zawał i leczenie statynami w wysokiej dawce wraz z ezetymibem daje bardzo dobre rezultaty. Po 12 miesiącach jedynie u 1,2% pacjentów stężenie cholesterolu LDL przekracza granicę 100 mg/dl (2,5 mmol/l) – aktualnego progu włączenia do programu lekowego. Udowadnia to, że leczenie standardowymi, refundowanymi lekami jest na tyle skuteczne, że w zasadzie nie ma wielu kandydatów do programu B101 w ramach obowiązujących kryteriów. Natomiast gdybyśmy ten próg ustawili na 70 mg/dl – o taką modyfikację kryteriów wejścia do programu B101 wnioskowaliśmy do Ministerstwa Zdrowia – to wówczas do programu lekowego kwalifikowałoby się jedynie 17% pacjentów objętych opieką w KOS-Zawał. Przy 67 tys. zawałów rocznie nie jest to jakaś wielka grupa. Zakładając, że musimy nałożyć na te 17% pacjentów inne kryteria włączenia do programu B101, szacunki wskazują, że jest to ok. 2 tys. pacjentów rocznie. Jest to grupa naprawdę wysokiego ryzyka, wielu z tych chorych będzie miało powtórny zawał albo rewaskularyzację. Myślę, że jest o co walczyć.
Rozmawiał Jerzy Dziekoński