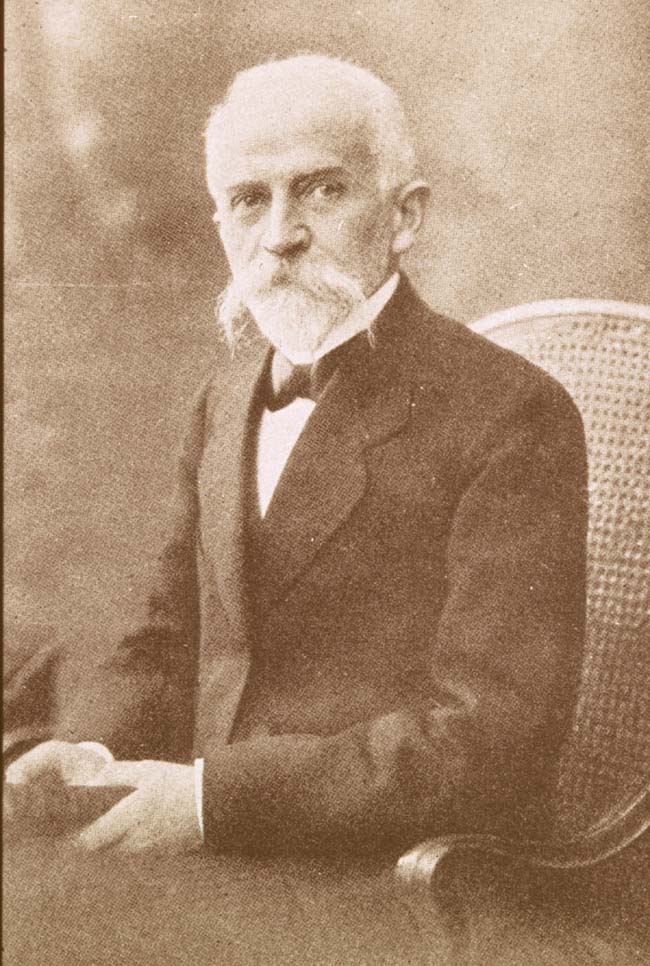Pierwsze antybiotyki były naturalnie występującymi w przyrodzie substancjami, a ich odkrycie wymagało szczęśliwego zbiegu okoliczności, a następnie miesięcy czy nawet lat żmudnej pracy prowadzącej do wyizolowania czynnej substancji i jej charakterystyki.

Alexander Fleming podczas pracy w swoim laboratorium w szpitalu St Mary's w Londynie. Fot. UK Ministry of Information Photo Division z kolekcji Imperial War Museums, domena publiczna, via Wikimedia Commons
- Chleb z pleśnią znali i z powodzeniem stosowali do leczenia ran starożytni Egipcjanie, Chińczycy czy Grecy
- Jako pierwszy terminu „antybiotyk” użył w 1889 roku francuski lekarz, botanik i mykolog Jean Paul Vuillemin
- Zazwyczaj początki nowoczesnej „ery antybiotyków” wiąże się z nazwiskami Paula Ehrlicha i Alexandra Fleminga
- Sulfonamidy – pierwsza grupa efektywnych leków o szerokim spektrum działania – ocaliły życie wielu ludziom, w tym m.in. Franklinowi D. Rooseveltowi czy Winstonowi Churchillowi
- Sir Aleksandrowi Flemingowi przypisuje się niezwykle skromną opinię na temat własnego wynalazku: „To natura wyprodukowała penicylinę, ja ją tylko odkryłem”
- Fleming był także jednym z pierwszych, którzy przestrzegali przed potencjalną opornością na penicylinę, jeśli będzie ona stosowana w zbyt małych ilościach lub przez zbyt krótki okres leczenia
- Śmiertelność z powodu infekcji bakteryjnych wielolekoopornych nieustannie rośnie – co roku umiera na nie nawet 2 mln ludzi na świecie
- Specjaliści szacują, że do roku 2050 tego typu zakażenia staną się przyczyną większej liczby zgonów niż nowotwory
Choć znamy i stosujemy antybiotyki od ponad 70 lat, infekcje i zakażenia nie odeszły w mroki historii i nadal nas nękają. Ignorowanie ostrzeżeń o spadku skuteczności antybiotykoterapii po dziesięcioleciach nadużyć w leczeniu ludzi oraz zwierząt, a także stosowania antybiotyków w hodowli przemysłowej stało się przyczyną jednego z najbardziej palących problemów, z jakimi mierzy się współczesna nauka. Choroby zakaźne należą obecnie do pierwszej dziesiątki najczęstszych przyczyn zgonów, a oporność na antybiotyki stanowi ogromne wyzwanie w dziedzinie zdrowia publicznego.
Podobnie jak inne zwierzęta, także my, ludzie, żyjemy wśród bakterii, wirusów i różnych drobnoustrojów, z których część jest dla nas niegroźna, ale inne bywają dla nas zabójcze. Ten stan rzeczy trwa od początków naszego gatunku, choć niewiele wiemy o tym, z jakimi chorobami zmagali się nasi praprzodkowie. Wiemy jednak, że wraz z powstawaniem pierwszych dużych osad, rozwojem handlu, konfliktami wojennymi czy hodowlą zwierząt udomowionych niektóre choroby zaczęły szerzyć się na nieznaną wcześniej skalę.
Miód, cebula... piwo z antybiotykiem
Obecnie naukowcy znają ponad 70 tys. związków będących naturalnymi antybiotykami. Istnieją one w naszym otoczeniu od zawsze, choć stosunkowo niedawno poznaliśmy sposoby ich izolacji i produkcji w postaci leku o maksymalnej skuteczności. Już tysiące lat temu znano i stosowano wiele naturalnych środków, jak miód czy zioła. Chleb z pleśnią znali i z powodzeniem stosowali do leczenia ran starożytni Egipcjanie, Chińczycy czy Grecy. W datowanym na 1550 roku p.n.e. Papirusie Ebersa znajdujemy zapisy o spleśniałym chlebie i leczniczej glinie, a kilka lat temu naukowcy odtworzyli anglosaski przepis z IX wieku, wykorzystujący m.in. cebulę i czosnek, który prawie całkowicie zniszczył oporne na metycylinę bakterie gronkowca złocistego. Z kolei w Nubii ok. V-VI w. stosowano w celach leczniczych piwo zawierające tetracyklinę.
Te choroby, które dzisiaj określamy mianem zakaźnych, przez wieki nie posiadały swoich nazw i często nie odróżniano ich między sobą, choć znano i opisywano ich objawy. Hipokrates, który żył na przełomie V i IV w. p.n.e. wierzył, że – poza karą boską – choroba może mieć przyczyny zewnętrzne (tzw. miazmaty – szkodliwe wydzieliny niektórych miejsc) lub wewnętrzne (nierównowaga tzw. humorów w ciele pacjenta).

Portret prawdop. Girolamo Fracastoro przypisywany Tycjanowi. National Gallery, Londyn. Fot. domena publiczna, via Wikimedia Commons
W epoce nowożytnej zaczęły pojawiać się nowe poglądy na przyczyny zakażeń – włoski lekarz Girolamo Fracastoro (1478–1553) posługiwał się pojęciami pestilentiae i morbes contagiones. Ten wybitny humanista, zresztą przyjaciel Mikołaja Kopernika z czasów studiów medycznych w Padwie, napisał traktat Syphilis sive Morbus Gallicus poświęcony szerzącej się wówczas w Europie kile. Wywiódł ją od mitologicznego pasterza Syfilusa. Sławę przyniosła mu jednak inna praca – De contagione et contagiosis morbis wydana w 1546 roku. Ów „kontagion”, czyli czynnik zakaźny, przenosił chorobę poprzez kontakty między ludźmi czy przedmioty, ale także na odległość, drogą powietrzną (tzw. „morowe powietrze”).
Jednak o znaczeniu i roli bakterii świat miał usłyszeć dopiero niemal trzy wieki później, dzięki odkryciom chemika Ludwika Pasteura (1822–1895) i lekarza Roberta Kocha (1843–1910). Robert Koch w 1873 roku rozpoczął badania nad laseczkami wąglika, dowodząc, że przyczyną choroby jest bakteria, która atakuje zarówno zwierzęta, jak i ludzi. Dzięki odkryciom Kocha świat poznał również bakterię wywołującą gruźlicę. Z kolei Ludwik Pasteur swoją tezę o chorobotwórczej działalności mikrobów ogłosił w 1879 roku na wykładzie w paryskiej Narodowej Akademii Medycznej. Obaj badacze zostali prekursorami bakteriologii i immunologii, a jednym z następstw odkrycia zarazków chorobotwórczych był rozwój badań nad sposobami leczenia wywoływanych przez nie chorób.

Ludwik Pasteur w laboratorium. Fot. Britannica Kids, domena publiczna, via Wikimedia Commons
Alchemia, jatrochemia, chemioterapia
Wraz z pierwszymi odkrytymi czynnikami zakaźnymi pojawiło się ogromne zainteresowanie sposobami walki z nimi. W wiek XX ludzkość wkraczała z nadzieją na to, że wielkie epidemie, które pochłonęły miliony istnień wreszcie odejdą w mroki historii. Rozwój nauki pozwolił wytyczyć kierunek zwalczania zarazków drogą seroterapii i poprzez inne rodzaje szczepień, nad którymi pracowali jeszcze Koch i Pasteur. Pojawiła się też druga możliwość, w wielu przypadkach znacznie skuteczniejsza – chemioterapia, następczyni słynnej jatrochemii, którą wyznawał i propagował Paracelsus (1493–1541).

Naczynie do przechowywania teriaku, 1641. Fot. Wellcome Collection, CC BY 4.0, via Wikimedia Commons
Przez wieki szukano leków w różnego rodzaju substancjach, minerałach czy środkach roślinnych. W dawnej Polsce leczono tzw. glinkami gruźlicę, dżumę, ukąszenia czy krwawienia, znano także słynną od antyku driakiew (teriak) – uniwersalną odtrutkę i panaceum, stosowaną m.in. na gorączki, trąd, syfilis czy żółtaczkę. W XVI wieku medycy wiedzieli już, że ekstrakt z kory chinowca skutecznie zwalcza malarię (choć nie wiedzieli jeszcze, że na skutek obecności chininy). Leczono się również złotem i srebrem (znanym w medycynie także dzisiaj), rtęcią (główny lek na syfilis zgodnie z powiedzeniem, że jedna noc w objęciach Wenery skutkuje potem resztą życia z Merkuriuszem), antymonem (tu przodował Paracelsus, którego zdaniem leczył on wszystkie choroby – iantimonum omnes morbos tollit). Związki antymonu ostatecznie odrzucono jako przynoszące pacjentom więcej szkody niż pożytku. Podobnie stało się w przypadku wielu substancji, w tym pierwszego szpitalnego leku, który dziś nazwalibyśmy antybiotykiem – Pyocyanase opartego na ekstraktach Pseudomonas aeruginosa (dawniej Bacillus pycyaneus), opracowanego w 1899 r. przez Rudolpha Emmericha i Oscara Löwa. Odkryli oni, że bakteria wyizolowana z bandaży chorych pacjentów hamuje rozwój innych mikrobów. Skuteczność substancji, którą błędnie określono jako enzym, była jednak niska, co więcej, okazała się toksyczna dla ludzi, więc wycofano ten lek jeszcze w pierwszej dekadzie XX wieku.
Jako pierwszy terminu „antybiotyk” użył w 1889 roku francuski lekarz, botanik i mykolog Jean Paul Vuillemin (1861–1932). W artykule Antibiose et symbiose zdefiniował pojęcie w następujący sposób: „Jeden organizm niszczy życie innego, by podtrzymać własne; pierwszy jest całkowicie aktywny, drugi całkowicie pasywny. Organizm aktywny jest ze wszech miar szkodliwy dla biernego. Jest to zjawisko tak częste w naturze, że nikt nie pomyślał o nadaniu mu nazwy. Zależność taka może być obserwowana na odosobnionym przykładzie, może również wystąpić w zjawiskach bardziej złożonych. Dlatego dla uproszczenia będziemy nazywać ją antybiozą”. Vuillemin w swoim artykule nie użył pojęcia antybiotyku w taki sposób, jak rozumiemy je dzisiaj, ale był niezwykle blisko współczesnego pojmowania takiej substancji, gdy pisał: „Najprostszym przykładem antybiozy są rośliny w stanie wegetacji, które nie wykazują żadnej odporności na inwazję szkodliwych mikroorganizmów”. Selman Waksman ponad pół wieku później w pracy Microbial antagonisms and antibiotic substances zdefiniował antybiozę jako zahamowanie wzrostu jednego organizmu przez drugi.
Zazwyczaj początki nowoczesnej „ery antybiotyków” wiąże się z nazwiskami Paula Ehrlicha i Alexandra Fleminga. Paul Ehrlich (1854–1915), współpracownik Kocha, bakteriolog i wybitny immunolog (twórca teorii odporności), na kongresie Berlińskiego Towarzystwa Medycznego w roku 1907 tak zdefiniował swoją misję i program badawczy: „Potrzebna nam jest chemotherapia specifica, znaczy to, iż szukamy czynników, które mogłyby zabijać niektóre pasożyty, nie czyniąc zbyt dużej szkody organizmowi”. Chemioterapię opisywał, używając metafory „magicznego pocisku”, który selektywnie namierzałby i niszczył mikroby chorobotwórcze, równocześnie jak najmniej szkody przynosząc pacjentowi. Zaobserwował, że anilina i inne syntetyczne barwniki dostępne w jego czasach barwiły niektóre mikroby, zaś innych nie.

Paul Ehrlich w swoim biurze we Frankfurcie nad Menem, 1910 r. Fot. Waldemar Franz Hermann Titzenthaler, domena publiczna, via Wikimedia Commons
W 1904 roku rozpoczął szeroko zakrojony program badawczy, którego celem miało być znalezieniem leku na syfilis, wywoływany przez krętek blady, odkryty w 1905 roku przez Fritza Schaudinna i Ericha Hoffmanna. Chorobę tę leczono przez stulecia za pomocą związków i preparatów na bazie rtęci, co wywoływało mnóstwo poważnych działań niepożądanych przy małej skuteczności terapii. Ehrlich wraz z chemikiem Alfredem Bertheimem oraz bakteriologiem Sahachiro Hata zsyntetyzowali setki pochodnych silnie toksycznego leku o nazwie Atoxyl i przetestowali uzyskane substancje na królikach zakażonych kiłą.

Zestaw do leczenia kiły Salvarsanem, Niemcy, 1909–1912. Fot. Wellcome Collection, CC-BY-4.0, CC BY 4.0, via Wikimedia Commons
W 1909 roku szósty z kolei związek w sześćsetnej serii testów, który otrzymał numer 606, okazał się skuteczny i został przetestowany na pacjentach cierpiących na syfilis. Ehrlich sam syntetyzował lek i rozprowadzał zgłaszającym się lekarzom. Pomimo żmudnej procedury wstrzykiwania i wielu działań niepożądanych (w tym nekrozy), lek pod nazwą Salvarsan okazał się wielkim sukcesem, a wraz z mniej toksycznym i wygodniejszym do podawania (rozpuszczalnym w wodzie) Neosalvarsanem cieszył się statusem najczęściej przepisywanych leków aż do pojawienia się penicyliny w latach 40.
Dzięki swoim odkryciom Ehrlich nie tylko zmienił oblicze medycyny, ale również otworzył drogę do poszukiwań leków przeciw drobnoustrojom. Wprawdzie jego marzenie o therapia sterilisans magna, która pozwalałaby na niszczenie zarazków za pomocą pojedynczych dawek potężnego leku ziściło się jedynie częściowo, ale systematyka testów przesiewowych legła u podwalin dalszych badań w przemyśle farmaceutycznym. W ten sposób odkryto i wprowadzono do medycyny tysiące leków, w tym antybiotyków. Przykładem mogą być sulfonamidy, a konkretnie pierwszy z nich – Prontosil, odkryty przez dwóch chemików firmy Bayer: Josefa Klarera i Fritza Mietzscha.
Z kolei niemiecki mikrobiolog, Gerhard Domagk (1895–1964) badał skuteczność barwników, w tym wspomnianego prontosilu należącego do sulfamidochryzoidyn przeciw bakteriom chorobotwórczym, zarówno in vivo, jak i in vitro. W roku 1939 otrzymał on Nagrodę Nobla za wykrycie nowej grupy chemioterapeutyków – sulfonamidów – niestety nie mógł jej odebrać z powodu zakazu Adolfa Hitlera. Dzięki prontosilowi uratował własną córkę przed amputacją ręki, ale sulfonamidy – pierwsza grupa efektywnych leków o szerokim spektrum działania – ocaliły życie wielu ludziom, w tym m.in. Franklinowi D. Rooseveltowi czy Winstonowi Churchillowi. Warto wspomnieć, że w Polsce działanie barwników, obok innych substancji, badał dyrektor Państwowej Stacji Bakteriologicznej w Krakowie, bakteriolog Filip Eisenbergh – autor ponad stu prac naukowych, który wprowadził do polskiej medycyny pojęcie immunochemii.
Od bezcennej pleśni do złotej ery antybiotyków
Pierwsze antybiotyki były naturalnie występującymi w przyrodzie substancjami, a ich odkrycie wymagało najpierw szczęśliwego zbiegu okoliczności, a następnie miesięcy czy nawet lat długiej i żmudnej pracy prowadzącej do wyizolowania czynnej substancji i jej charakterystyki. Sir Aleksandrowi Flemingowi (1881–1955) przypisuje się niezwykle skromną opinię na temat własnego wynalazku: „To natura wyprodukowała penicylinę, ja ją tylko odkryłem”.
Zanim doszło do wiekopomnego odkrycia, był on uznanym bakteriologiem z St. Mary’s Medical School w Londynie. Na początku września 1928 roku, przed wyjazdem na urlop, Fleming umieścił na szalkach Petriego bakterie gronkowca złocistego – Staphylococcus aureus. W tym samym budynku, piętro niżej, hodowano odmianę Penicillum notatum. Pleśń rozprzestrzeniła się po budynku i dostała się do szalek z gronkowcem. Po powrocie do laboratorium Fleming zauważył strefę zahamowania wzrostu bakterii na jednej z szalek, a substancję dyfundującą do podłoża nazwał penicyliną. Nie udało mu się jej nigdy oczyścić – badał jedynie filtraty hodowlane, stwierdzając ich wysoką aktywność.

Howard Florey, 1944. Fot. Fot. UK Ministry of Information Photo Division z kolekcji Imperial War Museums, domena publiczna
Przez ponad dekadę próbował zainteresować chemików oczyszczaniem i ustabilizowaniem nowej substancji czynnej. Dostarczał szczep Penicillium każdemu, kto chciał go badać. W roku 1935 dowiedział się, że dalsze prace nad oczyszczaniem i badaniem penicyliny przejęła grupa badaczy pracujących w Oksfordzie, kierowana przez profesora patologii – Howarda Floreya. Wraz z Ernstem Chainem i innymi współpracownikami uzyskali oni substancję rozpuszczalną w wodzie o wysokiej aktywności (raczej bakteriostatycznej niż bakteriobójczej) wobec gronkowców, paciorkowców oraz beztlenowej laseczki Clostridium septicum.
W 1945 roku Fleming, Florey i Cham za wykrycie i wprowadzenie penicyliny do terapii otrzymali Nagrodę Nobla. Warto podkreślić, że już na etapie odkrycia penicyliny Fleming sugerował możliwość miejscowego stosowania jej przeciwko powierzchniowym infekcjom skórnym i był jednym z pierwszych, którzy w praktyce lekarskiej zastosowali preparat Ehrlicha – salwarsan do leczenia syfilityków w Anglii. Fleming był także jednym z pierwszych, którzy przestrzegali przed potencjalną opornością na penicylinę, jeśli będzie ona stosowana w zbyt małych ilościach lub przez zbyt krótki okres leczenia.

Plakat przyczepiony do skrzynki pocztowej z radami dla żołnierzy podczas II wojny światowej: "Penicylina leczy rzeżączkę w 4 godziny". Fot. domena publiczna, via Wikimedia Commons
W trakcie II wojny światowej penicylina była powszechnie stosowana do leczenia infekcji wśród żołnierzy. W raportach lekarzy wojskowych znalazły się opisy leczenia zgorzeli gazowej, ran klatki piersiowej i głowy, skomplikowanych złamań i zmiażdżeń, posocznicy, zapalenia płuc, a także rzeżączki (w przypadkach, gdy posiadano zapasy leku). Pod koniec wojny penicylinę ochrzczono mianem „cudownego leku”, a jeszcze przed zakończeniem wojny powstał wielki program badawczy, obejmujący prace nad produkcją penicyliny na skalę przemysłową. W programie brali udział uczeni z Wielkiej Brytanii i Stanów Zjednoczonych. Otrzymano penicylinę w formie krystalicznej i określono jej strukturę chemiczną. W Polsce produkcja penicyliny rozpoczęła się w 1950 roku w warszawskich zakładach na Tarchominie.
Do wielkiego, choć przypadkowego odkrycia dokonanego przez Fleminga można zastosować słynne powiedzenie Pasteura, zgodnie z którym „przypadek sprzyja umysłom przygotowanym”. Odkrycie pierwszych trzech antybiotyków, mianowicie Salvarsanu, Prontosilu i penicyliny otworzyło tzw. złotą erę antybiotykoterapii. Warto dodać, że w 1964 roku Dorothy Crowfoot Hodgkin otrzymała Nagrodę Nobla za odkrycie struktury szeregu substancji czynnych, w tym penicyliny (w 1945 r.) i kolejnego istotnego antybiotyku – cefalosporyny (w 1961 r.). Umożliwiło to dalsze prace nad cząsteczkami antybiotyków zawierających pierścień ß-laktamowy, zakończone syntezą kwasu 6-aminopenicylinowego w 1958 roku i rozpoczęciem produkcji tzw. penicylin półsyntetycznych. Było to konieczne, gdyż bakterie poddane działaniu penicyliny benzylowej, a także innych antybiotyków ß-laktamowych zaczęły wykazywać oporność na leczenie. Z czasem los penicyliny miało podzielić wiele innych substancji.

Selman Waksman. Fot. Roger Higgins, Biblioteka Kongresu, domena publiczna
Drugi nurt badań, a wkrótce wielu odkryć, związany był z bakteriologią gleby. Wielkich odkryć na tym polu dokonał Selman Waksman (1888–1973) – mikrobiolog amerykański pochodzenia żydowskiego, związany z Rutgers College w New Brunswick, w stanie New Jersey. Zawdzięczamy mu odkrycie wielu antybiotyków, z których najbardziej pionierską okazała się streptomycyna, wyizolowana z promieniowca Streptomyces griseus razem z Albertem Schatzem w 1944 roku. Za odkrycie pierwszego antybiotyku skutecznie zwalczającego prątki gruźlicy Waksman otrzymał w roku 1952 Nagrodę Nobla.
Streptomycyna była pierwszym antybiotykiem należącym do grupy aminoglikozydów, kolejnym została neomycyna wyizolowana przez Waksmana i Hubertea A. Lechevaliera. Na początku lat 40. wprowadził do medycyny termin antybiotyk (gr. anti – przeciw, bios – życie) na określenie substancji hamujących namnażanie lub zabijających mikroorganizmy.
Odkrycia antybiotyków następowały od tego momentu lawinowo. W roku 1947 opracowano chloromycetynę, pierwszy antybiotyk o szerokim spektrum działania, a w rok później Benjamin Duggar opisał pierwszy antybiotyk z grupy tetracyklin, które do dziś mają najszersze spektrum działania obejmujące większość bakterii Gram-dodatnich i Gram-ujemnych, łącznie z riketsjami i chlamydiami oraz rodzajem Brucella.

Chemicy Fern P. Rathe, Karl August Folkers i Edward Anthony Kaczka jako pierwsi wyizolowali katomycynę w 1955 r. Fot. Smithsonian Institution Archives
Zapoczątkowano zupełnie nowy etap, przenosząc badania nad nowymi substancjami z uczelnianych laboratoriów do pracowni wielkich koncernów farmaceutycznych, dysponujących znacznymi środkami finansowymi i zatrudniających najlepszych specjalistów. Nastąpiły narodziny przemysłu biotechnologicznego, a badania nad antybiotykami i ich produkcja poszły w stronę tworzenia leków półsyntetycznych i w pełni syntetycznych, nie mających odpowiedników w naturze. Przykładem może być zarejestrowany w 2000 roku linezolid – syntetyczny antybiotyk należący do klasy oksazolidynonów stosowany w infekcjach wielolekoopornymi szczepami bakterii (MDR – ang. multidrug resistance), w tym paciorkowców i gronkowca złocistego. Oporność na ten lek już się pojawiła.
Wśród stosowanych już nowych antybiotyków znajdują się leki zarówno pochodzenia organicznego, jak i półsyntetyki czy syntetyki: daptomycyna (lipopeptyd), tygecyklina (III generacja tetracyklin), faropenem (penemy), lewofloksacyna i moksyfloksacyna (chinolony odpowiednio III i IV generacji) czy cefalosporyny IV i V generacji. Ich przyszłość w leczeniu będzie zależała od tego, czy i jak szybko pojawi się oporność na nie. Trwają również badania nad terapiami fagowymi, które mogą stanowić alternatywę w obliczu rosnącej oporności na antybiotyki.
(Niezupełny) triumf nauki nad chorobami
U progu XX w. średnia długość życia szacowana była na 46 lat u mężczyzn i 48 dla kobiet – nawet w krajach rozwiniętych. Dzięki odkryciu antybiotyków choroby zakaźne, takie jak ospa, cholera, błonica, zapalenie płuc, dur brzuszny, gruźlica, tyfus czy kiła przestały zagrażać ludzkości na taką skalę jak wcześniej. W ciągu zaledwie stulecia nowe leki odmieniły oblicze medycyny i przedłużyły ludzkie życie o ponad dwie dekady.
Jeszcze przed wprowadzeniem penicyliny do masowego użycia czyniono obserwacje i uwagi na temat odporności bakterii na antybiotykoterapię. W 1952 roku, w jednym w pierwszych badań nad możliwością oporności na leczenie w warunkach laboratoryjnych, autorzy konkludowali: „Syfilis leczony jest pochodnymi arsenu od około czterech dekad bez żadnych przypadków pojawienia się infekcji arsenoopornych. Możemy więc mieć nadzieję, że szerokie rozpowszechnienie penicyliny również nie przyniesie takich przypadków”. Niestety pojawienie się pierwszych szczepów opornych uświadomiło badaczom, jak dalece optymistyczne są tego typu przekonania.
Oporność wywołana jest naturalnymi właściwościami niektórych typów bakterii (obecnymi jeszcze przed odkryciem antybiotyków), może być także skutkiem mutacji genetycznych, nabywania przez jeden gatunek oporności od innego czy presji selekcyjnej wynikającej ze stosowania antybiotyków, która zapewnia przewagę konkurencyjną zmutowanym szczepom. Szczepy oporne są trudne w leczeniu i wymagają wyższych dawek lub innych substancji, które mogą wiązać się nie tylko ze znacznie wyższymi kosztami, ale i zwiększoną szkodliwością dla pacjentów. Oporność na sulfonamidy po raz pierwszy opisano pod koniec lat trzydziestych XX wieku. W 1940 r., kilka lat przed wprowadzeniem penicyliny do masowego obrotu, zidentyfikowano penicylinazę bakteryjną. Jako pierwsza pojawiła się duża grupa opornych na penicylinę szczepów gronkowca złocistego (lata 50. XX wieku), następnie na początku kolejnej dekady zaobserwowano szczepy oporne na metycylinę (MRSA), wprowadzoną w 1959 roku. W przypadku streptomycyny wprowadzonej w 1944 roku jako lek na gruźlicę, w trakcie leczenia pacjenta stwierdzono powstawanie zmutowanych szczepów Mycobacterium tuberculosis opornych na terapeutyczne dawki antybiotyku. Lawinowo zaczęły pojawiać się kolejne szczepy oporne.
Fleming przewidział ten niekorzystny scenariusz już w swojej mowie noblowskiej: „Może przyjść czas, gdy penicylinę każdy będzie mógł zakupić w sklepie. Istnieje niebezpieczeństwo, że nieświadomy […] pacjent będzie ją przyjmował w zbyt niskiej dawce i drobnoustroje traktowane taką dawką staną się oporne”. Jeszcze w trakcie prac nad penicyliną zaobserwował, że kolejne szczepy gronkowca złocistego poddawane działaniu penicyliny tworzą ściany komórkowe coraz mniej przepuszczalne dla antybiotyku.
Oporność jako zjawisko nie jest niczym nowym w przyrodzie – wręcz przeciwnie, to ukierunkowany proces ewolucyjny. Najstarsze próbki bakterii z genami oporności na szereg klas antybiotyków odnaleziono w wiecznej zmarzlinie przed 30 tys. lat, w mumii z Peru z czasów prekolumbijskich czy szkielecie ze średniowiecznego klasztoru. Dysponując tak olbrzymią liczbą leków przeciwbakteryjnych, które w chwili wprowadzania do lecznictwa były nowością, posługiwano się nimi w terapii dość niefrasobliwie. Ogromna liczba szczepów opornych jest przede wszystkim efektem nadużywania antybiotyków, głównie przez ich stosowanie w leczeniu zakażeń wirusowych.
Wiele patogenów bakteryjnych w wyniku stosowania antybiotyków przekształciło się w formy wielolekooporne (MDR), a z czasem pojawiły się odmiany XDR (rozszerzona oporność, ang. extensively drug resistance) i PDR (całkowita oporność, ang. pandrug resistance), przez co popularne infekcje, takie jak zapalenie płuc czy zakażenia pooperacyjne, stają się coraz częściej niemożliwe do wyleczenia. Patogeny, które udawało się wyeliminować, zmieniły się w „superbakterie”, ograniczając możliwości skutecznego leczenia wywołanych przez nie chorób. Niewłaściwe stosowanie antybiotyków i nieodpowiednie dawki, nadużywanie czy stosowanie jako dodatku do pasz skutkuje systematycznym pojawianiem się szczepów bakterii odpornych na leczenie i wymusza prace nad dalszymi antybiotykami o charakterze półsyntetycznym czy syntetycznym. Zbiega się to ze zjawiskiem tzw. „luki innowacyjności” (ang. innovation gap), znanym już od lat 60., które polega na tym, że przez długi czas nie następują żadne nowe odkrycia klas antybiotyków. Po 1962 roku, gdy wprowadzono do użycia chinolony, wspomniana luka trwała przez kolejne cztery dekady. Proces poszukiwania nowych, skutecznych substancji jest żmudny i długotrwały, obarczony znacznym ryzykiem niepowodzenia. Obejmuje identyfikację, walidację i optymalizację określonych cząsteczek na podstawie m.in. analizy bibliotek związków chemicznych, genomiki, metabolomiki, a następnie badania przedkliniczne, kliniczne i produkcję. Może to trwać wiele lat, a koszty wprowadzenia nowego antybiotyku do obrotu sięgają według szacunków nawet miliarda dolarów.
Tymczasem śmiertelność z powodu infekcji bakteryjnych wielolekoopornych jest wysoka i nieustannie rośnie – co roku umiera na nie nawet 2 mln ludzi na świecie. Specjaliści szacują, że do roku 2050 tego typu zakażenia staną się przyczyną większej liczby zgonów niż nowotwory. Koszty leczenia chorób spowodowanych przez oporne na antybiotyki szczepy wyniosą 100 miliardów dolarów, przewyższając wydatki na leczenie nowotworów. Według Światowej Organizacji Zdrowia antybiotykooporność jest obecnie jednym z dziesięciu największych globalnych zagrożeń dla zdrowia publicznego. Zdaniem ekspertów wyłącznie od dalszych działań, w tym programów i kampanii edukacyjnych, które mają na celu zwrócenie uwagi i zwiększenie świadomości zagrożeń oporności na antybiotyki wśród pacjentów, polityków i osób z branży medycznej. Czas pokaże, czy uda nam się uniknąć czarnego scenariusza w postaci utraty skutecznych metod leczenia i kontroli nad lawinowo rosnąca liczbą zakażeń, wzrostem kosztów opieki szpitalnej, zwiększeniem czasu infekcji, ryzykiem ostrego przebiegu choroby i zgonów w jej następstwie.
Agnieszka Bukowczan-Rzeszut – antropolog kultury, dziennikarka, tłumaczka i autorka związana z krakowskimi wydawnictwami Astra, Znak i Otwarte, autorka książki „Jak przetrwać w średniowiecznym Krakowie” (Astra 2018), a wspólnie z Barbarą Faron książki „Siedem śmierci. Jak umierano w dawnych wiekach” (Astra 2017).
Literatura:
- Brunel J., Antibiosis from Pasteur to Fleming, Journal of the History of Medicine and Allied Sciences, Vol. 6, No. 3 (Summer 1951), pp. 287-301
- Cendal I, Franczak B., Wpływ antybiotykoterapii na rozwój bakterii wielolekoopornych, [w:] ACTA UROBOROI – W KRĘGU EPIDEMII, t. 2, red. M. Dąsal, Wrocław 2019, ss. 87-103
- Davies J.&D., Origins and Evolution of Antibiotic Resistance, Microbiol. Mol. Biol. Rev., Sept. 2010, p. 417–433
- Dzierżanowska D., Antybiotykoterapia praktyczna, wyd. 6, Bielsko-Biała 2023
- Hutchins M., Truman A.W., Wilkinson B., Antibiotics: past, present and future, Current Opinion in Microbiology 2019, 51:72–80
- Kozińska A., Sitkiewicz I., "Nowe" i "stare" antybiotyki - mechanizmy działania i strategie poszukiwania leków przeciwbakteryjnych, "Kosmos. Problemy nauk biologicznych", t. 66, nr 1/2017, ss. 109-123
- Markiewicz Z., Kwiatkowski Z.A., Bakterie, antybiotyki, lekooporność, Warszawa 2008
- Mądry K., New antimicrobials, Współcz Onkol (2004) vol. 8; 2 (52–57) Nicolaou K.C., Rigol S., A brief history of antibiotics and select advances in their synthesis, The Journal of Antibiotics (2018) 71, 153–184
- Otten H., Domagk and the development of the sulphonamides, Journal of Antimicrobial Chemotherapy (1986) 17,689-6
- Rosen W., Miracle Cure: The Creation of Antibiotics and the Birth of Modern Medicine, New York 2017
- Ubysz J. , Tobiasz, E., Penicylina - pleśń która ratuje życie, Analit 2016, Nr 2, ss. 152—154