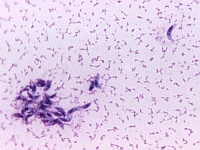
Wytyczne postępowania w zarażeniu rzęsistkiem pochwowym
13.10.2003
AGUM/MSSVD national guideline on the management of Trichomonas vaginalis
http://www.agum.org.uk/guidelines.htm (cyt. 23.06.2003)
Ciąg dalszy dostępny po zalogowaniu dla osób związanych zawodowo z ochroną zdrowia.
Zaloguj się lub przejdź do portalu dla pacjentów.
Zaloguj się lub przejdź do portalu dla pacjentów.
Wybrane treści dla pacjenta
-
 Przeliczanie zapotrzebowania na mleko u niemowląt karmionych mlekiem odciąganym z piersi matki Moja córka 4 marca skończyła 3 miesiące. Karmię ją tylko swoim mlekiem, ale z butelki. Je mniej więcej co 3 godziny, ale jej porcja wynosi 180 ml. Czy powinnam się martwić?
Przeliczanie zapotrzebowania na mleko u niemowląt karmionych mlekiem odciąganym z piersi matki Moja córka 4 marca skończyła 3 miesiące. Karmię ją tylko swoim mlekiem, ale z butelki. Je mniej więcej co 3 godziny, ale jej porcja wynosi 180 ml. Czy powinnam się martwić? -
 Do kiedy karmić piersią, jak często karmić, ile powinno trwać pojedyncze karmienie? Mleko mamy to najlepszy pokarm dla dziecka, dlatego wskazane jest jak najdłuższe karmienie piersią. Wyjaśniamy, co musisz robić, aby udało się długo utrzymywać laktację. Dowiesz się, ile minut powinno trwać jedno karmienie i ile czasu powinno upłynąć pomiędzy karmieniami.
Do kiedy karmić piersią, jak często karmić, ile powinno trwać pojedyncze karmienie? Mleko mamy to najlepszy pokarm dla dziecka, dlatego wskazane jest jak najdłuższe karmienie piersią. Wyjaśniamy, co musisz robić, aby udało się długo utrzymywać laktację. Dowiesz się, ile minut powinno trwać jedno karmienie i ile czasu powinno upłynąć pomiędzy karmieniami. -
 Rzęsistkowica Rzęsistkowica jest najczęściej występującą chorobą przenoszoną drogą płciową. Jest częściej diagnozowana u kobiet, niż u mężczyzn. W Polsce szacuje się, że rzęsistkiem pochwowym jest zarażonych 30-70% kobiet i 10-20% mężczyzn w zależności od populacji, warunków bytowych, sanitarno-higienicznych i socjoekonomicznych.
Rzęsistkowica Rzęsistkowica jest najczęściej występującą chorobą przenoszoną drogą płciową. Jest częściej diagnozowana u kobiet, niż u mężczyzn. W Polsce szacuje się, że rzęsistkiem pochwowym jest zarażonych 30-70% kobiet i 10-20% mężczyzn w zależności od populacji, warunków bytowych, sanitarno-higienicznych i socjoekonomicznych. -
 Czy można przyjmować antybiotyk podczas karmienia piersią? Karmię piersią, a lekarz przepisał mi Augmentin. Czy mogę go przyjmować i karmić?
Czy można przyjmować antybiotyk podczas karmienia piersią? Karmię piersią, a lekarz przepisał mi Augmentin. Czy mogę go przyjmować i karmić? -
 Podwyższone ciśnienie tętnicze krwi u kobiet w ciąży Podwyższone ciśnienie tętnicze krwi jest najczęściej występującym powikłaniem ciąży i dotyczy 8-10% kobiet.
Podwyższone ciśnienie tętnicze krwi u kobiet w ciąży Podwyższone ciśnienie tętnicze krwi jest najczęściej występującym powikłaniem ciąży i dotyczy 8-10% kobiet. -
 Toksoplazmoza w ciąży Toksoplazmoza jest jedną z najbardziej rozpowszechnionych chorób pasożytniczych u człowieka, wywołaną pierwotniakiem Toxoplasma gondii.
Toksoplazmoza w ciąży Toksoplazmoza jest jedną z najbardziej rozpowszechnionych chorób pasożytniczych u człowieka, wywołaną pierwotniakiem Toxoplasma gondii. -
 Ostre uszkodzenie nerek w ciąży Co to jest ostre uszkodzenie nerek i jakie są jego przyczyny w ciąży? Jak się objawia i jak często występuje ostre uszkodzenie nerek w ciąży? Jak przebiega leczenie?
Ostre uszkodzenie nerek w ciąży Co to jest ostre uszkodzenie nerek i jakie są jego przyczyny w ciąży? Jak się objawia i jak często występuje ostre uszkodzenie nerek w ciąży? Jak przebiega leczenie? -
 Zakażenie narządów płciowych wirusem opryszczki u kobiet w ciąży Opryszczkę narządów płciowych powoduje wirus Herpes (Herpes simplex virus – HSV). Jest to jedna z najczęściej występujących chorób przenoszona drogą płciową.
Zakażenie narządów płciowych wirusem opryszczki u kobiet w ciąży Opryszczkę narządów płciowych powoduje wirus Herpes (Herpes simplex virus – HSV). Jest to jedna z najczęściej występujących chorób przenoszona drogą płciową. -
 Małopłytkowość w czasie ciąży Jednym z rodzajów małopłytkowości obserwowanych w okresie ciąży jest tzw. małopłytkowość ciążowa. Występuje ona nawet u 10% kobiet w ciąży, zwykle w III trymestrze. Małopłytkowość ciążowa najczęściej przebiega bezobjawowo, a postępowanie polega w większości przypadków na kontroli liczby płytek w czasie ciąży oraz po rozwiązaniu. Samoistny powrót liczby płytek do normy w czasie 2–12 tygodni od porodu potwierdza rozpoznanie
Małopłytkowość w czasie ciąży Jednym z rodzajów małopłytkowości obserwowanych w okresie ciąży jest tzw. małopłytkowość ciążowa. Występuje ona nawet u 10% kobiet w ciąży, zwykle w III trymestrze. Małopłytkowość ciążowa najczęściej przebiega bezobjawowo, a postępowanie polega w większości przypadków na kontroli liczby płytek w czasie ciąży oraz po rozwiązaniu. Samoistny powrót liczby płytek do normy w czasie 2–12 tygodni od porodu potwierdza rozpoznanie -
 Nadciśnienie tętnicze u ciężarnych Nadciśnienie ciążowe to zwiększone ciśnienie krwi ≥140/90 stwierdzane po raz pierwszy po 20 tygodniu ciąży bez towarzyszącego białkomoczu i powracające do wartości prawidłowych w ciągu 12 tygodni po porodzie.
Nadciśnienie tętnicze u ciężarnych Nadciśnienie ciążowe to zwiększone ciśnienie krwi ≥140/90 stwierdzane po raz pierwszy po 20 tygodniu ciąży bez towarzyszącego białkomoczu i powracające do wartości prawidłowych w ciągu 12 tygodni po porodzie.
Nie przegap
Materiał Sponsora
Napisz do nas
Zadaj pytanie ekspertowi, przyślij ciekawy przypadek,
zgłoś absurd, zaproponuj temat dziennikarzom.
Pomóż redagować portal.
Pomóż usprawnić system ochrony zdrowia.