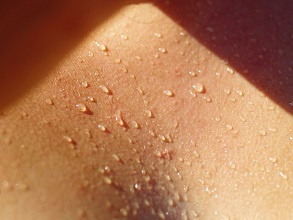
Erytrodyzestezja dłoniowo-podeszwowa (zespół ręka–stopa) w następstwie leczenia pegylowaną liposomalną doksorubicyną
31.03.2008
Pegylated liposomal doxorubicin-related palmar-plantar erythrodysesthesia ("hand-foot" syndrome)
Annals of Oncology, 2007; 18: 1159–1164
Ciąg dalszy dostępny po zalogowaniu dla osób związanych zawodowo z ochroną zdrowia.
Zaloguj się lub przejdź do portalu dla pacjentów.
Zaloguj się lub przejdź do portalu dla pacjentów.
Wybrane treści dla pacjenta
-
 Pemfigoid bliznowaciejący Pemfigoid bliznowaciejący dotyczyć może i błon śluzowych i skóry lub tylko błon śluzowych albo skóry. Cechą charakterystyczną jest postępujące bliznowacenie i zaniki. Występuje wiele podtypów klinicznych choroby.
Pemfigoid bliznowaciejący Pemfigoid bliznowaciejący dotyczyć może i błon śluzowych i skóry lub tylko błon śluzowych albo skóry. Cechą charakterystyczną jest postępujące bliznowacenie i zaniki. Występuje wiele podtypów klinicznych choroby. -
 Ostuda (melasma) Ostuda (melasma) to jasnobrązowe, brązowe lub szare przebarwienie skóry, które powstaje w związku z narażeniem na światło słoneczne. Ostuda zwykle pojawia się na twarzy oraz przedramionach. Ostuda występuje częściej u kobiet podczas ciąży, stosujących środki antykoncepcyjne, ale może nie mieć też znanej przyczyny. W leczeniu stosuje się miejscowe leki depigmentujące, peelingi chemiczne oraz foto- i laseroterapię. U niektórych osób, zwłaszcza u kobiet, u których ostuda pojawiła się w ciąży, po porodzie ostuda ustępuje bez leczenia.
Ostuda (melasma) Ostuda (melasma) to jasnobrązowe, brązowe lub szare przebarwienie skóry, które powstaje w związku z narażeniem na światło słoneczne. Ostuda zwykle pojawia się na twarzy oraz przedramionach. Ostuda występuje częściej u kobiet podczas ciąży, stosujących środki antykoncepcyjne, ale może nie mieć też znanej przyczyny. W leczeniu stosuje się miejscowe leki depigmentujące, peelingi chemiczne oraz foto- i laseroterapię. U niektórych osób, zwłaszcza u kobiet, u których ostuda pojawiła się w ciąży, po porodzie ostuda ustępuje bez leczenia. -
 Wrodzone pęcherzowe oddzielanie się naskórka Wrodzone pęcherzowe oddzielanie się naskórka jest grupą genetycznie uwarunkowanych chorób pęcherzowych skóry, której wspólną cechą jest wybitna wrażliwość skóry na urazy.
Wrodzone pęcherzowe oddzielanie się naskórka Wrodzone pęcherzowe oddzielanie się naskórka jest grupą genetycznie uwarunkowanych chorób pęcherzowych skóry, której wspólną cechą jest wybitna wrażliwość skóry na urazy. -
 Ziarniniak kwasochłonny twarzy Ziarniniak kwasochłonny twarzy, zwany również ziarniniakiem twarzy, jest przewlekłą chorobą skóry zlokalizowaną głównie na twarzy, która przebiega z tworzeniem ognisk rumieniowo-naciekowych. Przypuszcza się, że jedną z przyczyn choroby może być nadmierna ekspozycja na promieniowanie słoneczne, ale nie jest to w pełni udowodnione.
Ziarniniak kwasochłonny twarzy Ziarniniak kwasochłonny twarzy, zwany również ziarniniakiem twarzy, jest przewlekłą chorobą skóry zlokalizowaną głównie na twarzy, która przebiega z tworzeniem ognisk rumieniowo-naciekowych. Przypuszcza się, że jedną z przyczyn choroby może być nadmierna ekspozycja na promieniowanie słoneczne, ale nie jest to w pełni udowodnione. -
 Choroby wirusowe skóry Do najczęstszych chorób wirusowych zaliczamy opryszczkę zwykłą, brodawki wirusowe skórne i płciowe, półpasiec, ospę wietrzną oraz mięczaka zakaźnego.
Choroby wirusowe skóry Do najczęstszych chorób wirusowych zaliczamy opryszczkę zwykłą, brodawki wirusowe skórne i płciowe, półpasiec, ospę wietrzną oraz mięczaka zakaźnego. -
 Nadmierne wydzielanie potu (Hyperhidrosis) Nadmierne wydzielanie potu może występować w obrębie wybranych okolic ciała (głównie dłonie, pachy, stopy), ale może również być uogólnione (dotyczy wtedy całej skóry).Najczęściej zależy od osobniczej skłonności i wykazuje związek ze stresem, lękiem czy innymi emocjami.
Nadmierne wydzielanie potu (Hyperhidrosis) Nadmierne wydzielanie potu może występować w obrębie wybranych okolic ciała (głównie dłonie, pachy, stopy), ale może również być uogólnione (dotyczy wtedy całej skóry).Najczęściej zależy od osobniczej skłonności i wykazuje związek ze stresem, lękiem czy innymi emocjami. -
 Kandydoza skóry Najczęstsza lokalizacja wyprzeń drożdżakowych dotyczy fałdów skórnych (pachowe, pachwinowe, szpara międzypośladkowa, okolica podsutkowa, pępek, fałdy brzuszne u osób otyłych) oraz okolicy pieluszkowej u niemowląt. Stwierdza się ogniska zapalne, wyraźnie odgraniczone od skóry zdrowej, sączące, nierzadko pokryte białawym nalotem.
Kandydoza skóry Najczęstsza lokalizacja wyprzeń drożdżakowych dotyczy fałdów skórnych (pachowe, pachwinowe, szpara międzypośladkowa, okolica podsutkowa, pępek, fałdy brzuszne u osób otyłych) oraz okolicy pieluszkowej u niemowląt. Stwierdza się ogniska zapalne, wyraźnie odgraniczone od skóry zdrowej, sączące, nierzadko pokryte białawym nalotem. -
 Łojotokowe zapalenie skóry Łojotokowe zapalenie skóry (ŁZS) jest chorobą skóry występującą u osób w każdym wieku. Objawy ŁZS to łuszczenie się skóry, rumień oraz świąd. Zmiany skórne pojawiają się najczęściej na owłosionej skórze głowy, twarzy, klatce piersiowej, pod pachami i w pachwinach.
Łojotokowe zapalenie skóry Łojotokowe zapalenie skóry (ŁZS) jest chorobą skóry występującą u osób w każdym wieku. Objawy ŁZS to łuszczenie się skóry, rumień oraz świąd. Zmiany skórne pojawiają się najczęściej na owłosionej skórze głowy, twarzy, klatce piersiowej, pod pachami i w pachwinach. -
 Rumień obrączkowaty odśrodkowy Rumień obrączkowaty odśrodkowy to choroba skóry, której przyczyna w większości przypadków pozostaje nieznana. Do rozwoju wykwitów mogą przyczyniać się czynniki infekcyjne, nowotworowe, autoimmunologiczne, pokarmowe oraz niekiedy przyjmowane leki.
Rumień obrączkowaty odśrodkowy Rumień obrączkowaty odśrodkowy to choroba skóry, której przyczyna w większości przypadków pozostaje nieznana. Do rozwoju wykwitów mogą przyczyniać się czynniki infekcyjne, nowotworowe, autoimmunologiczne, pokarmowe oraz niekiedy przyjmowane leki. -
 Ból ręki oraz ból nadgarstka Ręka i nadgarstek zbudowane są z wielu drobnych stawów, co umożliwia precyzyjne wykonywanie ruchów. Są one narażone na liczne przeciążenia i urazy, mogą zostać również zaatakowane przez choroby zapalne. Oprócz samych stawów przyczyną bólu ręki i nadgarstka mogą być choroby innych struktur, np. ścięgien, nerwów i mięśni.
Ból ręki oraz ból nadgarstka Ręka i nadgarstek zbudowane są z wielu drobnych stawów, co umożliwia precyzyjne wykonywanie ruchów. Są one narażone na liczne przeciążenia i urazy, mogą zostać również zaatakowane przez choroby zapalne. Oprócz samych stawów przyczyną bólu ręki i nadgarstka mogą być choroby innych struktur, np. ścięgien, nerwów i mięśni.
Nie przegap
Gdzie kierować
Przedstawiamy aktualny wykaz dermatologicznych oddziałów klinicznych posiadających umowę z NFZ oraz dane kontaktowe konsultantów (stan na 01.05.2022 r.).
Konferencje i szkolenia dermatologiczne
18. Sympozjum Europejskiej Akademii Dermatologii i Wenerologii
16-18.05.2024, Malta
XIV Sympozjum Naukowo-Szkoleniowe Polskiego Towarzystwa Dermatologicznego „Polska Akademia Dermatologii i Wenerologii”
20-22.06.2024r., Kraków
Napisz do nas
Zadaj pytanie ekspertowi, przyślij ciekawy przypadek,
zgłoś absurd, zaproponuj temat dziennikarzom.
Pomóż redagować portal.
Pomóż usprawnić system ochrony zdrowia.