Autorzy aktualizacji Zaleceń
Redakcja Naukowa (Komitet Sterujący): prof. dr hab. n. med. Rafał Niżankowski (Przewodniczący Rady Przejrzystości, Centrum Monitorowania Jakości w Ochronie Zdrowia), prof. dr hab. n. med. Michał Myśliwiec (Wiceprzewodniczący Rady Przejrzystości, I Klinika Nefrologii i Transplantologii UM Białystok oraz PWSIP w Łomży), prof. dr hab. n. med. Piotr Szymański (Wiceprzewodniczący Rady Przejrzystości, Centrum Medyczne Kształcenia Podyplomowego w Warszawie, Centralny Szpital Kliniczny MSWiA)
Panel Ekspertów:prof. dr hab. Agnieszka Dobrzyń (Dyrektor Instytutu Biologii Doświadczalnej im. M. Nenckiego PAN w Warszawie), prof. dr hab. n. med. Katarzyna Dzierżanowska-Fangrat (Konsultant krajowy w dziedzinie mikrobiologii lekarskiej), dr hab. Rafał Gierczyński, prof. NIZP-PZH (Z-ca Dyrektora ds. Bezpieczeństwa Epidemiologicznego i Środowiskowego NIZP-PZH), dr hab. n. med. Jerzy Jaroszewicz (Kierownik Katedry i Oddziału Klinicznego Chorób Zakaźnych i Hepatologii Śląskiego Uniwersytetu Medycznego w Katowicach), prof. dr hab. n. med. Rafał Krenke (Kierownik Katedry i Kliniki Chorób Wewnętrznych, Pneumonologii i Alergologii Warszawskiego Uniwersytetu Medycznego), dr hab. Anna Mertas, prof. SUM (Prezes Polskiego Towarzystwa Diagnostyki Laboratoryjnej, Katedra i Zakład Mikrobiologii i Immunologii Wydziału Nauk Medycznych w Zabrzu, Śląski Uniwersytet Medyczny w Katowicach), prof. dr hab. n. med. Miłosz Parczewski (Kierownik Kliniki Chorób Zakaźnych, Tropikalnych i Nabytych Niedoborów Immunologicznych Pomorski Uniwersytet Medyczny w Szczecinie), dr hab. n. med. Edyta Podsiadły (Kierownik Działu Mikrobiologii, Zakład Diagnostyki Laboratoryjnej i Immunologii Klinicznej Wieku Rozwojowego UCK WUM, Zakład Mikrobiologii Farmaceutycznej WUM), prof. dr hab. Krzysztof Pyrć (Kierownik Pracowni Wirusologii Małopolskiego Centrum Biotechnologii Uniwersytetu Jagiellońskiego), prof. dr hab. med. Maciej Szmitkowski (Konsultant Krajowy w dziedzinie Diagnostyki Laboratoryjnej, Zakład Diagnostyki Biochemicznej, Uniwersytecki Szpital Kliniczny i Uniwersytet Medyczny w Białymstoku)
Wykaz skrótów: AOTMiT - Agencja Oceny Technologii Medycznych i Taryfikacji, COVID-19 - ang. Coronavirus Disease 2019, ELISA - ang. Enzyme-Linked Immunosorbent Assay, EMA - ang. European Medecines Agency – Europejska Agencja Leków, FDA - ang. Food and Drug Administration – Amerykańska Agencja ds. Żywności i Leków, JRC - ang. Joint Research Centre, PIMS-TS - ang. Paediatric Inflammatory Multisystem Syndrome Temporarily associated with SARS-CoV-2 infection – wieloukładowy zespół zapalny powiązany z COVID-19 u dzieci, POCT - ang. point-of-care testing – testowanie w miejscu opieki nad pacjentem, RNA - ang. ribonucleic acid – kwas rybonukleinowy, RT-LAMP - ang. reverse transcription loop-mediated isothermal amplification, RT-PCR - ang. reverse transcription - polymerase chain reaction, SARS-CoV-2 - ang. severe acute respiratory syndrome coronavirus 2, WHO - ang. World Health Organization – Światowa Organizacja Zdrowia
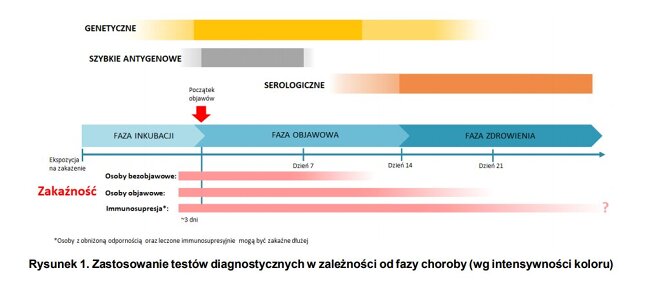
Poniżej zamieszczono diagram, obrazujący przydatność trzech rodzajów omówionych testów. Najważniejszy w wykryciu SARS-CoV-2 jest test genetyczny (RT-PCR), pozwalający wykryć RNA wirusa w wymazie z nosogardła.
Test antygenowy wykrywa białko wirusa, jeżeli w pobranym materiale jest go wystarczająco dużo; jest szybszy i tańszy od testu genowego, jednak jest wiarygodny tylko u pacjentów objawowych. Jego przydatność w innych populacjach wymaga dalszych badań.
Trzeci rodzaj testów służy do wykrycia przeciwciał przeciwko SARS-CoV-2.
Należy podkreślić, że pozytywna i negatywna wartość prognostyczna testów zależna jest od rozpowszechnienia zakażeń w populacji badanej.
1. Badania materiału genetycznego SARS-CoV-2
Diagnostyka molekularna (wykrywanie materiału genetycznego wirusa)
| Zalecenia (Konsensus Ekspertów) | |
| 1.1. | Podstawą rozpoznania zakażenia SARS-CoV-2 jest zastosowanie metod wykrywających materiał genetyczny wirusa (głównie RT-PCR). |
| 1.2. | Testy RT-PCR powinny być wykonywane w laboratoriach wpisanych na ”Listę laboratoriów COVID” Ministerstwa Zdrowia. |
Uzasadnienie:
Zaletą testów genetycznych jest potwierdzenie zakażenia we wczesnej fazie, przed wystąpieniem objawów klinicznych, gdy test antygenowy jest ujemny.
Wadami są: czasochłonność i możliwość długotrwałego utrzymywania się wyników dodatnich, mimo ustąpienia objawów i zakaźności.2
| Zalecenia (Konsensus Ekspertów) | |
| 1.3. | Szybkie testy genetyczne (RT-PCR lub izotermiczne RT-LAMP) mogą być stosowane przy łóżku chorego przez przeszkolony personel, jeżeli producent testu uwzględnił taką możliwość w procedurze rejestracji wyrobu medycznego do diagnostyki in vitro. Nadzór nad jakością tych badań pełni laboratorium wpisane na ”Listę laboratoriów COVID” Ministerstwa Zdrowia. |
| 1.4. | W przypadku ograniczonej dostępności do badań genetycznych, priorytetowo należy traktować próbki pobrane od pacjentów z niewydolnością oddechową lub pogorszeniem stanu klinicznego oraz w stanach nagłych. |
| 1.5. | Priorytetowo należy również traktować diagnostykę szeroko pojętego personelu medycznego, pracującego z chorymi na COVID-19 i pacjentami mogącymi być nosicielami wirusa oraz manifestującego objawy COVID-19. |
Uzasadnienie:
Szybkie testy genetyczne (czas otrzymania wyniku 15-45 minut) mogą stać się ważnym narzędziem diagnostycznym, zwłaszcza w pilnych przypadkach3,4.
Czułość badania genetycznego zależy od fazy zakażenia (najwyższy ładunek wirusa w drogach oddechowych obserwuje się w 4-7 dobie od wystąpienia objawów), rodzaju i sposobu pobrania materiału oraz jego transportu.
| Zalecenia (Konsensus Ekspertów) | |
| 1.6. | Materiałami zalecanymi w diagnostyce są wymazy z nosogardła, gardła i nosa (pobierane jednocześnie), aspiraty tchawicze lub BAL. U pacjentów z kaszlem i wykrztuszaniem dobrym materiałem diagnostycznym może być także plwocina. Nie zaleca się jednak indukcji plwociny ze względu na narażenie personelu medycznego na powstający zakaźny aerozol. Należy stosować materiał zalecany i zatwierdzony dla konkretnego testu diagnostycznego. |
Uzasadnienie:
Czułość badań molekularnych w poszczególnych rodzajach materiału przedstawia tabela poniżej:
| Tabela 1. Czułość badań molekularnych w zależności od rodzaju badanego materiału biologicznego | |
|---|---|
| Rodzaj materiału | Czułość* |
| Wymaz z gardła i nosa pobierany równocześnie | 97%3 |
| Wymaz z nosogardła | 92,2%4 |
| Ślina^ pobrana z gardła / ślina^ z tylnej części jamy ustno-gardłowej | 90,1%5 |
| Plwocina | 87,5%5 |
| Wymaz z gardła& | 84%3 |
| Ślina**^ | 83,9%5 |
| Wymaz z nosa | 82%3 |
| Kał | 46%5 |
| Łzy / wymaz ze spojówki | 17,4%5 |
| Krew | 7,3%6 |
| Mocz | 0%6 |
| * Czułość metody RT-PCR z uwzględnieniem różnych materiałów badanych w porównaniu do wymazu z nosogardła (badania Lee 2020, Ibrahimi 2021, Böger 2021) lub w porównaniu do wymazu z nosogardła / wymazu z gardła (ang. oropharyngeal swab) lub obu metod jednocześnie (badanie Moreira 2021);
^ Ślina – materiał łatwy do pobrania ale trudniejszy do opracowania; & Wymaz z gardła (ang. oropharyngeal swab);** Ślina bez określenia sposobu pobrania | |
| 3 Lee R.A., Herigon J.C., Benedetti A., Pollock N.R., Denkinger C.M. Performance of Saliva, Oropharyngeal Swabs, and Nasal
Swabs for SARS-CoV-2 Molecular Detection: A Systematic Review and Meta-analysis. MedRxiv preprint doi:
https://doi.org/10.1101/2020.11.12.20230748; this version posted November 13, 2020
4 Ibrahimi N., Delaunay-Moisan A., Hill C., Le Teuff G., Rupprecht J.F., Thuret J.Y., Chaltie D., Potier M.C. Screening for SARS-CoV-2 by RT-PCR: saliva or nasopharyngeal swab? Systematic review and meta-analysis. MedRxiv preprint February 12, 2021; doi: https://doi.org/10.1101/2021.02.10.21251508 5 Moreira V. M., Mascarenhas P., Machado V., Botelho J., Mendes J.J., Taveira N., Almeida M.G. Diagnosis of SARS-Cov-2 Infection by RT-PCR Using Specimens Other Than Naso- and Oropharyngeal Swabs: A Systematic Review and Meta-Analysis. Diagnostics 2021, 11, 363 6 Böger B., Fachi M.M., Vilhena R.O., Cobre A.F., Tonin F.S., Pontarolo R. Systematic review with meta-analysis of the accuracy of diagnostic tests for COVID-19. American Journal of Infection Control 49 (2021) 21-29 | |
Uzasadnienie:
Procedury związane z indukcją plwociny do celów diagnostycznych są uznawane za generujące aerozol i powiązane ze zwiększonym ryzykiem przenoszenia koronawirusów5.
Interpretacja wyniku testu genetycznego
Metody te pozwalają na wykrycie szeregu genów SARS-CoV-2 – między innymi N, E, S, RdRP oraz ORF1ab6.
| Zalecenia (Konsensus Ekspertów) | |
| 1.7. | Wg WHO, w obszarach, gdzie dochodzi do zakażeń populacyjnych COVID-197, wykrycie obecności pojedynczego genu wirusa wystarcza do potwierdzenia zakażenia. W Polsce, zgodnie z obowiązującą definicją przypadku COVID-19 z dn. 31.10.2020 r.8 , wykrycie pojedynczego genu wirusa pozwala na laboratoryjne potwierdzenie przypadku COVID-19. Jednak ze względu na ryzyko wyników fałszywie ujemnych, związanych z pojawieniem się nowych wariantów wirusa, WHO9 rekomenduje stosowanie testów diagnostycznych wykrywających 2 lub więcej fragmentów genomu SARS-CoV-2. Z tego względu, w Polsce, zaleca się stosowanie testów co najmniej 2. genowych, a optymalnie wykrywających 3 lub więcej obszarów genomu SARS-CoV-2. |
| 1.8. | Procedury diagnostyki genetycznej wymagają odpowiedniej walidacji/weryfikacji laboratoryjnej, a interpretację wyniku należy przeprowadzić na podstawie zaleceń producenta testu. |
| 1.9. | Wynik dodatni świadczy o zakażeniu SARS-CoV-2; wynik nierozstrzygający - nie wyklucza ani nie potwierdza zakażenia. W takim przypadku zalecane jest badanie kolejnej próbki, pobranej po upływie 24-48 godz. |
| 1.10. | Pojedynczy wynik ujemny nie wyklucza zakażenia i nie powinien być traktowany jako jedyne kryterium diagnostyczne, szczególnie w przypadkach, gdy obraz kliniczny sugeruje zakażenie SARS-CoV-2 lub pacjent miał bliski kontakt, bez środków ochrony osobistej, z potwierdzonym przypadkiem COVID-19, niezależnie od rodzaju i natężenia prezentowanych objawów klinicznych. |
| 1.11. | W przypadku pacjenta hospitalizowanego, u którego w pierwszorazowym badaniu genetycznym uzyskano wynik ujemny, badanie należy powtórzyć w następujących
sytuacjach:
a) gdy istnieje duże prawdopodobieństwo zakażenia, ocenione na podstawie wywiadu epidemiologicznego, obrazu klinicznego i wyniku badania obrazowego klatki piersiowej - kolejne badanie zlecić w 24-48 godz. po pobraniu pierwszej próbki, b) gdy stwierdzane jest nasilenie objawów ze strony układu oddechowego - kolejne badanie zlecić w 24-48 godz. po pobraniu pierwszej próbki, c) gdy pacjent wymaga intubacji i jest możliwość pobrania materiału z dolnych dróg oddechowych. |
| 1.12. | Badanie zawsze należy powtórzyć w przypadku, gdy zostało wykonane nieprawidłowo (np. niewłaściwie pobrany lub przechowywany materiał) - kolejne badanie należy zlecić niezwłocznie. |
Uzasadnienie:
Treść zaleceń ustalona na podstawie konsensusu eksperckiego oraz literatury7,8,9.
7 https://www.who.int/publications-detail/global-surveillance-for-human-infection-with-novel-coronavirus-(2019-ncov)
8 https://www.gov.pl/web/gis/definicja-przypadku-covid19-na-potrzeby-nadzoru-epidemiologicznego-nad-zakazeniami-wirusem sars-cov-2-definicja-z-dnia-31102020-
9 Genomic sequencing of SARS-CoV-2: a guide to implementation for maximum impact on public health. Geneva: World Health Organization; 2021. Licence: CC BY-NC-SA 3.0 IGO.https://apps.who.int/iris/rest/bitstreams/1326052/retrieve
Monitorowanie wirusologiczne u osób z potwierdzonym zakażeniem
| Zalecenia (Konsensus Ekspertów) | |
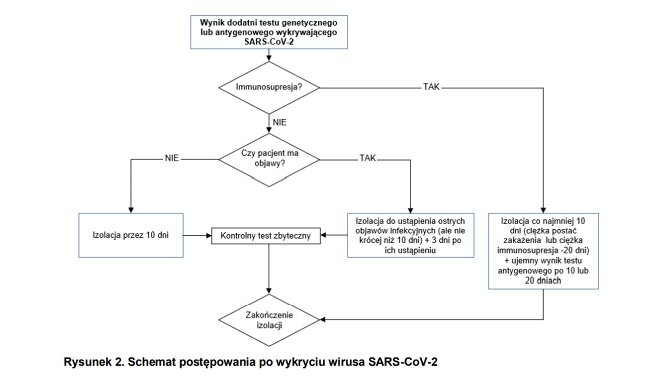
| 1.13. | U osób z potwierdzonym zakażeniem SARS-CoV-2 nie zaleca się wykonywania kontrolnych badań genetycznych w celu udokumentowania eradykacji wirusa. |
Uzasadnienie:
Wyniki wielu badań wskazują, że RNA SARS-CoV-2 może być wykrywany w materiałach klinicznych przez długi czas, mimo ustąpienia objawów choroby i zakaźności.
Monitorowanie wirusologiczne u pracowników ochrony zdrowia po ryzykownym kontakcie z osobą zakażoną SARS-CoV-2
| Zalecenia (Konsensus Ekspertów) | |
| 1.14. | Przez kontakt ryzykowny rozumie się bezpośredni kontakt z zakażonym, w czasie którego pracownik nie był zabezpieczony w odpowiednie środki ochrony osobistej. |
| 1.15. | Nieszczepiony pracownik ochrony zdrowia, który miał wyżej opisany kontakt ryzykowny podlega kwarantannie. U pracownika ochrony zdrowia, u którego nie występują żadne objawy kliniczne, dopuszcza się wykonanie badania genetycznego po min. 7 dniach od kontaktu i jeśli wynik jest ujemny, można rozważyć przywrócenie do pracy. Uzyskanie ujemnego wyniku nie wyklucza konieczności dalszej obserwacji klinicznej. |
| 1.16. | Zaszczepiony pracownik ochrony zdrowia, który miał kontakt ryzykowny nie podlega kwarantannie. Tym niemniej, ze względu na fakt, że szczepienie nie zabezpiecza w pełni przed zakażeniem, zaleca się wykonanie kontrolnego badania genetycznego po min. 7 dniach od kontaktu, jeśli nie występują objawy zakażenia oraz w każdym przypadku pojawienia się objawów klinicznych. |
Uzasadnienie:
Zalecenie sformułowane na podstawie konsensusu eksperckiego, wynikającego z bieżącej sytuacji epidemiologicznej.
2. Badania antygenowe służące do wykrywania białek SARS-CoV-2
Dostępne obecnie testy, służące do wykrywania białkowych antygenów SARS-CoV-2 w materiale z dróg oddechowych są to: jakościowe testy immunochromatograficzne (testy kasetkowe), inaczej nazywane szybkimi testami antygenowymi oraz półilościowe i ilościowe immunochemiczne testy diagnostyczne. Te ostatnie mają wysoką czułość i swoistość diagnostyczną (technika ELISA w wersji klasycznej lub zmodyfikowanej oraz techniki chemiluminescencyjne dedykowane automatycznym analizatorom). Zaletą szybkich testów antygenowych jest krótki czas trwania badania, natomiast ich wady to niższa czułość i możliwość uzyskania wyniku ujemnego u osoby zakażonej SARS-CoV-2.
| Zalecenia (Konsensus Ekspertów) | |
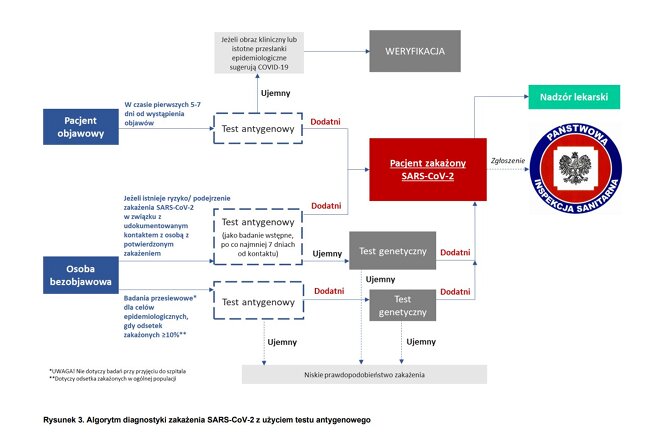
| 2.1. | Szybkie testy antygenowe mogą być wykorzystywane do diagnostyki zakażeń SARS-CoV-2 u pacjentów objawowych w czasie pierwszych 5-7 dni od wystąpienia objawów. Osoby objawowe z dodatnim wynikiem testu wykrywającego antygen SARS-CoV-2 należy traktować jako zakażone, natomiast ujemny wynik tego testu wymaga weryfikacji, jeżeli obraz kliniczny lub istotne przesłanki epidemiologiczne sugerują COVID-19, ponieważ ujemny wynik testu antygenowego nie wyklucza zakażenia. Weryfikacji można dokonać testem genetycznym tego samego dnia lub powtórzonym w kolejnych dniach testem antygenowym. |
| 2.2. | U osób bezobjawowych, u których istnieje ryzyko/podejrzenie zakażenia SARS-CoV-2 w związku z udokumentowanym kontaktem z osobą z potwierdzonym zakażeniem SARS-CoV-2 (zwłaszcza w ogniskach zakażeń), wstępne badanie można przeprowadzić testem antygenowym i osoby z wynikiem dodatnim traktować jako zakażone, natomiast u osób z wynikiem ujemnym należy wykonać test genetyczny. |
| 2.3. | Szybkie testy antygenowe mogą być stosowane bezpośrednio w miejscu opieki nad pacjentem (POCT), jeżeli producent testu uwzględnił taką możliwość w procedurze rejestracyjnej wyrobu medycznego do diagnostyki in vitro.12 | 2.4. | Nie zaleca się stosowania szybkich testów antygenowych w badaniach przesiewowych (np. w analizie rozpowszechnienia wirusa w populacji ogólnej) oraz przed udzielaniem świadczenia medycznego. |
| 2.5. | Gdy odsetek wyników dodatnich badań w kierunku SARS-CoV-2 wynosi 10% lub więcej w danej populacji to dopuszcza się badanie testem antygenowym osób bezobjawowych bez wskazań epidemiologicznych (badania przesiewowe). Pierwszy dodatni wynik testu antygenowego u osoby bezobjawowej powinien być zweryfikowany testem genetycznym. |