Tłumaczyła lek. Iwona Rywczak
Konsultowali: dr med. Agnieszka Matkowska-Kocjan, dr hab. med. Leszek Szenborn, prof. nadzw.,
Klinika Pediatrii i Chorób Infekcyjnych Uniwersytetu Medycznego we Wrocławiu
Skróty: ACIP – Advisory Committee on Immunization Practices, IChP – inwazyjna choroba pneumokokowa, PCV-7 – skoniugowana 7-walentna szczepionka przeciwko pneumokokom, PCV-13 – skoniugowana 13-walentna szczepionka przeciwko pneumokokom, PMR – płyn mózgowo-rdzeniowy, PPSV-23 – polisacharydowa 23-walentna szczepionka przeciwko pneumokokom
20 lutego 2013 roku amerykański Advisory Committee on Immunization Practices (ACIP) wydał zalecenie rutynowego stosowania skoniugowanej 13-walentnej szczepionki przeciwko pneumokokom (PCV-13 [Prevnar 13, Wyeth Pharmaceuticals, Inc., filia Pfizer, Inc.]; w Polsce dostępny jest preparat Prevenar 13 zarejestrowany u dzieci od 6. tygodnia życia i dorosłych – przyp. red.) u dzieci w wieku 6–18 lat z niedoborami odporności, czynnościowym lub anatomicznym brakiem śledziony, wyciekiem płynu mózgowo-rdzeniowego (PMR) oraz z wszczepionym implantem ślimakowym, które nie były wcześniej szczepione PCV-13. Dzieci z wymienionych grup należy zaszczepić szczepionką PCV-13 niezależnie od tego, czy w przeszłości otrzymały inne szczepionki przeciwko pneumokokom, tj. skoniugowaną szczepionkę 7-walentną (PCV-7) lub polisacharydową szczepionkę 23-walentną (PPSV-23). Zalecenia dotyczące szczepienia dzieci szczepionką PPSV-23 nie zmieniły się. Jakość danych dotyczących ryzyka i korzyści szczepienia dzieci z niedoborami odporności szczepionką PCV-13 oceniono zgodnie z systemem Grading of Recommendations, Assessment, Development and Evaluation (GRADE).1 Przedstawione zalecenia odzwierciedlają zmianę polityki w zakresie szczepień przeciwko pneumokokom. W przeszłości szczepionkę PCV-13 stosowano u dzieci z niedoborami odporności poza zarejestrowanymi wskazaniami (off label), natomiast aktualnie zalecenia dotyczące szczepień PCV-13 tych pacjentów przypisano do kategorii A (tzn. zaleceń do powszechnego przestrzegania w tej populacji – przyp. red.).1,2 W artykule podsumowano dane uwzględnione przez ACIP w procesie opracowywania zaleceń oraz przedstawiono wytyczne dotyczące stosowania PCV-13 i PPSV-23 u dzieci w wieku 6–18 lat.
Epidemiologia zakażeń pneumokokowych u osób z niedoborami odporności i obowiązujące dotąd zalecenia
Streptococcus pneumoniae (pneumokok) wywołuje ciężkie zakażenia, w tym posocznicę i zapalenie opon mógowo-rdzeniowych, a w Stanach Zjednoczonych jest jedną z częstszych przyczyn ciężkich zachorowań i umieralności.3 PCV-13, która zastąpiła PCV-7, została zarejestrowana w lutym 2010 roku przez amerykański Food and Drug Administration (FDA) do stosowania w zapobieganiu zachorowaniom na inwazyjną chorobę pneumokokową (IChP) i zapalenie ucha środkowego u niemowląt i małych dzieci.4 Szczepienie PCV-13 zaleca się wszystkim dzieciom w wieku 2–59 miesięcy oraz dzieciom w wieku 60–71 miesięcy z chorobami przewlekłymi (np. chorobami serca, cukrzycą), niedoborami odporności (np. zakażonych HIV), z czynnościowym lub anatomicznym brakiem śledziony, wyciekiem PMR lub z wszczepionym implantem ślimakowym. U dzieci w wieku 6–18 lat z niedoborami odporności, czynnościowym lub anatomicznym brakiem śledziony, wyciekiem PMR lub z wszczepionym implantem ślimakowym ACIP dopuszczał stosowanie PCV-13 poza zarejestrowanymi wskazaniami (off label).4 U dzieci w wieku 2–18 lat z chorobami przewlekłymi zaleca się także szczepienie PPSV-23 po otrzymaniu kompletnego szczepienia PCV-13. Dzięki stosowaniu skoniugowanych szczepionek przeciwko pneumokokom i wytworzeniu się tzw. odporności zbiorowiskowej zapadalność na IChP zmniejszyła się zarówno wśród szczepionych dzieci, jak i osób nieszczepionych.4 Ogólna zapadalność na IChP oraz na IChP wywołaną przez typy serologiczne objęte PCV-7 u dorosłych zakażonych HIV zmniejszyła się odpowiednio o 25 i 88%. Jednak 7 lat po wprowadzeniu do programu szczepień dla dzieci szczepionki PCV-7, zapadalność na IChP wywołaną przez objęte nią typy jest u dorosłych zakażonych HIV nadal 40-krotnie większa od zapadalności u zdrowych dorosłych w tym samym wieku.5 Dane te pokazują, że dorośli z niedoborami odporności odnieśli korzyści z wytworzenia odporności zbiorowiskowej, lecz ryzyko IChP jest u nich nadal zwiększone. W czerwcu 2012 roku, po zarejestrowaniu PCV-13 u dorosłych >50. roku życia, ACIP zalecił rutynowe stosowanie tej szczepionki, oprócz PPSV-23, u osób ≥19. roku życia z niedoborami odporności, czynnościowym lub anatomicznym brakiem śledziony, wyciekiem PMR lub z wszczepionym implantem ślimakowym, które nie otrzymały wcześniej szczepionki 13-walentnej.6
W latach 2007–2009 średnia roczna zapadalność na IChP w grupie wiekowej 6–18 lat wynosiła 2,6/100 000, przy czym typy serologiczne objęte PCV-13 były odpowiedzialne za 57% zachorowań (CDC, 2013, dane niepublikowane z programu Active Bacterial Core surveillance obejmujące lata 2007–2009). U dzieci w wieku 6–18 lat z niedoborami odporności typy serologiczne objęte PCV-13 odpowiadały za 49% zachorowań na IChP, a typy objęte PPSV-23 za dodatkowych 23% zachorowań. Zapadalność na IChP wywołaną typami objętymi PCV-13 u dzieci w wieku 6–18 lat chorujących na nowotwory układu krwiotwórczego oszacowano na 1282 zachorowania na 100 000 badanych (rate ratio [RR]: 822 [95% CI: 687–983] w porównaniu z dziećmi bez takich chorób [rate ratio odpowiada ryzyku względnemu – przyp. red.]), a u dzieci zakażonych HIV i chorych na niedokrwistość sierpowatokrwinkową odpowiednio: 197 (RR: 122 [CI: 94–161]) i 56/100 000 (RR: 27 [CI: 9–73]) (p. ryc. [CDC, 2013, dane niepublikowane z programu Active Bacterial Core surveillance obejmujące okres 2007–2009]).
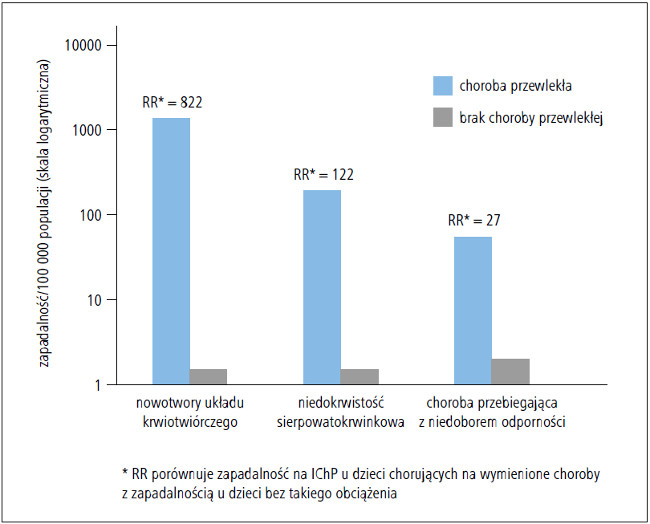
Ryc. Średnia roczna zapadalność na inwazyjną chorobę pneumokokową (IChP) wywołaną przez typy serologiczne uwzględnione w PCV-13 u zdrowych dzieci i chorujących na niektóre choroby przewlekłe
Skuteczność, immunogenność i bezpieczeństwo PCV-13 u osób z niedoborami odporności
W badaniach obejmujących pacjentów z niedoborami odporności oceniono stosowanie skoniugowanych szczepionek przeciwko pneumokokom zawierających podobne antygeny, lecz obejmujące mniejszą liczbę typów serologicznych. W badaniu z randomizacją przeprowadzonym w RPA skuteczność 9-walentnej szczepionki (PCV-9) w zapobieganiu zachorowaniom na IChP i zapalenie płuc potwierdzone radiologicznie u dzieci w wieku 2–45 miesięcy zakażonych HIV oceniono odpowiednio na 65 (95% CI: 24–86) i 13% (95% CI: –7–29).7 U zakażonych HIV dorosłych pochodzących z Malawi skuteczność PCV-7 w zapobieganiu IChP wywołanej przez typy serologiczne objęte tą szczepionką wyniosła 74% (95% CI: 30–90).8 Natomiast w badaniu obserwacyjnym przeprowadzonym w Stanach Zjednoczonych w grupie dzieci w wieku ≤10 lat chorych na niedokrwistość sierpowatokrwinkową, które otrzymały co najmniej 1 dawkę PCV-7, skuteczność rzeczywista szczepionki w profilaktyce IChP wyniosła 81% (95% CI: 19–96).9 W badaniach potwierdzono odpowiednią skuteczność i efektywność (skuteczność rzeczywistą) szczepionki, jednak nie wiadomo, przez jaki czas po szczepieniu utrzymuje się ochrona przed IChP.
W styczniu 2013 roku FDA zatwierdził PCV-13 do stosowania u zdrowych dzieci w wieku 6–17 lat w zapobieganiu IChP wywołanej przez typy serologiczne pneumokoka zawarte w tej szczepionce. U dzieci w wieku 6–9 lat skuteczność rzeczywistą PCV-13 oszacowano na podstawie stężenia przeciwciał w klasie IgG w odpowiedzi na pojedynczą dawkę, które było porównywalne do stężenia uzyskanego po podaniu czwartej dawki PCV-13 u zdrowych niemowląt. Natomiast u dzieci w wieku 10–17 lat średnia geometryczna mian przeciwciał w teście opsonofagocytozy (OPA [oceniającym funkcjonalność swoistych przeciwciał – przyp. red.]) była podobna do mian uzyskanych w teście OPA u uczestniczących w tym samym badaniu dzieci w wieku 6–9 lat (FDA, Vaccines and Related Biological Products Advisory Committee, dane niepublikowane, 2013). U dzieci w wieku 6–18 lat chorujących na niedokrwistość sierpowatokrwinkową wykazano odpowiednio duże stężenia IgG swoistych dla wszystkich typów serologicznych objętych szczepionką PCV-13 po podaniu 1 dawki tej szczepionki.10 W badaniu z randomizacją obejmującym dzieci w wieku 2–45 miesięcy zakażone HIV istotnie większe miana przeciwciał w teście OPA stwierdzono w grupie zaszczepionej 3 dawkami PCV w porównaniu z grupą placebo.11 W innym badaniu obejmującym dzieci zakażone HIV w wieku <2 lat, w którym porównano PCV-7 z placebo, stężenia IgG swoistych dla typów serologicznych były znamienne większe w grupie zaszczepionej PCV-7.12 W badaniu obserwacyjnym, w którym dzieciom w wieku 2–18 lat zakażonym HIV podano 2 dawki PCV-7, a następnie 1 dawkę PPSV-23, stężenie przeciwciał po podaniu pojedynczej dawki PCV-7 było porównywalne do stężenia uzyskanego po zaszczepieniu PPSV-23 lub od niego większe.13 Wyniki obecnie dostępnych badań przemawiają za bezpieczeństwem PCV-13 u dzieci z niedoborami odporności. W badaniu przeprowadzonym metodą otwartej próby, bez grupy kontrolnej, obejmującym 158 dzieci w wieku 6–18 lat chorych na niedokrwistość sierpowatokrwinkową, których w przeszłości zaszczepiono PPSV-23, stwierdzono, że podanie 1 dawki PCV-13 było bezpieczne.10 Do najczęstszych zdarzeń niepożądanych zgłaszanych w ciągu 7 dni po podaniu 1 dawki szczepionki należy ból mięśni (74,8%), osłabienie (66,1%) i ból głowy (53,6%). Rzadziej obserwowano ból stawów (39,8%), gorączkę (26%), wymioty (15,4%) i biegunkę (13,3%). U 8% dzieci wystąpiły ciężkie niepożądane odczyny, takie jak przełom sierpowatokrwinkowy (4%), ostry zespół klatki piersiowej (acute chest syndrome [2%]) i gorączka (2%). Nie zanotowano żadnego zgonu.10 W badaniu oceniającym skuteczność PCV-7 u dzieci zakażonych HIV wśród najczęstszych niepożądanych odczynów poszczepiennych (NOP) obserwowano nasilone stwardnienie oraz rumień w miejscu wkłucia, gorączkę i ograniczenie ruchomości kończyny. Nie zarejestrowano ciężkich NOP. Częstość występowania NOP w grupie szczepionej i nieszczepionej była podobna.12
PPSV-23 u dzieci z niedoborami odporności
PPSV-23 zawiera antygeny 12 typów serologicznych obecnych w PCV-13 oraz antygeny 11 dodatkowych typów, które są odpowiedzialne za 23% zachorowań na IChP u dzieci z niedoborami odporności w wieku 6–18 lat (CDC, 2013, dane niepublikowane z programu Active Bacterial Core surveillance obejmujące lata 2007–2009). Aktualnie szczepionkę PPSV-23 zaleca się dzieciom >2. roku życia z grupy zwiększonego ryzyka IChP.4 Biorąc pod uwagę duże obciążenie systemu opieki zdrowotnej związane z zachorowaniami na IChP wywołaną przez typy serologiczne objęte PPSV-23, lecz nie objęte szczepionką PCV-13, zastosowanie zarówno PCV-13, jak i PPSV-23 może zapewnić szerszą ochroną. Zalecenia dotyczące szczepień PPSV-23 nie zmieniły się.4
Zalecenia ACIP dotyczące stosowania PCV-13 i PPSV-23 u dzieci z niedoborami odporności w wieku 6–18 lat
Dzieci nieszczepione wcześniej PPSV-23
Zgodnie z zaleceniami ACIP, dzieci w wieku 6–18 lat, które nie były szczepione PCV-13, a należą do grupy zwiększonego ryzyka IChP z powodu anatomicznego lub czynnościowego braku śledziony (np. w przebiegu niedokrwistości sierpowatokrwinkowej), zakażenia HIV, wszczepienia implantu ślimakowego, wycieku PMR lub innej choroby upośledzającej odporność, powinny otrzymać w pierwszej kolejności 1 dawkę PCV-13, a po upływie co najmniej 8 tygodni – 1 dawkę PPSV-23. Dzieciom z anatomicznym lub czynnościowym brakiem śledziony (np. w przebiegu niedokrwistości sierpowatokrwinkowej), zakażeniem HIV lub innym niedoborem odporności należy podać drugą dawkę szczepionki PPSV-23 po upływie 5 lat od podania pierwszej dawki tej szczepionki (p. tab.).
| Tabela. Choroby przewlekłe i inne czynniki ryzyka będące wskazaniem do szczepienia PCV-13 i PPSV-23 oraz do podania dawki przypominającej PPSV-23 u dzieci w wieku 6–18 lataa | ||||
|---|---|---|---|---|
| Grupa ryzyka | Choroba przewlekła lub inny czynnik ryzyka | PCV-13 | PPSV-23 | |
| Zalecana | Zalecana | Dawka przypominająca po 5 latach | ||
| osoby immunokompetentne | przewlekła choroba sercab | tak | ||
| przewlekła choroba płucc | tak | |||
| cukrzyca | tak | |||
| wyciek płynu mózgowo-rdzeniowego | tak | tak | ||
| implant ślimakowy | tak | tak | ||
| choroba alkoholowa | tak | |||
| przewlekła choroba wątroby, marskość | tak | |||
| palenie papierosów | tak | |||
| brak śledziony (anatomiczny lub czynnościowy) | niedokrwistość sierpowatokrwinkowa i inne hemoglobinopatie | tak | tak | tak |
| wrodzony lub nabyty brak śledziony | tak | tak | tak | |
| niedobory odporności | wrodzone i nabyte niedobory odpornościd | tak | tak | tak |
| zakażenie HIV | tak | tak | tak | |
| przewlekła niewydolność nerek | tak | tak | tak | |
| zespół nerczycowy | tak | tak | tak | |
| białaczki | tak | tak | tak | |
| chłoniaki | tak | tak | tak | |
| choroba Hodgkina | tak | tak | tak | |
| nowotwory złośliwe w stadium uogólnienia | tak | tak | tak | |
| jatrogenna immunosupresjae | tak | tak | tak | |
| przeszczepienie narządu miąższowego | tak | tak | tak | |
| szpiczak mnogi | tak | tak | tak | |
| a Od 2010 r. u dzieci w wieku 2–5 lat chorych przewlekle (np. na choroby serca lub cukrzycę), z niedoborami odporności (np. zakażonych HIV), z czynnościowym lub anatomicznym brakiem śledziony (w tym chorujących na niedokrwistość sierpowatokrwinkową), z wyciekiem płynu mózgowo-rdzeniowego lub z implantem ślimakowym szczepienie PCV-13, jeśli wcześniej nie otrzymały tej szczepionki. b w tym zastoinowa niewydolność serca i kardiomiopatie c w tym przewlekła obturacyjna choroba płuc, rozedma, astma d w tym zależne od limfocytów B (niedobory humoralne) lub T (niedobory komórkowe), niedobory składowych układu dopełniacza (zwłaszcza C1, C2, C3 lub C4) i zaburzenia fagocytozy (z wyjątkiem przewlekłej choroby ziarniniakowej) e choroby wymagające leczenia immunosupresyjnego (w tym długotrwałego stosowania glikokortykosteroidów ogólnie lub radioterapii) PCV-13 – skoniugowana 13-walentna szczepionka przeciwko pneumokokom, PPSV-23 – polisacharydowa 23-walentna szczepionka przeciwko pneumokokom | ||||
Dzieci zaszczepione wcześniej PPSV-23
Dzieci w wieku 6–18 lat, które nie były szczepione PCV-13, lecz otrzymały co najmniej 1 dawkę PPSV-23 i należą do grupy zwiększonego ryzyka IChP z powodu anatomicznego lub czynnościowego braku śledziony (np. w przebiegu niedokrwistości sierpowatokrwinkowej), zakażenia HIV, wszczepienia implantu ślimakowego, wycieku PMR lub innego niedoboru odporności, powinny otrzymać 1 dawkę PCV-13 co najmniej 8 tygodni po podaniu ostatniej dawki PPSV-23, nawet jeśli były wcześniej szczepione PCV-7. Drugą dawkę PPSV-23, jeżeli istnieją takie wskazania, należy podać po upływie co najmniej 5 lat od szczepienia pierwszą dawką PPSV-23. Do ukończenia 65. roku życia dzieci te powinny otrzymać nie więcej niż 2 dawki PPSV-23.
PIŚMIENNICTWO
1. CDC: GRADE evidence tables – recommendations in MMWR. Atlanta, GA: US Department of Health and Human Services, CDC, 2013 http://www.cdc.gov/vaccines/acip/recs/grade/table-refs.html.
2. Ahmed F., Temte J.L., Campos-Outcalt D. i wsp.: ACIP Evidence Based Recommendations Work Group. Methods for developing evidence-based recommendations by the Advisory Committee on Immunization Practices (ACIP) of the U.S. Centers for Disease Control and Prevention (CDC). Vaccine, 2011; 29: 9171–9176
3. Huang S.S., Johnson K.M., Ray G.T. i wsp.: Healthcare utilization and cost of pneumococcal disease in the United States. Vaccine, 2011; 29: 3398–3412
4. CDC: Prevention of pneumococcal disease among infants and children – use of 13 -valent pneumococcal conjugate vaccine and 23-valent pneumococcal polysaccharide vaccine: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR, 2010: 59
5. Cohen A.L., Harrison L.H., Farley M.M. i wsp.: Prevention of invasive pneumococcal
disease among HIV-infected adults in the era of childhood pneumococcal immunization.
AIDS, 2010; 24: 2253–2562
6. CDC: Use of 13-valent pneumococcal conjugate vaccine and 23-valent pneumococcal polysaccharide vaccine for adults with immunocompromising conditions: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR, 2012; 61: 816–819
7. Klugman K.P., Madhi S.A., Huebner R.E. i wsp.: A trial of a 9-valent pneumococcal
conjugate vaccine in children with and those without HIV infection. N. Engl. J. Med.,
2003; 349: 1341–1348
8. French N., Gordon S.B., Mwalukomo T. i wsp.: A trial of a 7-valent pneumococcal conjugate vaccine in HIV-infected adults. N. Engl. J. Med., 2010; 362: 812–822
9. Adamkiewicz T.V., Silk B.J., Howgate J. i wsp.: Effectiveness of the 7-valent pneumococcal conjugate vaccine in children with sickle cell disease in the first decade of life. Pediatrics, 2008; 121: 562–569
10. Montalembert M., Abboud M., Fiquet A. i wsp.: A 2-dose schedule of 13-valent pneumococcal conjugate vaccine (PCV13) given to children with sickle cell disease previously immunized with 23-valent pneumococcal polysaccharide vaccine (PPSV23): results of a phase 3 study. 54th Annual Meeting of the American Society of Hematology. Atlanta, 8–11.12.2012
11. Madhi S.A., Kuwanda L., Cutland C. i wsp.: Quantitative and qualitative antibody response to pneumococcal conjugate vaccine among African human immunodeficiency virus-infected and uninfected children. Pediatr. Infect. Dis. J., 2005; 24: 410–416
12. Nachman S., Kim S., King J. i wsp.: Safety and immunogenicity of a heptavalent pneumococcal conjugate vaccine in infants with human immunodeficiency virus type 1 infection. Pediatrics, 2003; 112 (1 Pt 1): 66–73
13. Abzug M.J., Pelton S.I., Song L.Y. i wsp.: Immunogenicity, safety, and predictors of response after a pneumococcal conjugate and pneumococcal polysaccharide vaccine series in human immunodeficiency virus-infected children receiving highly active antiretroviral
therapy. Pediatr. Infect. Dis. J., 2006; 25: 920–929
KOMENTARZ
dr med. Agnieszka Matkowska-Kocjan, dr hab. med. Leszek Szenborn, prof. nadzw.
Klinika Pediatrii i Chorób Infekcyjnych Uniwersytetu Medycznego
we Wrocławiu
Pacjenci z niedoborami odporności należą do grupy zwiększonego ryzyka zakażeń inwazyjnych wywołanych przez bakterie otoczkowe. Z tego względu bardzo istotna jest optymalizacja profilaktyki zakażeń pneumokokowych, meningokokowych i wywołanych przez Haemophilus influenzae typu b u wszystkich osób z upośledzeniem funkcji układu immunologicznego. Najważniejszym elementem tej profilaktyki są szczepienia ochronne. Niedawno opublikowane wytyczne ACIP dotyczące szczepień przeciwko pneumokokom u dzieci z niedoborami odporności są oczekiwanym dokumentem porządkującym algorytm stosowania skoniugowanej szczepionki 13-walentnej (PCV-13), także u dzieci uprzednio zaszczepionych szczepionką 7-walentną (PCV-7), oraz polisacharydowej szczepionki 23-walentnej (PPSV-23).
Zalecenia ACIP nawiązują do wytycznych obowiązujących w „erze” stosowania szczepionki 7-walentnej. Nowością jest sformułowanie wytycznych dotyczących stosowania PCV-13 u dzieci z niedoborami odporności w wieku 6.–17. roku życia, co jest następstwem niedawnego rozszerzenia rejestracji Prevenaru 13 dla tej grupy wiekowej1 (zmiany rejestracji wiekowej dokonano w styczniu 2013 r., wcześniej Prevenar 13 był zarejestrowany tylko u dzieci do ukończenia 5. rż.). Dotychczas starsze dzieci z niedoborami odporności otrzymywały te szczepionki poza rejestracją (w trybie off label). Rozszerzenie rejestracji szczepionki 13-walentnej w połączeniu z przedstawionymi zaleceniami ACIP zapewnia teraz duży komfort wszystkim lekarzom zajmującym się szczepieniami dzieci z grup ryzyka.
W związku ze zmianami w rejestracji PCV-13 i opublikowaniem wytycznych dotyczących jej stosowania powinniśmy dążyć do zmiany zapisu w treści polskiego Programu Szczepień Ochronnych (PSO). Obecnie szczepionki skoniugowane przeciwko pneumokokom są refundowane dla dzieci z wybranych grup ryzyka w wieku od 2 miesięcy do 5 lat (w tym praktycznie wszystkich grup dzieci z niedoborami odporności2). Wynikało to z wcześniejszych rejestracji dostępnych w Polsce skoniugowanych szczepionek przeciwko pneumokokom. W chwili, gdy powstaje niniejszy tekst, nie znamy jeszcze treści PSO na rok 2014. Pozostaje mieć nadzieję, że powyższe zmiany zostaną w nim uwzględnione.
Należy zaznaczyć, że w nowych zaleceniach ACIP nie uwzględniono wszystkich grup pacjentów z niedoborami odporności – mowa tu o biorcach przeszczepów komórek hematopoetycznych szpiku (HSCT), którzy są szczególnie narażeni na bakteryjne zakażenia inwazyjne. W wytycznych ACIP wspomniano jedynie o biorcach przeszczepów narządów litych, u których zmiany w układzie immunologicznym są niewspółmiernie mniejsze niż u pacjentów po HSCT. W wielu badaniach wykazano, że pojedyncza dawka szczepionki skoniugowanej przeciwko pneumokokom (PCV-7 – przyp. red.) jest u pacjentów po allogenicznym HSCT niewystarczająca, a zadowalająca odpowiedź poszczepienna powstaje po podaniu co najmniej 3 dawek szczepionki skoniugowanej, niezależnie od wieku pacjenta.3-5 Zgodnie z obowiązującymi międzynarodowymi wytycznymi biorcom HSCT należy podać 3 dawki skoniugowanej szczepionki 13-walentnej (między 3. a 6. miesiącem po przeszczepie), a następnie uzupełnić schemat szczepień pojedynczą dawką 23-walentnej szczepionki polisacharydowej (między 9. a 12. miesiącem po HSCT).6
Komentarza wymaga również zaproponowany przez ACIP 8-tygodniowy odstęp pomiędzy podaniem szczepionki 13-walentnej a podaną uprzednio 23-walentną szczepionką polisacharydową (mowa tu o „doszczepianiu” PCV-13 dzieci, które zostały zaszczepione wcześniej PCV-7, a następnie PPSV-23). Odstęp ten jest znacznie krótszy od proponowanego u dorosłych – analogiczne wytyczne ACIP dotyczące szczepienia przeciwko pneumokokom u dorosłych z niedoborami odporności zalecają zachowanie co najmniej rocznej przerwy pomiędzy szczepionką 13-walentną a podaną wcześniej szczepionką PPSV-23.7
PIŚMIENNICTWO DO KOMENTARZA
1. Charakterystyka Produktu Leczniczego Prevenar 13
2. Komunikat Głównego Inspektora Sanitarnego z dnia 29.10.2012 r. w sprawie Programu
Szczepień Ochronnych na rok 2013. Dziennik Urzędowy Ministra Zdrowia z 30.10.2012 r.,
poz. 78. (p. Med. Prakt. Szczepienia 4/2012, s. 23–32 i www.mp.pl/szczepienia – przyp. red.)
3. Molrine D., Antin J., Guinan E. i wsp.: Donor immunization with pneumococcal conjugate
vaccine and early protective antibody responses following allogennic hematopoietic cell
transplantation. Blood, 2003; 101: 831–836
4. Meisel R., Kuypers L., Dirksen U. i wsp.: Pneumococcal conjugate vaccine provides
early protective antibody responses in children after related and unrelated allogeneic
hematopoietic stem cell transplantation. Blood, 2007; 109: 2322–2326
5. Cordonnier C., Labopin M., Chesnel V. i wsp.: Randomized study of early versus late
immunization with pneumococcal conjugate vaccine after allogeneic stem cell transplantation.
Infectious Diseases Working Party of the European Group for Blood and
Marrow Transplantation. Clin. Infect. Dis., 2009; 48: 1392–1401
6. Ljungman P., Cordonnier C., Einsele H. i wsp.: Vaccination of hematopoietic cell transplant recipients. Bone Marrow Transplant., 2009; 44: 521–526
7. Use of 13-valent pneumococcal conjugate vaccine and 23-valent pneumococcal polysaccharide vaccine for adults with immunocompromising conditions: recommendations of the Advisory Committee on Immunization Practices (ACIP), MMWR, 2013; 62: 521–524
(p. Med. Prakt. Szczepienia 1/2013, s. 29–34 – przyp. red.)

























