łac., ang. toxocarosis
Epidemiologia
Toksokaroza jest jedną z najczęstszych chorób odzwierzęcych (antropozoonoz) występujących na całym świecie, ale najwięcej zachorowań obserwuje się w krajach o klimacie wilgotnym i niskim poziomie sanitarno-higienicznym.
Etiologia i patogeneza
1. Czynnik etiologiczny: glista psia (Toxocara canis) i glista kocia (Toxocara cati), które są przypadkowymi pasożytami człowieka, migrującymi przez wiele lat w postaci larwalnej w tkankach i narządach wewnętrznych, nigdy nie osiągając dojrzałości płciowej. Postać dorosła nicienia rozwija się odpowiednio w organizmie psa domowego i innych psowatych (np. wilków i lisów) lub domowych i dzikich kotów. Inwazje Toxocara spp. występują aż u ~80% populacji psów i ~90% populacji kotów, przy czym są one częstsze u młodych zwierząt niż u dorosłych osobników. Jaja pasożyta wydalone z kałem zwierząt trafiają do gleby, gdzie następuje ich dalszy rozwój biologiczny.
2. Rezerwuar i droga przenoszenia: rezerwuarem są domowe i dzikie psy oraz koty. Do zarażenia człowieka dochodzi poprzez przypadkowe spożycie inwazyjnych jaj Toxocara spp. po kontakcie z zanieczyszczoną odchodami zwierząt ziemią (np. w piaskownicach, skwerach i parkach miejskich, ogródkach przydomowych oraz osiedlowych placach zabaw dla dzieci) lub też poprzez niemyte ręce lub zabrudzone ziemią surowe warzywa i owoce. Jaja Toxocara spp. charakteryzują się dużą odpornością na działanie niesprzyjających czynników zewnętrznych, co wiąże się z ich długą przeżywalnością w środowisku (nawet kilka lat). Rzadką drogą zarażenia jest również spożywanie surowego lub niedogotowanego mięsa i podrobów pochodzących od żywicieli paratenicznych (kurczęta, bydło, owce), a szczególnie surowych wątrób zwierzęcych zawierających niedojrzałe larwy Toxocara spp.
Po zarażeniu inwazyjnymi jajami pasożyta rozwijająca się w żołądku człowieka postać larwalna nicienia wędruje do błony śluzowej jelita cienkiego, a następnie drogą krwi i chłonki penetruje organizm żywiciela, docierając do różnych tkanek i narządów, tj. gałek ocznych, płuc, mięśnia sercowego, mięśni szkieletowych i ośrodkowego układu nerwowego (OUN). Rozprzestrzenianie się zarażenia odbywa się poprzez układ krwionośny, chłonny, tkanki i jamy ciała. Znaczna część larw Toxocara spp. jest zatrzymywana w wątrobie, a wokół martwych pasożytów w wątrobie tworzą się z czasem duże ziarniniaki złożone z granulocytów kwasochłonnych, limfocytów i komórek olbrzymich. Większość postaci larwalnych nicienia po osiągnięciu docelowego miejsca wędrówki przybiera postać „uśpioną” o trybie metabolicznym hipobiozy i zachowuje zdolność do życia przez wiele lat, co jakiś czas wznawiając swoją migrację w organizmie człowieka (reaktywacja zarażenia). Larwy Toxocara spp. są odporne na reakcje obronne układu immunologicznego żywiciela i mogą przetrwać w jego tkankach nawet do 10 lat. Przezłożyskowa transmisja larw Toxocara spp. do płodu ludzkiego nie została dotąd udokumentowana.
3. Czynniki ryzyka zarażenia: geofagia i nawykowe ssanie palców u małych dzieci, nieprzestrzeganie zasad higieny, hodowanie psów lub kotów, zwłaszcza kontakt ze szczeniętami lub młodymi kotami <8. mż., nieregularne odrobaczanie zwierząt domowych, zawodowy kontakt ze zwierzętami (weterynarze, hodowcy), skażoną odchodami glebą (rolnicy, pracownicy parków i miejskich terenów rekreacyjnych, geolodzy) oraz zanieczyszczonymi ziemią warzywami i owocami spożywanymi w stanie surowym (ogrodnicy, sadownicy). W Polsce szczególne ryzyko zarażenia stanowią tereny rekreacyjne i podwórka przydomowe w centrach dużych miast, gdzie skażenie ziemi inwazyjnymi jajami pasożyta może być bardzo duże. Zachorowania często występują w środowisku rodzinnym.
4. Okres wylęgania i zakaźności: od 2 tygodni do kilku miesięcy lub lat. Choroba o przewlekłym przebiegu, może pozostać bezobjawowa przez wiele lat lub nawet przez całe życie żywiciela. Chory człowiek nie jest zakaźny dla kontaktujących się z nim osób.
Obraz kliniczny i przebieg naturalny
Przebieg kliniczny choroby zależy od gatunku nicienia, intensywności inwazji pierwotnej, częstości zarażeń wtórnych (reinwazji) u osób z grup ryzyka, stopnia inwazyjności połkniętych jaj, patogenności szczepu pasożyta, długości przeżycia wędrujących larw w organizmie oraz stopnia nasilenia reakcji obronnych układu immunologicznego żywiciela. Postaci kliniczne rzadko współistnieją ze sobą.
1. Postać układowa: pełnoobjawowy zespół larwy wędrującej trzewnej (łac. syndroma larvae migrantis visceralis) charakteryzuje się gorączką, powiększeniem wątroby i śledziony, dużą eozynofilią, hipergammaglobulinemią i zajęciem układu oddechowego; może też wystąpić niepełny zespół larwy wędrującej trzewnej. Pełnoobjawowe przypadki o ciężkim przebiegu są rzadkie i dotyczą głównie małych dzieci w wieku 2–5 lat z geofagią w wywiadzie. Wędrówce postaci larwalnych pasożyta towarzyszą ból brzucha, brak apetytu, utrata masy ciała, kaszel, napady duszności, przelotne osutki skórne (pokrzywka lub wyprysk), zapalenie węzłów chłonnych, ból mięśni i stawów, rzadziej zapalenie mięśnia sercowego lub opon mózgowo-rdzeniowych.
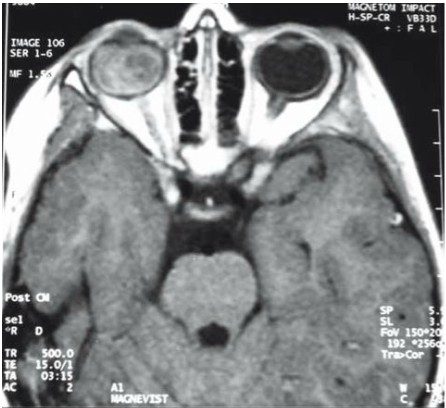
2. Postać zlokalizowana: toksokaroza narządu wzroku (zespół larwy wędrującej ocznej [łac. syndroma larvae migrantis ocularis]) i toksokaroza OUN (neurotoksokaroza) są konsekwencją osiedlenia się niewielkiej liczby larw, zwykle nawet pojedynczej larwy w obrębie narządu wzroku lub mózgowia. W toksokarozie ocznej obserwuje się jednostronne osłabienie ostrości widzenia, leukokorię (biały odblask siatkówki), zez, niekiedy bolesność gałki ocznej. Zmiany mogą dotyczyć różnych struktur oka; u małych dzieci mogą przypominać siatkówczaka (ryc. 1).
Toksokarozę OUN spotyka się bardzo rzadko. W obrazie klinicznym dominują objawy zapalenia mózgu, często z uogólnionymi lub częściowymi napadami padaczkowymi. W masywnych inwazjach może wystąpić eozynofilowe zapalenie mózgu z występowaniem granulocytów kwasochłonnych w płynie mózgowo-rdzeniowym.
3. Toksokaroza ukryta („covert” toxocarosis) przejawia się różnorodnymi i stosunkowo mało charakterystycznymi objawami klinicznymi, np. jako ostre zapalenie oskrzeli, zapalenie płuc z zespołem Löfflera lub bez niego, astma, przewlekła pokrzywka, wyprysk alergicznyego, a także uogólnione powiększenie węzłów chłonnych, zapalenie mięśni lub stawów. Istnieje duże ryzyko przechodzenia toksokarozy ukrytej w pełnoobjawowy zespół larwy wędrującej trzewnej lub ocznej.
4. Postać bezobjawowa: rozpoznawana najczęściej na podstawie dodatnich wyników przypadkowo wykonanych badań serologicznych, w związku z występowaniem tej parazytozy u innych członków rodziny. Ta postać choroby jest związana ze stanem zmniejszonej aktywności larw Toxocara spp. w tkankach, zachowujących zdolność do aktywacji i rozpoczęcia ponownej wędrówki w dowolnym momencie.
Rozpoznanie
Badania pomocnicze
1. Badania laboratoryjne
1) badania parazytologiczne
Ponieważ pasożyt nie odbywa pełnego cyklu rozwojowego w organizmie człowieka, nigdy nie obserwuje się jaj glisty psiej lub kociej w kale, i dlatego bezpośrednia diagnostyka parazytologiczna toksokarozy nie jest możliwa. Wykonuje się tylko badania immunodiagnostyczne:
a) wykrywanie swoistych przeciwciał IgG lub IgE w surowicy metodą immunoenzymatyczną (ELISA); referencyjnym testem potwierdzenia jest technika immunoblottingu (Western blot)
b) oznaczenie awidności (siły wiązania z antygenem) swoistych przeciwciał IgG umożliwia ocenę czasu trwania zarażenia i różnicowanie ostrej fazy inwazji aktywnej (<5 miesięcy od zarażenia) cechującej się niską awidnością od przewlekłego okresu choroby, charakteryzującego się wysoką awidnością przeciwciał
c) porównawcza analiza profilu immunologicznego swoistych przeciwciał IgG w surowicy oraz w cieczy wodnistej pobranej z przedniej komory oka lub płynu śródocznego techniką immunoblottingu pozwala na stwierdzenie lokalnej produkcji przeciwciał w narządzie wzroku i ostateczne potwierdzenie toksokarozy ocznej
d) oznaczanie całkowitej puli przeciwciał IgE we krwi obwodowej – ma znaczenie w przypadku objawów alergicznych towarzyszących wędrówce postaci larwalnych nicienia, zwłaszcza w postaci ukrytej choroby (np. w astmie i przewlekłej pokrzywce).
2) morfologia krwi i stężenie immunoglobulin: w pełnoobjawowych przypadkach zespołu larwy wędrującej trzewnej występuje zwiększenie liczby i odsetka eozynofilów oraz liczby leukocytów we krwi obwodowej, a także hipergammaglobulinemia w surowicy; w przypadku eozynofilowego zapalenia mózgu i opon mózgowo-rdzeniowych stwierdza się dużą eozynofilię we krwi obwodowej i w płynie mózgowo-rdzeniowym
2. Badania obrazowe
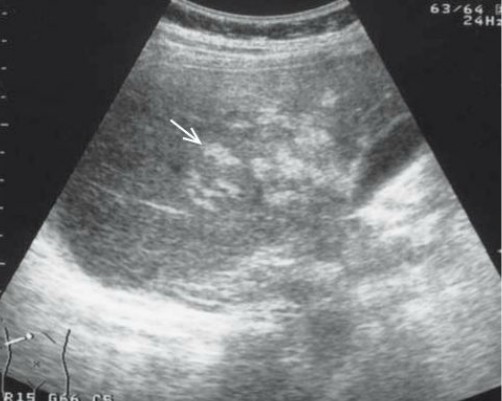
- USG lub TK jamy brzusznej pozwalają na stwierdzenie powiększenia wątroby oraz uwidaczniają liczne ziarniniaki w wątrobie tworzące się wokół postaci larwalnych pasożyta (ryc. 2)
- TK lub MR mózgu pozwalają stwierdzić obecność regularnych, dobrze odgraniczonych od otoczenia zmian ogniskowych w istocie białej lub warstwie korowej, często pojedynczych i częściowo zwapniałych
- RTG klatki piersiowej może uwidocznić zwiewne nacieki w eozynofilowym zapaleniu płuc na tle alergicznym (zespół Löfflera)
- USG narządu wzroku w zespole larwy wędrującej ocznej pozwala na uwidocznienie ziarniniaków zlokalizowanych wewnątrzgałkowo lub podsiatkówkowo; zmiany są zwykle jednostronne i pojedyncze