Szacuje się, że w 2019 roku w zakładach karnych na terenie Europy przebywało 1,5 mln więźniów.53 Wyzwaniem dla skutecznego kontrolowania ognisk COVID-19 w więzieniach są nieuniknione bliskie kontakty międzyludzkie, słaba wentylacja, nieoptymalna opieka zdrowotna, choroby współistniejące u więźniów, a często również duża rotacja osób przychodzących z zewnątrz i opuszczających zakład, w tym personelu więziennego. Znane są przypadki wykrycia ognisk zakażeń SARS-CoV-2 w zakładach karnych na terenie Europy, przy czym należy pamiętać, że takie zakażenia mogą mieć poważne konsekwencje dla zdrowia publicznego, grożą bowiem szybkim przeciążeniem systemu opieki zdrowotnej, zarówno w więzieniu, jak i poza nim. Ponadto z uwagi na dużą rotację w wielu zakładach karnych takie ogniska mogą skutkować zwiększeniem transmisji lub ponownym rozprzestrzenieniem się zakażeń wśród zmarginalizowanych grup społecznych.54
Wszystkich więźniów z objawami wskazującymi na COVID-19 oraz wszystkie osoby z kontaktu z przypadkiem potencjalnego zakażenia SARS-CoV-2 (małego i dużego ryzyka, niezależnie od występowania objawów) należy zbadać w kierunku zakażenia SARS-CoV-2. Dotyczy to osób, u których objawy wystąpiły po stawieniu się w więzieniu, w czasie odbywania kary lub przed zwolnieniem.12
Z uwagi na możliwość wystąpienia w zakładach karnych ognisk zakażeń mogących istotnie wpłynąć na całą populację więzienia, szczególnie na terenie z dużą transmisją zakażeń, można również traktować priorytetowo wykonywanie testów u:
- więźniów przybywających do zakładów karnych (nowych, przeniesionych z innych zakładów, wchodzących na teren placówki lub ją opuszczających), niezależnie od występowania objawów w celu zmniejszenia ryzyka zawleczenia zakażenia do zakładu karnego. Ponieważ ujemny wynik testu wykonanego po stawieniu się więźnia w zakładzie nie wyklucza możliwości zakażenia, należy rozważyć wyznaczenie miejsc do kohortowania nowych lub przeniesionych więźniów w ramach 14-dniowej kwarantanny poprzedzającej ich dołączenie do innych więźniów
- wszystkich więźniów i całego personelu – po wykryciu zakażenia u pracownika lub więźnia bądź w celu wykrycia przypadków bezobjawowych i tych we wczesnym stadium zakażenia. Takie podejście sprzyja prawidłowemu wdrażaniu izolacji, monitorowaniu osób z kontaktu oraz kontroli zakażeń, a ponadto może się okazać pomocne przy wdrażaniu strategii kokonu i wczesnego leczenia w celu minimalizowania przypadków ciężkiego przebiegu i liczby zgonów.
Inne populacje o zwiększonym ryzyku
Po złagodzeniu obostrzeń wykryto liczne ogniska zakażeń związanych z wydarzeniami towarzyskimi, w szczególności z udziałem młodych ludzi w nocnych imprezach na świeżym powietrzu.64 Pojawiły się sugestie, że zwiększenie transmisji należy wiązać z głośnym mówieniem (przekrzykiwaniem muzyki lub hałasu), często w połączeniu z piciem alkoholu, oraz nieutrzymywaniem dystansu fizycznego.64 Ponadto w kilku miejscach na świecie zidentyfikowano zakażenia związane z próbami chórów i duże ogniska związane ze zgromadzeniami religijnymi.65-67
Ryzyko zakażenia jest zwiększone także u osób bezdomnych, z powodu warunków, w jakich żyją. Dodatkowo część z nich znajduje się w grupie zwiększonego ryzyka ciężkiego przebiegu COVID-19 i zgonu z jej powodu.68,69 Kilka schronisk dla osób bezdomnych stało się ogniskiem zakażeń i część przebywających w nich chorych zmarło.70-72 Osoby z objawami wskazującymi na COVID-19 powinno się badać i umieszczać w odrębnych pomieszczeniach w schroniskach.
Bez względu na sytuację epidemiologiczną w razie wykrycia zakażenia w wyżej wspomnianych środowiskach należy wykonać badanie w kierunku zakażenia SARS-CoV-2 u wszystkich osób z kontaktu (dużego i małego ryzyka), niezależnie od występowania objawów.
Cel E: zapobieganie (ponownemu) przywleczeniu wirusa do regionów/ państw, w których uzyskano trwałą i skuteczną kontrolę transmisji zakażeń
W obecnej sytuacji epidemiologicznej ECDC nie zaleca rutynowego badania podróżnych przekraczających wewnętrzne lub zewnętrzne granice administracyjne.5,73 Proponowane w niniejszym rozdziale rozwiązania mają konkretny cel i dotyczą wyjątkowej sytuacji, w której w kraju lub regionie udało się uzyskać stałą kontrolę zakażeń potwierdzoną przez skutecznie wdrożony nadzór populacyjny (opisany wyżej).
Wdrożenie interwencji niefarmakologicznych wraz z badaniem wszystkich przypadków możliwego zakażenia i intensywnym monitorowaniem osób z kontaktu może pozwolić na długoterminowe wyeliminowanie transmisji SARS-CoV-2 w niektórych regionach lub państwach. Taka sytuacja umożliwiłaby powrót do aktywności społecznej, edukacyjnej, działalności handlowej itd. i miałaby korzystny wpływ na dobrostan ludzi i gospodarkę. Wszystkie kraje lub regiony, które osiągną taki status, powinny rozważyć wykonywanie badań w kierunku zakażenia SARS-CoV-2 u osób przyjeżdżających z regionów lub państw, w których nie uzyskano trwałej kontroli zakażeń. Aby omawiane podejście było skuteczne, wszystkie osoby powinny zostać przebadane przed przybyciem na teren wolny od COVID-19. Z uwagi na 14-dniowy okres inkubacji wirusa i możliwość bezobjawowego przebiegu zakażenia takie osoby powinny prowadzić codzienną samoobserwację w kierunku objawów wskazujących na COVID-19, a w razie ich wystąpienia należy niezwłocznie wykonać u nich test. Osoby przebywające na kwarantannie, u których nie rozwinęły się objawy, powinny zostać ponownie zbadane w kierunku zakażenia SARS-CoV-2 po jej zakończeniu, tj. po 14 dniach od przybycia do danego kraju/regionu.
W pozostałych sytuacjach epidemiologicznych, w tym w warunkach panujących obecnie w państwach UE/EOG i Wielkiej Brytanii (wrzesień 2020 r.), badania przesiewowe podróżnych nie stanowią opłacalnej strategii zapobiegania transgranicznej transmisji SARS-CoV-2.
Wyzwania związane z tą strategią testowania opisano dokładnie w dokumencie ECDC dotyczącym badań populacyjnych.49 Szczegółowe wymogi dotyczące protokołów badań przesiewowych na podstawie oświadczeń o stanie zdrowia, pomiarów temperatury i przesiewowej oceny indywidualnej (przeprowadzanej zwykle przez personel medyczny) obejmują wdrożenie określonych mechanizmów, przyjęcie jasnej definicji przypadku, zapewnienie odpowiedniej liczby przeszkolonych osób wykonujących badania przesiewowe, używanie odpowiednich PPE oraz bezpieczne izolowanie osób z podejrzeniem zakażenia od innych podróżnych.74 Poza wymogami logistycznymi i technicznymi istnieje też obowiązek powiadamiania podróżnych z odpowiednim wyprzedzeniem o procedurach testowania i wymogach związanych z wjazdem do danego państwa.
Metody testowania i ich ograniczenia
Okres inkubacji
Okres inkubacji SARS-CoV-2 może trwać 1–14 dni, a jego medianę szacuje się na 5–6 dni. W grupie 425 chorych na COVID-19 okres inkubacji w 95% przypadków był krótszy niż 12,5 dnia i wynosił średnio 5,2 dnia (CI: 4,1–7,0 dni).75 Bardzo podobne wyniki uzyskano w innej grupie 181 chorych: mediana okresu inkubacji wyniosła 5,1 dnia (CI: 4,5–5,8 dnia), a w 97,5% przypadków okres inkubacji nie przekroczył 11,5 dnia.76 Dodatkowo według szacunków u <2,5% zakażonych objawy pojawiły się w ciągu 2,2 dnia (CI: 1,8–2,9 dnia) od kontaktu z wirusem. Powyższe obserwacje wskazują, że u zdecydowanej większości chorych objawowych okres inkubacji wynosi 2–12 dni. Informacje te mają duże znaczenie w podejmowaniu decyzji o terminie wykonania testu.
Rodzaje testów
Dostępne są 3 rodzaje badań diagnostycznych w kierunku COVID-19, różniące się tym, co wykrywają:
- testy amplifikacji kwasu nukleinowego (NAAT) wykrywają RNA wirusa; wykorzystuje się w nich RT-PCR
- testy antygenowe wykrywają antygen SARS-CoV-2, zwykle fragment białka powierzchniowego
- testy wykrywające przeciwciała przeciwko SARS-CoV-2.
Zarówno NAAT, jak i testy antygenowe można wykorzystywać do wykrycia czynnego zakażenia, ale wytyczne WHO zalecają, aby do ustalenia rozpoznania wykorzystywać NAAT.77 Przeciwciała przeciwko SARS-CoV-2 są wykrywalne zazwyczaj po 10–14 dniach od zakażenia, co oznacza, że testy wykrywające przeciwciała pozwalają jedynie potwierdzić przebyte zakażenie; ponadto dodatni wynik nie oznacza odporności na ponowne zakażenie SARS-CoV-2.78
Kolejne 2 ważne cechy testów to szybkość i łatwość wykonania. Specyfikacje techniczne dla wyrobów medycznych do diagnostyki in vitro (decyzja Komisji 2002/364/WE)79 definiują szybkie testy jako takie, które „można wykonywać wyłącznie pojedynczo lub w małych seriach i które zostały zaprojektowane w celu szybkiego uzyskania wyniku przy wykonywaniu ich w pobliżu chorego”. Według opracowanego przez WHO wstępnego profilu testów wykonywanych w miejscu opieki nad chorym (POCT [testy, które można wykonywać bezpośrednio przy chorym, np. w domu, przy łóżku szpitalnym, w gabinecie lekarskim – przyp. red.]) dla osób z podejrzeniem COVID-19 i osób z kontaktu, taki test powinien spełniać następujące wymogi:80
1. docelowe warunki wykonania
a) dopuszczalne – test można wykonywać poza
laboratorium, zarówno w stałych, jak i w organizowanych
doraźnie punktach segregacji/
badań przesiewowych prowadzonych na terenie
placówek medycznych, na przykład
na szpitalnych oddziałach ratunkowych, w jednostkach mobilnych oraz poza placówkami
opieki zdrowotnej (monitorowanie
osób z kontaktu), przez personel medyczny
lub techników laboratoryjnych odpowiednio
przeszkolonych w zakresie pobierania próbek
materiału, bezpieczeństwa biologicznego i wykonywania testu
b) pożądane – takie same jak dopuszczalne; dodatkowo
test może być wykonywany przez
przeszkolony personel niemedyczny (wolontariuszy/
pracowników środowiskowych)
2. czas oczekiwania na wynik: a) dopuszczalny ≤40 minut b) pożądany ≤20 minut.
Algorytmy wykonywania badań
W celu usprawnienia procesu testowania i zwiększenia jego skuteczności oprócz jednorazowej analizy pojedynczej próbki można zastosować kombinację kilku testów (tj. algorytm testowania). Największą przydatność mają 3 algorytmy przedstawione poniżej.
Szybki test, po którym wykonuje się test potwierdzający z użyciem tej samej próbki
Celem stosowania szybkiego testu jest sprawne wykrycie dużego odsetka przypadków zakażenia i umożliwienie bezzwłocznego wdrożenia odpowiednich środków kontroli. Taki test powinien się cechować dużą swoistością, by uniknąć wyników fałszywie dodatnich, w praktyce jednak zwykle charakteryzuje się małą czułością. Istnieje zatem znaczne prawdopodobieństwo, że ujemny wynik szybkiego testu jest fałszywie ujemny, natomiast wynik dodatni jest z dużym prawdopodobieństwem prawdziwie dodatni. Następnie można wykonać test potwierdzający o dużej czułości i dużej swoistości – zwykle jest nim test molekularny, niebędący testem szybkim, wykonywany w laboratorium – korzystając z próbek, których badanie testem szybkim dało wynik ujemny, w celu wykrycia dodatkowych przypadków zakażenia. Dodatni wynik szybkiego testu, zgodnie z definicją przypadku, wymaga potwierdzenia badaniem RT-PCR.
Zbiorcze badanie próbek
Zbiorcze badanie (pulowanie) próbek jest metodą szybszą niż analiza próbek pojedynczych, a dodatkowo oszczędza zasoby w sytuacjach, w których oczekiwany odsetek wyników dodatnich jest bardzo mały (≤5%).11,81 Metoda polega na połączeniu większej liczby próbek, przy czym należy zabezpieczyć część materiału lub drugą próbkę od każdego badanego. Częstość uzyskania dodatniego wyniku badania zbiorczego zależy od sytuacji epidemiologicznej. W przypadku uzyskania takiego wyniku próbki należy zbadać pojedynczo.
Alternatywnie próbki można umieścić w kilku pulach, których wyniki łącznie identyfikują próbkę pozytywną.
Jeżeli częstość zakażeń wynosi 0–2,5%, najlepszą metodą wydaje się dzielenie binarne puli,81 jeśli natomiast odsetek wyników dodatnich wynosi <1,3%, proponuje się jednoetapowe badanie całej puli, bez konieczności późniejszego badania poszczególnych próbek81. ECDC opracowało metodologię szacowania częstości występowania zakażenia SARS-CoV-2 na podstawie zbiorczego badania metodą RT-PCR.11
Kontynuacja badań i czas wykonania testów
Przez kontynuację badań rozumie się wykonanie u danej osoby więcej niż 1 testu w różnym czasie w celu zwiększenia prawdopodobieństwa wykrycia zakażenia. Taki algorytm testowania służy przede wszystkim zidentyfikowaniu przypadków zakażeń bezobjawowych i przedobjawowych. Wyniku dodatniego nie uzyskuje się zaraz po zakażeniu, ale dopiero po wystarczającej replikacji wirusa, kiedy w pobranej próbce jest obecna odpowiednia ilość RNA lub antygenu SARS-CoV-2. Znaczenie ma również granica wykrywalności użytego testu. Jednakże w niektórych sytuacjach nie jest możliwe stwierdzenie, czy czas, jaki upłynął od zakażenia, pozwala już na wykrycie wirusa za pomocą wybranego testu. Może to wynikać ze zmienności okresu inkubacji, który jest różny u poszczególnych osób, lub braku informacji o tym, kiedy doszło do ekspozycji. Im wcześniej wykryje się zakażenie, tym większe jest prawdopodobieństwo zapobieżenia dalszej transmisji (np. przez monitorowanie osób z kontaktu). Badania kontynuowane wykonuje się więc z uwagi na ryzyko uzyskania ujemnego wyniku pierwszego testu, jeżeli się go wykona na etapie zakażenia, w którym nie można jeszcze wykryć obecności wirusa za pomocą danego testu, szczególnie jeśli jest to szybki test o większej granicy wykrywalności.
Jak pokazano na wykresie średniego okresu występowania zakaźności (ryc.), określonej jako odsetek możliwych transmisji, na około 4 dni przed wystąpieniem objawów obserwuje się jego gwałtowny wzrost, a tym samym zwiększenie wiremii i wykrywalności wirusa.82,83 Wykazano jednak, że za pomocą testu RT-PCR w okresie inkubacji można wykryć RNA wirusa na 1–3 dni przed wystąpieniem objawów.82,84,85
Jako że w zdecydowanej większości przypadków okres inkubacji wynosi ≤12 dni (zob. „Okres inkubacji” powyżej), przeważnie od zakażenia do wykrywalności wirusa upływa kilka dni. Z tego względu u osób bezobjawowych lub przedobjawowych, gdy nie wiadomo, kiedy doszło do kontaktu z patogenem, lub informacja o tym nie jest wiarygodna, weryfikacja pierwszego testu z wynikiem ujemnym jednym lub kilkoma kolejnymi badaniami może znacznie zwiększyć skuteczność identyfikacji osób zakażonych. Ponieważ w większości przypadków okres inkubacji choroby wynosi 12 dni, a wirus jest wykrywalny na 1–3 dni przed wystąpieniem objawów, na podstawie aktualnie dostępnych danych oceniamy, że badanie wykonane około 10. dnia po ewentualnym kontakcie z wirusem pozwala zidentyfikować większość przypadków zakażenia SARS-CoV-2. ECDC stale analizuje pojawiające się dane i prowadzi własne analizy modelowe w tym zakresie, niniejsza ocena może więc ulec zmianie, gdy pojawią się nowe informacje.
Jeżeli data możliwego kontaktu z patogenem jest znana i planuje się wykonanie tylko jednego badania, nie należy go wykonywać w pierwszych 2 dniach od ekspozycji, z uwagi na małe prawdopodobieństwo wykrycia zakażenia. Jeżeli natomiast data ekspozycji nie jest znana, pierwsze badanie należy wykonać jak najszybciej. Jeśli planuje się przeprowadzenie jednego kolejnego badania, należy je wykonać po około 10 (tj. 12 minus 2) dniach od pierwszego testu, ponieważ takie podejście maksymalizuje szansę wykrycia największej liczby przypadków. W zależności od dostępności zasobów w celu jak najwcześniejszego wykrycia zakażenia można wykonać dodatkowe badania przed dniem 10. Jeżeli u badanej osoby przed planowanym kolejnym badaniem wystąpią objawy, takie badanie należy wykonać jak najszybciej, zgodnie z obowiązującą strategią badania przypadków objawowych. Badań kontynuowanych służących wykryciu przypadków bezobjawowych i przedobjawowych nie należy mylić z badaniem w celu zwolnienia pacjenta z izolacji – tu zwykle niezbędne jest uzyskanie wyniku ujemnego w 2 kolejnych testach.86
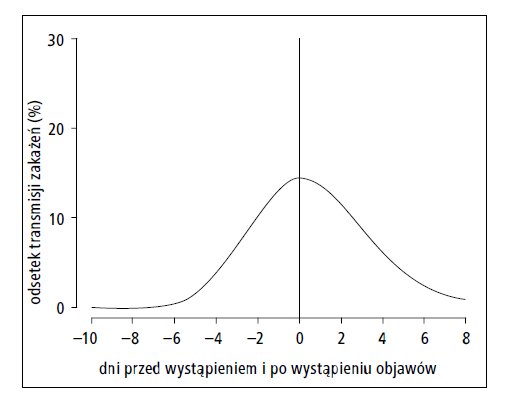
Ryc. Szacowany odsetek transmisji zakażeń w zależności od liczby dni przed i po wystąpieniu objawów (orientacyjny profil zakaźności po wystąpieniu objawów – przyp. red.). W tym badaniu oszacowano, że 44% (95% CI: 30–57%) transmisji zakażeń nastąpiło przed wystąpieniem objawów. Nasilenie zakaźności (%) można uznać za wyrażone w jednostkach umownych; obszar pod krzywą reprezentuje 100% (transmisji zakażeń – przyp. red.). Na podstawie: He i wsp.73,74
Rodzaje próbek
Próbki do badań diagnostycznych w kierunku SARS-CoV-2 można pobierać z górnych (wymazy z nosowej lub ustnej części gardła, aspirat z nosa, popłuczyny nosowe, ślina) lub dolnych dróg oddechowych (plwocina, aspirat z tchawicy lub popłuczyny oskrzelowo-pęcherzykowe). Porównania dokładności badań RT-PCR tych materiałów wskazują na możliwe różnice w granicy oznaczalności testu w zależności od rodzaju próbki. Wymazy z jamy nosowej i ustnej części gardła uznaje się za materiał zapewniający odpowiednią granicę oznaczalności badań w kierunku SARS-CoV-2, przy czym wykazano, że testy z użyciem próbek stanowiących połączenie materiału z nosowej i ustnej części gardła zapewniają większą granicę oznaczalności niż wykonane z użyciem wymazu pobranego tylko z nosowej części gardła.84,87,88 Jeśli nie ma możliwości pobrania wymazu z nosowej części gardła lub innego materiału z górnych dróg oddechowych (jak wyżej), dopuszcza się pobranie próbki śliny.89,90 Ślinę pozyskuje się w sposób nieinwazyjny, można więc rozważyć jej samodzielne pobranie przez pacjenta.
Monitorowanie osób z kontaktu
Celem śledzenia kontaktów jest szybka identyfikacja osób mających styczność z osobą z laboratoryjnie potwierdzonym COVID-19 i poddanie ich kwarantannie, aby ograniczyć dalszą transmisję wirusa, zanim zakażenie zostanie u nich rozpoznane. Rygorystyczne ustalanie osób z kontaktu w połączeniu z szeroko zakrojoną strategią testowania stanowi skuteczną metodę kontroli rozprzestrzeniania COVID-19. ECDC opublikowało wytyczne dotyczące sposobu ustalania osób z kontaktu1 oraz wskazówki, jak zwiększyć wydajność podjętych działań i utrzymać ich ciągłość nawet w sytuacji rozpowszechnionej transmisji lub ograniczonych zasobów1,91. Do zapewnienia identyfikacji osób z kontaktu, zanim dojdzie do dalszej transmisji zakażenia, osoby z objawami wskazującymi na COVID-19 należy poddawać badaniu niezwłocznie po ich wystąpieniu. Aby było to możliwe, należy uświadamiać społeczeństwu konieczność poddania się badaniu od razu po wystąpieniu objawów oraz zapewnić łatwy dostęp do testów (powyższe zalecenie dotyczy również osób z zagranicy). Należy skrócić do minimum czas oczekiwania na wynik testu i niezwłocznie poinformować badanych i właściwe instytucje zdrowia publicznego o dodatnich wynikach, w celu wdrożenia poszukiwania osób z kontaktu, przeprowadzenia wywiadu z zakażonymi i dotarcia do osób, z którymi mieli kontakt. ECDC określiło wskaźniki monitorowania osób z kontaktu i zachęca poszczególne państwa do gromadzenia i analizowania danych w tym zakresie.92
Badanie osób z kontaktu
Wszystkie osoby z kontaktu (dużego i małego ryzyka), u których wystąpiły objawy, należy jak najszybciej poddać badaniu, aby móc monitorować osoby, które miały z nimi styczność. Ponadto zaleca się jak najszybsze zbadanie wszystkich zidentyfikowanych osób z kontaktu dużego ryzyka, a w niektórych okolicznościach także z kontaktu małego ryzyka. Takie działanie ułatwia wczesną identyfikację wszelkich przypadków zakażenia wśród osób, które miały z nimi kontakt, i umożliwia rozszerzenie monitorowania na ich kontakty sprzed rozpoczęcia kwarantanny.
W razie uzyskania ujemnego wyniku pierwszego testu oraz testu kontrolnego wykonanego nie wcześniej niż w 10. dniu od ekspozycji osoba z kontaktu może zostać zwolniona z kwarantanny przed upływem zalecanego 14-dniowego okresu. Należy jednak pamiętać, że u niewielkiego odsetka takich osób zakażenie może się rozwinąć pod koniec okresu inkubacji, w związku z czym w 10. dniu mogą one nie wykazywać jeszcze objawów albo wirus może jeszcze nie być wykrywalny. Dlatego też każdy przypadek wcześniejszego zwolnienia z kwarantanny należy oceniać indywidualnie oraz rozważyć wykonanie testu później niż w 10. dniu u osób z kontaktu, które pracują z osobami z grup wymagających szczególnej troski lub w środowiskach dużego ryzyka (jak np. więzienia).2
W miarę możliwości testy należy wykonywać także w ramach analizy przypadku w celu poznania źródła zakażenia pacjenta zero. Takie podejście ułatwia dalsze monitorowanie osób z kontaktu i przerwanie łańcucha transmisji.
Transmisja zakażeń przez osoby bezobjawowe i przedobjawowe
W maju i czerwcu 2020 roku niektóre państwa członkowskie UE zaczęły stopniowo rozszerzać strategię testowania i badać również osoby z łagodnymi objawami oraz osoby bez objawów. Osoby bezobjawowe i osoby z kontaktu z zakażonymi badano w ramach programów badań przesiewowych (populacje zwiększonego ryzyka, lotniska, chorzy przyjmowani do szpitali), monitorowania osób z kontaktu, badań częstości zakażeń albo innych badań populacyjnych.49
Strategie szerszego testowania i badań populacyjnych, którymi objęto osoby niezależnie od występowania objawów, pozwoliły na oszacowanie odsetka przypadków osób bezobjawowych lub przedobjawowych w dniu badania i wykazały bezobjawowy przebieg choroby u 5–80% zakażonych SARS-CoV-2.93 Sermet i wsp. stwierdzili, że ponad 50% badanych dzieci seropozytywnych nie zgłaszało żadnych objawów.94 Podobny odsetek odnotowali Oran i wsp. u dorosłych.95 W populacyjnym badaniu częstości występowania przeciwciał przeprowadzonym w Hiszpanii wykazano, że 22–36% zakażeń przebiegło bezobjawowo.96
Z kolei w badaniu obejmującym 303 zakażonych SARS-CoV-2 przeprowadzonym w marcu 2020 roku w Korei u 21 spośród 110 (36%) osób, które w momencie rozpoczęcia izolacji były bezobjawowe, objawy wystąpiły podczas izolacji.97 Badanie nie obejmowało oceny dalszej transmisji zakażenia przez pacjentów bezobjawowych, ale wskazuje na taką samą zawartość RNA wirusa w badanym materiale u pacjentów bezobjawowych i objawowych. U osób bez objawów RNA wirusa było wykrywalne do 17. dnia, a u objawowych (w tym przedobjawowych) do 19,5. dnia od wykrycia zakażenia. 97 Z uwagi na duże ryzyko narażenia u pracowników ochrony zdrowia w szpitalach i placówkach opieki długoterminowej testy w kierunku zakażenia SARS-CoV-2 wykonuje się częściej niż dou pozostałych bezobjawowych osób z populacji ogólnej. W tej grupie stwierdzono duży odsetek osób bezobjawowych wśród potwierdzonych laboratoryjnie przypadków zakażenia.10,98
Przez osoby niemające objawów przez cały okres zakażenia może się zmniejszać skuteczność strategii prewencji i kontroli zakażeń, które polegają na identyfikacji przypadków objawowych. W systemie monitorowania opartego na objawach takie osoby nie są badane i zakażenie pozostaje u nich niewykryte, co się przyczynia do szerzenia transmisji w danym kraju. Odsetek przypadków bezobjawowych wśród wszystkich potwierdzonych zakażeń jest zmienny i prawdopodobnie zależy od sytuacji. Chociaż nadal nie jest znana ogólna częstość występowania zakażeń bezobjawowych, wiadomo, że osoby z takim przebiegiem zakażenia stanowią znaczny odsetek wszystkich przypadków.
Długotrwałe nosicielstwo i ponowne zakażenie
Od początku pandemii identyfikuje się osoby z laboratoryjnie potwierdzonym COVID-19, u których wynik testów PCR pozostaje dodatni długo po zakażeniu. 99,100 W ostatnich tygodniach u kilku osób stwierdzono powtórne – objawowe lub bezobjawowe – zakażenie SARS-CoV-2 (po wcześniejszym, potwierdzonym laboratoryjnie). Te przypadki potwierdzono metodą sekwencjonowania – wyizolowano różne szczepy SARS-CoV-2.101-103 W kilku krajach badane są kolejne przypadki ponownego zakażenia, ale ich liczba ani czynniki, które mogą się przyczyniać do tego zjawiska, nie są znane. W strategiach testowania i innych działaniach w obszarze zdrowia publicznego należy uwzględniać osoby z utrzymującym się dodatnim wynikiem badania PCR oraz przypadki ponownego zakażenia. Oba zagadnienia wymagają dalszych analiz, które pozwolą lepiej zrozumieć proces wykształcania odpowiedzi immunologicznej i oszacować prawdopodobieństwo ponownego zakażenia.
Ograniczenia
Nie znamy odsetka osób, u których zakażenie przebiega bez- lub skąpoobjawowo i które się przy czyniają do transmisji SARS-CoV-2. Wydaje się jednak, że różni się on w zależności od sytuacji i populacji. Taki stan rzeczy znacznie ogranicza skuteczność podejścia do testowania opartego przede wszystkim na osobach objawowych: ponieważ osoby bez objawów lub ze skąpymi objawami zwykle nie wymagają opieki medycznej, nie wykonuje się u nich testów i nie wykrywa zakażenia.
Nie opisano jeszcze dokładnie zależności między zakaźnością i stężeniem wirusa w danej części ciała (tj. gardle, płucach, przewodzie pokarmowym) a jego wykrywalnością za pomocą testu w próbce pobranej z tej części ciała. Nie jest też znana dawka zakaźna SARS-CoV-2. Przyjęto, że wirus można wykryć za pomocą dowolnego testu od momentu, gdy jego ilość zaczyna rosnąć w tempie wykładniczym, do czasu osiągnięcia stężenia sprzed wzrostu. Niezbędne jest uzyskanie dokładniejszych danych na temat zależności między tymi zmiennymi, a następnie przeprowadzenie modelowania scenariuszy, przede wszystkim dotyczących badań kontynuowanych. Trzeba też pamiętać, że strategia testowania zależy od dostępności zasobów, a o jej skuteczności decyduje krótki czas oczekiwania na wynik testu. Na wiarygodność wyniku wpływają natomiast: ogólna sytuacja epidemiologiczna (tj. częstość zakażeń w populacji), jakość próbki, transport, jakość laboratorium, a także specyfikacja testu, w tym wartości decyzyjne oraz normy odniesienia.
Poza osobami z czynnym zakażeniem są też takie, u których ponownie może dojść do zakażenia mimo wytworzenia odpowiedzi immunologicznej na SARS-CoV-2. To zagadnienie również wymaga dalszych badań. Aktualnie nie da się z dużą dozą pewności określić odsetka takich osób ani poziomu ochrony przed ponownym zakażeniem zapewnianej przez wytworzoną odpowiedź immunologiczną.
Wnioski
Niniejszy dokument zawiera krótki opis różnych strategii testowania, które mogą być przyjęte przez poszczególne kraje w zależności od sytuacji epidemiologicznej, możliwości systemu testowania, dostępnej infrastruktury i wyznaczonych celów. Kwestię strategii badań w kierunku zakażenia SARS-CoV-2 poruszono już we wcześniejszych do kumentach ECDC, m.in. w najnowszej (11.) wersji dokumentu poświęconego szybkiej ocenie ryzyka,5 w którym zaleca się maksymalizację wysiłków oraz zapewnienie szybkiego testowania wszystkich osób z objawami w celu ich izolowania oraz monitorowania i kwarantanny osób z kontaktu. W niniejszym dokumencie przedstawiono szersze, celowane podejście do testowania, polegające na aktywnym nadzorze i wczesnym wykrywaniu wszystkich przypadków objawowych, opracowane i zaktualizowane na podstawie bieżącej oceny lokalnej sytuacji epidemiologicznej. Sprawny system z łatwym dostępem do testów ma zasadnicze znaczenie dla wczesnej identyfikacji lokalnego wzrostu liczby zakażeń. Taki system może pomóc zastąpić uciążliwe ogólnopopulacyjne środki zwalczania epidemii celowanymi rozwiązaniami. Państwa członkowskie UE/EOG i Wielka Brytania powinny zasadniczo utrzymywać system testowania na poziomie, który pozwoli na badanie wszystkich przypadków objawowych oraz objawowych osób z kontaktu, i skupić się na optymalizacji strategii testowania, aby maksymalnie skrócić czas oczekiwania na wynik badania i zapewnić sprawne monitorowanie osób z kontaktu.
W środowiskach, w których przebywają osoby obciążone zwiększonym ryzykiem zachorowania (np. w placówkach opieki długoterminowej i zakładach karnych), ECDC proponuje przyjęcie bardziej kompleksowego podejścia i obniżenie kryteriów kwalifikacji do wykonania testu, tak by objąć badaniem nawet osoby bez objawów. Wykonywanie badania niezależnie od występowania objawów należy rozważyć wśród pracowników, pacjentów i pensjonariuszy placówek medycznych i opieki społecznej oraz innych populacji wrażliwych. W zależności od dostępności zasobów można też objąć nim osoby, które miały kontakt dużego ryzyka (bliski kontakt) z osobą z potwierdzonym zakażeniem.1 Należy przy tym pamiętać, że przyjęta strategia testowania nie może negatywnie wpływać na dostępność lub terminowość badania osób z objawami oraz że niezbędne jest regularne weryfikowanie jej skuteczności. Strategie testowania powinny być elastyczne i dostosowywane do lokalnej sytuacji epidemiologicznej, dynamiki populacji oraz posiadanych zasobów.
Czytaj również komentarze do raportu ECDC: Strategie i cele testowania w kierunku COVID-19
Komentarz I dr hab. n. med. Anny Mertas
Komentarz II dr hab. n. med. Jerzego Jaroszewicza
Piśmiennictwo:
1. European Centre for Disease Prevention and Control (ECDC): Contact tracing: public health management of persons, including healthcare workers, having had contact with COVID-19 cases in the European Union – second update. 9.04.2020. www.ecdc.europa. eu/en/covid-19-contact-tracing-public-health-management2. ECDC: Case definition for coronavirus disease 2019 (COVID-19). 29.05.2020. www.ecdc. europa.eu/en/covid-19/surveillance/case-definition
3. ECDC: Testing strategies. 29.05.2020. www.ecdc.europa.eu/en/covid-19/surveillance/ testing-strategies
4. ECDC: Strategies for the surveillance of COVID-19. 9.04.2020. www.ecdc.europa.eu/ en/publications-data/strategies-surveillance-covid-195. ECDC: Rapid risk assessment: coronavirus disease 2019 (COVID-19) in the EU/EEA and the UK – eleventh update: resurgence of cases. 10.08.2020. www.ecdc.europa.eu/en/publications-data/rapid-risk-assessment-coronavirus-disease-2019-covid-19-eueea-and-uk-eleventh
5. Vestergaard L.S., Nielsen J., Richter L. i wsp.: Excess all-cause mortality during the COVID-19 pandemic in Europe – preliminary pooled estimates from the EuroMOMO network, March to April 2020. Euro Surveill., 2020; 25; https://doi.org/10.2807/1560–7917. ES.2020.25.26.2001214
6. Martellucci C.A., Sah R., Rabaan A.A. i wsp.: Changes in the spatial distribution of COVID-19 incidence in Italy using GIS-based maps. Ann. Clin. Microbiol. Antimicrob., 2020; 19: 30
7. ECDC: Weekly surveillance report on COVID-19. 4.09.2020. www.ecdc.europa.eu/en/ covid-19/surveillance/weekly-surveillance-report
8. Jing Q.L., Liu M.J., Zhang Z.B. i wsp.: Household secondary attack rate of COVID-19 and associated determinants in Guangzhou, China: a retrospective cohort study. Lancet Infect. Dis., 2020; 20: P1141–1150
9. ECDC: Surveillance of COVID-19 at long-term care facilities in the EU/EEA. 19.05.2020. www. ecdc.europa.eu/en/publications-data/surveillance-COVID-19-long-term-care-facilities-EU-EEA
10. ECDC: Methodology for estimating point prevalence of SARS-CoV-2 infection by pooled RT-PCR testing. 28.05.2020. www.ecdc.europa.eu/en/publications-data/methodology-estimating-point-prevalence-sars-cov-2-infection-pooled-rt-pcr
11. ECDC: Infection prevention and control and surveillance for coronavirus disease (COVID-19) in prisons in EU/EEA countries and the UK. 3.07.2020. www.ecdc.europa.eu/ en/publications-data/infection-prevention-and-control-and-surveillance-covid-19-prisons
12. US Centers for Disease Control and Prevention (CDC). CDC’s Diagnostic Multiplex Assay for Flu and COVID-19 at Public Health Laboratories and Supplies. 2.08.2020. www.cdc. gov/coronavirus/2019-ncov/lab/multiplex.html
13. Hartmann S., Rubin Z., Sato H. i wsp.: Coronavirus 2019 (COVID-19) infections among healthcare workers, Los Angeles County, February–May 2020. Clin. Infect. Dis., 2020; https://doi.org/10.1093/cid/ciaa1200
14. ECDC: COVID-19 clusters and outbreaks in occupational settings in the EU/EEA and the UK. 11.08.2020. www.ecdc.europa.eu/en/publications-data/covid-19-clusters-and-outbreaks-occupational-settings-eueea-and-uk
15. Menezes M.O., Andreucci C.B., Nakamura-Pereira M. i wsp.: Universal COVID19 testing in the obstetric population: impacts on public health. Cad. Saude Publica, 2020; 36: e00164820
16. Prabhu M., Cagino K., Matthews K.C. i wsp.: Pregnancy and postpartum outcomes in a universally tested population for SARS-CoV-2 in New York City: a prospective cohort study. BJOG, 2020; https://doi.org/10.1111/1471-0528.16403
17. Doria M., Peixinho C., Laranjo M. i wsp.: Covid-19 during pregnancy: a case series from an universally tested population from the north of Portugal. Eur. J. Obstet. Gynecol. Reprod. Biol., 2020; 250: 261–262
18. Ferrazzi E., Beretta P., Bianchi S. i wsp.: SARS-CoV-2 infection testing at delivery: a clinical and epidemiological priority. J. Matern. Fetal. Neonatal. Med., 2020; https://doi.org/10. 1080/14767058.2020.1788532
19. Iida M., Tanaka M.: Screening maternity populations during the COVID-19 pandemic. BJOG, 2020; doi: 10.1111/1471-0528.16439
20. Abeysuriya S., Wasif S., Counihan C. i wsp.: Universal screening for SARS-CoV-2 in pregnant women at term admitted to an East London maternity unit. Eur. J. Obstet. Gynecol. Reprod. Biol., 2020; 252: 444–446
21. Cavicchiolo M.E., Trevisanuto D., Lolli E. i wsp.: Universal screening of high-risk neonates, parents, and staff at a neonatal intensive care unit during the SARS-CoV-2 pandemic. Eur. J. Pediatr., 2020; https://doi.org/10.1007/s00431-020-03765-7
22. Grassly N.C., Pons-Salort M., Parker E.P.K. i wsp.; Imperial College C-RT: Comparison of molecular testing strategies for COVID-19 control: a mathematical modelling study. Lancet Infect. Dis., 2020; https://doi.org/10.1016/S1473-3099(20)30630–7
23. Sastry S.R., Pryor R., Raybould J.E. i wsp.: Universal screening for the SARS-CoV-2 virus on hospital admission in an area with low COVID-19 prevalence. Infect. Control. Hosp. Epidemiol., 2020; doi: 10.1017/ice.2020.358
24. Poline J., Gaschignard J., Leblanc C. i wsp.: Systematic SARS-CoV-2 screening at hospital admission in children: a French prospective multicenter study. Clin. Infect. Dis., 2020; doi: 10.1093/cid/ciaa1044
25. Fong D., Rauch S., Petter C. i wsp.: Infection rate and clinical management of cancer patients during the COVID-19 pandemic: experience from a tertiary care hospital in northern Italy. ESMO Open., 2020; 5(3)
26. Madariaga A., McMullen M., Sheikh S. i wsp.: COVID-19 testing in patients with cancer: does one size fit all? Clin. Cancer Res., 2020; doi: 10.1158/1078–0432.CCR-20-2224
27. de Sandes-Freitas T.V., Canito Brasil I.R., Oliveira Sales M. i wsp.: Lessons from SARS-CoV-2 screening in a Brazilian organ transplant unit. Transpl. Infect. Dis., 2020; https://doi. org/10.1111/tid.13376
28. McDevitt K.E.M., Ganjoo N., Mlangeni D., Pathak S.: Outcome of universal screening of neonates for COVID-19 from asymptomatic mothers. J. Infect., 2020; 81: 452–482
29. Expresso: COVID. DGS confirma surto no Hospital de Sao José, em Lisboa. Expresso; 26.07.2020. https://expresso.pt/coronavirus/2020-07-08-Covid.-DGS-confirma-surto-no-Hospital-de-Sao-Jose-em-Lisboa
30. Lewis S.S., Smith B.A., Akinboyo I.C. i wsp.: Early experience with Universal preprocedural testing for SARS-CoV-2 in a relatively low-prevalence area. Infect. Control Hosp. Epidemiol., 2020; doi: 10.1017/ice.2020.398
31. Gruskay J.A., Dvorzhinskiy A., Konnaris M.A. i wsp.: Universal testing for COVID-19 in essential orthopaedic surgery reveals a high percentage of asymptomatic infections. J. Bone Joint Surg. Am., 2020; 102: 1379–1388
32. Hernigou J., Valcarenghi J., Safar A. i wsp.: Post-COVID-19 return to elective orthopaedic surgery-is rescheduling just a reboot process? Which timing for tests? Is chest CT scan still useful? Safety of the first hundred elective cases? How to explain the “new normality health organization” to patients? Int. Orthop., 2020; doi: 10.1007/s00264-020-04728-1
33. Mohanty S., Lakkireddy D., Trivedi C. i wsp.: Creating a safe workplace by universal testing of SARS-CoV-2 infection in patients and healthcare workers in the electrophysiology unit having no symptoms of COVID-19: a multi-center experience. medRxiv; https://doi. org/10.1101/2020.07.14.20153494
34. Raba A.A., Abobaker A., Elgenaidi I.S., Daoud A.: Novel coronavirus infection (COVID-19) in children younger than one year: a systematic review of symptoms, management and outcomes. Acta Paediatrica, 2000; https://doi.org/10.1111/apa.15422
35. Naqvi M., Burwick R.M., Ozimek J.A. i wsp.: Severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) universal testing experience on a Los Angeles labor and delivery unit. Obstet. Gynecol., 2020; 136: 235–236
36. Bakaev I., Retalic T., Chen H.: Universal testing-based response to COVID-19 outbreak by a long-term care and post-acute care facility. J. Am. Geriatr. Soc., 2020; 68: E38–E39
37. Bigelow B.F., Tang O., Barshick B. i wsp.: Outcomes of universal COVID-19 testing following detection of incident cases in 11 long-term care facilities. JAMA Intern. Med., 2020; doi:10.1001/jamainternmed.2020.3738
38. Dora A.V., Winnett A., Jatt L.P. i wsp.: Universal and serial laboratory testing for SARS-CoV-2 at a long-term care skilled nursing facility for veterans – Los Angeles, California, 2020. MMWR Morb. Mortal. Wkly Rep., 2020; 69: 651–655
39. Hatfield K.M., Reddy S.C., Forsberg K. i wsp.: Facility-wide testing for SARS-CoV-2 in nursing homes – seven U.S. jurisdictions, March–June 2020. MMWR Morb. Mortal. Wkly Rep., 2020; 69: 1095–1099
40. Feaster M., Goh Y.Y.: High proportion of asymptomatic SARS-CoV-2 infections in 9 long-term care facilities, Pasadena, California, USA, April 2020. Emerg. Infect. Dis., 2020; 26 (10)
41. Louie J.K., Scott H.M., DuBois A. i wsp.: Lessons from mass-testing for COVID-19 in long term care facilities for the elderly in San Francisco. Clin. Infect. Dis., 2020; doi: 10.1093/cid/ciaa1020
42. Telford C.T., Onwubiko U., Holland D. i wsp.: Mass screening for SARS-CoV-2 infection among residents and staff in twenty-eight long-term care facilities in Fulton County, Georgia. medRxiv, 2020; doi: 10.1101/2020.07.01.20144162
43. Escobar D.J., Lanzi M., Saberi P. i wsp.: Mitigation of a COVID-19 outbreak in a nursing home through serial testing of residents and staff. Clin. Infect. Dis., 2020; doi: 10.1093/ cid/ciaa1021
44. Powell T., Bellin E., Ehrlich A.R.: Older adults and Covid-19: the most vulnerable, the hardest hit. Hastings Cent. Rep., 2020; 50: 61–63
45. Rudolph J.L., Halladay C.W., Barber M. i wsp.: Temperature in nursing home residents systematically tested for SARS-CoV-2. J. Am. Med. Dir. Assoc., 2020; 21: 895–899 e1
46. White E.M., Kosar C.M., Feifer R.A. i wsp.: Variation in SARS-CoV-2 prevalence in U.S. skilled nursing facilities. J. Am. Geriatr. Soc., 2020; doi: 10.1111/jgs.16752
47. Nguyen L.H., Drew D.A., Graham M.S. i wsp.: Risk of COVID-19 among front-line healthcare workers and the general community: a prospective cohort study. Lancet Public Health, 2020; 5: E475–E483
48. ECDC: Population-wide testing of SARS-CoV-2: country experiences and potential approaches in the EU/EEA and the United Kingdom. 19.08.2020. www.ecdc.europa.eu/ en/publications-data/population-wide-testing-sars-cov-2-country-experiences-and-potential-approaches
49. Mossong J., Hens N., Jit M. i wsp.: Social contacts and mixing patterns relevant to the spread of infectious diseases. PLoS Med., 2008; 5: e74
50. ECDC: COVID-19 in children and the role of school settings in COVID-19 transmission. 6.08.2020. www.ecdc.europa.eu/en/publications-data/children-and-school-settings-covid-19-transmission
51. ECDC: Objectives for COVID-19 testing in school settings. 10.08.2020. www.ecdc.europa. eu/en/publications-data/objectives-covid-19-testing-school-settings
52. Aebi M.F., Tiago M.M.: Prisons and prisoners in Europe 2019: key findings of the SPACE I report. 9.06.2020. http://wp.unil.ch/space/files/2020/04/Key-Findings-2019_200406.pdf
53. EPSU: Fighting COVID-19 in prisons and detention centres in Europe: protected prison workers – protected inmates. 15.04.2020. www.epsu.org/article/fighting-covid19-prisons-and-detention-centres-europe-protected-prison-workers-protected
[...]
64. Catala Sabaté M., Cardona Iglesias P.J., Prats Soler C. i wsp.: Situation report 108. Analysis and prediction of COVID-19 for EU-EFTA-UK and other countries. 29.07.2020. https:// upcommons.upc.edu/handle/2117/328129
65. Leclerc Q., Fuller N., Knight L. i wsp.: What settings have been linked to SARS-CoV-2 transmission clusters? [version 2; peer review: 2 approved]. Wellcome Open Research, 2020; 5: 83
66. Hamner L., Dubbel P., Capron I. i wsp.: High SARS-CoV-2 attack rate following exposure at a choir practice – Skagit County, Washington, March 2020. MMWR Morb. Mortal. Wkly Rep., 2020; 69: 606–610
67. James A., Eagle L., Phillips C. i wsp.: High COVID-19 attack rate among attendees at events at a church – Arkansas, March 2020. MMWR Morb. Mortal. Wkly Rep., 2020; 69: 632–635
68. The European Federation of National Organisations Working with the Homeless (FEANTSA): COVID-19: “Staying Home” not an option for people experiencing homelessness. 18.03.2020. www.feantsa.org/en/news/2020/03/18/covid19-staying-home-not-an-option-for-people-experiencing-homelessness? bcParent=26
69. Simone J.: Coalition for the homeless testifies on the disparate impact of COVID-19 on homeless people in New York City. Coalition for the Homeless, 22.05.2020. www. coalitionforthehomeless.org/coalition-for-the-homeless-testifies-on-the-disparate-impact-of-covid-19-on-homeless-people-in-new-york-city/
70. Canadian Broadcasting Corporation (CBC): Toronto shelter temporarily shuts down amid COVID-19 outbreak that killed 2. 30.05.2020. www.cbc.ca/news/canada/toronto/ st-simons-outbreak-toronto-1.5590942
71. Stewart N.: It’s a Time Bomb’: 23 die as virus hits packed homeless shelters. The New York Times, 13.04.2020. www.nytimes.com/2020/04/13/nyregion/new-york-coronavirus-homeless. html
72. Baggett T.P., Keyes H., Sporn N., Gaeta J.M.: COVID-19 outbreak at a large homeless shelter in Boston: implications for universal testing. medRxiv, 2020; https://doi.org/10. 1101/2020.04.12.20059618 2020.04.12.20059618
73. ECDC: Considerations for travel-related measures to reduce spread of COVID-19 in the EU/ EEA. 26.05.2020. www.ecdc.europa.eu/en/publications-data/considerations-travel-related-measures-reduce-spread-covid-19-eueea
74. CDC: Migration and border health. Considerations for health screening for COVID-19 at points of entry. 23.06.2020. https://www.cdc.gov/coronavirus/2019-ncov/global-covid-19/ migration-border-health.html
75. Li Q., Guan X., Wu P. i wsp.: Early transmission dynamics in Wuhan, China, of novel coronavirus-infected pneumonia. N. Engl. J. Med., 2020; 382: 1199–1207
76. Lauer S.A., Grantz K.H., Bi Q. i wsp.: The incubation period of coronavirus disease 2019 (COVID-19) from publicly reported confirmed cases: estimation and application. Ann. Intern. Med., 2020; 172: 577–582
77. World Health Organization (WHO): Laboratory testing for coronavirus disease (COVID-19) in suspected human cases: interim guidance. 19.03.2020. https://apps.who.int/iris/ handle/10665/331501
78. Kellam P., Barclay W.: The dynamics of humoral immune responses following SARS-CoV-2 infection and the potential for reinfection. J. Gen. Virol., 2020; 101: 791–797
79. European Commission (EC): 2002/364/EC: Commission Decision of 7 May 2002 on common technical specifications for in vitro-diagnostic medical devices (Text with EEA relevance) (notified under document number C(2002) 1344). 2002. https://eurlex.europa. eu/legal-content/EN/TXT/?uri=CELEX%3A32002D0364
80. WHO: COVID-19 Target product profiles for priority diagnostics to support response to the COVID-19 pandemic v.0.1. 5.08.2020. www.who.int/publications/m/item/covid-19-target-product-profiles-for-priority-diagnostics-to-support-response-to-the-covid-19-pandemic-v. 0.1
81. Shental N., Levy S., Wuvshet V. i wsp.: Efficient high-throughput SARS-CoV-2 testing to detect asymptomatic carriers. Science Adv., 2020: eabc5961
82. He X., Lau E.H.Y., Wu P. i wsp.: Temporal dynamics in viral shedding and transmissibility of COVID-19. Nat. Med., 2020; 26: 672–675
83. He X., Lau E.H.Y., Wu P. i wsp.: Author correction: temporal dynamics in viral shedding and transmissibility of COVID-19. Nat. Med., 2020; 26: 1491–1493
84. Pan Y., Zhang D., Yang P. i wsp.: Viral load of SARS-CoV-2 in clinical samples. Lancet Infect. Dis., 2020; 20: 411–412
85. Wei W.E., Li Z., Chiew C.J. i wsp.: Presymptomatic transmission of SARS-CoV-2 – Singapore, January 23–March 16, 2020. MMWR Morb. Mortal. Wkly Rep., 2020; 69: 411–415
86. ECDC: Guidance for discharge and ending isolation In the context of widespread community transmission of COVID-19 – first update. 8.04.2020. www.ecdc.europa.eu/en/ publications-data/covid-19-guidance-discharge-and-ending-isolation
87. Yan Y., Chang L., Wang L.: Laboratory testing of SARS-CoV, MERS-CoV, and SARS-CoV-2 (2019-nCoV): current status, challenges, and countermeasures. Rev. Med. Virol., 2020; 30: e2106
88. Mawaddah A., Gendeh H.S., Lum S.G., Marina M.B.: Upper respiratory tract sampling in COVID-19. Malays J. Pathol., 2020; 42: 23–35
89. Yang Y., Yang M., Shen C. i wsp.: Evaluating the accuracy of different respiratory specimens in the laboratory diagnosis and monitoring the viral shedding of 2019-nCoV infections. medRxiv, 2020.02.11.20021493
90. Czumbel L.M., Kiss S., Farkas N. i wsp.: Saliva as a candidate for COVID-19 diagnostic testing: a meta-analysis. Front. Med., 2020; 7: 465
91. ECDC: Contact tracing for COVID-19: current evidence, options for scale-up and an assessment of resources needed. 5.05.2020. www.ecdc.europa.eu/sites/default/files/ documents/COVID-19-Contract-tracing-scale-up.pdf
92. ECDC: Monitoring and evaluation framework for COVID-19 response activities in the EU/ EEA and the UK. 17.06.2020. www.ecdc.europa.eu/sites/default/files/documents/ covid-19-framework-monitor-responses.pdf
93. Heneghan C., Brassey J., Jefferson T.: COVID-19: What proportion are asymptomatic? 6.04.2020]. www.cebm.net/covid-19/covid-19-what-proportion-are-asymptomatic/
94. Sermet I., Temmam S., Huon C. i wsp.: Prior infection by seasonal coronaviruses does not prevent SARS-CoV-2 infection and associated Multisystem Inflammatory Syndrome in children. medRxiv, 2020.06.29.20142596
95. Oran D.P., Topol E.J.: Prevalence of asymptomatic SARS-CoV-2 infection: a narrative review. Ann. Intern. Med., 2020; doi: 10.7326/M20-3012
96. Pollan M., Perez-Gomez B., Pastor-Barriuso R. i wsp.: Prevalence of SARS-CoV-2 in Spain (ENE-COVID): a nationwide, population-based seroepidemiological study. Lancet, 2020; 396: 535–544
97. Lee S., Kim T., Lee E. i wsp.: Clinical course and molecular viral shedding among asymptomatic and symptomatic patients with SA RS-CoV-2 infection in a community treatment center in the Republic of Korea. JAMA Intern. Med., 2020; doi: 10.1001/ jamainternmed.2020.3862
98. Sciensano: Coronavirus Covid-19. Situation epidémiologique globale. 29.08.2020. https:// covid19.sciensano.be/fr/covid-19-situation-epidemiologique
99. Health Information and Quality Authority (HIQA): Evidence summary of the immune response following infection with SARSCoV-2 or other human coronaviruses. 6.08.2020. www.hiqa.ie/reports-and-publications/health-technology-assessment/ evidence-summary-immunity-response-following
100. Perera R., Tso E., Tsang O.T.Y. i wsp.: SARS-CoV-2 virus culture and subgenomic RNA for respiratory specimens from patients with mild coronavirus disease. Emerg. Infect. Dis., 2020; doi: 10.3201/eid2611.203219
101. To K.K., Hung I.F., Ip J.D. i wsp.: COVID-19 re-infection by a phylogenetically distinct SARS-coronavirus-2 strain confirmed by whole genome sequencing. Clin. Infect. Dis., 2020; doi: 10.1093/cid/ciaa1275
102. Tillett R., Sevinsky J., Kerwin H. i wsp.: Genomic evidence for a case of reinfection with SARS-CoV-2. Lancet, 2020; http://dx.doi.org/10.2139/ssrn.3680955
103. Van Elslande J., Vermeersch P., Vandervoort K. i wsp.: Symptomatic SARS-CoV-2 reinfection by a phylogenetically distinct strain. Clin. Infect. Dis., 2020; doi: 10.1093/cid/ciaa1330


















