Do I fazy badań klinicznych weszła też pierwsza rosyjska eksperymentalna szczepionka przeciwko SARS-CoV-2 opracowana przez Gamaleya Research Institute of Epidemiology and Microbiology w Moskwie. Szczepionka „Gam-COVID-Vac Lyo” to preparat oparty o 2 różne wektory adenowirusowe (ludzki adenowirus typu 26 [Ad26] i typu 5 [Ad5]) w postaci liofilizatu do rekonstytucji. Badanie prowadzone jest niezależnie w 2 moskiewskich ośrodkach (w Wojskowym Szpitalu Klinicznym im. N.N. Burdenko oraz w Pierwszym Moskiewskim Państwowym Uniwersytecie Medycznym im. I.M. Sieczenowa), a współfinansuje je Ministerstwo Zdrowia Federacji Rosyjskiej. Na razie są to badania bez randomizacji oceniające immunogenność i bezpieczeństwo preparatu. W każdym weźmie udział 38 zdrowych ochotników w wieku 18–60 lat. Zakończenie obu badań zaplanowano na sierpień 2020 roku.40,41
DNA z systemem do elektroporacji (INO-4800)
Amerykańska firma Inovio Pharmaceuticals
we współpracy z CEPI prowadzi badania kliniczne
eksperymentalnej szczepionki opartej
na plazmidowym DNA kodującym antygeny
SARS-CoV-2 podawanej metodą elektroporacji
(INO-4800). Elektroporacja polega na zastosowaniu
pola elektrycznego lub elektromagnetycznego
do odwracalnego uszkodzenia błony
komórkowej w celu wprowadzania do komórek
kwasów nukleinowych. Po raz pierwszy zastosowano
ją w latach 80. XX wieku jako alternatywę
dla zmodyfikowanych genetycznie wektorów wirusowych i wykorzystywanych w tym celu metod
chemicznych. Zespół Inovio Pharmaceuticals przebadał
już to rozwiązanie technologiczne we wcześniejszych
pracach nad innymi szczepionkami.4,42 W badaniu I fazy, bez randomizacji, naukowcy
ustalali optymalną dawkę szczepionki oraz
wstępnie ocenili jej bezpieczeństwa i immunogenność.
Protokół przewidywał włączenie do badania
40 zdrowych ochotników w wieku 18–50 lat.
Głównymi punktami końcowymi są m.in.: miejscowe i ogólnoustrojowe zdarzenia niepożądane,
immunogenność (stężenie swoistych przeciwciał,
IFN-γ). Zakładany okres obserwacji to 52 tygodnie, a zakończenie zbierania danych do oceny głównych
punktów końcowych zaplanowano na kwiecień
2021 roku. Rekrutację uczestników prowadzi się w 2 ośrodkach: Center for Pharmaceutical Research w Kansas City oraz na Uniwersytecie Pensylwanii w Filadelfii.42
W czerwcu br. Inovio Pharmaceuticals
we współpracy z International Vaccine Institute w Seulu rozpoczęło badanie fazy I/II szczepionki
„INO-4800” również w Korei Południowej. Podobnie
jak w badaniu prowadzonym w Stanach Zjednoczonych, naukowcy ocenią bezpieczeństwo i immunogenność szczepionki w grupie łącznie
160 zdrowych ochotników (40 w fazie I, 120 w fazie
II). Badanie toczy się w 2 szpitalach uniwersyteckich w Seulu (Seoul National University Hospital
oraz Seoul National University Bundang
Hospital). Zbieranie danych do oceny głównych
punktów końcowych potrwa do lutego 2022 roku.43
Szczepionka „GX-19”
Szczepionka „GX-19” to preparat DNA (szczegóły nie są znane) opracowany przez koncern biotechnologiczny Genexine z siedzibą w Seongnam w Korei Południowej.44 Pod koniec czerwca br. rozpoczęto badanie z randomizacją prowadzone metodą podwójnie ślepej próby z placebo, oceniające immunogenność i bezpieczeństwo szczepionki w grupie 190 zdrowych ochotników w wieku 18–50 lat. Badanie prowadzone jest w 1 ośrodku badawczym w Seulu. Zbieranie danych do oceny głównych punktów końcowych potrwa do marca 2021 roku.45
Chińskie szczepionki inaktywowane
W Chinach toczy się aktualnie niezależnie od siebie 5 badań nad 4 różnymi szczepionkami inaktywowanymi
(z „zabitym” wirusem) – p. tabela 1.
Pierwsze prowadzi Wuhan Institute of Biological
Products. Jest to badanie fazy I/II z randomizacją,
prowadzone metodą podwójnie ślepej
próby, a jego celem jest ocena bezpieczeństwa i immunogenności
szczepionki inaktywowanej (wirus
namnażany w hodowli komórek Vero). O samej
szczepionce na razie wiadomo niewiele. Protokół
przewiduje włączenie do badania zdrowych osób w wieku >6 lat (w rejestrze nie podano liczby
uczestników). Głównymi punktami końcowymi
są m.in.: zdarzenia niepożądane, ciężkie zdarzenia
niepożądane oraz serokonwersja. Okres obserwacji
zaplanowano na 12 miesięcy, a badanie
prowadzą 2 ośrodki w chińskiej prowincji Henan
(do początku lipca nie rozpoczęto rekrutacji).4,46
Drugie badanie prowadzi Beijing Institute of
Biological Products, a finansowane jest ze środków
Ministerstwa Nauki i Technologii Chińskiej Republiki
Ludowej. Jest to również badanie I/II fazy prowadzone metodą podwójnie ślepej próby oceniające
bezpieczeństwo i immunogenność szczepionki
inaktywowanej (wirus namnażany w hodowli
komórek Vero). Protokół przewiduje włączenie
do badania zdrowych osób w wieku >3 lat (również
nie podano liczby uczestników). Głównymi punktami
końcowymi są m.in.: zdarzenia niepożądane,
ciężkie zdarzenia niepożądane oraz serokonwersja.
Okres obserwacji zaplanowano na 14 miesięcy, a badanie prowadzi ośrodek prowincji Henan.47
Trzecie badanie prowadzi Institute of Medical
Biology należący do Chinese Academy of Medical
Sciences. Jest to badanie z randomizacją prowadzone
metodą podwójnie ślepej próby z kontrolą
placebo oceniające immunogenność i bezpieczeństwo
eksperymentalnej szczepionki inaktywowanej.
Protokół przewiduje włącznie 942 zdrowych
ochotników w wieku 18–59 lat, którzy otrzymają
domięśniowo 2 dawki szczepionki w schemacie 0,
14 lub 0, 28 dni i różnej wielkości (50, 100 lub 150
U/ml). Badanie prowadzone jest w 2 ośrodkach w prowincji Sichuan.48
Czwarte i piąte badanie fazy I/II prowadzi
chiński koncern biotechnologiczny Sinovac Biotech z siedzibą w Pekinie, który opracował i dostarczył
prototypową szczepionkę PiCoVacc zawierającą
wirusa inaktywowanego β-propionolaktonem
oraz adiuwant glinowy. Jest to
badanie fazy I/II z randomizacją, prowadzone
metodą podwójnie ślepej próby z użyciem placebo w grupie kontrolnej, a jego celem jest ocena bezpieczeństwa i immunogenności szczepionki. Protokół
przewiduje włączenie do badania w sumie
744 zdrowych ochotników w wieku 18–59 lat (144
do badania I fazy oraz kolejnych 600 do badania
II fazy klinicznej), a schemat szczepienia obejmuje 2 dawki podawane – zależnie od wielkości – co
14 lub 28 dni. Głównymi punktami końcowymi
są m.in.: zdarzenia niepożądane i serokonwersja, a dodatkowymi – ciężkie zdarzenia niepożądane i immunogenność (serokonwersja w zakresie
przeciwciał neutralizujących, stężenie swoistych
przeciwciał IgG i IgM oraz przeciwciał neutralizujących).
Okres obserwacji w badaniu wynosi
56 dni, a zbieranie danych do oceny głównych
punktów końcowych potrwa do sierpnia br.4,49 Rekrutacja
ochotników odbywa się w jednym ośrodku w Suining County Center for Disease Control and Prevention w mieście Xuzhou w Chinach. Pod
koniec maja Sinovac Biotech zarejestrował drugi
protokół badania fazy I/II szczepionki PiCoVacc,
ale w grupie 422 zdrowych ochotników w wieku ≥60 lat (72 do badania I fazy oraz kolejnych 350
do badania II fazy klinicznej), w którym oceniane
będzie bezpieczeństwo (zdarzenia niepożądane,
ciężkie zdarzenia niepożądane) i immunogenność
(serokonwersja w zakresie przeciwciał neutralizujących
oraz ich stężenie). Schemat szczepienia
obejmuje podanie 2 dawek w schemacie 0, 28 dni.
Rekrutacja do badania jeszcze się nie rozpoczęła
ze względu na wygaśnięcie epidemii w Chinach
(stan na początek lipca br.).50
Na internetowej platformie preprintowej ukazał
się nierecenzowany artykuł podsumowujący wyniki
badań szczepionki PiCoVacc u myszy, szczurów
oraz małp nienaczelnych (rezusów). Badania te
wykazały, że skutecznie stymulowała ona produkcję
swoistych przeciwciał neutralizujących wszystkie
znane aktualnie linie genetyczne SARS-CoV-2,
które wywołują zachorowania w różnych rejonach
świata, a także niemal całkowicie chroniła małpy
(4 osobniki) przed zachorowaniem po eksperymentalnej
ekspozycji na SARS-CoV-2.51
Szczepionki białkowe, podjednostkowe
Do badań klinicznych weszły również 4 podjednostkowe
szczepionki przeciwko SARS-CoV-2,
zawierające wybrany antygen lub antygeny
SARS-CoV-2.
Pod koniec maja br. amerykańska firma biotechnologiczna
Novavax rozpoczęła badania
kliniczne fazy I/II (z randomizacją i placebo)
eksperymentalnej szczepionki podjednostkowej
zawierającej trimery/nanocząsteczki kompletnej
glikoproteiny S z opatentowanym systemem adiuwantowym
Matrix MTM. Celem jest ocena bezpieczeństwa i immunogenności szczepionki. Protokół
przewiduje włączenie 131 zdrowych ochotników w wieku 18–59 lat. Uczestnicy będę przydzielani
losowo do grup, w których otrzymają: (1) 2 dawki
eksperymentalnej szczepionki bez adiuwanta,
(2) 2 dawki eksperymentalnej szczepionki z adiuwantem
lub (3) placebo. W badaniu analizowane
będą m.in. miejscowe i uogólnione zdarzenia niepożądane,
stężenie swoistych przeciwciał IgG, odsetek serokonwersji). Badanie prowadzą 2 ośrodki w Herston i Melbourne w Australii. Na razie
trwa I faza badania, a zbieranie danych do oceny
punktów końcowych potrwa do 31 grudnia 2020
roku. Po wstępnej analizie danych i pozytywnych
wynikach naukowcy rozpoczną fazę II.52
Kolejne badanie prowadzone jest przez koncern
Clover Biopharmaceuticals z siedzibą w Australii.
Jest to badanie z randomizacją prowadzone
metodą podwójnie ślepej próby z placebo, którego
celem jest ocena immunogenności i bezpieczeństwa
szczepionki „SCB 2019” zawierającej trimery
glikoproteiny S SARS-CoV-2 i dwa różne adiuwanty
AS03 lub CpG 1018 + adiuwant glinowy. W badaniu
weźmie udział 150 zdrowych ochotników w wieku 18–54 lat, którzy otrzymają 2 dawki
(3–30 µg) eksperymentalnej szczepionki „SCB
2019” w schemacie 0, 21 dni z systemem adiuwantowym
AS03 (zawiera skwalen i α tokoferol;
opatentowany przez GSK) lub CpG 1018 (zawiera
oligonukleotydy stymulujące receptor Toll-like 9
[TLR9]; opatentowany przez Dynavax Technologies) z adiuwantem glinowym. Zbieranie danych
do oceny głównych punktów końcowych potrwa
do października br.53
Pod koniec czerwca zarejestrowano także protokół
badania I fazy szczepionki opracowanej
przez chiński koncern Anhui Zhifei Longcom
Biologic Pharmacy, będący częścią Chongqing
Zhifei Biological Products. Badanie prowadzone
jest we współpracy z Uniwersytetem Medycznym w Chongqing. Jest to badanie z randomizacją prowadzone
metodą podwójnie ślepej próby z placebo
oceniające tolerancję i bezpieczeństwo rekombinowanej
szczepionki „CHO Cells”, która zawiera
glikoproteinę S SARS-CoV-2 wytwarzaną w hodowli
komórek jajnika chomika chińskiego (system
ekspresji białek rekombinowanych). W badaniu
weźmie udział 50 zdrowych ochotników w wieku
18–59 lat, którzy otrzymają domięśniowo 1 dawkę
szczepionki (testowane będą dawki różnej wielkości).
Zakończenie badania zaplanowano na wrzesień
2022 roku.54
W lipcu br. rozpoczęło się również badanie
szczepionki australijskiego koncernu biotechnologicznego
Vaxine Pty Ltd. Jest to badanie z randomizacją
prowadzone metodą podwójnie ślepej
próby z kontrolą placebo oceniające immunogenność i bezpieczeństwo rekombinowanej, podjednostkowej
szczepionki „Covax-19” zawierającej
glikoproteinę S SARS-CoV-2 z opatentowanym
systemem adiuwantowym Advax™. W badaniu
weźmie udział 40 zdrowych ochotników w wieku
18–65 lat, którzy otrzymają dawkę szczepionki
lub placebo. Badanie prowadzone jest w 1 ośrodku i potrwa do lipca 2021 roku.55
Wyzwania „pandemicznej szybkości”
Kiedy będzie dostępna szczepionka chroniąca przed COVID-19? – to jedno z częściej zadawanych aktualnie pytań. Jak wspomniano na wstępie niniejszego artykułu, choć badania nad szczepionką przeciwko SARS-CoV-2 mają aktualnie najwyższy priorytet i zapewnione finansowanie, normalny cykl opracowania, oceny skuteczności i bezpieczeństwa nowej szczepionki, przygotowania jej produkcji i uzyskania wymaganych pozwoleń na wprowadzenie preparatu na rynek trwa zazwyczaj kilkanaście lat.56-58 Uzyskanie odpowiedzi na powyższe pytanie zależy więc od rozwiązania problemów, z którymi aktualnie mierzy się świat nauki i instytucje regulacyjne. Jak skrócić czas potrzebny na wprowadzenie nowej bezpiecznej szczepionki do masowego stosowania w obliczu ogromnego zapotrzebowania podczas pandemii, która już trwa? Przed jakimi wyzwaniami staną w związku z tym naukowcy, producenci, urzędy regulacyjne oraz rządy poszczególnych krajów? Na łamach „The New England Journal of Medicine” głos w tej sprawie zabrali pod koniec marca br. eksperci CEPI.3
Sprawdzone i uniwersalne platformy technologiczne
Eksperci CEPI podkreślają znaczenie, jakie dla
skrócenia czasu potrzebnego do uzyskania nowej
skutecznej szczepionki ma wybór odpowiedniego
rozwiązania technologicznego jeszcze
na etapie badań przedklinicznych. W procesie
decyzyjnym należy uwzględnić kilka kryteriów:
1) jaka jest szansa na to, by dana technologia
umożliwiła szybkie uzyskanie produktu gotowego
do badań klinicznych na ludziach – pod tym względem najbardziej atrakcyjne są
szczepionki oparte na kwasach nukleinowych
RNA lub DNA, w drugiej kolejności bierze się
pod uwagę szczepionki podjednostkowe
2) ile dawek należy podać w schemacie szczepienia
pierwotnego, aby uzyskać optymalną i długotrwałą
odpowiedź immunologiczną –
teoretycznie pojedyncza dawka zazwyczaj
wystarcza w przypadku szczepionek „żywych”
(atenuowanych) oraz opartych na wektorze wirusowym
zdolnym lub niezdolnym do replikacji
3) czy technologia jest już opatentowana i stosowana w praktyce w medycynie (aktualnie
są to technologie wykorzystywane w produkcji
szczepionek inaktywowanych, atenuowanych i podjednostkowych)
4) jakie jest doświadczenie instytucji regulacyjnych w ocenie wniosków rejestracyjnych
szczepionek opracowanych z użyciem poszczególnych
technologii
5) jakie jest doświadczenie producentów w produkcji szczepionek opartych na danej
technologii na masową skalę.3
Dzięki „idealnej” platformie technologicznej,
która pozwalałaby na uzyskanie optymalnej odpowiedzi
immunologicznej i szybką produkcję
szczepionki na masową skalę niezależnie od zastosowanego w niej ostatecznie antygenu, czas od wyizolowania
materiału genetycznego drobnoustroju
do rozpoczęcia pierwszych badań klinicznych można
skrócić do <16 tygodni.57
Zmiana paradygmatu prac nad opracowaniem szczepionek
Korzystanie ze sprawdzonych rozwiązań (platform) technologicznych to nie jedyny sposób na skrócenie czasu niezbędnego do uzyskania bezpiecznej i skutecznej nowej szczepionki. Eksperci CEPI wskazują także na konieczną zmianę całego procesu prac i potrzebę odejścia od modelu „tradycyjnego” na rzecz szybszego modelu „pandemicznego” (ryc.).
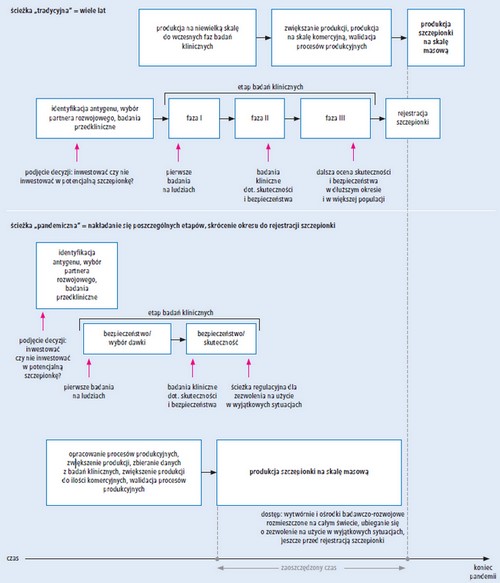
Ryc. Schemat „tradycyjnej” i „pandemicznej” ścieżki prac nad nowymi szczepionkami – w ścieżce „pandemicznej” dzięki realizacji kilku etapów równolegle szybciej można rozpocząć programy masowych szczepień ludzi, istotnie zmniejszając skalę zachorowań i obciążenie systemów opieki zdrowotnej (na podstawie 3. pozycji piśmiennictwa, zmodyfikowane
Opracowanie i wdrożenie do praktyki klinicznej
nowej szczepionki to długi, złożony i niezwykle
kosztowny proces.58 Każdy preparat eksperymentalny
musi pomyślnie przejść kilka etapów
badań przedklinicznych, a następnie klinicznych (tzn. na ludziach), w których ocenia się jego tolerancję i bezpieczeństwo, immunogenność oraz
skuteczność kliniczną. Ze względu na duże ryzyko
niepowodzenia na każdym z tych etapów ścieżka
„tradycyjna” zakłada podążanie liniową sekwencją
kroków – do kolejnego przechodzi się dopiero
po uzyskaniu pomyślnych wyników poprzedniego.
Ścieżka „pandemiczna” zakłada natomiast
szybkie podjęcie decyzji o rozpoczęciu prac (i poczynieniu
koniecznej inwestycji) oraz realizację
kilku etapów jednocześnie. Wykorzystując w pracach
nad nową szczepionką sprawdzoną, przebadaną
wcześniej platformę technologiczną, badania
kliniczne I fazy na ochotnikach prowadzi się jednocześnie z badaniami przedklinicznymi na zwierzętach i już na wczesnym etapie badań klinicznych
rozpoczyna się przygotowywanie linii produkcyjnej i jej rozruch do mocy umożliwiających produkcję
eksperymentalnego preparatu na masową
skalę, jeszcze zanim się ostatecznie pozna jego
skuteczność.3 Przyśpieszenie dojścia do celu
nie polega więc na ograniczeniu zakresu badań
nad bezpieczeństwem lub skutecznością
szczepionki. Taką szybką ścieżką „pandemiczną”
podążają aktualnie w pracach nad swoimi szczepionkami
m.in. zespoły naukowców z Instytutu
Jennera Uniwersytetu w Oksfordzie oraz firmy
Moderna i NIH w Stanach Zjednoczonych.5 Plany
naukowców w zakresie oceny skuteczności szczepionki
może jednak opóźnić wygasanie epidemii w krajach, w których toczą się badania kliniczne.
Mniejsza zapadalność pociąga za sobą konieczność
włączenia do badania znacznie większej liczby
ochotników i/lub wydłużenia okresu obserwacji,
aby zaobserwować odpowiednią liczbę zachorowań w grupie kontrolnej. Z tego powodu niektóre zespoły
badawcze już podjęły decyzję o częściowym
przeniesieniu badań do krajów, w których aktualnie
utrzymuje się duża zapadalność na COVID-19
(np. do Brazylii lub Stanów Zjednoczonych).
Wsparcie finansowe i podział ryzyka
Przestawienie się na „pandemiczny” paradygmat
prac nad szczepionką wiąże się jednak ze zwiększeniem
kosztów i ryzyka strat finansowych dla
inwestorów. Uruchamianie produkcji preparatu o niepotwierdzonej skuteczności, często z wykorzystaniem nieopatentowanej technologii, która
wymaga opracowania i walidacji procesów produkcyjnych,
jest bardzo kosztowne, a do tego nie daje
jakiejkolwiek gwarancji opłacalności.3,58 W takiej
sytuacji kluczowe staje się wsparcie instytucji rządowych,
które choć w części wezmą na siebie ryzyko
finansowe związane z „pandemicznym tempem”
prac nad nową szczepionką.
W tym kontekście eksperci CEPI przypominają
historię szczepionek przeciwko wirusom SARS i zika. Epidemie obu chorób wygasły zanim udało
się opracować skuteczną szczepionkę. Przeznaczone
na ten cel fundusze rządowe wycofano, rozpoczęte
prace przerwano, a laboratoria i firmy
biotechnologiczne oraz koncerny farmaceutyczne
pozostawiono ze stratami finansowymi. Ważne,
aby z tej historii wyciągnąć mądre wnioski. CEPI
apeluje więc, aby intensywne prace nad najbardziej
obiecującymi eksperymentalnymi szczepionkami
przeciwko SARS-CoV-2 kontynuować niezależnie
od sytuacji epidemiologicznej.3 Nie tylko
dlatego, żeby nie zmarnować dotychczas podjętych
wysiłków i zainwestowanych funduszy, ale także
po to, by przygotować sprawdzone platformy
technologiczne i rozwiązania produkcyjne do szybkiego
wykorzystania podczas kolejnych epidemii,
które nieuchronnie nastąpią.57
Aspekty etyczne
Wyzwaniem podczas pandemii jest również prowadzenie
badań klinicznych, których celem
jest ocena skuteczności i bezpieczeństwa nowej
szczepionki.59 Eksperci CEPI zwracają uwagę,
że w sytuacji choroby o dużej śmiertelności
badania kliniczne z użyciem placebo mogą nie
uzyskać społecznej akceptacji. Istnieją wprawdzie
metody na pokonanie tej trudności – można
na przykład porównać efekty „wczesnego” i „późniejszego” podania szczepionki lub
oceniać skuteczność kilku różnych preparatów
szczepionkowych jednocześnie,
ale ze wspólną grupą kontrolną w ramach nowego modelu badań
adaptacyjnych (w ten sposób więcej osób otrzymuje
„aktywny lek”, a do niezbędnego minimum
ogranicza się liczbę osób otrzymujących placebo
lub interwencję kontrolną), ale logistyka takich
badań jest dużo bardziej skomplikowana, a analiza statystyczna i interpretacja wyników stają się w nich trudniejsze.59 Niestety również producenci
niechętnie zgadzają się na takie bezpośrednie porównanie
ich szczepionek w ramach jednego badania
klinicznego. Dużo kontrowersji budzi też propozycja
celowego, eksperymentalnego narażania
na zakażenie SARS-CoV-2 ochotników biorących
udział w badaniach szczepionek, co mogłoby być
rozwiązaniem w przypadku wygasania epidemii.
Choć są zwolennicy takiego postępowania u ochotników,
którzy wyrażą świadomie zgodę na taką
ekspozycję i nie należą do grupy ryzyka ciężkiego
przebiegu COVID-19, chyba mocniejsze są głosy
naukowców i etyków przeciwnych takiemu rozwiązaniu.
Oponenci podkreślają, że nawet u młodych
dorosłych bez obciążeń zdrowotnych zdarzają się
ciężkie zachorowania i zgony z powodu COVID-19, a w obliczu braku leków o dużej skuteczności taka
eksperymentalna ekspozycja na zakażenie wiązałaby
się ze zbyt dużym ryzykiem.
Trzeba się liczyć także z tym, że jeżeli w drugiej
połowie br. duża liczba eksperymentalnych
szczepionek przeciwko SARS-CoV-2 będzie gotowa
do wejścia w fazę badań klinicznych, to „wąskim
gardłem” może być uzyskanie zgody na ich rozpoczęcie
od przeciążonych pracą organów regulacyjnych i komisji bioetycznych.
''Kończąc rozważania, eksperci CEPI zadają
nie mniej ważne pytania związane z charakterystycznym
dla pandemii zapotrzebowaniem
na ogromną liczbę dawek szczepionki jednocześnie
na całym świecie. Czy będziemy w stanie sprostać
produkcji szczepionki na tak olbrzymią skalę w krótkim czasie? Jak zagwarantować jej sprawiedliwą
dystrybucję między krajami i najbardziej
zagrożonymi populacjami? Być może należy pomyśleć o stworzeniu globalnego systemu finansowania,
który będzie wspierał całościowy rozwój,
produkcję i dystrybucję szczepionek na masową
skalę, a także chronił partnerów z sektora prywatnego
przed znacznymi stratami finansowymi.3,59
Spełnienie tego postulatu będzie kluczowym elementem
gotowości na kolejne pandemie, które z pewnością wcześniej lub później wystąpią.
Wydaje się, że na ten apel CEPI właśnie odpowiedziała
Komisja Europejska. W ramach zorganizowanej
przez nią międzynarodowej inicjatywy
zbierane są fundusze na opracowanie skutecznych metod leczenia COVID-19 i szczepionki przeciwko
SARS-CoV-2. Planowano zebrać 7,5 mld euro, ale
do końca czerwca uzyskano już kwotę 15,9 mld
euro. Na oficjalnej stronie internetowej Unii Europejskiej
dostępna jest aktualizowana na bieżąco lista
darczyńców (https://global-response.europa.eu/pledge_pl), a do końca czerwca br. fundusz wsparły
już rządy 47 krajów z całego świata (w tym Polska
kwotą prawie 90 mln euro). Zebrane fundusze zostaną
przekazane Światowej Organizacji Zdrowia
(WHO), Global Alliance for Vaccines and Immunization
(GAVI), a także CEPI. Środki mają zapewnić
globalny i sprawiedliwy dostęp do innowacyjnych
narzędzi oraz metod zwalczania zakażeń
SARS-CoV-2.60
Piśmiennictwo:
1. International Federation of Pharmaceutical Manufacturers & Associations: Novel coronavirus (COVID 19) – Industry’s R&D efforts. www.ifpma.org/subtopics/novel coronavirus covid 19/ (dostęp: 24.04.2020)2. DRAFT landscape of COVID-19 candidate vaccines – 2 July 2020. www.who.int/publications/ m/item/draft-landscape-of-covid-19-candidate-vaccines (dostęp: 05.07.2020)
3. Lurie N., Saville M., Hatchett R., Halton J.: Developing Covid 19 vaccines at pandemic speed. NEJM, 2020; doi: 10.1056/NEJMp2005630
4. Mahase E.: Covid 19: what do we know so far about a vaccine? BMJ, 2020; 369: m1679; doi: 10.1136/bmj.m1679 (dostęp: 27.04.2020)
5. Ściubisz M.: Szczepionka przeciwko COVID 19 już we wrześniu 2020? 15.04.2020. www. mp.pl/szczepienia/aktualnosci/233521 (dostęp: 4.05.2020)
6. CEPI and GSK announce collaboration to strengthen the global effort to develop a vaccine for the 2019 nCoV virus. 3.02.2020. www.gsk.com/en gb/media/press releases/cepi and gsk announce collaboration to strengthen the global effort to develop a vaccine for the 2019 ncov virus/ (dostęp: 4.05.2020)
7. CEPI partners with University of Hong Kong to develop COVID 19 vaccine. 18.03.2020. www.cepi.net/news_cepi/cepi partners with university of hong kong to develop covid 19 vaccine/ (dostęp: 4.05.2020)
8. CEPI collaborates with the Institut Pasteur in a consortium to develop COVID 19 vaccine. 19.03.2020. www.cepi.net/news_cepi/cepi collaborates with the institut pasteur in a consortium to develop covid 19 vaccine/ (dostęp: 4.05.2020)
9. CEPI gets €140 million funding boost from Germany while expanding coronavirus vaccine search. 13.03.2020. www.cepi.net/news_cepi/cepi gets e140 million funding boost from germany while expanding coronavirus vaccine search/ (dostęp: 4.05.2020)
10. Oxford University vaccine against COVID 19 starts clinical tests. 23.04.2020. https:// cepi.net/news_cepi/oxford university vaccine against covid 19 starts clinical tests/ (dostęp: 4.05.2020)
11. IVI, INOVIO, and KNIH to partner with CEPI in a Phase I/II clinical trial of INOVIO’s COVID 19 DNA vaccine in South Korea. 16.04.2020. https://cepi.net/news_cepi/ivi inovio and knih to partner with cepi in a phase i ii clinical trial of inovios covid 19 dna vaccine in south korea/ (dostęp: 4.05.2020)
12. Netherlands and Switzerland join the search for COVID 19 vaccines. 16.04.2020. https:// cepi.net/news_cepi/netherlands and switzerland join the search for covid 19 vaccines/ (dostęp: 4.05.2020)
13. Belgium and Canada provide funding boost for CEPI’s COVID 19 vaccine research. 6.04.2020. https://cepi.net/news_cepi/belgium and canada provide funding boost for cepis covid 19 vaccine research/ (dostęp: 4.05.2020)
14. Johnson & Johnson Announces Collaboration with the Beth Israel Deaconess Medical Center to Accelerate COVID 19 Vaccine Development. www.jnj.com/johnson johnson announces collaboration with the beth israel deaconess medical center to accelerate covid 19 vaccine development (dostęp: 4.05.2020)
15. Pfizer and Biontech to co develop potential COVID 19 vaccine. 17.03.2020. www.pfizer. com/news/press release/press release detail/pfizer_and_biontech_to_co_develop_potential_ covid_19_vaccine (dostęp: 4.05.2020)
16. BARDA to give Moderna up to $483 million for COVID 19 vaccine development. 21.04.2020. https://www.europeanpharmaceuticalreview.com/news/117 327/barda to give moderna up to 483 million for covid 19 vaccine development/ (dostęp: 4.05.2020)
17. BioNTech i Pfizer rozpoczną badania kliniczne szczepionki przeciwko COVID 19. 27.04.2020. https://www.mp.pl/szczepienia/aktualnosci/235012 (dostęp: 4.05.2020)
18. Dresden D.: Coronavirus vaccine: everything you need to know. 12.03.2020. www. medicalnewstoday.com/articles/coronavirus vaccine#development (dostęp: 4.05.2020)
19. Wilson J.C.: Approaches for creating a COVID 19 vaccine. 16.03.2020. www.pharma. elsevier.com/pharma rd/approaches for creating a covid 19 vaccine/ (dostęp: 4.05.2020)
20. Ahmed S.S., Ellis R.W., Rappuoli R.: Technologies for making new vaccines. W: Plotkin S.A., Orenstein W.A., Offit P.A., Edwards K.M., ed.: Plotkin’s vaccines. Filadelfia, Elsevier, 2018: 1286–1305
21. Phase I, open label, dose ranging study of the safety and immunogenicity of 2019 nCoV vaccine (mRNA 1273) in healthy adults. NCT0 428 346. www.clinicaltrials.gov/ct2/show/ NCT04283461 (dostęp: 4.05.2020)
22. NIH clinical trial of investigational vaccine for COVID 19 begins. 16.03.2020. www. nih.gov/news events/news releases/nih clinical trial investigational vaccine covid 19 begins (dostęp: 4.05.2020)
23. Jackson L.A., Anderson E.J., Rouphael N.G. i wsp.: An mRNA vaccine against SARS-CoV-2 – preliminary report. N. Engl. J. Med. 2020; doi: 10.1056/NEJMoa2022483
24. A Phase 2a, randomized, observer-blind, placebo controlled, dose-confirmation study to evaluate the safety, reactogenicity, and immunogenicity of mrna-1273 sars-cov-2 vaccine in adults aged 18 years and older. https://clinicaltrials.gov/ct2/show/NCT04405076 (dostęp: 8.06.2020)
25. Moderna Advances Late-Stage Development of its Vaccine (mRNA-1273) Against COVID-19. https://investors.modernatx.com/news-releases/news-release-details/moderna-advances-late-stage-development-its-vaccine-mrna-1273/ (dostęp: 6.07.2020)
26. Paul Erlich Institut: First clinical trial of a COVID 19 vaccine authorised in Germany. https://www.pei.de/EN/newsroom/press releases/year/2020/08 first clinical trial sars cov 2 germany.html (dostęp: 4.05.2020)
27. EU Clinical Trials Register: A multi site phase I/II, 2 part, dose escalation trial investigating the safety and immunogenic-ity of four prophylactic SARS CoV 2 RNA vaccines against COVID 2019 using different dosing regimens in healthy adults. https://www.clinicaltrialsregister. eu/ctr search/trial/2020 001 038 36/DE (dostęp: 4.05.2020)
28. Study to Describe the Safety, Tolerability, Immunogenicity, and Potential Efficacy of RNA Vaccine Candidates Against COVID-19 in Healthy Adults. https://clinicaltrials.gov/ ct2/show/NCT04368728 (dostęp: 8.06.2020)
29. A Multi-site, Phase I/II, 2-part, dose-escalation trial investigating the safety and immunogenicity of four prophylactic SARS-CoV-2 RNA vaccines against COVID-2019 using different dosing regimens in healthy adults. https://clinicaltrials.gov/ct2/show/ NCT04380701 (dostęp: 8.06.2020)
30. Clinical trial to assess the safety of a coronavirus vaccine in healthy men and women. http://www.isrctn.com/ISRCTN17072692 (dostęp: 8.07.2020)
31. A Phase 1, Partially Blind, Placebo-controlled, Dose-escalation, First-in-human, Clinical Trial to Evaluate the Safety, Reactogenicity and Immunogenicity After 1 and 2 Doses of the Investigational SARS-CoV-2 mRNA Vaccine CVnCoV Administered Intramuscularly in Healthy Adults. https://clinicaltrials.gov/ct2/show/NCT04449276 (dostęp: 8.07.2020)
32. About CureVac’s activities regarding an mRNA based vaccine against COVID-19. https:// www.curevac.com/covid-19 (dostęp: 8.07.2020)
33. A Phase I clinical trial to evaluate the safety, tolerance and preliminary immunogenicity of different doses of a SARS-CoV-2 mRNA vaccine in population aged 18–59 years and 60 years and above. http://www.chictr.org.cn/showprojen.aspx?proj=55524 (dostęp: 8.07.2020)
34. A phase I/II study to determine efficacy, safety and immunogenicity of the candidate coronavirus disease (COVID 19) vaccine ChAdOx1 nCoV 19 in UK healthy adult volunteers. NCT04 324 606. https://clinicaltrials.gov/ct2/show/NCT04324606 (dostęp: 4.05.2020)
35. A phase 2/3 study to determine the efficacy, safety and immunogenicity of the candidate coronavirus disease (COVID-19) vaccine ChAdOx1 nCoV-19. https://clinicaltrials.gov/ct2/ show/NCT04400838 (dostęp: 8.06.2020)
36. A phase III study to investigate a vaccine against COVID-19. http://www.isrctn.com/ ISRCTN89951424 (dostęp: 8.07.2020)
37. A phase I clinical trial for recombinant novel coronavirus (2019 COV) vaccine (adenoviral vector). ChiCTR2 000 030 906. www.chictr.org.cn/showprojen.aspx?proj=51154 (dostęp: 4.05.2020)
38. Feng-Cai Zhu, Yu-Hua Li, Xu-Hua Guan i wsp.: Safety, tolerability, and immunogenicity of a recombinant adenovirus type-5 vectored COVID-19 vaccine: a dose-escalation, open-label, non-randomised, first-in-human trial. Lancet, 2020; doi.org/10.1016/ S0140-6736(20)31208–3
39. A randomized, double blinded, placebo controlled phase II clinical trial for recombinant novel coronavirus (2019 nCOV) vaccine (adenovirus vector) in healthy adults aged above 18 years. ChiCTR2 000 031 781. http://www.chictr.org.cn/showprojen.aspx?proj=52006 (dostęp: 4.05.2020)
40. An Open Study of the Safety, Tolerability and Immunogenicity of the Drug “Gam-COVID-Vac” a Solution for Intramuscular Injection With the Participation of Healthy Volunteers. https://clinicaltrials.gov/ct2/show/NCT04436471 (dostęp: 8.07.2020)
41. An Open Study of the Safety, Tolerability and Immunogenicity of the Drug “Gam-COVID-Vac” a Solution for Intramuscular Injection With the Participation of Healthy Volunteers. https://clinicaltrials.gov/ct2/show/NCT04436471 (dostęp: 8.07.2020)
42. Phase 1 open label study to evaluate the safety, tolerability and immunogenicity of INO 4800, a prophylactic vaccine against SARS CoV 2, administered intradermally followed by electroporation in healthy volunteers. NCT04 336 410. www.clinicaltrials.gov/ct2/ show/NCT04 336 410 (dostęp: 4.05.2020)
43. A Phase I/IIa, Dose-Ranging Trial to Evaluate Safety, Tolerability and Immunogenicity of INO-4800, a Prophylactic Vaccine Against SARS-CoV-2, Administered Intradermally Followed by Electroporation in Healthy Volunteers. https://clinicaltrials.gov/ct2/show/ NCT04447781 (dostęp: 8.07.2020)
44. Genexine consortium’s Covid-19 vaccine acquires approval for clinical trails in Korea. https://www.ivi.int/genexine-consortiums-covid-19-vaccine-acquires-approval-for-clinical-trails-in-korea/ (dostęp: 8.07.2020)
45. A Phase 1/2a, Multi-center, Randomized, Double-blind, Placebo-controlled Study to Investigate the Safety, Tolerability, and Immunogenicity of GX-19, a COVID-19 Preventive DNA Vaccine in Healthy Subjects. https://clinicaltrials.gov/ct2/show/NCT04445389 (dostęp: 8.07.2020)
46. A randomized, double blind, placebo parallel controlled phase I/II clinical trial for inactivated Novel Coronavirus Pneumo-nia vaccine (Vero cells). ChiCTR2 000 031 809. http:// www.chictr.org.cn/showprojen.aspx?proj=52227 (dostęp: 4.05.2020)
47. Evaluation of the safety and immunogenicity of inactivated novel coronavirus (2019-CoV) vaccine (Vero cells) in healthy population aged 3 years and above: a randomized, double-blind, placebo parallel-controlled phase I/II clinical trial. http://www.chictr.org.cn/ showprojen.aspx?proj=53003 (dostęp: 8.07.2020)
48. . A Randomized, Double-blind, Placebo-controlled, Phase Ia/IIa Trial of an Inactivated SARS-CoV-2 Vaccine in Healthy People Aged 18 to 59 Years. https://clinicaltrials.gov/ ct2/show/NCT04412538 (dostęp: 8.07.2020)
49. A randomized, double blinded, placebo controlled, phase I/II clinical trial, to evaluate the safety and immunogenicity of the SARS CoV 2 inactivated vaccine in healthy adults aged 18–59 years. NCT04 352 608. https://www.clinicaltrials.gov/ct2/show/NCT04352608 (dostęp: 4.05.2020)
50. A randomized, double-blinded, placebo-controlled, phase ?/? clinical trial, to evaluate the safety and immunogenicity of the SARS-CoV-2 inactivated vaccine (vero cell) in healthy population aged ?60 years. https://clinicaltrials.gov/ct2/show/NCT04383574 (dostęp: 9.06.2020)
51. Gao Q., Bao L., Mao H. i wsp.: Rapid development of an inactivated vaccine for SARS CoV 2. https://www.biorxiv.org/content/10.1101/2020.04.17.046375v1.full.pdf (dostęp: 4.05.2020)
52. A 2-part, phase 1/2, randomized, observer-blinded study to evaluate the safety and immunogenicity of a SARS-CoV-2 recombinant spike protein nanoparticle vaccine (SARS-CoV-2 rS) with or without MATRIX-M™ adjuvant in healthy subjects. https://clinicaltrials.gov/ ct2/show/NCT04368988 (dostęp: 8.07.2020)
53. A Phase 1, Randomized, Double-blind, Placebo-controlled, First-in-human Study to Evaluate the Safety and Immunogenicity of SCB 2019, a Recombinant SARS-CoV-2 Trimeric S Protein Subunit Vaccine for COVID-19 in Healthy Volunteers. https://clinicaltrials.gov/ ct2/show/NCT04405908 (dostęp: 8.07.2020)
54. A Multi-center, Double-blind, Randomized, Placebo Parallel Controlled, Safety and Tolerability Phase I Clinical Trial of Recombinant Novel Coronavirus Vaccine (CHO Cells) in Healthy People Between 18 and 59 Years of Age. https://clinicaltrials.gov/ct2/show/ NCT04445194 (dostęp: 8.07.2020)
55. A Randomised, Controlled, Phase 1 Study to Evaluate the Safety and Immunogenicity of a Candidate Adjuvanted Recombinant Protein SARS-COV-2 Vaccine in Healthy Adult Subjects. https://clinicaltrials.gov/ct2/show/NCT04453852 (dostęp: 8.07.2020)
56. World Health Organization: Prioritizing diseases for research and development in emergency contexts. https://www.who.int/activities/prioritizing diseases for research and development in emergency contexts (dostęp: 4.05.2020)
57. Marston H.D., Paules C.I., Fauci A.S.: The critical role of biomedical research in pandemic preparedness. JAMA, 2017; 318: 1757–1758
58. Gouglas D., Thanh Le T., Henderson K. i wsp.: Estimating the cost of vaccine development against epidemic infectious diseases: a cost minimisation study. Lancet Glob. Health, 2018; 6: e1386–e1396
59. World Health Organization: A coordinated global research roadmap. 2020. https:// www.who.int/blueprint/priority diseases/key action/Roadmap version FINAL for WEB. pdf?ua=1 (dostęp: 4.05.2020)
60. Ściubisz M.: Komisja Europejska zbiera fundusze na walkę z COVID-19. https://www. mp.pl/szczepienia/235826 (dostęp: 5.05.2020)




























