Skróty: ERAS – protokół kompleksowej opieki okołooperacyjnej dla poprawy wyników leczenia; NLPZ – niesteroidowe leki przeciwzapalne; PCA – analgezja kontrolowana przez pacjenta; PONV – pooperacyjne nudności i wymioty; TAP block – miejscowe znieczulenie płaszczyzny pomiędzy mięśniem skośnym wewnętrznym a mieśniem poprzecznym brzucha; TME – całkowite wycięcie mezorektum
Już od dłuższego czasu przedmiotem szczególnego zainteresowania chirurgów na całym świecie pozostaje odpowiedź ustroju na uraz. Pionierskie badania nad patofizjologią chorób chirurgicznych prowadzone przez znanych chirurgów zagranicznych takich jak Cuthbertson i Moore czy w Polsce przez prof. Oszackiego wykazały, że operacja wpływa niekorzystnie na homeostazę, a odpowiednie postępowanie okołooperacyjne może w istotny sposób zmniejszyć liczbę powikłań i śmiertelność okołooperacyjną.1-3 Mimo stałego postępu w zakresie opieki nad chorymi po operacjach jelita grubego oraz zmniejszenia odsetka powikłań średni czas pobytu w szpitalu po zabiegu w drugiej połowie XX wieku wynosił 10–15 dni.4-5 W 2013 roku ERAS Society opublikowało zalecenia odnośnie do opieki okołooperacyjnej u chorych kwalifikowanych do zabiegów resekcyjnych w obrębie okrężnicy i odbytnicy.6,7 Przewidują one po pierwsze odpowiednie przygotowanie przedoperacyjne. Kolejny etap obejmuje odpowiednie postępowanie w okresie okołooperacyjnym oraz – co zrozumiałe – zapewnienie właściwej opieki pooperacyjnej. Obecnie protokół ERAS zasadza się na kilkunastu składowych, które zastosowane łącznie umożliwiają skrócenie czasu trwania hospitalizacji oraz zmniejszenie odsetka powikłań okołooperacyjnych (ryc.). Celem niniejszego artykułu jest omówienie najważniejszych elementów opieki okołooperacyjnej opartej na wytycznych ERAS Society i próba przedstawienia ich zastosowania w codziennej praktyce na polskich oddziałach chirurgicznych.
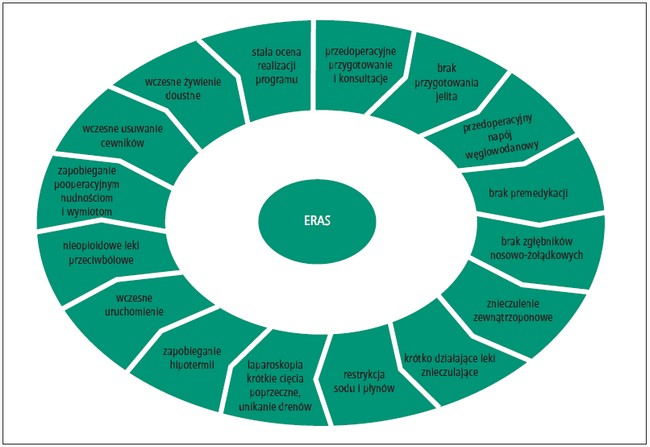
Ryc. Koło ERAS
Przygotowanie przedoperacyjne i zaplanowanie poszczególnych etapów leczenia
Zgodnie z protokołem ERAS planowanie leczenia powinno się odbywać wspólnie z chorym po wcześniejszym wyjaśnieniu istoty choroby oraz omówieniu możliwych sposobów leczenia. Od dawna wiadomo, że szczegółowa informacja (ustna i pisemna) na temat ewentualnego leczenia neoadiuwantowego, planowanego zabiegu operacyjnego, rodzaju znieczulenia oraz przebiegu pooperacyjnego w korzystny sposób wpływa na poziom odczuwanego lęku przed operacją, a po niej istotnie obniża stopień nasilenia i odczuwania bólu.8,9 Omówienie poszczególnych elementów leczenia pozwala również na czynne zaangażowanie się samego chorego i jego rodziny w proces rehabilitacji, zachęca do szybszego rozpoczęcia rehabilitacji ruchowej i przyczynia się do skrócenia czasu trwania hospitalizacji.10
Bardzo ważny jest okres przed przyjęciem do szpitala, w którym powinno się zaplanować niezbędne konsultacje specjalistyczne w celu wykrycia potencjalnych zagrożeń w okresie okołooperacyjnym. Chorym poleca się zaprzestanie palenia tytoniu i spożywania alkoholu na przynajmniej miesiąc przed operacją, a dodatkowa poprawa wydolności fizycznej jest możliwa dzięki regularnym ćwiczeniom (np. spacerom) dostosowanym do ich sprawności fizycznej.11-13 Wyniki kilku badań klinicznych z randomizacją potwierdziły, że takie postępowanie ma istotny wpływ na zmniejszenie odsetka powikłań w okresie okołooperacyjnym, a w dalszej perspektywie przyspiesza powrót do pełnej aktywności po zabiegu.14-16
W ośrodkach, w których pracujemy, rozmowę dotyczącą planowanego leczenia operacyjnego i przygotowania do operacji oraz kwalifikację anestezjologiczną przeprowadza się w ambulatorium podczas ustalania terminu operacji. Chorym zaleca się wykonywanie regularnych ćwiczeń fizycznych (30–60-minutowe spacery) przez przynajmniej 2 tygodnie przed planowanym terminem operacji. Przy przyjęciu na oddział każdy chory jest dodatkowo szczegółowo informowany o planie postępowania w kolejnych dniach hospitalizacji oraz oczekiwaniach wobec niego i jego rodziny, która bierze aktywny udział w procesie rehabilitacji. Z naszego doświadczenia wynika, że rozmowa z pacjentem trwa zwykle około 30–45 minut. Osobiście zalecamy, by była prowadzona przez jednego z członków zespołu operacyjnego.
Przygotowanie jelita grubego przed zabiegiem operacyjnym
W świecie chirurgicznym panuje pewien dogmat lub raczej przyzwyczajenie nakazujące oczyszczenie jelita grubego przed każdym zabiegiem resekcyjnym w obrębie jelita grubego. Niemniej jednak wyniki licznych analiz (w tym opublikowana w 2011 roku analiza Cochrane obejmująca łącznie 18 badań z randomizacją, 5808 chorych) nie wykazały, aby brak takiego przygotowania jelita wiązał się z większym ryzykiem: wystąpienia nieszczelności zespolenia, rozwoju ropni wewnątrzbrzusznych, przetok czy zakażenia miejsca operowanego ani zgonu.17 Ciekawych obserwacji dostarczyło badanie, na podstawie którego stwierdzono, że w grupie mechanicznego przygotowania jelita częściej dochodziło do kontaminacji pola operacyjnego bardziej płynną treścią kałową, a przez to do zwiększenia liczby powikłań.18 Wiadomo też, że oczyszczenie jelita wiąże się z istotnym ryzykiem odwodnienia i zaburzeń elektrolitowych, co w konsekwencji istotnie opóźnia powrót perystaltyki po operacji.19,20 Zastosowanie techniki laparoskopowej nie przysparza większych trudności technicznych w grupie bez mechanicznego przygotowywana jelita grubego do zabiegu.21 W przypadku guzów niedużych rozmiarów, gdy istnieje ryzyko ich przeoczenia z uwagi na wypełnienie jelita masami kałowymi, oraz brak możliwości palpacji w trakcie laparoskopii proponuje się przedoperacyjny endoskopowy tatuaż poniżej guza, co ułatwia precyzyjną lokalizację zmiany w trakcie zabiegu.22 Szczególną grupę stanowią chorzy na raka odbytnicy, u których oprócz przedniej resekcji odbytnicy z całkowitym wycięciem mezorektum (total mesorectal excision – TME) planuje się wykonanie odbarczającej ileostomii. Wyniki kilku badań z randomizacją oraz metaanaliza Cochrane potwierdziły, że pozwala to na zmniejszenie ryzyka rozwoju nieszczelności zespolenia, a w razie powikłań ułatwia podjęcie odpowiedniego, często także małoinwazyjnego leczenia.23-26
Wówczas z oczywistych względów zaleca się oczyszczenie
jelita grubego.27 W naszej praktyce zawodowej
nie stosujemy rutynowego oczyszczenia jelita
grubego w przypadku resekcji w obrębie okrężnicy. Z kolei u wszystkich chorych kwalifikowanych do
przedniej resekcji odbytnicy z TME planowo wykonuje
się ileostomię odbarczającą i w związku z tym
rutynowo przed zabiegiem oczyszcza jelito grube.
Pewnego omówienia wymaga sposób, w jaki
przebiega przygotowanie jelita grubego. Na dzień
przed operacją zalecamy ubogobłonnikową dietę
zamiast diety płynnej powszechnie stosowanej
na polskich oddziałach chirurgicznych. Spośród
dostępnych środków oczyszczających jelito grube
sugerujemy wykorzystanie w pierwszym rzędzie
pochodnych glikolu polietylenowego (np. Fotrans®)
podawanych w dawce podzielonej, to znaczy połowa
przewidzianej do przygotowania dawki preparatu
rozpuszczona w 2 litrach płynu w dniu poprzedzającym
zabieg operacyjny, druga połowa rano w dniu
zabiegu, także rozpuszczona w 2 litrach płynu.
Choć dopuszczalne jest stosowanie soli sodowych
kwasu fosforowego (np. Fleet Phospho Soda®), to –
jak wykazują wyniki licznych metaanaliz – przygotowanie
przy użyciu tego preparatu wiąże się z większym ryzykiem rozwoju zaburzeń wodno-elektrolitowych. Wykorzystanie soli sodowych
kwasu fosforowego odradzamy szczególnie chorym z niewydolnością nerek. Warto zwrócić także uwagę
na rosnące znaczenie preparatów stanowiących
mieszankę pikosiarczanu sodu, tlenku magnezu
oraz kwasu cytrynowego (np. preparat Citrafleet®).
Jest to środek bezpieczny, smaczny i znacznie lepiej
tolerowany przez pacjentów. Co ważne, stosowanie
preparatów opartych na pikosiarczanie sodu i tlenku magnezu wiąże się z koniecznością przyjęcia
znacznie mniejszej objętości płynu, w której preparat
jest rozpuszczany (w sumie ok. 500 ml), aniżeli w przypadku stosowania soli sodowych kwasu
fosforowego.
Skrócenie okresu głodzenia przed zabiegiem operacyjnym
W przeszłości powszechnie przyjętą praktyką było zaprzestanie podaży pokarmów stałych i płynów, począwszy od wieczoru dnia poprzedzającego operację, w przekonaniu że zmniejsza to ryzyko aspiracji podczas wprowadzenia do znieczulenia. Metaanaliza Cochrane obejmująca 22 badania kliniczne z randomizacją nie potwierdziła jednak zasadności takiego postępowania.28 Większość towarzystw anestezjologicznych w swoich zaleceniach podaje, że bezpieczne jest zakończenie podaży pokarmów nawet na 6 godzin, a płynów klarownych – na 2 godziny przed operacją. Wykazano także korzyści płynące z wprowadzenia specjalnych wysokowęglowodanowych napojów podawanych chorym na kilka godzin przed zabiegiem. Postępowanie to minimalizuje uczucie pragnienia i obniża poziom lęku. Co bardzo ważne, odpowiada ono także za redukcję insulinooporności w okresie pooperacyjnym oraz wpływa korzystnie na bilans azotowy, zmniejszając liczbę powikłań okołooperacyjnych i przyspieszając powrót prawidłowej czynności przewodu pokarmowego.30-32 Interesujące są wyniki dwóch badań klinicznych z randomizacją, w których wykazano, że samo spożycie takiego napoju skróciło czas trwania hospitalizacji o jeden dzień.33,34
Wszystkim chorym operowanym w ośrodkach, w których pracujemy, rutynowo podaje się wysokowęglowodanowy napój na 2–3 godziny przed planowaną operacją.
Protokół znieczulenia do zabiegu
Rola anestezjologa w protokole ERAS jest nieoceniona. Odgrywa on szczególną rolę przed zabiegiem operacyjnym, kwalifikując do znieczulenia, którego efekty powinny być jak najbardziej krótkotrwałe. Preferuje się znieczulenie z wykorzystaniem krótko działających leków znieczulających w systemie określanym akronimem TIVA (total intravenous anaesthesia).6
W trakcie zabiegu anestezjolog prowadzi właściwą płynoterapię, unikając nadmiernej podaży płynów bogatych w sód, a pod koniec operacji powinien wdrożyć postępowanie pozwalające na zmniejszenie pooperacyjnych nudności i wymiotów. Zespół anestezjologiczny odpowiada także za skuteczne leczenie przeciwbólowe, wykorzystując znieczulenie zewnątrzoponowe, analgezję kontrolowaną przez pacjenta (patient controlled analgesia – PCA) i miejscowe znieczulenie płaszczyzny pomiędzy mięśniem skośnym wewnętrznym a mieśniem poprzecznym brzucha (transversusabdominis plane block – TAP block).35 Korzystne jest również zapobieganie wychłodzeniu organizmu poprzez zastosowanie koców ogrzewających. Wiadomo, że obniżona temperatura ciała prowadzi do wystąpienia dreszczy, przez co zwiększa się zarówno zapotrzebowanie na tlen jak i ryzyko rozwoju powikłań w postaci zakażenia miejsca operowanego, krwawień i incydentów sercowo-naczyniowych.36-39 Ponadto stopień nasilenia bólu jest mniejszy u chorych pozostających w stanie normotermii.37
Technika operacyjna
Preferowane techniki operacyjne powinny mieścić się w spektrum metod minimalnie inwazyjnych, ponieważ dzięki laparoskopii jest możliwe zmniejszenie ryzyka rozwoju powikłań, zmniejszenie nasilenia odczuwanego bólu oraz skrócenie czasu trwania hospitalizacji.35 Wiadomo powszechnie, że jeśli chodzi o wymóg radykalności onkologicznej, wyniki zabiegów z dostępu laparoskopowego są porównywalne z wynikami operacji z dostępu klasycznego.40,41 Co więcej, badacze porównując obie techniki dostępu, zauważyli, że operacja laparoskopowa u chorych na raka okrężnicy w III stopniu zaawansowania wiąże się z lepszymi wynikami w zakresie przeżycia całkowitego i mniejszymi odsetkami wznów w porównaniu z operacjami z dostępu klasycznego.42 Fenomen ów można pośrednio wytłumaczyć w następujący sposób: techniki minimalnie inwazyjne w mniejszym stopniu upośledzają czynność układu immunologicznego, którego prawidłowe funkcjonowanie ma zasadnicze znaczenie dla przebiegu choroby.43,44 Należy jednak podkreślić, że laparoskopia nie jest warunkiem koniecznym powodzenia zastosowania protokołu ERAS. W badaniu LAFA, w którym porównano 4 grupy chorych operowanych laparoskopowo i klasycznie, u których zastosowano protokół ERAS lub prowadzono tradycyjną opiekę okołooperacyjną, wykazano skrócenie czasu trwania hospitalizacji także w grupie osób operowanych klasycznie, nad którymi opiekę sprawowano zgodnie z protokołem ERAS.45 Wyniki opublikowanych ostatnio metaanaliz potwierdzają te dane.46 Zachęcamy więc chirurgów preferujących dostęp klasyczny do stosowania protokołu ERAS. Niektórzy autorzy postulują, aby w przypadku dostępu klasycznego wybierać cięcia poprzeczne, ponieważ wiążą się one z mniejszym stopniem nasilenia bólu pooperacyjnego, a zastosowanie ich nie utrudnienia dostępu do miejsca operowanego.47,48 W ośrodkach, w których pracujemy, laparoskopia jest preferowaną techniką operacyjną.
Preparat usuwa się poprzez minilaparotomię poprzeczną (w miejscu zależnym od operowanego odcinka jelita), którą zawsze osłania się plastikowym rękawem ochronnym, aby zapobiec wszczepom nowotworowym.
Zastosowanie zgłębników, drenów i cewników
Wyniki licznych metaanaliz i badań z randomizacją
potwierdziły, że zastosowanie zgłębników nosowo-żołądkowych w chirurgii jelita grubego nie wpływa
pozytywnie na gojenie się zespoleń, a ponadto
zwiększa ryzyko rozwoju powikłań pooperacyjnych
(zapalenie płuc, niedodma płuc).49,50 Nie znajdujemy
zatem uzasadnienia dla takiego postępowania.
Podobnych obserwacji dostarczyły badania nad
zasadnością rutynowego drenażu pooperacyjnego
(8 badań klinicznych z randomizacją, 1390 chorych).51-53 Nie potwierdzono, aby pozostawienie
drenu wpływało na ryzyko wystąpienia nieszczelności
zespolenia, uformowania się ropni czy rozwoju
przetok jelitowych. W przekonaniu niektórych
chirurgów dren może pomóc we wczesnym
wykryciu nieszczelności zespolenia. Okazuje się
jednak, że u osób z klinicznymi objawami nieszczelności
treść jelitowa w drenie pojawia się stosunkowo
rzadko, bo u co 20. chorego, a jej obecność
lub brak nie wpływa na decyzję o interwencji chirurgicznej.53
Wobec powyższego w przypadku operacji
przebiegających bez zdarzeń niepożądanych
drenażu nie trzeba rutynowo stosować.
Należy wcześnie usuwać cewnik z pęcherza
moczowego, zwłaszcza że operacje kolorektalne,
nawet z opcją znieczulenia zewnątrzoponowego,
nie zwiększają ryzyka zastoju moczu po zabiegu.54
Podsumowując, w naszym przekonaniu nie ma
przesłanek przemawiających za używaniem zgłębników
nosowo-żołądkowych, podobnie, drenaż pola
operacyjnego także nie powinien być stosowany
rutynowo, a jedynie w szczególnych przypadkach.
Preferujemy usuwanie cewnika z pęcherza moczowego w ciągu pierwszych 24 godzin od operacji.
Skuteczne leczenie przeciwbólowe
Warunkiem sine qua non powodzenia zastosowania
protokołu ERAS jest odpowiednie leczenie
przeciwbólowe. Postulujemy, aby opierać się na
kilku metodach leczenia przeciwbólowego, które
na 48 godzin po operacji powinno być zlecone na
stałe, aby zapewnić chorym maksymalny komfort
rehabilitacji.6,7,35
Lekami stosowanymi w leczeniu przeciwbólowym
są głównie paracetamol oraz niesteroidowe
leki przeciwzapalne (NLPZ). Chociaż są badania
sugerujące, że podawanie tych ostatnich może się
wiązać z większym ryzykiem rozwoju nieszczelności
zespolenia, wciąż nie ma mocnych argumentów
przemawiających przeciwko przyjmowaniu leków z tej grupy.6,7
Z uwagi na działania niepożądane w postaci
porażenia perystaltyki powinno się unikać podawania
silnych opioidów lub, jeśli to konieczne, stosować
je w małych dawkach metodą PCA.35 W ciągu pierwszych 48 godzin od zabiegów z dostępu klasycznego zalecamy stosowanie znieczulenia
zewnątrzoponowego jako główną formę
terapii bólu. Oprócz oczywistego działania przeciwbólowego
zapewnia też inne korzyści. Metaanaliza
autorstwa Rodgersa i wsp. (obejmująca 141 badań,
ok. 10 tys. chorych) wykazała, że dzięki znieczuleniu
zewnątrzoponowemu zmniejsza się śmiertelność
(nawet do 30%) oraz częstość powikłań
zakrzepowo-zatorowych (o >50%) i zakażeń układu
oddechowego (o 40%).55 Chociaż ten rodzaj znieczulenia
niesie z sobą pewne ryzyko rozwoju powikłań,
wydaje się, że korzyści z jego zastosowania
są większe.35 Stwierdzono również, że dzięki znieczuleniu
zewnątrzoponowemu możliwe jest skrócenie
okresu pooperacyjnej niedrożności porażennej
jelit.56 Alternatywą dla znieczulenia zewnątrzoponowego w grupie chorych operowanych sposobem
laparoskopowym jest ostrzyknięcie miejsc
wkłucia trokarów środkami miejscowo znieczulającymi
(np. bupiwakainą) lub bardzo skuteczne
ostrzyknięcie środkiem znieczulającym TAP block.
Postępowanie takie zapewnia działanie przeciwbólowe
nawet przez 24 godziny i w istotny sposób
redukuje zapotrzebowanie na opioidy.57,58
Zabieg laparoskopowy w porównaniu z operacją z dostępu klasycznego wiąże się ze znacznie mniejszym
urazem, a co za tym idzie niższym stopniem
nasilenia bólu, dlatego znieczulenie zewnątrzoponowe
bardzo często okazuje się niepotrzebne. W ośrodkach, w których pracujemy, znieczulenie
zewnątrzoponowe stosuje się planowo u chorych
operowanych z dostępu klasycznego, w przypadku
konwersji (wprowadzenie następuje po zabiegu)
oraz laparoskopowej brzuszno-kroczowej amputacji
odbytnicy. U wszystkich chorych po zabiegach laparoskopowych wykorzystujemy TAP block
pod kontrolą ultrasonografii. W 1. dobie leki przeciwbólowe
podajemy dożylnie, a od kolejnej doby
– doustnie. W razie bardzo silnych dolegliwości
bólowych wykorzystujemy tramadol lub w ostateczności
niewielkie dawki opioidów metodą PCA.
Restrykcyjna płynoterapia
Właściwa płynoterapia w okresie okołooperacyjnym jest jednym z najważniejszych elementów protokołu ERAS. Nieodpowiednia podaż płynów może prowadzić do hipowolemii (co niekorzystnie wpływa na ukrwienie narządów), z kolei nadmierna płynoterapia powoduje obrzęk tkanek i upośledzenie ich czynności. Zgodnie z aktualnymi wytycznymi w opiece pooperacyjnej należy dążyć do zerowego bilansu płynowego nie tylko pod względem ilości wody, ale także podawanych elektrolitów, zwłaszcza sodu.6,7 Słuszność tej hipotezy potwierdziły badania przeprowadzone przez Lobo i Brandstrupa, w których porównano tak zwaną restrykcyjną płynoterapię (chorzy otrzymywali łącznie <2 l płynów z ograniczoną ilością sodu) z klasycznym schematem postępowania (>3 l płynów bogatych w sód). U chorych wcześnie rozpoczynano doustną podaż pokarmu. W grupie restrykcyjnej płynoterapii odnotowano znacznie mniej powikłań (nawet o 50%), w tym nieszczelności zespolenia. Stwierdzono także przyspieszenie powrotu perystaltyki i skrócenie czasu pobytu w szpitalu.59,60 W badaniach innych autorów można się spotkać z podobnymi spostrzeżeniami.61 Wszyscy jednogłośnie podkreślają, że – poza ograniczeniem w zakresie podaży dożylnej płynów – na odpowiedni bilans wodno-elektrolitowy wpływa również wczesne rozpoczęcie doustnego przyjmowania pokarmu. W ośrodkach, w których pracujemy, u wszystkich chorych rutynowo stosuje się restrykcyjną płynoterapię polegającą na: ograniczeniu podaży płynów w trakcie zabiegu operacyjnego (zwykle maksymalnie 1000–1500 ml), częściowym zastąpieniu krystaloidów koloidami oraz redukcji (jeżeli to możliwe – do zera) podaży płynów w okresie pooperacyjnym. Podawanie dożylne płynów jest uzasadnione tylko w razie braku tolerancji dla ich doustnego przyjmowania.
Profilaktyka pooperacyjnych nudności i wymiotów
Pooperacyjne nudności i wymioty (postoperative nausea and vomiting – PONV) należą do częstych zdarzeń niepożądanych w przebiegu pooperacyjnym (mogą dotyczyć nawet 1/4 chorych).Czynnikami ryzyka dla PONV są: płeć żeńska, niepalenie papierosów oraz dodatni wywiad w kierunku choroby lokomocyjnej. Zmniejszenie częstości występowania PONV możliwe jest dzięki odpowiedniemu leczeniu przeciwbólowemu (unikanie opioidów, znieczulenie miejsca operowanego, znieczulenie zewnątrzoponowe), zastosowaniu leków przeciwwymiotnych (antagoniści receptorów serotoninergicznych, np. ondansetron) i profilaktycznej dawce deksametazonu podanej na początku zabiegu operacyjnego.
Wykazano także, że skrócenie czasu trwania głodzenia (podanie wysokowęglowodanowego napoju przed zabiegiem, wczesne rozpoczęcie żywienia dietą doustną) i wczesna rehabilitacja ruchowa zmniejszają ryzyko wystąpienia PONV. Zastosowanie restrykcyjnej płynoterapii również zmniejsza częstość występowania tego powikłania. Proponujemy, aby każdemu choremu pod koniec operacji podać profilaktyczną dawkę leków przeciwwymiotnych, a na początku – deksametazonu.
W razie wystąpienia PONV należy powtórzyć dawkę ondansetronu. Nie ma konieczności rutynowego wprowadzania zgłębnika nosowo-żołądkowego, chyba że nie uzyskano poprawy stanu chorego po wdrożeniu omówionego wcześniej postępowania. Utrzymanie zgłębnika przez dłuższy czas nie jest konieczne i powinno służyć jedynie odbarczeniu żołądka. Po kilku godzinach od epizodu PONV można rozpocząć podaż doustną i ponownie ocenić jej tolerancję.
Wczesne rozpoczęcie żywienia doustnego
Zgodnie z założeniami ERAS należy jak najszybciej
rozpocząć podawanie diety doustnej. W dobie
zabiegu operacyjnego po przetransportowaniu z sali wybudzeniowej chory może przyjmować
dowolną ilość płynów, a dietę lekkostrawną można podać wieczorem w dniu operacji.6,7,35 Badania kliniczne z randomizacją wykazały, że wczesne
żywienie doustne jest całkowicie bezpieczne i pozwala na zmniejszenie liczby powikłań infekcyjnych i skrócenie czasu trwania hospitalizacji
przy niezmienionym odsetku nieszczelności zespoleń,
zmniejsza też śmiertelność w okresie 30 dni
od zabiegu.62-64
Dodatkowych korzyści dostarcza doustne leczenie
immunomodulujące, zwłaszcza u chorych obarczonych
ryzykiem niedożywienia.65 Trzeba podkreślić,
że wczesne żywienie bez odpowiedniej profilaktyki
PONV może skutkować zwiększeniem
częstości występowania nudności i wymiotów.6 W ośrodkach, w których pracujemy, chorzy bezpośrednio
po powrocie z sali wybudzeniowej mogą
rozpocząć doustne spożywanie płynów, a na kolację w zależności od preferencji otrzymują doustny
suplement pokarmowy lub lekkostrawną dietę
szpitalną (suchary, kleiki, zupy). Pełną dietę lekkostrawną
podaje się w kolejnym dniu pooperacyjnym.
Wczesna rehabilitacja ruchowa po zabiegu operacyjnym
Przedłużone unieruchomienie chorego wpływa
niekorzystnie na przebieg pooperacyjny, zwiększając
ryzyko rozwoju powikłań (m.in. zapalenia
płuc, powikłań zakrzepowo-zatorowych) oraz osłabiając
siłę mięśniową.66-68 Wczesna rehabilitacja
ruchowa jest z kolei czynnikiem warunkującym
szybszy wypis ze szpitala. Analiza dokonana przez
Smarta wykazała, że brak rehabilitacji ruchowej w 1. dobie po zabiegu był niezależnym czynnikiem
predykcyjnym wydłużenia czasu trwania hospitalizacji.69
Główne przeszkody w szybkim podjęciu rehabilitacji
ruchowej to: nieodpowiednie leczenie przeciwbólowe,
ciągła dożylna podaż płynów, długotrwały
drenaż i utrzymanie cewników.35 Należy
zatem położyć szczególny nacisk na to, aby stworzyć
chorym warunki do wstania z łóżka w dniu
operacji. W ośrodkach, w których pracujemy,
pacjenci rozpoczynają rehabilitację ruchową wieczorem w dniu zabiegu operacyjnego, od siadania
lub wstawania i krótkich spacerów przy łóżku. W kolejnym dniu chorzy są proszeni o spędzenie
przynajmniej 6 godzin poza łóżkiem (siedząc na
krześle, spacerując w asyście rodziny). Dzięki
temu przeważająca większość z nich jest całkowicie
samodzielna w ciągu 48 godzin od zabiegu
operacyjnego.
Kryteria wypisu ze szpitala
Kryteria wypisu ze szpitala są jasno ustalone.6,7 Przyjmuje się, że chory może zostać wypisany do domu, gdy:
Wszyscy chorzy powinni otrzymać zalecenia odnośnie do dalszego postępowania, zwłaszcza w razie wystąpienia ewentualnych powikłań. W przypadku szybkiego wypisu do domu przed oddaniem pierwszego stolca (który w przekonaniu wielu nie jest warunkiem koniecznym do wypisania do domu) powszechną praktyką w naszym ośrodku jest telefoniczny kontakt z lekarzem prowadzącym przez pierwsze dni po wypisie. Termin pierwszej wizyty ambulatoryjnej wyznacza się zwykle po upływie 7–10 dni w celu kontroli gojenia ran i usunięcia szwów oraz ustalenia dalszego postępowania o charakterze leczenia uzupełniającego. Chorzy otrzymują receptę na doustne leki przeciwbólowe oraz są objęci profilaktyką przeciwzakrzepową.
Podsumowanie
Chociaż koncepcja ERAS w chirurgii jelita grubego znana jest już od około 20 lat, ulega ona ciągłym modyfikacjom. Pozwala na optymalizację i przyspieszenie rehabilitacji chorych po zabiegu operacyjnym, umożliwiając skrócenie czasu hospitalizacji. Należy jednak podkreślić, że chociaż wprowadzenie i realizacja programu ERAS są możliwe w warunkach polskiego szpitala (co wynika z naszego doświadczenia zawodowego), wymaga to zaangażowania zarówno zespołu chirurgicznego jak i anestezjologicznego. Co najistotniejsze, pozytywnych efektów można oczekiwać tylko w przypadku pełnej realizacji założeń przyjętych w protokole ERAS. Należy o tym pamiętać, ponieważ wybiórcze wprowadzanie modyfikacji do standardowej ścieżki opieki pooperacyjnej może przynieść odwrotny skutek i doprowadzić do zwiększenia odsetka powikłań.
Piśmiennictwo:
1. Cuthbertson D.P.: Further observations on the disturbance of metabolism caused by injury, with particular reference to the dietary requirements of fracture cases. Br. J. Surg., 1936; 23: 505–520
2. Moore F.D., Olesen K.H., McMurrey J.D. i wsp.: The body cell mass and its supporting environment: body composition in health and disease. Philadelphia 1963
3. Oszacki J. (red.): Patofizjologia chorób chirurgicznych. Warszawa 1964
4. Kehlet H., Büchler M.W., Beart R.W. Jr i wsp.: Care after colonic operation – is it evidencebased? Results from a multinational survey in Europe and the United States. J. Am. Coll. Surg., 2006; 202: 45–54
5. Staib L., Link K.H., Blatz A., Beger H.G.: Surgery of colorectal cancer: surgical morbidity and five- and ten-year results in 2400 patients – monoinstitutional experience. World J. Surg., 2002; 26: 59–66
6. Gustafsson U.O., Scott M.J., Schwenk W. i wsp.; Enhanced Recovery After Surgery (ERAS) Society, for Perioperative Care; European Society for Clinical Nutrition and Metabolism (ESPEN); International Association for Surgical Metabolism and Nutrition (IASMEN): Guidelines for perioperative care in elective colonic surgery: Enhanced Recovery After Surgery (ERAS) Society recommendations. World J. Surg., 2013; 37: 259–284
7. Nygren J., Thacker J., Carli F. i wsp.: Guidelines for perioperative care in elective rectal/pelvic surgery: Enhanced Recovery After Surgery (ERAS) Society recommendations. World J. Surg., 2013; 37: 285–305
8. Egbert L.D., Battit G.E., Welch C.E., Bartlett M.K..: Reduction of postoperative pain by encouragement and instruction of patients. A study of doctor-patient rapport. N. Engl. J. Med., 1964; 270: 825–827
9. Kiecolt-Glaser J.K., Page G.G., Marucha P.T. i wsp.: Psychological influences on surgical recovery. Perspectives from psychoneuroimmunology. Am. Psychol., 1998; 53: 1209–1218
10. Halaszynski T.M., Juda R., Silverman D.G.: Optimizing postoperative outcomes with efficient preoperative assessment and management. Crit. Care Med., 2004; 32 (4 supl.): S76–86
11. Tonnesen H., Rosenberg J., Nielsen H.J. i wsp.: Effect of preoperative abstinence on poor postoperative outcome in alcohol misusers: randomised controlled trial. BMJ, 1999; 318: 1311–1316
12. Sorensen L.T., Karlsmark T., Gottrup F.: Abstinence from smoking reduces incisional wound infection: a randomized controlled trial. Ann. Surg., 2003; 238: 1–5
13. Lindstrom D., Sadr Azodi O., Wladis A. i wsp.: Effects of a perioperative smoking cessation intervention on postoperative complications: a randomized trial. Ann. Surg., 2008; 248: 739–745
14. Carli F., Charlebois P., Stein B. i wsp.: Randomized clinical trial of prehabilitation in colorectal surgery. Br. J. Surg., 2010; 97: 1187–1197
15. Dronkers J.J., i wsp.: Preoperative therapeutic programme for elderly patients scheduled for elective abdominal oncological surgery: a randomized controlled pilot study. Clin. Rehabil., 2010; 24: 614–622
16. Hulzebos E.H., Lamberts H., Reutelingsperger I.M. i wsp.: Preoperative intensive inspiratory muscle training to prevent postoperative pulmonary complications in high-risk patients undergoing CABG surgery: a randomized clinical trial. JAMA, 2006; 296: 1851–1857
17. Guenaga K.F., Matos D., Wille-Jorgensen P.: Mechanical bowel preparation for elective colorectal surgery. Cochrane Database Syst. Rev., 2011;(9): CD001544
18. Mahajna A., Krausz M., Rosin D. i wsp.: Bowel preparation is associated with spillage of bowel contents in colorectal surgery. Dis. Colon Rectum, 2005; 48: 1626–1631
19. Holte K., Nielsen K.G., Madsen J.L., Kehlet H.: Physiologic effects of bowel preparation. Dis. Colon Rectum, 2004; 47: 1397–1402
20. Jung B., Lannerstad O., Pahlman L. i wsp.: Preoperative mechanical preparation of the colon: the patient’s experience. BMC Surg., 2007; 7: 5
21. Zmora O., Lebedyev A., Hoffman A. i wsp.: Laparoscopic colectomy without mechanical bowel preparation. Int. J. Colorectal Dis., 2006; 21: 683–687
22. Cho Y.B., Lee W.Y., Yun H.R. i wsp.: Tumor localization for laparoscopic colorectal surgery. World J. Surg., 2007; 31: 1491–1495
23. Montedori A., Cirocchi R., Farinella E. i wsp.: Covering ileo- or colostomy in anterior resection for rectal carcinoma. Cochrane Database Syst. Rev., 2010;(5):CD006878
24. Huser N., Michalski C.W., Erkan M. i wsp.: Systematic review and meta-analysis of the role of defunctioning stoma in low rectal cancer surgery. Ann. Surg, 2008; 248: 52–60
25. Matthiessen P., Hallböök O., Rutegard J. i wsp.: Defunctioning stoma reduces symptomatic anastomotic leakage after low anterior resection of the rectum for cancer: a randomized multicenter trial. Ann. Surg., 2007; 246: 207–214
26. Chen J., Wang D.R., Yu H.F. i wsp.: Defunctioning stoma in low anterior resection for rectal cancer: a meta- analysis of five recent studies. Hepatogastroenterology, 2012; 59: 1828–1831
27. Bretagnol F., Panis Y., Rullier E. i wsp.; French Research Group of Rectal Cancer Surgery (GRECCAR): Rectal cancer surgery with or without bowel preparation: The French GRECCAR III multicenter single-blinded randomized trial. Ann. Surg., 2010; 252: 863–868
28. Brady M., Kinn S., Stuart P.: Preoperative fasting for adults to prevent perioperative complications. Cochrane Database Syst. Rev., 2003;(4):CD004423
29. Hausel J., Nygren J., Lagerkranser M. i wsp.: A carbohydrate-rich drink reduces preoperative discomfort in elective surgery patients. Anesth. Analg., 2001; 93: 1344–1350
30. Nygren J., Soop M., Thorell A. i wsp.: Preoperative oral carbohydrate administration reduces postoperative insulin resistance. Clin. Nutr., 1998; 17: 65–71
31. Crowe P.J., Dennison A., Royle G.T.: The effect of pre-operative glucose loading on postoperative nitrogen metabolism. Br. J. Surg., 1984; 71: 635–637
32. Svanfeldt M., Thorell A., Hausel J. i wsp.: Randomized clinical trial of the effect of preoperative oral carbohydrate treatment on postoperative whole-body protein and glucose kinetics. Br. J. Surg., 2007; 94: 1342–1350
33. Nygren J., Thorell A., Ljungqvist O.: Preoperative oral carbohydrate nutrition: an update. Curr. Opin. Clin. Nutr. Metab. Care, 2001; 4: 255–259
34. Noblett S.E., Snowden C.P., Shenton B.K., Horgan A.F.: Randomized clinical trial assessing the effect of Doppler-optimized fluid management on outcome after elective colorectal resection. Br. J. Surg., 2006; 93: 1069–1076
35. Francis N., Kennedy R.H., Ljungqvist O., Mythen M.G. (red.): Manual of fast track recovery for colorectal surgery. Londyn 2012
36. Kurz A., Sessler D.I., Lenhardt R.: Perioperative normothermia to reduce the incidence of surgical-wound infection and shorten hospitalization. Study of Wound Infection and Temperature Group. N. Engl. J. Med., 1996; 334: 1209–1215
37. Scott E.M., Buckland R.: A systematic review of intraoperative warming to prevent postoperative complications. AORN J., 2006; 83: 1090–1104, 1107–1113
38. Schmied H., Kurz A., Sessler D.I. i wsp.: Mild hypothermia increases blood loss and transfusion requirements during total hip arthroplasty. Lancet, 1996; 347: 289–292
39. Camus Y., Delva E, Cohen S, Lienhart A.: The effects of warming intravenous fluids on intraoperative hypothermia and postoperative shivering during prolonged abdominal surgery. Acta Anaesthesiol. Scand., 1996; 40: 779–782
40. Green B.L., Marshall H.C., Collinson F. i wsp.: Long-term follow-up of the Medical Research Council CLASICC trial of conventional versus laparoscopically assisted resection in colorectal cancer. Br. J. Surg., 2013; 100: 75–82
41. van der Pas M.H., Haglind E., Cuesta M.A. i wsp.; COlorectal cancer Laparoscopic or Open Resection II (COLOR II) Study Group: Laparoscopic versus open surgery for rectal cancer (COLOR II): short-term outcomes of a randomised, phase 3 trial. Lancet Oncol., 2013; 14: 210–218
42. Lacy A.M., García-Valdecasas J.C., Delgado S. i wsp.: Laparoscopy-assisted colectomy versus open colectomy for treatment of non-metastatic colon cancer: a randomised trial. Lancet, 2002; 359: 2224–2229
43. Da Costa M.L., Redmond H.P., Finnegan N. i wsp.: Laparotomy and laparoscopy differentially accelerate experimental flank tumour growth. Br. J. Surg., 1998; 85: 1439–1442
44. Bouvy N.D., Marquet R.L., Hamming J.F. i wsp.: Laparoscopic surgery in the rat. Beneficial effect on body weight and tumor take. Surg. Endosc., 1996; 10: 490–494
45. Vlug M.S., Wind J., Hollmann M.W. i wsp.; LAFA study group: Laparoscopy in combination with fast track multimodal management is the best perioperative strategy in patients undergoing colonic surgery: a randomized clinical trial (LAFA-study). Ann. Surg., 2011; 254: 868–875
46. Nicholson A., Lowe M.C., Parker J. i wsp.: Systematic review and meta-analysis of enhanced recovery programmes in surgical patients. Br. J. Surg., 2014; 101: 172–188
47. Lindgren P.G., Nordgren S.R., Oresland T., Hultén L.: Midline or transverse abdominal incision for right-sided colon cancer-a randomized trial. Colorectal Dis., 2001; 3: 46–50
48. Brown S.R., Goodfellow P.J., Adam I.J., Shorthouse A.J.: A randomised controlled trial of transverse skin crease vs. vertical midline incision for right hemicolectomy. Tech. Coloproctol., 2004; 8: 15–18
49. Cheatham M.L., Chapman W.C., Key S.P., Sawyers J.L.: A meta-analysis of selective versus routine nasogastric decompression after elective laparotomy. Ann. Surg., 1995; 221: 469–476; discussion 476–478
50. Nelson R., Tse B., Edwards S.: Systematic review of prophylactic nasogastric decompression after abdominal operations. Br. J. Surg., 2005; 92: 673–680
51. Petrowsky H., Demartines N., Rousson V., Clavien P.A.: Evidence-based value of prophylactic drainage in gastrointestinal surgery: a systematic review and meta-analyses. Ann. Surg., 2004; 240: 1074–1084; discussion 1084–1085
52. Karliczek A., Jesus E.C., Matos D. i wsp.: Drainage or nondrainage in elective colorectal anastomosis: a systematic review and meta-analysis. Colorectal Dis., 2006; 8: 259–265
53. Urbach D.R., Kennedy E.D., Cohen M.M.: Colon and rectal anastomoses do not require routine drainage: a systematic review and meta-analysis. Ann. Surg., 1999; 229: 174–180
54. Basse L., Werner M., Kehlet H.: Is urinary drainage necessary during continuous epidural analgesia after colonic resection? Reg. Anesth. Pain Med., 2000; 25: 498–501
55. Rodgers A., Walker N., Schug S. i wsp.: Reduction of postoperative mortality and morbidity with epidural or spinal anaesthesia: results from overview of randomised trials. BMJ, 2000; 321: 1493
56. Jorgensen H., Wetterslev J., Moiniche S., Dahl J.B.: Epidural local anaesthetics versus opioidbased analgesic regimens on postoperative gastrointestinal paralysis, PONV and pain after abdominal surgery. Cochrane Database Syst. Rev., 2000;(4):CD001893
57. Charlton S., Cyna A.M., Middleton P., Griffiths J.D.: Perioperative transversus abdominis plane (TAP) blocks for analgesia after abdominal surgery. Cochrane Database Syst. Rev., 2010;(12):CD007705
58. Walter C.J., Maxwell-Armstrong C., Pinkney T.D. i wsp.: A randomised controlled trial of the efficacy of ultrasound-guided transversus abdominis plane (TAP) block in laparoscopic colorectal surgery. Surg. Endosc., 2013; 27: 2366–2372
59. Brandstrup B., Tonnesen H., Beier-Holgersen R. i wsp.: Effects of intravenous fluid restriction on postoperative complications: comparison of two perioperative fluid regimens: a randomized assessor-blinded multicenter trial. Ann. Surg., 2003; 238: 641–648
60. Lobo D.N., Bostock K.A., Neal K.R. i wsp.: Effect of salt and water balance on recovery of gastrointestinal function after elective colonic resection: a randomised controlled trial. Lancet, 2002; 359: 1812–1818
61. Varadhan K.K., Lobo D.N.: A meta-analysis of randomised controlled trials of intravenous fluid therapy in major elective open abdominal surgery: getting the balance right. Proc. Nutr. Soc., 2010; 69: 488–498
62. Hannemann P., Lassen K., Hausel J. i wsp.: Patterns in current anaesthesiological peri-operative practice for colonic resections: a survey in five northern-European countries. Acta Anaesthesiol. Scand., 2006; 50: 1152–1160
63. Lewis S.J., Egger M., Sylvester P.A., Thomas S. i wsp.: Early enteral feeding versus “nil by mouth” after gastrointestinal surgery: systematic review and meta-analysis of controlled trials. BMJ, 2001; 323: 773–776
64. Han-Geurts I.J., Hop W.C., Kok N.F. i wsp.: Randomized clinical trial of the impact of early enteral feeding on postoperative ileus and recovery. Br. J. Surg., 2007; 94: 555–561
65. Marimuthu K., Varadhan K.K., Ljungqvist O., Lobo D.N.: A meta-analysis of the effect of combinations of immune modulating nutrients on outcome in patients undergoing major open gastrointestinal surgery. Ann. Surg., 2012; 255: 1060–1068
66. Fearon K.C., Ljungqvist O., Von Meyenfeldt M. i wsp.: Enhanced recovery after surgery: a consensus review of clinical care for patients undergoing colonic resection. Clin. Nutr., 2005; 24: 466–477
67. Convertino V.A.: Cardiovascular consequences of bed rest: effect on maximal oxygen uptake. Med. Sci. Sports Exerc., 1997; 29: 191–196
68. Kehlet H., Wilmore D.W.: Multimodal strategies to improve surgical outcome. Am. J. Surg., 2002; 183: 630–641
69. Smart N.J., White P., Allison A.S. i wsp.: Deviation and failure of enhanced recovery after surgery following laparoscopic colorectal surgery: early prediction model. Colorectal Dis., 2012; 14: e727–734