Wstęp
Jeżeli niemowlę nie jest karmione piersią lub mlekiem kobiecym, konieczne jest stosowanie produktów zastępujących pokarm matki. Wzorcem, zwłaszcza w odniesieniu do produktów stosowanych w pierwszym okresie życia, jest mleko kobiece. Produkt zastępujący mleko matki powinien nie tylko naśladować je swoim składem, ale dodatkowo sprawiać, by tempo wzrastania oraz wskaźniki przemiany materii u żywionych nim niemowląt były maksymalnie zbliżone do obserwowanych u niemowląt karmionych wyłącznie piersią. Wierne odtworzenie składu mleka kobiecego nie jest jednak możliwe, chociażby dlatego, że zmienia się on w trakcie trwania laktacji.
Terminologia
W piśmiennictwie polskim stosuje się różne nazewnictwo określające produkty zastępujące mleko kobiece. Obok terminów omówionych poniżej potocznie używana jest również nazwa „mieszanka mleczna”, odnosząca się ogólnie do mleka stosowanego w żywieniu niemowląt, bez uwzględniania jego swoistych cech.
Produkty zastępujące mleko kobiece wytwarzane są zwykle z białek mleka krowiego, poddanego niezbędnym zmianom ilościowym i jakościowym. Od niedawna źródłem białka w tych preparatach może być również mleko kozie. Wytwarzane są także z izolatów białka sojowego lub hydrolizatów białka.
Preparaty do początkowego żywienia niemowląt
Skład preparatów do początkowego żywienia niemowląt uwzględnia swoiste potrzeby żywieniowe w pierwszych miesiącach życia i w całości zaspokaja zapotrzebowanie na wszystkie niezbędne w tym okresie składniki odżywcze. Potocznie tę grupę preparatów nazywa się „mlekiem początkowym”. Można je podawać również w późniejszym wieku, razem z pokarmami uzupełniającymi.
Preparaty do dalszego żywienia niemowląt
Przeznaczone są do zaspokojenia potrzeb żywieniowych dzieci w okresie wprowadzania pokarmów uzupełniających. Wymagania co do stopnia modyfikacji są dla tego typu produktu znacznie mniejsze niż w przypadku preparatu do żywienia początkowego. Potocznie określane są mianem „mleko następne”.
Odrębną kategorię stanowi żywność specjalnego przeznaczenia medycznego (food for special medical purposes [FSMP]). Są to preparaty przeznaczone do żywienia pacjentów, którzy z powodu określonej choroby lub stanu klinicznego mają potrzeby żywieniowe, których nie można zaspokoić spożywaniem standardowych środków spożywczych. Produkty specjalnego przeznaczenia medycznego należy stosować wyłącznie pod nadzorem lekarza, a na etykiecie muszą się znajdować informacje o ich przeznaczeniu.
Produkty zastępujące mleko kobiece na bazie mleka krowiego
W krajach Unii Europejskiej skład i wartość odżywczą produktów dla niemowląt opiniuje EFSA, a prawnie reguluje Dyrektywa Komisji Europejskiej. Zalecany przez EFSA skład mleka do początkowego i dalszego żywienia niemowląt – p. tab. 1. Wszystkie zarejestrowane preparaty zastępujące mleko kobiece są bezpieczne i zapewniają pokrycie zapotrzebowania niemowlęcia na wszystkie niezbędne składniki odżywcze. Możliwe są modyfikacje i dodawanie przez producentów do produktów zastępujących mleko kobiece nowych składników, wykraczających poza te wymienione w dyrektywie, pod warunkiem, że bezpieczeństwo takiej suplementacji udokumentowano w badaniach klinicznych przeprowadzonych zgodnie z powszechnie uznawanymi standardami.
| Tabela 1. Skład mleka początkowego i następnego z mleka krowiego (wg EFSA) | ||||
|---|---|---|---|---|
| Mleko początkowe | Mleko następne | |||
| min./100 ml | maks./100 ml | |||
| wartość energetyczna kJ (kcal) | 250 (60)–295 (70) | |||
| makroskładniki | min.–maks./100 kcal | |||
| białko (g) | 1,8–2,5 | |||
| węglowodany | – w tym laktoza (g) | 9,0 (34,5)–14 (N/S) | ||
| – bez laktozy | ≤0,01 | |||
| sacharoza, fruktoza, cukier z miodu (% węglowodanów) | 0 | ≤20 | ||
| glukoza | 0 | |||
| skrobia (bezglutenowa) | ≤2 g/100 ml, ≤30% całkowitych węglowodanów, bez górnej granicy | |||
| tłuszcze (g) | 4,4–6,0 | |||
| kwas linolowy w(mg) | 500–1200 | |||
| DHA 20–50 | ||||
| kwasy tłuszczowe trans (% kwasów tłuszczowych) | ≤3% | |||
| witaminy | ||||
| witamina A (µg) | 70 | |||
| witamina D (µg) | 2 | |||
| witamina B12 (µg) | 0,1 | 0,5 | ||
| witamina C (mg) | 8 | 30 | ||
| witamina E (mg) | 0,6 | |||
| witamina K (µg) | 1 | |||
| tiamina (µg) | 40 | |||
| ryboflawina (µg) | 60 | |||
| niacyna (µg) | 400 | |||
| witamina B6 (µg) | 20 | |||
| kwas foliowy (µg) | 15 | |||
| biotyna (µg) | 1 | |||
| kwas pantotenowy (mg) | 0,4 | |||
| składniki mineralne (minimalne) | ||||
| Ca (mg) | 50 | |||
| Cl (mg) | 60 | |||
| Cu (µg) | 60 | |||
| F (µg) | N/S | |||
| Fe (mg) | 0,3 | 0,6 | ||
| J (µg) | 15 | |||
| Mg (mg) | 5 | |||
| Mn (µg) | 1 | |||
| P (mg) | 25 | |||
| K (mg) | 60 | |||
| Se (mg) | 3 | |||
| Na (mg) | 25 | |||
| Zn (mg) | 0,5 | |||
| inne | ||||
| cholina (mg) | 25 | |||
| L-karnityna (mg) | 1,2 | niepotrzebna | ||
| inozytol (mg) | 4 | niepotrzebny | ||
Wartość energetyczna
Wartość energetyczna mleka modyfikowanego dla niemowląt powinna wynosić 60–70 kcal/100 ml.
Białko
Białka w mleku kobiecym i mleku krowim się różnią. Ilość białka w dojrzałym pokarmie kobiecym wynosi ~1 g/100 ml, a w mleku krowim – 3,3 g/100 ml. Odmienny jest również stosunek białek serwatkowych do kazeiny. W mleku kobiecym wynosi on 60/40, a w mleku krowim 20/80. Dominującym białkiem serwatkowym pokarmu kobiecego jest α-laktoalbumina, wykazująca głównie działanie odżywcze. Przeważającym białkiem serwatkowym mleka krowiego jest β-laktoglobulina, która niemal nie występuje w pokarmie kobiecym. Ma ona silne właściwości antygenowe i jest często odpowiedzialna za alergię na białka mleka krowiego.
Zawartość białka w większości preparatów mleka modyfikowanego dostępnych aktualnie w krajach UE utrzymuje się w dolnej granicy zawartości zalecanej w dyrektywie UE i wynosi 1,2–1,3 g/100 ml (w porównaniu z ~2,0 g/100 ml jeszcze kilka lat temu).
Trwają dyskusje na temat optymalnej zawartości białka w mleku modyfikowanym. Wyniki aktualnego (2014 r.) przeglądu systematycznego przygotowanego na zlecenie EFSA wskazują na brak jednoznacznego korzystnego lub niekorzystnego wpływu zmniejszenia zawartości białka w produktach zastępujących mleko kobiece na wskaźniki rozwoju fizycznego dzieci, stężenie aminokwasów oraz ryzyko AZS. Do wyjaśnienia pozostaje znaczenie ilości spożywanego białka w kontekście ryzyka rozwoju nadwagi i otyłości w późniejszym wieku. Dostępne dane sugerują, że nadmierne spożycie białka we wczesnym okresie życia wiąże się z szybkim przyrostem masy ciała i większym ryzykiem rozwoju otyłości w kolejnych latach życia.
Tłuszcze
Zawartość tłuszczów w mleku kobiecym i krowim jest zbliżona. Różnią się one jednak zasadniczo składem, a zwłaszcza zawartością niezbędnych nienasyconych kwasów tłuszczowych (PUFA). Dyrektywa unijna precyzuje ilościową i jakościową zawartość tłuszczów w preparatach zastępujących mleko kobiece dla niemowląt. Celem jest uzyskanie profilu kwasów tłuszczowych zbliżonego do profilu w mleku kobiecym.
- Nienasycone kwasy tłuszczowe
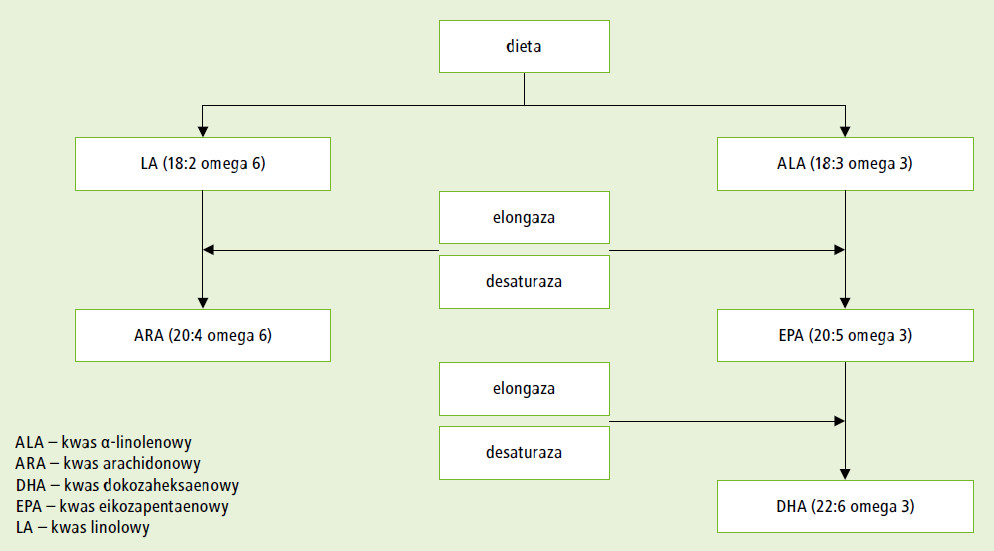
Najważniejszymi z nich są omega-6 i omega-3 PUFA (kwas α-linolenowy i kwas linolowy, będące prekursorami LCPUFA, m.in. kwasu dokozaheksoenowego [DHA] i arachidonowego [ARA]). Powstają one w wątrobie dzięki aktywności enzymatycznej desaturaz i elongaz wątrobowych (ryc. 1). LCPUFA są składnikami błon komórkowych, a szczególnie dużą ich zawartość stwierdza się w błonach komórek nerwowych i siatkówki. W preparatach zastępujących mleko kobiece stosuje się głównie oleje:- słonecznikowy – źródło PUFA, w tym kwasu linolowego i α-linolenowego;
- rzepakowy – dobre źródło nienasyconych kwasów tłuszczowych omega-6 i omega-3 w idealnej proporcji 2:1;
- palmowy (lub oleina palmowa) – w odróżnieniu od innych olei roślinnych stanowi źródło długołańcuchowych nasyconych kwasów tłuszczowych, w tym kwasu palmitynowego;
- kokosowy – nawet do 100% kwasów tłuszczowych mogą stanowić kwasy nasycone, głównie średniołańcuchowe (kwas laurynowy i mirystynowy);
- sojowy lub kukurydziany – źródło wielonienasyconych kwasów tłuszczowych.
- Olej palmowy i β-palmitynian
Pośród wymienionych powyżej olejów roślinnych olej palmowy budzi wiele emocji ze względu na zagrożenie wycinką lasów tropikalnych pod plantacje (stąd działania mające na celu pozyskiwanie oleju palmowego w sposób zrównoważony) oraz z uwagi na aspekty zdrowotne. Olej palmowy zawiera dużą (~45,5%) ilość nasyconych kwasów tłuszczowych (dla porównania olej rzepakowy tylko ~7%). Duża zawartość nasyconych kwasów tłuszczowych w oleju palmowym potencjalnie wpływa na ryzyko chorób sercowo-naczyniowych, cukrzycy typu 2 i chorób nowotworowych. Olej palmowy stosowany jest jako źródło tłuszczu w preparatach zastępujących mleko w celu osiągnięcia stężenia kwasu palmitynowego podobnego jak w mleku kobiecym. Znaczenie ma nie tylko obecność, ale również konfiguracja kwasu palmitynowego w triacyloglicerolach. W mleku kobiecym występuje on głównie w pozycji środkowej (SN-2), podczas gdy w oleju palmowym – w pozycjach zewnętrznych (SN-1 i SN-3), co potencjalnie wpływa na twardszą konsystencję stolca. SN-2-palmitynian (tzw. β-palmitynian) stosowany jest w niektórych preparatach do naśladowania pozycji kwasu palmitynowego w ludzkim mleku.
Zgodnie z aktualnym (2019 r.) stanowiskiem Komitetu Żywienia ESPGHAN nie ma wystarczających danych naukowych wskazujących, że ze względów zdrowotnych należy unikać oleju palmowego jako źródła tłuszczu w preparatach do początkowego żywienia niemowląt. Zastosowanie β-palmitynianu w preparatach zastępujących mleko kobiece dla niemowląt może mieć krótkotrwały wpływ na konsystencję stolca, ale jego dodatek nie jest niezbędny.
Ryc. 1. Metabolizm wielonienasyconych kwasów tłuszczowych
Węglowodany
- Laktoza
Podstawowym węglowodanem w pokarmie kobiecym jest laktoza, będąca przede wszystkim źródłem energii. Odgrywa ona również istotną korzystną rolę we wchłanianiu wapnia, cynku i magnezu oraz sprzyja rozwojowi typowej dla niemowląt karmionych piersią mikrobioty bifidogennej w przewodzie pokarmowym. W preparatach mleka modyfikowanego podstawowym węglowodanem również jest laktoza. - Inne
Mleko kobiece nie zawiera sacharozy i fruktozy, ale występuje w nim niewielka ilość alkoholi cukrowych, w tym inozytolu. W składzie preparatów mleka modyfikowanego nie ma więc fruktozy, a sacharoza może być źródłem węglowodanów tylko w hydrolizatach białka (≤20% ogólnej ilości). Ograniczenia dotyczące fruktozy i sacharozy wynikają z tego, że mogą one wywoływać groźne następstwa w przypadku dziedzicznej nietolerancji fruktozy (fruktozemii; częstość w Polsce: 1/31 000;).
Obecność innych węglowodanów zależy od rodzaju mleka. Przykładowo w preparatach bezlaktozowych są nimi glukoza lub syrop glukozowy. Źródłem węglowodanów mogą być również maltoza i maltodekstryna. - Oligosacharydy
Oligosacharydy mleka kobiecego (HMO) wchodzą – obok laktozy – w skład węglowodanów ludzkiego mleka. Są bardzo zróżnicowaną frakcją ~200 strukturalnie różnych związków, w skład których wchodzi 5 monocukrów: glukoza, galaktoza, N-acetyloglukozamina, fukoza i kwas sjalowy. Ich stężenie wynosi średnio ~1,5 g/100 ml. Nie mają żadnej wartości odżywczej dla niemowlęcia, co jednak nie znaczy, że są zbędne. Wykazują właściwości prebiotyczne – w przewodzie pokarmowym niemowląt HMO stymulują rozwój wybranych bakterii z rodzaju Bifidobacterium, zwłaszcza B. longum subs. infantis (B. infantis), B. breve i B. bifidum. Mają działanie antyadhezyjne i przeciwdrobnoustrojowe wobec wielu patogenów. Ze względu na podobieństwo struktury chemicznej do węglowodanów w cząsteczkach glikoprotein i glikolipidów na powierzchni komórek nabłonkowych mogą odgrywać ważną rolę w zapobieganiu przyleganiu drobnoustrojów chorobotwórczych do receptorów i wiązaniu toksyn bakteryjnych, co może sprzyjać ochronie niemowlęcia przed zakażeniem.
Nieobowiązkowe składniki dodatkowe
Przepisy regulują skład preparatów zastępujących mleko kobiece i gwarantują, że pokrywają one zapotrzebowanie dzieci na wszystkie niezbędne składniki odżywcze i są bezpieczne. Poszczególne preparaty mogą się natomiast różnić pod względem dodatkowych składników lub ich kompozycji, co może mieć znaczenie w pewnych szczególnych sytuacjach klinicznych. W przypadku wielu z tych substancji potencjalne korzyści zdrowotne wzbogacania w nie mleka modyfikowanego wymagają jednak jeszcze udowodnienia w prawidłowo przeprowadzonych badaniach klinicznych.
- Prebiotyki
Prebiotyk to substrat, który jest wybiórczo wykorzystywany przez mikrobiotę gospodarza i w ten sposób korzystnie wpływa na jego zdrowie. Do tej grupy należą HMO naturalnie występujące w mleku kobiecym, a także galaktooligosachardy (oligomery galaktozy syntezowane z laktozy [GOS]) oraz fruktooligosacharydy (FOS) powstające z inuliny.
Nowoczesne metody biotechnologiczne pozwalają na wytwarzanie przynajmniej niektórych HMO. Są one strukturalnie identyczne jak HMO występujące w pokarmie matki, ale pozyskiwane w inny sposób, stąd stosowane są takie nazwy, jak „identyczne jak oligosacharydy pokarmu kobiecego” (human-identical milk oligosaccharide – HiMO), „syntetyczne oligosacharydy” lub „biotechnologicznie uzyskiwane HMO” (biotechnologically obtained HMO – bio-HMO).
Od kilku lat w wielu krajach, w tym w Polsce, dostępne są mleka modyfikowane zawierające 2’fukozylolaktozę (2’-FL) lub lakto-N-neotetraozę (LNnT). Stosowanie mieszanek zawierających 2-’FL i LNnT zapewnia prawidłowy rozwój fizyczny niemowląt i jest dobrze tolerowane, ale ocena innych efektów klinicznych wymaga jeszcze dalszych badań.
Znaczna różnorodność, złożona budowa i polimorfizm oligosacharydów pokarmu kobiecego sprawiają jednak, że na obecnym etapie wiedzy ich wierne odtworzenie nie jest możliwe. W praktyce w mleku modyfikowanym stosowane są najczęściej prebiotyki będące mieszaniną GOS o krótkim łańcuchu i FOS o długim łańcuchu. Do potencjalnych korzyści wynikających z suplementacji GOS/FOS należy zwiększenie liczby bakterii z rodzaju Bifidobacterium w jelitach oraz bardziej plastyczna konsystencja stolca (może mieć znaczenie u niemowląt z tendencją do zaparcia). Według EFSA (2014 r.) nie ma potrzeby dodawania oligosacharydów do mleka modyfikowanego początkowego lub następnego, ale potwierdzono, że ich wzbogacenie w GOS/FOS w stosunku 9:1 jest bezpieczne (występują w wielu dostępnych aktualnie preparatach). Możliwe są korzystne działania, ale każdy prebiotyk należy oceniać indywidualnie - Probiotyki
Żywe drobnoustroje, które w odpowiednich ilościach wywierają korzystny efekt zdrowotny u gospodarza, określane są terminem „probiotyki”. Według EFSA nie ma jednak potrzeby dodawania probiotyków (również synbiotyków) do mleka modyfikowanego początkowego lub następnego. Podawanie zdrowym niemowlętom mleka modyfikowanego zawierającego probiotyki nie wpływa niekorzystnie na rozwój fizyczny i nie wywołuje działań niepożądanych. Możliwe są natomiast korzystne skutki takiej suplementacji, ale każdy probiotyk (szczep) należy oceniać indywidualnie. - Synbiotyki
Synbiotyk to mieszanina składająca się z żywych drobnoustrojów i substratu lub substratów wybiórczo wykorzystywanych przez mikrobiotę gospodarza, co korzystnie oddziałuje na jego zdrowie. Podawanie zdrowym niemowlętom preparatów zastępujących mleko kobiece zawierających synbiotyki nie wpływa niekorzystnie na rozwój fizyczny i nie wywołuje działań niepożądanych. Możliwe są natomiast korzystne skutki, ale każdy synbiotyk należy oceniać indywidualnie. - Postbiotyki
Postbiotyk to preparat nieżywych drobnoustrojów lub ich metabolitów, albo składników, który korzystnie wpływa na zdrowie docelowego gospodarza. W Polsce dostępne są mleka modyfikowane z postbiotykami, np. powstałymi w wyniku fermentacji Bifidobacterium breve C50 i Streptococcus thermophilus O65 (fermentacja to jeden z procesów pozyskiwania postbiotyków, stąd wcześniej używany termin „mleko fermentowane”). Niektóre z tych rodzajów mleka zawierają dodatkowe modyfikacje składu (np. prebiotyki). - Nukleotydy
Są prekursorami DNA i RNA. Wchodzą w skład 3 podstawowych koenzymów (NAD+, FAD, CoA), dlatego mogą być nośnikami energii chemicznej i pełnić w komórce rolę regulatorową. Dodawane do preparatów mleka modyfikowanego, prawdopodobnie modulują fenotyp odpowiedzi immunologicznej. U dzieci urodzonych z małą masą urodzeniową poprawiają wskaźniki rozwoju fizycznego i w umiarkowanym stopniu zapobiegają biegunce. Według EFSA nie ma jednak potrzeby dodawania nukleotydów do mleka modyfikowanego początkowego lub następnego, ale są one dopuszczone i wchodzą w skład wielu dostępnych preparatów. - Błony otoczek kuleczek tłuszczowych mleka
W mleku kobiecym tłuszcze są „zapakowane” w globulki tłuszczu mlecznego otoczone błoną (milk fat globule membranes – MFGM). Są to trójbłonowe struktury, w skład których wchodzą złożone tłuszcze i białka aktywne biologicznie, osadzone głównie w błonie zewnętrznej. Pełnią one ważną rolę odżywczą i funkcjonalną. W ich skład wchodzą m.in. fosfolipidy, glikolipidy, sfingolipidy, glikoproteiny, cholesterol, węglowodany oraz białka (np. mucyny, laktoadheryny). Niektóre preparaty zastępujące mleko kobiece dla niemowląt są wzbogacane w MFGM. Potencjalnie mogą mieć działanie immunomodulujące oraz korzystnie wpływać na rozwój funkcji poznawczych, zmniejszać ryzyko wystąpienia ostrego zapalenia ucha środkowego lub biegunki infekcyjnej i łagodzić jej przebieg, a pośrednio ograniczać stosowanie leków przeciwgorączkowych. Dane naukowe są jednak ograniczone i wymagają potwierdzenia w kolejnych badaniach klinicznych. - Osteopontyna
Jest to glikoproteina posiadająca właściwości immunomodulujące m.in. poprzez stymulowanie subpopulacji limfocytów Th1 oraz domniemany udział w transporcie białek o właściwościach przeciwbakteryjnych. Występuje w znacznej ilości w mleku kobiecym, a tylko w niewielkiej ilości w mleku krowim, stąd próby suplementacji osteopontyną mleka modyfikowanego dla niemowląt. - Laktoferyna
Laktoferyna to wielofunkcyjne białko serwatkowe występujące m.in. w mleku kobiecym, zwłaszcza w siarze. Uczestniczy w homeostazie żelaza dzięki zdolności do silnego i odwracalnego wiązania jonów tego pierwiastka. Wykazuje właściwości przeciwdrobnoustrojowe (przeciwbakteryjne, przeciwwirusowe, przeciwgrzybicze oraz przeciwpasożytnicze) i bierze udział w funkcjonowaniu układu odporności. Ma również działanie przeciwutleniające, enzymatyczne oraz hamujące procesy rakotwórcze.
Zbliżona do laktoferyny ludzkiej, ale łatwiej dostępna, jest laktoferyna wołowa. Jej bezpieczeństwo zostało potwierdzone przez EFSA i można ją dodawać m.in. do mleka modyfikowanego dla niemowląt. Problemem technologicznym jest podatność laktoferyny na działanie wysokiej temperatury lub suszenie natryskowe (procesy technologiczne stosowne w produkcji mleka modyfikowanego) i możliwość jej denaturacji. Przedmiotem dyskusji pozostaje również optymalna zawartość laktoferyny w mleku dla niemowląt, a także realne efekty kliniczne takiej suplementacji. - α-laktalbumina
Bywa dodawana do mleka modyfikowanego ze względu na jej większą zawartość w mleku kobiecym niż krowim. Wprawdzie istnieją przesłanki teoretyczne uzasadniające takie postępowanie, ale faktyczne korzyści nadal pozostają przedmiotem badań.
Substancje zagęszczające
Jako substancje zagęszczające stosuje się: mączkę z ziaren chlebowca świętojańskiego, skrobię ryżową, skrobię ziemniaczaną, skrobię kukurydzianą i gumę skrobiową z nasion fasoli. Substancje zagęszczające wpływają na zmniejszenie liczby regurgitacji u dziecka, bez wpływu na liczbę epizodów kwaśnego refluksu, a tym samym mają ograniczone znaczenie w leczeniu choroby refluksowej przełyku. Stosowanie mleka modyfikowanego zawierającego substancje zagęszczające jest uzasadnione – zawsze pod nadzorem lekarza – jedynie u niemowląt z chorobą refluksową i towarzyszącymi zaburzeniami wzrastania spowodowanymi stratami energetycznymi. Nie należy ich natomiast podawać zdrowym, prawidłowo rozwijającym się niemowlętom, u których występują tylko regurgitacje (tzw. ulewanie).
Produkty zastępujące mleko kobiece na bazie mleka koziego
Mleko kozie jako źródło białka może być stosowane w mleku modyfikowanym pod warunkiem, że produkt końcowy spełnia wymagania określone w odpowiednich dyrektywach Komisji Europejskiej (podobnie jak w przypadku preparatów dla niemowląt wytwarzanych z mleka krowiego). Modyfikacja jest potrzebna, ponieważ niemodyfikowane mleko kozie, podobnie jak niemodyfikowane mleko krowie, nie nadaje się do żywienia niemowląt <12. miesiąca życia. Wbrew obiegowym opiniom, mleko kozie zawiera potencjalnie alergizujące białka i nie można go stosować w leczeniu alergii na białka mleka krowiego. Dotyczy to również mleka koziego modyfikowanego.
Preparaty sojowe
Definicja
Preparaty, w których źródłem białka jest izolowane białko soi, wzbogacane w L-metioninę, L-karnitynę i taurynę. Źródłem tłuszczów są w nich oleje roślinne (np. sojowy, słonecznikowy, palmowy, szafranowy, kokosowy, a w niektórych przypadkach także oleina), a węglowodanów skrobia kukurydziana lub produkty jej hydrolizy (polimery glukozy), skrobia tapioki albo sacharoza. Nie zawierają laktozy. Preparaty sojowe wzbogacane są w składniki mineralne, ale zawartość wielu z nich, zwłaszcza fosforu i wapnia, jest większa niż w mleku modyfikowanym dla niemowląt ze względu na obecność fitynianów utrudniających wchłanianie tych pierwiastków.
Należy odróżniać preparaty sojowe przeznaczone dla niemowląt od niemodyfikowanego mleka sojowego (tzn. napoju roślinnego, którego nie należy stosować w żywieniu niemowląt).
Zastosowanie
- Wskazania
- Galaktozemia
- Wrodzony niedobór laktazy
- Udokumentowany wtórny niedobór laktazy
- Względy religijne, etyczne i filozoficzne (np. dieta wegetariańska lub wegańska)
Według ekspertów europejskich niemowlęta z alergią na białka mleka krowiego powinny otrzymywać hydrolizaty białek o znacznym stopniu hydrolizy, a w wybranych przypadkach preparaty zawierające mieszaninę aminokwasów. We wstępnej fazie leczenia nie poleca się stosowania preparatów soi, chociaż niektóre niemowlęta dobrze je tolerują.
Jeżeli takie względy, jak smak lub koszt, sprawiają, że rozważa się zastosowanie preparatu sojowego u niemowlęcia przed 6. miesiącem życia, wcześniej należy potwierdzić tolerancję soi w teście prowokacji. - Przeciwwskazania
- Wcześniaki o urodzeniowej masie ciała <1800 g
- Zapobieganie kolce niemowlęcej
- Zapobieganie chorobom atopowym
- Alergia na białka mleka krowiego objawiająca się biegunką lub enteropatią
Bezpieczeństwo
Mimo pewnych wątpliwości przeważa pogląd, że preparaty sojowe przeznaczone do żywienia niemowląt są bezpieczne. Jedna z wątpliwości dotyczy zawartości fitoestrogenów, czyli substancji pochodzenia roślinnego strukturalnie zbliżonych do estrogenów. W soi występują przede wszystkim izoflawony (głównie genisteina i daidzeina). Podobieństwo izoflawonów i estrogenów wynika z obecności pierścienia fenolowego, determinującego ich wiązanie z receptorami estrogenowymi. Potencjalne niekorzystne działania fitoestrogenów dotyczą między innymi wpływu na rozwój fizyczny, mineralizację kośćca oraz dojrzewanie płciowe. Wstępne obserwacje wskazują jednak na małe powinowactwo fitoestrogenów do receptorów estrogenowych człowieka i małą aktywność u ludzi. Na obecnym etapie badań nie ma jednoznacznych dowodów ani na korzystne, ani na szkodliwe efekty spożywania fitoestrogenów. Mimo braku jednoznacznych danych w wielu krajach zaleca się ograniczenie stosowania preparatów sojowych do wyjątkowych sytuacji, a w niektórych (np. Francja, Belgia) nie są one aktualnie dostępne.
W preparatach sojowych stężenie glinu jest – prawdopodobnie w wyniku zanieczyszczeń technologicznych – znacznie większe niż w mleku kobiecym (4–65 vs 650–1300 ng/ml). Toksyczność glinu w zbyt dużej dawce wynika z:
- odkładania się w tkance kostnej i OUN, zwłaszcza w przypadku istotnego upośledzenia czynności nerek,
- hamowania wchłaniania wapnia z przewodu pokarmowego.
Duże stężenie tego pierwiastka w preparatach sojowych może więc nasilać osteopenię u wcześniaków oraz niemowląt z wewnątrzmacicznym ograniczeniem wzrastania (stąd przeciwwskazanie u wcześniaków o mc. <1800 g). Nie wydaje się jednak, by ryzyko takie istniało również w przypadku niemowląt urodzonych w fizjologicznym terminie, u których czynność nerek jest prawidłowa.
Hydrolizaty białka
Definicja
Są to preparaty mlekozastępcze, w których cząsteczki białka poddano hydrolizie enzymatycznej (np. trypsyna) i/lub termicznej, a czasami dodatkowo ultrafiltracji. W wyniku hydrolizy powstają krótkołańcuchowe peptydy o zmniejszonych właściwościach antygenowych. Im większy stopień fragmentacji białka wyjściowego, tym mniejsza immunogenność i prawdopodobieństwo alergizacji, ale jednocześnie tym gorszy smak i zapach produktu końcowego.
Podział
Dostępne hydrolizaty dzieli się ze względu na rodzaju białka wyjściowego oraz stopień hydrolizy (tab. 2). Białka mleka krowiego – kazeina lub białka serwatki – to najczęściej używany substrat do produkcji hydrolizatów. Rzadziej źródłem białka jest ryż. Stąd wynika ich podział na hydrolizaty kazeiny, białek serwatkowych i białek ryżu (te ostatnie są dostępne tylko w niektórych krajach; w Polsce nie są dostępne).
| Tabela 2. Dostępne w Polsce preparaty żywieniowe dla niemowląt i małych dzieci zawierające hydrolizaty białek lub aminokwasya | |||
|---|---|---|---|
| Źródło białka | Nieznaczny stopień hydrolizy | Znaczny stopień hydrolizy | Preparaty aminokwasoweb |
| białka serwatkowe | Bebilon Prosyneo HA Hydrolyzed Advance: 1, 2, 3 Humana: HA 1, HA2 NAN EXPERTPRO: HA 1, HA 2, HA 3 HiPP: 1 HA Combiotik, 2 HA Combiotik |
Bebilon pepti 1 DHA Bebilon pepti 1 Syneo Bebilon pepti 2 Syneo Infatrini Peptisorb |
|
| kazeina | Nutramigen 1 LGG Complete Nutramigen 2 LGG Complete Nutramigen 3 LGG Complete | ||
| aminokwasy | Neocate LCP Neocate Syneo Neocate Juniorc Nutramigen PURAMINO Nutramigen PURAMINO Juniorc | ||
| a Podano nazwy handlowe; szczegółowy skład poszczególnych preparatów – tab. D.4-3, rozdz. D.4 b mieszanki (diety) elementarne c >12. mż. | |||
W zależności od stopnia hydrolizy białka, zgodnie z klasyfikacją zaproponowaną przez AAP, wyróżnia się hydrolizaty o:
- nieznacznym stopniu hydrolizy – zawierają oligopeptydy o masie cząsteczkowej zwykle <5000 Da (w Europie zwykle oznaczone są symbolem HA [hipoalergenowe]),
- znacznym stopniu hydrolizy – zawierają wyłącznie peptydy o masie cząsteczkowej <3000 Da. Podział ten bywa kwestionowany.
Zastosowanie
Znajomość stopnia hydrolizy białka w hydrolizatach (wg klasyfikacji producenta) ma zasadnicze znaczenie, ponieważ determinuje kliniczne wskazania do zastosowania (tab. 3). Hydrolizaty białka:
- o nieznacznym stopniu hydrolizy – do niedawna zalecano w zapobieganiu zachorowaniom na choroby alergiczne u dzieci z udokumentowanym obciążeniem rodzinnym atopią (chory rodzic lub rodzeństwo), jednak aktualnie ich rola jest przedmiotem dyskusji, co znajduje odzwierciedlenie w wytycznych różnych towarzystw naukowych (od „brak zalecenia za lub przeciwko” do „brak danych uzasadniających stosowanie”).
- o znacznym stopniu hydrolizy – można stosować w diagnostyce i leczeniu alergii na białka mleka krowiego (lub soi) oraz w przypadku szeroko rozumianych zaburzeń wchłaniania i trawienia (np. w niektórych postaciach niewydolności zewnątrzwydzielniczej trzustki czy w zespole krótkiego jelita). Ich rola w zapobieganiu alergii na pokarm jest aktualnie przedmiotem dyskusji.
| Tabela 3. Wskazania do zastosowania hydrolizatów białek oraz preparatów wolnych aminokwasów | |||
|---|---|---|---|
| Wskazania | Nieznaczny stopień hydrolizy | Znaczny stopień hydrolizy | Preparaty aminokwasówa |
| zapobieganie alergii na pokarm | kontrowersyjne | kontrowersyjne | nie oceniano |
| diagnostyka alergii na białka mleka krowiego | nie | tak – 1–2 tyg.b – reakcje wczesne lub opóźnione (np. wymioty, wyprysk atopowy) – 2–4 tyg.b – objawy ze strony przewodu pokarmowego (np. biegunka, zaparcie) | tak |
| leczenie alergii na białka mleka krowiego | nie | tak – ≥6 mies. lub do 9.–12. mż. – w przypadku ciężkich, natychmiastowych IgE-zależnych reakcji alergicznych konieczne może być stosowanie diety eliminacyjnej przez 12–18 mies. | tak – jako postępowanie pierwszego wyboru wyłącznie w przypadku niemowląt z objawami bardzo ciężkimi lub zagrażającymi życiu; zawsze, gdy brak efektu stosowania hydrolizatu o znacznym stopniu hydrolizy białka |
| przeciwwskazania | alergia na białka mleka krowiego | nadwrażliwości na hydrolizaty o znacznym stopniu hydrolizyc | brak |
| a mieszanki (diety) elementarne b zalecany czas stosowania danego preparatu; jeśli po tym okresie brak efektu – rozpoznanie alergii na białka mleka krowiego mało prawdopodobne c rzadko, dotyczy <10% dzieci z alergią na białka mleka krowiego (zazwyczaj z ciężką postacią) mż. – miesiąc życia | |||
Węglowodany i tłuszcze
W niektórych preparatach hydrolizatów poza białkiem zmodyfikowany jest również skład węglowodanów lub tłuszczów. Modyfikacja węglowodanów polega na całkowitym lub częściowym zastąpieniu laktozy polimerami glukozy, a modyfikacja tłuszczów – na dodaniu MCT. Przejściowe zastosowanie preparatów o znacznym stopniu hydrolizy białka, bezlaktozowych i ewentualnie zawierających również MCT może być konieczne u niemowląt z enteropatią (zespołem upośledzonego wchłaniania w wyniku niepożądanej reakcji na białka pokarmowe) do czasu powrotu prawidłowego wchłaniania.
Smak i zapach
Podstawową wadą hydrolizatów białek są ich właściwości organoleptyczne (nieprzyjemny smak i zapach), często nieakceptowane przez dzieci, a jeszcze częściej przez ich rodziców. Dziecko chętniej spożywa hydrolizaty, gdy wprowadzono je przed 4. miesiącem życia, natomiast rozpoczynanie ich stosowania u starszych dzieci bywa trudniejsze. Pewne ułatwienie stanowi metoda stopniowego wprowadzania nowego preparatu żywieniowego w ciągu kilku karmień, a czasem nawet w ciągu kilku dni, czyli powolnego zwiększania objętości nowego produktu.
Preparaty zawierające wolne aminokwasy
Definicja
Mieszaniny wolnych aminokwasów, syntetycznych lub powstałych w wyniku znacznego stopnia hydrolizy białka, są specjalnym rodzajem preparatów mlekozastępczych. W odniesieniu do nich używa się nazwy „mieszanka elementarna”, „dieta elementarna” lub „preparat aminokwasowy”. Źródłem aminokwasów są w nich najczęściej białka mleka krowiego poddane znacznego stopnia hydrolizie lub aminokwasy syntetyczne. Poza białkiem modyfikowany może być również skład węglowodanów lub tłuszczów.
Zastosowanie
Rola preparatów aminokwasów pozostaje przedmiotem
dyskusji. W polskich warunkach dodatkowe znaczenie ma
system ich refundacji, ściśle uzależniony od wybranych
wskazań klinicznych.
Zgodnie z aktualnymi zaleceniami wskazania do zastosowania
preparatu aminokwasowego obejmują leczenie:
- alergii na białka mleka krowiego – preparaty aminokwasów są równie skuteczne jak hydrolizaty o znacznym stopniu hydrolizy; szczególne grupy pacjentów, u których mieszanki elementarne mogą wykazywać większą skuteczność, to chorzy z zapaleniem błony śluzowej żołądka i jelit zależnym od pokarmu, przebiegającym z zaburzeniem przyrostu masy ciała, chorzy z ciężkim AZS oraz dzieci z objawami klinicznymi alergii karmione wyłącznie piersią;
- nadwrażliwości na hydrolizaty o znacznym stopniu hydrolizy – szacuje się, że dotyczy ona <10% dzieci z alergią na białka mleka krowiego; odsetek ten może być większy w przypadku ciężkiej enteropatii lub alergii na wiele alergenów pokarmowych;
- ciężkich reakcji anafilaktycznych na białka mleka krowiego – preparaty aminokwasów mogą być leczeniem pierwszego wyboru (ograniczone dane naukowe);
- eozynofilowego zapalenia przełyku (skuteczność potwierdzona jedynie wynikami badania obserwacyjnego).
Ogólne zasady przygotowywania mleka dla niemowląt
Mleko (produkt zastępujący mleko kobiece) należy przygotować zgodnie z zaleceniami producenta. Wbrew obiegowym opiniom preparaty odżywcze w proszku przeznaczone dla niemowląt nie są sterylne. Sporadycznie, w procesie produkcji mieszanek lub podczas przygotowywania ich do spożycia, zdarzają się zanieczyszczenia drobnoustrojami chorobotwórczymi. Zakażenia niektórymi bakteriami (np. Cronobacter sakazakii [dawniej Enterobacter sakazakii]) były przyczyną poważnych chorób, a nawet zgonów niemowląt karmionych mlekiem modyfikowanym. Mając to na uwadze, Komitet Żywienia ESPGHAN sformułował zalecenia dotyczące przygotowania mieszanek.
Przygotowanie w warunkach domowych
- W przypadku korzystania z produktu w proszku świeżą porcję mleka należy przygotować bezpośrednio przed każdym karmieniem.
- Niezjedzone mleko i inne pozostałości po każdym karmieniu należy wyrzucić, a nie przechowywać w celu wykorzystania podczas następnego karmienia.
- Mieszanek nie należy przetrzymywać w termosach ani podgrzewaczach do butelek; alternatywnym rozwiązaniem jest przechowanie podgrzanej wody w termosie i dodanie do niej proszku bezpośrednio przed karmieniem.
Przygotowanie w warunkach szpitalnych
- Należy wypracować pisemne zasady przechowywania i wykorzystywania mieszanek.
- U zdrowych noworodków na oddziałach położniczych należy stosować mleko w postaci płynnej.
- Jeśli konieczne jest wcześniejsze przygotowanie mieszanki, należy to robić na bieżąco, bezpośrednio przed podaniem dziecku (obecnie rzadko potrzebne, ponieważ dostępne są preparaty gotowe do bezpośredniego spożycia).
- Mleko modyfikowane należy przechowywać w temperaturze ≤4oC (konieczne jest monitorowanie temperatury!), nie dłużej jednak niż 30 h.
- Mleko modyfikowane należy podgrzewać bezpośrednio przed karmieniem.
- Mleka modyfikowanego podawanego przez dłuższy czas (np. w celu żywienia przez zgłębnik) nie należy przetrzymywać w temperaturze pokojowej dłużej niż 4 h.
Wybrane piśmiennictwo:
1. Agostoni C., Axelsson I., Goulet O. i wsp.; ESPGHAN Committee on Nutrition: Preparation and handling of powdered infant formula: a commentary by the ESPGHAN Committee on Nutrition. J. Pediatr. Gastroenterol. Nutr., 2004; 39: 320–3222. Agostoni C., Braegger C., Decsi T. i wsp.: Breast-feeding: A commentary by the ESPGHAN Committee on Nutrition. J. Pediatr. Gastroenterol. Nutr., 2009; 49: 112–125
3. Bode L., Contractor N., Barile D. i wsp.: Overcoming the limited availability of human milk oligosaccharides: challenges and opportunities for research and application. Nutr. Rev., 2016; 74: 635–644
4. Braegger C., Chmielewska A., Decsi T. i wsp.; ESPGHAN Committee on Nutrition: Supplementation of infant formula with probiotics and/or prebiotics: a systematic review and comment by the ESPGHAN committee on nutrition. J. Pediatr. Gastroenterol. Nutr., 2011; 52: 238–250
5. Dyrektywa Komisji 2013/46/UE z dnia 28 sierpnia 2013 r. zmieniająca dyrektywę 2006/141/WE w odniesieniu do wymogów dotyczących białek, odnoszących się do preparatów do początkowego żywienia niemowląt i preparatów do dalszego żywienia niemowląt. Dziennik Urzędowy Unii Europejskiej
6. EFSA Panel on Dietetic Products, Nutrition and Allergies: Scientific opinion on nutrient requirements and dietary intakes of infants and young children in the European Union. EFSA J., 2013; 11: 3408
7. EFSA Panel on Dietetic Products, Nutrition, and Allergies (NDA): Lipil® and visual development – Scientific substantiation of a health claim related to Lipil® and visual development pursuant to Article14 of Regulation (EC) No 1924/2006
8. EU Commission Health and Consumers Directorate General (2013): Regulation (EU) no 609/2013 of the European Parliament and of the Council of 12 June 2013 on food intended for infants and young children, food for special medical purposes, and total diet replacement for weight control. www.eur-lex.europa.eu/legal-content/EN/ALL/?uri=celex%3A32013R0609
9. European Commission: Commission delegated regulation (EU) 2016/127 of 25 September 2015 supplementing Regulation (EU) No 609/2013 of the European Parliament and of the Council as regards the specific compositional and information requirements for infant formula and follow-on formula and as regards requirements on information relating to infant and young child feeding. Official Journal of the European Union 2015. https://public/ations.europa.eu/en/publication-detail/-/publication/95d90c87-c97e-11e5-a4b5-01aa75ed71a1
10. European Food Safety Authority: Scientific opinion on the suitability of goat milk protein as a source of protein in infant formulae and in follow-on formulae. EFSA J., 2012; 10: 2603
11. European Food Safety Authority: Scientific opinion on nutrient requirements and dietary intakes of infants and young children in the European Union. EFSA J., 2013; 11: 3408
12. European Food Safety Authority: Scientific opinion on the essential composition of infant and follow-on formulae. EFSA J., 2014; 12: 3760.
13.Expert Panel on Integrated Guidelines for Cardiovascular Health and Risk Reduction in Children and Adolescents; National Heart, Lung, and Blood Institute: Expert panel on integrated guidelines for cardiovascular health and risk reduction in children and adolescents: summary report. Pediatrics, 2011; 128: S213–S256
14. Fewtrell M., Bronsky J., Campoy C. i wsp.: Complementary Feeding: A Position Paper by the European Society for Paediatric Gastroenterology, Hepatology, and Nutrition (ESPGHAN) Committee on Nutrition. J. Pediatr. Gastroenterol. Nutr., 2017; 64: 119–132
15. Halken S., Muraro A., de Silva D. i wsp.; European Academy of Allergy and Clinical Immunology Food Allergy and Anaphylaxis Guidelines Group: EAACI guideline: Preventing the development of food allergy in infants and young children (2020 update). Pediatr. Allergy Immunol., 2021; 32: 843–858
16. Lightdale J.R., Gremse D.A.; Section on Gastroenterology, Hepatology and Nutrition: Gastroesophageal reflux: management guidance for the pediatrician. Pediatrics, 2013; 131: e1684–e1695
17. Michaelsen K.F., Greer F.R.: Protein needs early in life and long-term health. Am. J. Clin. Nutr., 2014; 99: 718S–722S
18. Prosser C.G.: Compositional and functional characteristics of goat milk and relevance as a base for infant formula. J. Food Sci., 2021; 86: 257–265
19. Rosen R., Vandenplas Y., Singendonk M. i wsp.: Pediatric Gastroesophageal Reflux Clinical Practice Guidelines: Joint Recommendations of the North American Society for Pediatric Gastroenterology, Hepatology, and Nutrition and the European Society for Pediatric Gastroenterology, Hepatology, and Nutrition. J. Pediatr. Gastroenterol. Nutr., 2018; 66: 516–554
20. Szajewska H., Socha P., Horvath A. i wsp.: Zasady żywienia zdrowych niemowląt. Stanowisko PTGHiŻD. Med. Prakt. Pediatr., 2021: 1: 23–44
21. Tijhuis M.J., Doets E.L., Noordegraaf-Schouten V.: Extensive literature search and review as preparatory work for the evaluation of the essential composition of infant and follow-on formulae and growing-up milk. www.efsa.europa.eu/en/supporting/doc/551e.pdf
22. Triantis V., Bode L., van Neerven R.J.J.: Immunological effects of human milk oligosaccharides. Front Pediatr., 2018; 6: 190
23. Verduci E., Di Profio E., Cerrato L. i wsp.: Use of soy-based formulas and cow’s milk allergy: lights and shadows. Front Pediatr., 2020; 8: 591 988