Skróty: ELISA – test immunoenzymatyczny, PCR – reakcja łańcuchowej polimerazy
Krztusiec jest bardzo zaraźliwą chorobą układu oddechowego o ostrym przebiegu, wywoływaną przez pałeczkę krztuśca – Bordetella pertussis. Bakterię tę po raz pierwszy wyizolowali Bordet i Gangou w 1900 roku. W przebiegu tej choroby obserwuje się ostry napadowy kaszel z głośnym wdechem, któremu mogą towarzyszyć wymioty.[1] Rozpoznanie ustala się na podstawie obrazu klinicznego, zwłaszcza gdy wywiad wskazuje na kontakt z chorym na krztusiec, oraz badań laboratoryjnych: hodowli, badań serologicznych (testu immunoenzymatycznego [ELISA], odczynu hemaglutynacji biernej), testu immunofluorescencji bezpośredniej oraz reakcji łańcuchowej polimerazy (PCR).[2,3]
Etiologia i patogeneza
B. pertussis jest Gram-ujemną pałeczką tlenową. Nie posiada zdolności poruszania się, na podłożu hodowlanym wzrasta powoli i wymaga specjalnych czynników odżywczych. Jest chorobotwórcza tylko dla człowieka. Do zakażenia dochodzi na drodze kropelkowej. B. pertussis produkuje toksyny i inne substancje biologicznie aktywne, które warunkują jej zjadliwość.[3-6] Czynniki te, a także zmienność fazowa i antygenowa, prawdopodobnie chronią bakterię przed mechanizmami obronnymi gospodarza, ułatwiają szerzenie się zakażenia w populacji oraz pozwalają przetrwać trudne warunki środowiskowe.[4,7]
Toksyna krztuścowa jest najważniejszym czynnikiem warunkującym zjadliwość bakterii. Hamuje napływ limfocytów do ognisk zapalnych oraz odgrywa rolę w adhezji całej komórki bakteryjnej do komórek układu oddechowego gospodarza. Powoduje leukocytozę z limfocytozą, hiperinsulinemię i prawdopodobnie jest odpowiedzialna za rozwój encefalopatii w przebiegu krztuśca. Inne toksyny (tchawicza, lipopolisacharydowa, dermonekrotyczna, cyklaza adenylowa) uszkadzają miejscowe mechanizmy obronne i powodują niszczenie komórek układu oddechowego. Pozostałe czynniki: hemaglutynina włókienkowa, pertaktyna oraz rzęski, wpływają na zdolność adhezji bakterii do komórek nabłonkowych układu oddechowego.[3-5]
Epidemiologia
Krztusiec występuje wyłącznie u ludzi. Do zakażenia dochodzi drogą kropelkową w wyniku bezpośredniego kontaktu z chorym. Ryzyko zarażenia nieuodpornionej osoby jest bardzo duże. Zakażenie nawet jednej osoby powoduje nagłe powstanie ognisk zakażeń w szkołach, przedszkolach, jednostkach wojskowych czy domach opieki.[8] Do zakażenia dochodzi prawie u 80% osób mających bezpośredni kontakt z chorym, przy czym w ponad połowie przypadków przebiega ono skrycie. W ostatnich latach wykazano, że głównym źródłem zakażenia niemowląt i małych dzieci są chorzy rodzice i najbliższa rodzina, co wskazuje na konieczność dodatkowego szczepienia przypominającego tej grupy osób.[9]
Przebycie choroby i zaszczepienie nie dają trwałej odporności. Badania dowodzą, że odporność utrzymuje się przez około 5–10 lat po szczepieniu[10] i 7–20 lat po przebyciu naturalnego zakażenia.[11] Krzusiec występuje na całym świecie. Powszechne szczepienia początkowo drastycznie zmniejszyły liczbę zachorowań na krzusiec, ale w końcu lat 90. ubiegłego wieku stwierdzono stopniowe zwiększanie się zapadalności. Przyczyny tego zjawiska nie są jasne – bierze się pod uwagę suboptymalną skuteczność szczepień, redukcję liczby osób zakażonych w populacji (a przez to zmniejszenie częstości naturalnego kontaktu z antygenami bakterii i stymulacji komórek pamięci immunologicznej), zmiany struktury antygenowej szczepów bakterii.[12]
W Polsce zapadalność na krztusiec w latach 1950–1960 wynosiła rocznie 100–200/100 000, natomiast w latach 1981–1990 mniej niż 1/100 000. Jednak począwszy od 1998 roku, zaobserwowano wyraźne zwiększenie zapadalności do 6/100 000 (ryc.). Mimo to liczba zgonów z powodu krztuśca zmniejszyła się z 1000 w latach 50. do pojedynczych przypadków rejestrowanych w latach 80. XX wieku. Ostatni zgon z powodu krztuśca odnotowano w Polsce w 1991 roku.[13] Ciężki, typowy przebieg krztuśca dotyczy dzieci do ukończenia 1. roku życia. Zachorowania u starszych dzieci często wynikają z nieprawidłowego szczepienia (odraczanie lub niepełny schemat szczepień). Znaczny odsetek osób chorujących na krztusiec stanowią osoby po 20. roku życia, aczkolwiek publikowana zachorowalność jest najpewniej zaniżona, gdyż wyniki badań obejmujących chorych z przewlekłym napadowym kaszlem wykazują dużą częstość tego zakażenia.[14]
Obraz kliniczny
Objawy kliniczne są bardzo zróżnicowane, często niecharakterystyczne. Zależą od wieku chorego, indywidualnej odporności oraz czasu, jaki upłynął od szczepienia lub przebytego zakażenia. Okres wylęgania choroby wynosi 7–20 dni. Zakaźność jest największa w pierwszych 3 tygodniach choroby. U małych dzieci i osób nieszczepionych choroba przebiega w klasycznych trzech fazach, trwając 6–12 tygodni (tab. 1).
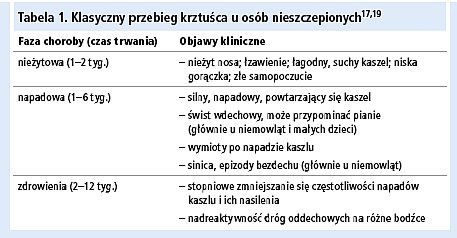
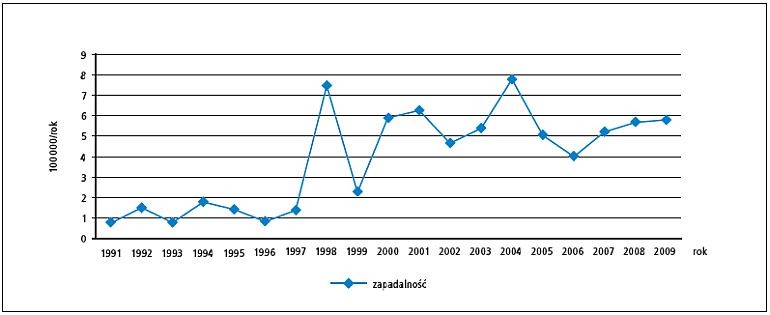
Ryc. Zapadalność na krztusiec w Polsce w latach 1991–2009 (na podstawie meldunków epidemiologicznych Zakładu Epidemiologii Narodowego Instytutu Zdrowia Publicznego Państwowego Zakładu Higieny w Warszawie13)
W badaniach laboratoryjnych charakterystyczna dla dwóch pierwszych faz jest leukocytoza z bezwzględną limfocytozą.[15]
U młodzieży i dorosłych choroba najczęściej przebiega łagodnie:
1) z przewlekłym, męczącym kaszlem utrzymującym się 36–48 dni, bez innych typowych objawów – sporadycznie obserwuje się ataki kaszlu kończące się głośnym wdechem lub wymiotami
2) kaszlowi zwykle towarzyszą: nadmierna potliwość, zaczerwienienie twarzy, spłycenie oddechu, omdlenia
3) do częstych objawów współistniejących, jednak mało swoistych, należą: gorączka, mrowienie i drętwienie w tylnej części gardła, zaburzenia snu, ból mięśni, ból głowy, kichanie oraz ogólne osłabienie.[16]
W badaniach przeprowadzonych wśród 257 pacjentów ze 121 rodzin z potwierdzonym zakażeniem pałeczką krztuśca, 79 (30,7%) stanowiły osoby dorosłe. Dominującym objawem w tej grupie był kaszel (trwający śr. 54 dni), który występował u 91% badanych. U 62 osób (80%) kaszel utrzymywał się dłużej niż 3 tygodnie, a jego napadowy charakter zaobserwowano u 63%, następujące po nim dławienie się i/lub wymioty u 53%, a "zanoszenie się" u 8% badanych. Zaburzenia snu związane z kaszlem zgłaszało 52% chorych. Dodatkowo u 14% chorych zaobserwowano napady pocenia się, u 37% objawy ze strony gardła, u 30% objawy grypopodobne, u 22% napady kichania, u 18% chrypkę, u 16% ból okolicy zatok, a u 14% ból głowy.[17,18]
Ryzyko wystąpienia powikłań zależy od wieku chorego i chorób współistniejących. Największe zagrożenie dotyczy niemowląt. Powikłania występują u 23–28% dorosłych (40% po 60. rż.), z których najczęstsze to: zapalenie płuc (10%), zapalenie oskrzeli lub zapalenie ucha środkowego. Może dojść do zmniejszenia masy ciała, powstania przepukliny, żylaków przełyku, odmy opłucnowej, krwawienia z nosa lub do spojówek, a także nietrzymania moczu (4–34%, szczególnie u kobiet po 50. rż.).[19-22]
Diagnostyka laboratoryjna i rozpoznawanie
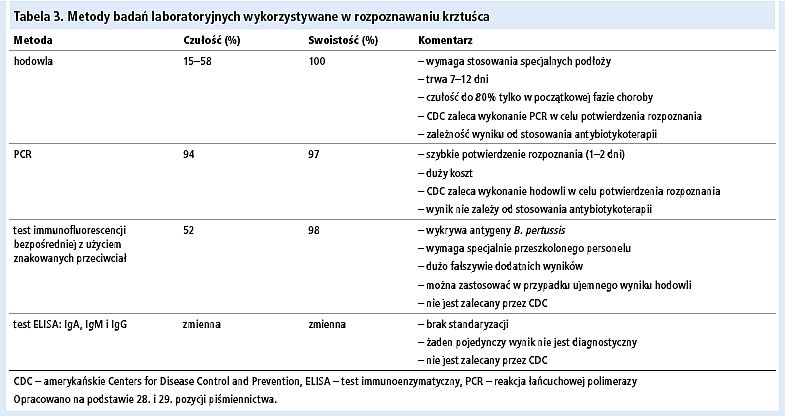
Diagnostyka laboratoryjna krztuśca jest trudna. Najbardziej dostępne są metody serologiczne wykrywające swoiste przeciwciała w surowicy, natomiast "złotym" standardem jest identyfikacja bakterii na podstawie hodowli, wykrycia DNA metodą PCR i reakcji immunofluorescencji bezpośredniej z użyciem znakowanych przeciwciał przeciwko B. pertussis.[23]
Warto podkreślić, że stwierdzenie typowego przebiegu choroby u pacjenta, który miał kontakt z chorym na krztusiec potwierdzony laboratoryjnie, jest równoznaczne z pewnym rozpoznaniem (kryterium epidemiologiczne) i nie wymaga potwierdzenia laboratoryjnego.
W odczynie hemaglutynacji biernej wykrywa się przeciwciała skierowane przeciwko antygenowi krztuścowemu (toksynie lipopolisacharydowej). Podstawą rozpoznania jest stwierdzenie 4-krotnego zwiększenia miana (stężenia) przeciwciał w 2 próbkach pobranych w odstępie co najmniej 2 tygodni.[24]
Diagnostyka na podstawie wykrycia przeciwciał klas IgG, IgM i IgA przeciwko toksynie krztuścowej lub hemaglutyninie włókienkowej w surowicy jest utrudniona.[20] Rozpoznanie opiera się na stwierdzeniu zwiększonego miana (stężenia) swoistych przeciwciał klasy IgA w pojedynczej próbce (po zakażeniu przeciwciała utrzymują się we krwi do kilku miesięcy). W przypadku przeciwciał klasy IgG konieczne jest wykazanie zwiększenia miana w 2 próbkach pobranych w odstępie co najmniej 2 tygodni. Dodatni wynik badania przeciwciał w klasie IgM może wskazywać na zachorowanie lub świadczyć tylko o kontakcie z bakterią albo być efektem niedawnego szczepienia (tab. 2).[25,26]

Diagnostyka laboratoryjna wiąże się z wieloma problemami wynikającymi z opóźnienia lub błędów podczas pobierania materiału, niewłaściwego transportu próbek, małego doświadczenia laboratorium w tego typu badaniach oraz względów ekonomicznych.[25]
Standardową metodą diagnostyczną jest hodowla bakterii. Wymaz należy pobrać z części nosowej gardła poprzez wprowadzenie do nozdrzy wymazówki zakończonej alginianem wapnia i pozostawieniu jej na kilka sekund w celu nawilżenia. Materiału do badań nie wolno natomiast pobierać za pomocą wymazówek wełnianych lub ze sztucznego jedwabiu, ponieważ są one toksyczne dla B. pertussis (wynik będzie więc fałszywie ujemny).[21] Materiał diagnostyczny należy niezwłocznie umieścić na podłożu transportowym (np. Regan-Lowe – podłoże z węgla drzewnego z dodatkiem 10% krwi końskiej i 40 mg/l cefalosporyny) lub bezpośrednio na świeżym podłożu Bordeta i Gengou[5] (krew zwierzęca, glicerol, wyciąg z ziemniaków, chlorek sodu). Izolacja, hodowla i identyfikacja bakterii trwa 7–12 dni.[19,25,26] Tak długi czas oczekiwania na wynik niestety zmniejsza kliniczną przydatność hodowli.
Szanse diagnostyczne zwiększa natomiast wykrywanie DNA bakterii w materiale pobranym z części nosowej gardła (wymaz) za pomocą metody PCR. Próbki należy pobrać wymazówką wykonaną z dakronu bądź sztucznego jedwabiu, ponieważ alginian wapnia oraz drewno hamują polimerazę używaną w metodzie PCR. Do inaktywacji inhibitorów używa się ditiotreitolu.[30] Metoda PCR niestety często daje wyniki fałszywie dodatnie. Związane jest to z małą swoistością w porównaniu z hodowlą. Aby zmniejszyć liczbę fałszywie dodatnich rozpoznań, w Stanach Zjednoczonych nie zaleca się zgłaszania zachorowań w przypadku dodatniego wyniku PCR, jeżeli kaszel utrzymywał się krócej niż 14 dni. Po 7 dniach leczenia skutecznym antybiotykiem u 56% pacjentów nadal uzyskiwano dodatni wynik PCR, podczas gdy wynik hodowli był ujemny.[5]
W badaniu obejmującym 3096 chorych (496 zakażonych B. pertussis) czułość hodowli w rozpoznawaniu krztuśca wynosiła 58%, a PCR – 97%. Swoistość hodowli, która jest "złotym" standardem, ocenia się na 100%, podczas gdy PCR na 93%. Wykazano, że przydatność poszczególnych metod diagnostycznych ma związek z wiekiem pacjenta. U dzieci w wieku od 6 miesięcy do 3 lat większą wartość miała PCR.[31] Ponieważ czułość PCR zmniejsza się wraz z czasem trwania kaszlu, badanie to należy wykonać do 4. tygodnia choroby. Materiał do hodowli należy natomiast pobrać w pierwszych 2 tygodniach trwania choroby. Badania wykonane po długim czasie trwania choroby charakteryzują się małą wartością diagnostyczną (tab. 3).[19,26]
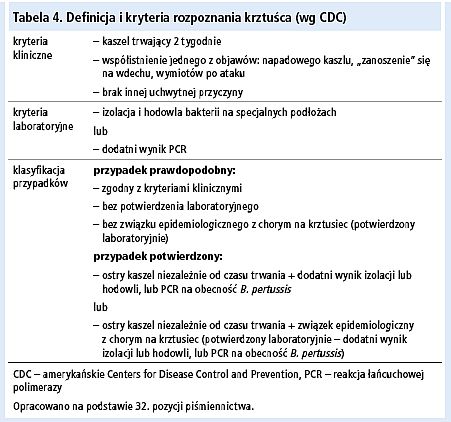
Ostateczne rozpoznanie krztuśca ustala się na podstawie wywiadu, obrazu i przebiegu klinicznego oraz wyników badań laboratoryjnych. Pomocne mogą być kryteria rozpoznania zalecane przez amerykańskie Centers for Disease Control and Prevention (tab. 4).
Rozpoznanie różnicowe
Ze względu na nieswoiste objawy kliniczne krztuśca w rozpoznaniu różnicowym należy uwzględniać wszystkie czynniki etiologiczne odpowiedzialne za zakażenia górnych dróg oddechowych. Przede wszystkim należy jednak brać pod uwagę zakażenia innymi gatunkami Bordetella, zwłaszcza B. parapertussis, która zwykle powoduje łagodniejszy przebieg choroby. Czynnikami chorobotwórczymi wywołującymi zakażenia układu oddechowego o podobnym obrazie klinicznym (dominuje przewlekły kaszel) są również: adenowirusy, wirusy RS (respiratory syncytial virus – RSV), wirusy grypy, Mycoplasma pneumoniae i Chlamydophila pneumoniae.[19]
Piśmiennictwo
1. Ward J.I., Cherry J.D., Chang S.J. i wsp.; APERT Study Group: Efficacy of an acellular pertussis vaccine among adolescents and adults. N. Engl. J. Med., 2005; 353:1555–1563
2. Cherry J.D., Grimprel E., Guiso N. i wsp.: Defining pertussis epidemiology clinical, microbiologic and serologic perspectives. Pediatr. Infect. Dis. J., 2005; 24: S25–S34
3. Mattoo S., Cherry JD.: Molecular pathogenesis, epidemiology, and clinical manifestations of respiratory infections due to Bordetella pertussis and other Bordetella subspecies. Clin. Microbiol. Rev., 2005; 8: 326–382
4. Mooi F.R., van Loo I.H.M., van Gent M. i wsp.: Bordetella pertusis Strain with Increased Toxin Production Associated with Pertussis Resurgence. Emerg. Infect. Dis., 2009; 15 (8): 1206–1212
5. Hewlett E.L.: Bordetella species. W: Principles and practice of infectious diseases. 6th ed. Oxford, United Kingdom, Churchill Livingstone, 2004: 2701–2708
6. Centers for Disease Control and Prevention: Epidemiology and prevention of vaccine-preventable disease: the pink book. 7th ed. Atlanta, 2003: 58–69
7. Bassinet L., Gueirard P., Maitre J. i wsp.: Role of adhesions and toxins in invasion of human tracheal epithelial cells by Bordetella pertussis. Infect. Immun., 2000; 68 (4): 1934–1941
8. Christopher F.L., Hepburn M.J., Frolichstein R.A.: Pertussis in a military and military beneficiary population: case series and review of the literature. Mil. Med., 2002; 167 (3): 215–218
9. Wendelboe A.M., Njamkepo E ., Bourillon A. i wsp.: Transmission of Bordetella pertussis to young infants. Pediatr. Infect. Dis. J., 2007; 26 (4): 283–289
10. Hellenbrand W., Beier D., Jensen E. i wsp.: The epidemiology of pertussis in Germany: past and prezent. BMC Infect. Dis., 2009; 9: 22–31
11. Wendelboe A.M., Van R.A., Salmaso S., Englund J.A.: Duration of immunity against pertussis after natural infection or vaccination. Pediatr. Infect. Dis. J., 2005; 24: 58–61
12. Galanis E ., King A.S., Varughese P., Halperin U.: Changing epidemiology and emerging risk groups for pertussis. CMAJ, 2006; 174: 451–452
13. Meldunki epidemiologiczne Narodowego Instytutu Zdrowia Publicznego Państwowego Zakładu Higieny, Warszawa, 2009
14. Gilberg S., Njamkepo E., Du Chatelt I.P. i wsp.: Evidence of Bordetella pertussis infections in adults presenting with persistent cough in a french area with very high whole-cell vaccine coverage. J. Infect. Dis., 2002; 186: 415–418
15. Prokopowicz D.: Zakażenia. Obraz kliniczny, rozpoznanie, leczenie. Białystok, Wyd. Ekonomia i Środowisko, 2004: 147–148
16. E dwards K., Freeman D.M.: Adolescent and adult pertussis: disease burden and prevention. Curr. Opin. Pediatr., 2006; 18: 77–80
17. Rothstein E ., Edwards K.: Health burden of pertussis in adolescents and adults. Pediatr. Infect. Dis. J., 2005; 24: 44–47
18. Postels-Multani S., Schmitt H.J., Wirsing von König C.H. i wsp.: Symptoms and complications of pertussis in adults. Infection, 1995; 23 (3): 139–142
19. Riffelmann M., Littmann M., Hellenbrand W. i wsp.: Pertussis: not only a disease of childhood. Dtsch. Arztebl. Int., 2008; 105 (37): 623–628
20. Greenberg D.P., von König C .H., Heininger U.: Health burden of pertussis in infants and children. Pediatr. Infect. Dis. J., 2005; 24: 39–43
21. De Serres G., Shadmani R., Duval B. i wsp.: Morbidity of pertussis in adolescents and adults. J. Infect. Dis., 2000; 182: 174–179
22. C rowcroft N.S., Booy R., Harrison T. i wsp.: Severe and unrecognized: pertussis in the UK. Arch. Dis. Child., 2003; 88: 802–809
23. Hewlett E .L.: Bordetella species. W: Mandell G.L., Bennett J.E., Dolin R., red.: Principles and practice of infectious diseases. 6th ed. Oxford, 2004: 2701–2708
24. Jóźwiak H., Wysocki J.: Krztusiec – nadal aktualny problem. Przew. Lek., 2006; 6: 72–76
25. Raguckas S.E., Van denBussche H.L., Jacobs C. i wsp.: Pertussis resurgence: diagnosis, treatment, prevention, and beyond. Pharmacotherapy, 2007; 27 (1): 41–52
26. Riffelmann M., Caro V., Guiso N. i wsp.: Consensus Group: Nucleic acid amplification tests for diagnosis of Bordetella infections. J. Clin. Microbiol., 2005; 43: 4925–4929
27. Wendelboe A.M., Van Rie A.: Diagnosis of pertussis: a historical review and recent developments. Expert Rev. Mol. Diagn., 2006; 6: 857–864
28. Gregory D.S.: Pertussis: a disease affecting all ages. Am. Fam. Physician, 2006; 74: 420–426
29. Loeffelholz M.J., Thompson C.J., Long K.S. i wsp.: Comparison of PCR, culture, and direct fluorescent-antibody testing for detection of Bordetella pertussis. J. C lin. Microbiol., 1999; 37: 2872–2876
30. Mattoo S., Cherry J.D.: Molecular pathogenesis, epidemiology, and clinical manifestations of respiratory infections due to Bordetella pertussis and other Bordetella subspecies. Clin. Microbiol. Rev., 2005; 18: 326–382
31. Dragsted D.M., Dohn B., Madsen J., Jensen J.S.: Comparison of culture and PCR for detection of Bordetella pertussis and Bordetella parapertussis under routine laboratory conditions. J. Med. Microbiol., 2004; 53: 749–754
32. Guidelines for the control of pertussis outbreaks. Centers for Disease Control and Prevention, 2006 (www.cdc.gov/nip/publications/pertussis/guide.htm)















