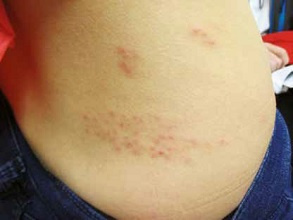
Reprinted with permission of Slack, Inc., www.slackinc.com from Trinidad Hasbún, Sarah L. Chamlin (2013). A 3-year-old girl with a painful skin eruption. Pediatric Annals, 42 (1): 8–10
Tłumaczyła lek. Aleksandra Margol-Szczerbicka
Skróty: VZV – wirus ospy wietrznej i półpaśca
Do poradni dermatologicznej zgłosili się rodzice z 3-letnią dziewczynką w celu oceny bolesnych wykwitów skórnych na jej prawym ramieniu i plecach. Poza zmianami skórnymi u dziecka nie występowały żadne objawy chorobowe. Wysypka utrzymywała się od 6 dni, pierwszą zmianą był pojedynczy pęcherzyk na czwartym palcu prawej dłoni. W ciągu kilku dni pojawiały się nowe wykwity – na prawej dłoni, przedramieniu, ramieniu i plecach. Wszystkie zmiany były bolesne i swędzące. Dziewczynka nie gorączkowała i ogólnie czuła się dobrze. Była szczepiona zgodnie z kalendarzem szczepień. W wywiadzie nie stwierdzono żadnych zaburzeń ze strony innych narządów. Wywiad rodzinny dotyczący występowania poważnych chorób również był ujemny.
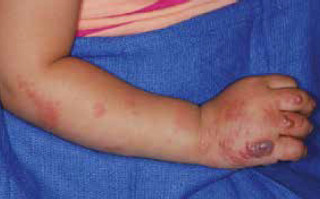
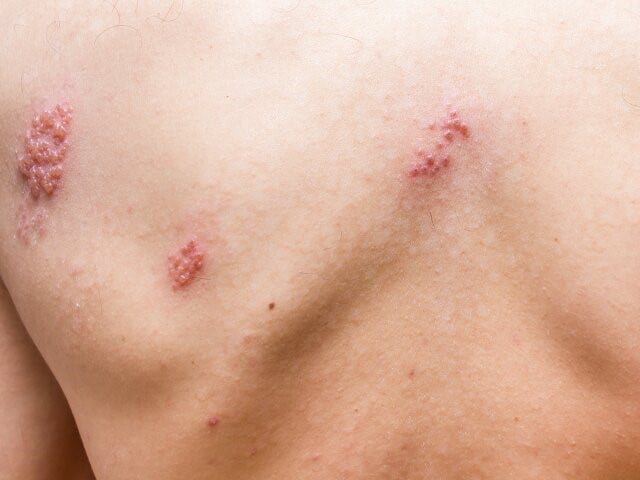
Ryc. 1. Ułożone linijnie rumieniowe grudki i skupiska pęcherzyków na rumieniowym podłożu na prawej kończynie górnej.
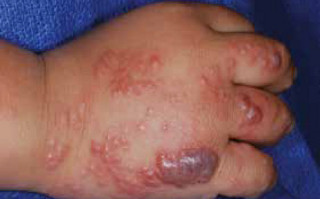
Ryc. 2. Rumieniowe grudki, pęcherzyki i pęcherze wypełnione krwią na prawej dłoni.
W badaniu przedmiotowym stwierdzono pojedyncze rumieniowe grudki, pęcherzyki oraz kilka wypełnionych krwią pęcherzy na trzecim i piątym palcu dłoni, na przedramieniu i ramieniu oraz liczne grupy pęcherzyków na rumieniowym podłożu (ryc. 1. i 2.). Nie stwierdzono innych zmian skórnych ani powiększenia pachwinowych węzłów chłonnych.
Rozpoznanie
Półpasiec (Herpes zoster)Dyskusja
Herpes zoster, potocznie nazywany półpaścem, jest ostrą osutką pęcherzykową ograniczoną do jednego dermatomu, która rozwija się w wyniku reaktywacji latentnego wirusa ospy wietrznej i półpaśca (VZV) w zwojach czuciowych korzeni grzbietowych. Najczęściej występuje u dorosłych, zwłaszcza u osób w podeszłym wieku lub z upośledzoną odpornością, ale może również dotyczyć dzieci.
Według dostępnych danych półpasiec występuje jedynie u 1,1 dziecka do 14. roku życia na 1000 osobolat.1 Do czynników ryzyka zachorowania w wieku dziecięcym należą: nowotwór złośliwy lub inne stany przebiegające z upośledzeniem odporności, pierwotne zakażenie VZV przed ukończeniem 1. roku życia oraz zachorowanie matki dziecka na ospę wietrzną w II trymestrze ciąży.2,3 Funaki i wsp.4 opisali wystąpienie półpaśca u 0,07% dzieci będących biorcami narządów lub chorych na nowotwory złośliwe do 9. roku życia.
W 1995 roku do amerykańskiego programu szczepień zdrowych dzieci i dorosłych podatnych na zakażenie VZV włączono atenuowaną szczepionkę przeciwko ospie wietrznej. Pojawiły się wtedy obawy o zwiększenie ryzyka wystąpienia półpaśca związanego ze szczepieniem, szczególnie wśród dzieci z upośledzoną odpornością. Częstość występowania półpaśca była przedmiotem badania obejmującego 548 dzieci chorych na ostrą białaczkę limfoblastyczną, które otrzymały szczepionkę przeciwko VZV. W okresie obserwacji trwającym średnio 4,1 roku półpasiec wystąpił u 13 z nich (2,4%). Na podstawie analizy przeprowadzonej w podgrupach uczestników badania, która polegała na porównaniu 96 zaszczepionych dzieci z dziećmi po przebyciu naturalnego zakażenia VZV, wykazano rzadsze występowanie półpaśca w grupie dzieci szczepionych (4 przypadki w grupie szczepionej i 15 w grupie naturalnego zakażenia).5
Najnowsze dane również wskazują, że zmniejszenie liczby zachorowań na ospę wietrzną wynikające z powszechnego stosowania szczepień nie wpłynęło na zwiększenie częstości występowania półpaśca w populacji ogólnej.6,7
Do objawów klinicznych półpaśca należy jednostronny ból, przeczulica oraz tkliwość przy dotyku, które pojawiają się 4 dni do 2 tygodni przed wystąpieniem zmian w zajętej okolicy lub okolicach. W dalszej kolejności pojawia się jednostronna pęcherzykowa osutka obejmująca na ogół skórę jednego dermatomu unerwianego przez jeden lub więcej nerwów czuciowych. Pierwszymi wykwitami są rumieniowe grudki, które szybko ewoluują w skupiska pęcherzyków na rumieniowym podłożu, ułożonych zgodnie z unerwieniem dermatomu. W kolejnych dniach pęcherzyki pękają, przekształcając się w pokryte strupem nadżerki. Wykwity pojawiają się w ciągu 7 dni, a pokrywają się strupem w ciągu 14–21 dni.
Najczęściej zajęte są dermatomy klatki piersiowej. Osutka zazwyczaj obejmuje jeden dermatom. Możliwe jest jednak zajęcie ich większej liczby – szczególnie u chorych z niedoborami odporności,8 u których jednocześnie występuje zwiększone ryzyko wiremii, zajęcia narządów wewnętrznych i większej rozległości zmian9.
Rozpoznanie zazwyczaj ustala się na podstawie obrazu klinicznego. W razie niejednoznacznych objawów klinicznych wskazane jest laboratoryjne potwierdzenie zakażenia. W tym celu można zlecić hodowle wirusów, testy immunofluorescencji bezpośredniej lub polimerazową reakcję łańcuchową (PCR). Ostatnio w identyfikowaniu VZV przydatne okazało się badanie próbek zmian skórnych za pomocą PCR wewnętrznej (nested PCR) lub w czasie rzeczywistym (real-time PCR), które cechuje szybsza amplifikacja i większa czułość.10,11
Obraz kliniczny w pełni rozwiniętego półpaśca jest charakterystyczny. W diagnostyce różnicowej nietypowych postaci oraz u chorych z niedoborami odporności należy uwzględnić inne choroby zakaźne – zakażenie wirusem Herpes simplex, szczególnie w przypadku lokalizacji w okolicy krzyżowej, oraz liszajec pęcherzowy. Należy również rozważyć alergiczne kontaktowe zapalenie skóry wywoływane na przykład sokiem roślin z rodzaju Toxicodendron (np. sumak jadowity, nie występuje w Polsce – przyp. tłum.).
U dzieci choroba zwykle przebiega łagodniej, utrzymując się średnio przez 1–3 tygodni. Możliwe powikłania obejmują: wtórne zakażenie bakteryjne, opryszczkowe zapalenie rogówki, nerwoból popółpaścowy (rzadki u dzieci), zapalenie opon mózgowo-rdzeniowych i mózgu, porażenie nerwu twarzowego oraz rozsiew skórny. W 1 badaniu powikłania obserwowano u 115 (47%) z 244 dzieci hospitalizowanych z powodu półpaśca. Do najczęstszych powikłań należało nadkażenie skóry, półpasiec oczny, półpasiec uszny oraz zapalenie mózgu i opon mózgowo-rdzeniowych.12
Brakuje jednoznacznych opinii dotyczących stosowania leków przeciwwirusowych w leczeniu półpaśca u dzieci. Na ogół nie zaleca się ich stosowania, jeśli choroba ma niepowikłany przebieg. Leczenie można jednak rozważyć u dzieci i nastolatków bez zaburzeń odporności z jednoczesnym ciężkim przebiegiem choroby, zajęciem dużego obszaru skóry lub obszaru unerwionego przez pierwszą gałąź nerwu trójdzielnego.8 Leczenie należy rozpocząć w ciągu 72 godzin od wystąpienia zmian skórnych.
Lekiem pierwszego wyboru w zakażeniu VZV u dzieci pozostaje acyklowir, mimo że na rynku dostępnych jest wiele preparatów przeciwwirusowych. Nie ustalono dokładnej dawki w leczeniu półpaśca u dzieci, zwyczajowo jednak stosuje się 20–40 mg/kg mc. 4 razy/24 h. Chorzy z upośledzoną odpornością mogą wymagać dożylnego podawania leku.13,14
Zapamiętaj!*
- Półpasiec rzadko dotyczy dzieci do 14. roku życia (1,1/1000 osobolat). Do czynników ryzyka zachorowania należą: nowotwór złośliwy, upośledzenie odporności, pierwotne zakażenie VZV przed ukończeniem 1. roku życia oraz zachorowanie na ospę wietrzną matki dziecka w II trymestrze ciąży.
- Szczepienie przeciwko VZV zmniejsza ryzyko wystąpienia półpaśca u zaszczepionych dzieci, nie zwiększając liczby zachorowań na półpasiec w populacji ogólnej.
- Wykwity półpaścowe pojawiają się w ciągu 7 dni, a w ciągu 14–21 dni pokrywają się strupem. Najczęściej są ograniczone do 1 dermatomu.
- Powikłania u dzieci obejmują: wtórne zakażenie bakteryjne, zapalenie rogówki, nerwoból popółpaścowy (rzadko), zapalenie opon mózgowo-rdzeniowych i mózgu, porażenie nerwu twarzowego i rozsiew skórny.
- U dzieci i nastolatków bez zaburzeń odporności z ciężkim przebiegiem choroby, z zajęciem dużego obszaru skóry lub obszaru unerwionego przez pierwszą gałąź nerwu trójdzielnego można rozważyć zastosowanie leków przeciwwirusowych (w ciągu 72 h).
* Od Redakcji
Zobacz także: List do Redakcji. Szczepienie przeciwko ospie wietrznej a ryzyko półpaśca
Piśmiennictwo
1. Insinga R.P., Itzler R.F., Pellissier J.M. et al.: The incidence of herpes zoster in a United
States administrative database. J. Gen. Intern. Med., 2005; 20: 748–753
2. Guess H.A., Broughton D.D., Melton L.J., Kurland L.T.: Epidemiology of herpes zoster
in children and adolescents: a population-based study. Pediatrics, 1985; 76: 512–517
3. Baba K., Yabuuchi H., Takahashi M., Ogra P.: Increased incidence of herpes zoster in
normal children infected with varicella zoster virus during infancy: community-based
follow up study. J. Pediatr., 1986; 108 (3): 372–377
4. Funaki B., Elpern D.J.: Herpes zoster incidence in younger age groups. J. Am. Acad.
Dermatol., 1987; 16: 883–884
5. Hardy I., Gershon A.A., Steinberg S.P., LaRussa P.: The Incidence of zoster after immunization with live attenuated varicella vaccine – a study in children with leukemia. N. Engl. J. Med., 1991; 325: 1545–1550
6. Jumaan A., Onchee Y., Jackson L. et al.: Incidence of herpes zoster, before and after
varicella-vaccination-associated decreases in the incidence of varicella, 1992–2002.
J. Infect. Dis., 2005; 191 (12): 2002–2007
7. Hambleton S., Steinberg S.P., LaRussa P.S. et al.: Risk of herpes zoster in adults immmunized with varicella vaccine. J. Infect. Dis., 2008; 197 (suppl. 2): 196–199
8. Nikkels A.F., Nikkels-Tassoudji N., Piérard G.E.: Revisiting childhood herpes zoster.
Pediatr. Dermatol., 2004; 21 (1): 18–23
9. Gnann J.W., Varicella-zoster virus: atypical presentations and unusual complications.
J. Infect. Dis., 2002; 186 (suppl. 1): 91–98
10. Weinberg J.: Herpes zoster: epidemiology, natural history, and common complications.
J. Am. Acad. Dermatol., 2007; 57 (6 suppl.): 130–135
11. Schmutzhard J., Riedel H.M., Wirgart B.Z., Grillner L.: Detection of herpes simplex virus
type 1, herpes simplex virus type 2 and varicella-zoster virus in skin lesions: comparison
of real-time PCR, nested PCR and virus isolation. J. Clin. Virol., 2004; 29: 120–126
12. Grote V., Von Kries R., Rosenfeld E., et al.: J: Immunocompetent children account for
the majority of complications in childhood herpes zoster. J. Infect. Dis., 2007; 196: 1455–1458
13. Kakourou T., Theodoridou M., Mostrou G., et al.: Herpes zoster in children. J. Am. Acad.
Dermatol. 1998; 39: 207–210
14. Arvin A.M.: Management of varicella-zoster virus infections in children. Adv. Exp. Med.
Biol. 1999; 458: 167–174