Monitorowanie leczenia. W trakcie leczenia remdesiwirem należy regularnie wykonywać odpowiednie badania laboratoryjne, w tym oceniać biochemiczne parametry czynności wątroby. Regularnie należy monitorować również eGFR, zwłaszcza u chorych, u których jeszcze przed rozpoczęciem leczenia remdesiwirem stwierdzono zaburzenia czynności nerek. W przypadku eGFR <30 ml/min należy rozważyć zaprzestanie podawania leku, a chorych należy uważnie monitorować do czasu powrotu eGFR do wartości wyjściowych lub ustalenia przyczyny takiej zmiany parametru.
Działania niepożądane, interakcje leku i ostrzeżenia dotyczące jego stosowania. Nie poznano jeszcze pełnego profilu bezpieczeństwa remdesiwiru, ale znane jest ryzyko hepatotoksyczności związane z jego stosowaniem. W przeprowadzonych dotąd badaniach klinicznych zaobserwowano przemijające zwiększenie aktywności ALT i AST (zarówno po podaniu pojedynczej dawki 225 mg remdesiwiru, jak i po stosowaniu leku w dawce 150 mg/d przez 14 dni) z towarzyszącym łagodnym, przemijającym wydłużeniem PT u niektórych pacjentów, ale bez klinicznie istotnego wpływu na INR lub innych objawów ze strony wątroby.
W przeprowadzonych dotąd badaniach klinicznych nie zaobserwowano objawów nefrotoksyczności remdesiwiru podawanego w pojedynczej dawce do 225 mg lub w dawce 150 mg 1 ×/d stosowanej przez 14 dni. Brak danych dotyczących przenikania remdesiwiru do mleka matki oraz jego wpływu na płodność ludzi.
Chociaż badania in vitro wskazują, że remdesiwir jest substratem CYP2C8, CYP2D6 i CP3A4, nie przeprowadzono dotąd badań klinicznych interakcji z innymi lekami, w tym stosowanymi w leczeniu COVID-19.
Charakterystyka farmakologiczna remdesiwiru
Remdesiwir (określany również kodem GS-5734) jest analogiem adenozyny o działaniu przeciwwirusowym. Jest prolekiem, który wewnątrz komórek ulega przekształceniu do związku oznaczonego jako GS-441524, a ten szybkiemu metabolizmowi do aktywnego metabolitu – farmakologicznie czynnego trifosforanu (GS-443902; ryc.). GS-443902 będąc strukturalnym analogiem ATP, jest w jego miejsce wykorzystywany przez wirusową polimerazę RNA, co blokuje jej aktywność i prowadzi do przedwczesnego zakończenia syntezy łańcucha RNA, a w konsekwencji do zahamowania replikacji wirusa.
W przeprowadzonych dotąd badaniach in vitro (w hodowli komórkowej) lub na zwierzętach remdesiwir wykazywał działanie przeciwko wielu wirusom RNA, w tym z rodzin Coronaviridae (takim jak SARS-CoV, MERS-CoV czy szczepy wirusów pochodzących od nietoperzy, zdolnych do zakażenia ludzkich komórek nabłonka oddechowego), Paramyxoviridae (takim jak wirusy Nipah, RSV i Hendra) oraz Filoviridae (np. wirusy gorączek krwotocznych ebola i marburg). Dane dotyczące aktywności remdesiwiru wobec SARS-CoV-2 są obecnie ograniczone do kilku obserwacji in vitro oraz stanowią rezultat ekstrapolowania wyników badań nad podobnymi koronawirusami SARS i MERS.
Remdesiwir pozostaje nadal lekiem eksperymentalnym, w fazie badań. Opracowany pierwotnie w celu leczenia gorączki krwotocznej ebola, okazał się nieskuteczny podczas epidemii tej choroby w Demokratycznej Republice Konga w 2019 roku. Nie zdefiniowano jego profilu bezpieczeństwa, ani nie potwierdzono dotąd skuteczności w żadnym wskazaniu. Nie jest również dopuszczony do obrotu w żadnym państwie.
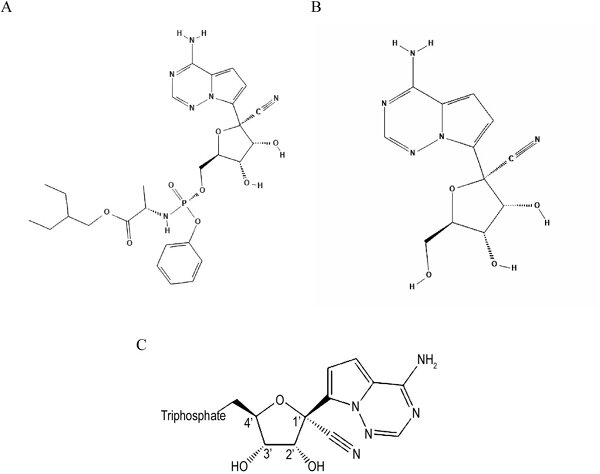
Ryc. Struktury chemiczne: A – remdesiwir (prolek); B – GS-441524 (metabolit pośredni); C – aktywny metabolit GS-443092 (Amirian S.E., Levy J.K.: Current knowledge about the antivirals remdesivir [GS-5734] and GS-441524 as therapeutic options for coronaviruses”, One Health, 2020; 9 1001282)
Piśmiennictwo:
1. Komunikat z 03.04.2020 „EMA provides recommendations on compassionate use of remdesivir for COVID-19” https://www.ema.europa.eu/en/news/ema-provides-recommendations-compassionate-use-remdesivir-covid-19 [dostęp 08.04.2020]2.Informacja nt. procedury „compassionate use” https://www.ema.europa.eu/en/human-regulatory/research-development/compassionate-use [dostęp 08.04.2020]
3. Dokument z 03.04.2020 „Summary on compassionate use Remdesivir Gilead” https://www.ema.europa.eu/en/documents/other/summary-compassionate-use-remdesivir-gilead_en.pdf [dostęp 08.04.2020]
4. Dokument z dn. 03.04.2020 „Conditions of use, conditions for distribution and patients targeted and conditions for safety monitoring adressed to member states for remdesivir available for compassionate use” https://www.ema.europa.eu/en/documents/other/conditions-use-conditions-distribution-patients-targeted-conditions-safety-monitoring-adressed_en-2.pdf [dostęp 08.04.2020]
5. Amirian S.E., Levy J.K.: Current knowledge about the antivirals remdesivir (GS-5734) and GS-441524 as therapeutic options for coronaviruses”, One Health 9 (2020) 1001282 https://doi.org/10.1016/j.onehlt.2020.100128 [dostęp 8.04.2020]
6. Informacje opublikowane na stronie internetowej Gilead Science: https://www.gilead.com/purpose/advancing-global-health/covid-19 [ostatnia aktualizacja: 4.04.2020; dostęp: 8.04.2020]
7. Rozporządzenie (WE) nr 726/2004 PE i RE z dn. 31.03.2004 ustanawiające wspólnotowe procedury wydawania pozwoleń dla produktów leczniczych stosowanych u ludzi i do celów weterynaryjnych i nadzoru nad nimi oraz ustanawiające Europejską Agencję Leków https://eur-lex.europa.eu/legal-content/PL/TXT/PDF/?uri=CELEX:32004R0726&from=PL [dostęp 8.04.2020]
8. Ustawa z dn. 6.09.2001 Prawo farmaceutyczne, z późn. zm., tekst ujednolicony.



















