Tłumaczył: dr n. med. Dariusz Stencel
Skróty: EBLV-1 – europejski wirus wścieklizny nietoperzy typu 1, EBLV-2 – europejski wirus wścieklizny nietoperzy typu 2, EOG – Europejski Obszar Gospodarczy, RABV – wirus wścieklizny, UE – Unia Europejska
Streszczenie
Wścieklizna jest chorobą enzootyczną w >100 krajach na całym świecie. Zdecydowana większość zachorowań na wściekliznę u ludzi w krajach UE/EOG występuje na skutek pogryzienia przez psy u osób podróżujących do krajów, w których choroba ta ma charakter enzootyczny, najczęściej w Azji i Afryce. W związku z tym mieszkańcy UE/EOG odwiedzający takie kraje powinni być świadomi ryzyka zakażenia podczas fizycznego kontaktu ze zwierzętami z gromady ssaków. Przed ekspozycją należy rozważyć poddanie się szczepieniu ochronnemu zgodnie z zaleceniami WHO, natomiast osoby niezaszczepione w przypadku ugryzienia lub zadrapania przez ssaki powinny niezwłocznie zasięgnąć porady lekarza. W większości krajów UE/EOG wścieklizna u ssaków nie występuje, dlatego do 2020 r. udało się ją wyeliminować (brak enzootycznego występowania wirusa i mała liczba przywleczonych zachorowań). Nielegalny import potencjalnie zarażonych zwierząt, głównie psów, stanowi jednak zagrożenie dla zdrowia publicznego i eliminacji wścieklizny. Pojawiło się też dodatkowe niebezpieczeństwo, jakim są nowo odkryte lyssawirusy występujące u nietoperzy, ponieważ szczepionka przeciwko wściekliźnie może nie zapewniać odporności na zakażenie tymi drobnoustrojami. Działania wspierające przygotowanie krajów UE/EOG do skutecznego zapobiegania zakażeniom powinny obejmować opracowanie odpowiednich wytycznych dotyczących oceny i zarządzania ryzykiem, jakie dla zdrowia publicznego stanowi nie tylko wścieklizna, ale i zakażenia wywołane innymi lyssawirusami.Wprowadzenie
Wścieklizna jest wirusową chorobą odzwierzęcą (zoonozą), występującą enzootycznie w >100 krajach na całym świecie.1 Z powodu wścieklizny rocznie umiera około 59 000 ludzi, przy czym 95% zgonów odnotowuje się w Azji i Afryce. Obraz kliniczny choroby jest szeroki i obejmuje objawy nadpobudliwości oraz porażenia. W przypadku braku profilaktyki śmiertelność wynosi blisko 100%.1
Wirus wścieklizny (RABV) z rodzaju Lyssavirus jest obecny w ślinie zakażonych zwierząt do 10 dni przed wystąpieniem objawów. Przenosi się poprzez kontakt śliny zwierzęcia z raną (np. po ugryzieniu lub zadrapaniu) lub powierzchnią błony śluzowej (np. poprzez lizanie).1,2 Zgony z powodu wścieklizny u mieszkańców Azji i Afryki są prawie wyłącznie wynikiem przenoszenia wirusa przez psy, natomiast w obu Amerykach za zgony odpowiada głównie RABV występujący u nietoperzy.1 Odnotowano też przypadki przeniesienia zakażenia z człowieka na człowieka, którego źródłem byli zakażeni dawcy narządów i tkanek.3
Dostępne są bezpieczne i skuteczne szczepionki dla ludzi, które można stosować w ramach profilaktyki przedekspozycyjnej i poekspozycyjnej. Światowa Organizacja Zdrowia (WHO) zaleca profilaktykę przedekspozycyjną u osób: (1) narażonych na duże ryzyko zakażenia RABV i innymi lyssawirusami w związku z wykonywaniem zawodu lub podejmowaniem innych aktywności (np. pracownicy służb weterynaryjnych, grotołazi) oraz (2) podróżujących do odległych regionów, gdzie nie można zagwarantować szybkiego dostępu do odpowiedniej profilaktyki poekspozycyjnej lub gdzie istnieje duże ryzyko kontaktu z dzikimi zwierzętami, zwłaszcza nietoperzami.1 Postępowanie w ramach profilaktyki poekspozycyjnej, obejmujące dokładne przemycie i przepłukanie rany, natychmiastowe rozpoczęcie szczepienia poekspozycyjnego oraz podanie immunoglobulin, jeśli są do tego wskazania, zależy od rodzaju kontaktu ze zwierzęciem podejrzanym o wydalanie lyssawirusa. Szybka i właściwa profilaktyka zapewnia przeżycie blisko 100% narażonych osób.1
Celem niniejszego artykułu dotyczącego zachorowań na wściekliznę u ludzi zamieszkujących w krajach Unii Europejskiej/Europejskiego Obszaru Gospodarczego (UE/EOG) jest: (1) przedstawienie aktualnej sytuacji epidemiologicznej wścieklizny u ludzi i zwierząt w UE/EOG, (2) zwrócenie uwagi na ryzyko u podróżnych w skali globalnej i lokalnej, (3) przedstawienie dostępnych metod zapobiegania zachorowaniom i związane z tym wyzwania dla poszczególnych krajów oraz (4) przedstawienie działań nadzorujących i przygotowawczych. Autorzy skupili się głównie na wściekliźnie, ale krótko omówili też ryzyko związane z innymi lyssawirusami.
Zachorowania na wściekliznę u ludzi
Na podstawie danych zebranych przez European Centre for Disease Prevention and Control (ECDC) oraz niesystematycznego przeglądu piśmiennictwa ustalono, że w latach 2006–2019 w krajach UE/EOG odnotowano 18 przypadków wścieklizny związanych z podróżami, a liczba zachorowań w poszczególnych latach wahała się od 0 (w 2015 r.) do 4 (w 2019 r.) – p. tabela 1. Szczegółowe wyniki wyszukiwania danych przedstawiono w materiałach dodatkowych. Średnia wieku chorych wynosiła 44 lata (przedział międzykwartylowy: 38–55 lat), a stosunek kobiet do mężczyzn 0,6:1. We wszystkich przypadkach do zakażenia doszło w krajach, w których wścieklizna występuje enzootycznie. Średni okres inkubacji wynosił około 5 miesięcy. Wszystkie osoby zmarły z powodu zakażenia.
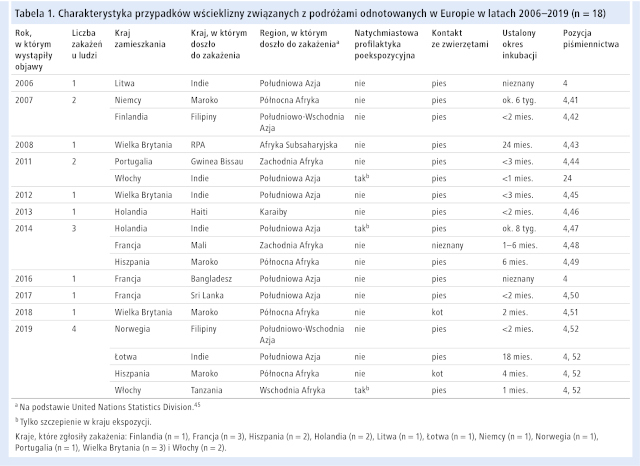
Siedem zachorowań związanych z podróżami było następstwem zakażeń w Południowej Azji (Indie, Bangladesz, Sri Lanka), 4 zakażenia miały miejsce w Północnej Afryce (Maroko), 2 w Zachodniej Afryce (Mali, Gwinea Bissau), 2 w Południowo-Wschodniej Azji (Filipiny), 1 we Wschodniej Afryce (Tanzania), 1 w Afryce Subsaharyjskiej (RPA) i 1 na Karaibach (Haiti). W 16 przypadkach do zakażenia doszło wskutek ugryzienia przez psa, a w 2 – przez kota. Zgodnie z wiedzą autorów, w żadnym przypadku nie zastosowano profilaktyki przedekspozycyjnej. Piętnaście zakażonych osób nie otrzymało profilaktyki natychmiast po ekspozycji, a w 3 przypadkach profilaktyka poekspozycyjna, którą wdrożono w kraju zakażenia, była niepełna (tzn. nie podano immunoglobulin).
Ponadto w analizowanym okresie we Francji i Rumunii odnotowano przypadki wścieklizny nabytej lokalnie (niezwiązane z podróżą). W 2008 roku we Francji wykryto zakażenie u osoby mieszkającej na stałe na terytorium Gujany Francuskiej.4 Do 2012 roku w Rumunii rejestrowano średnio 1 zachorowanie rocznie – wtedy doszło do ostatniego lokalnego zakażenia w tym kraju.4
Zachorowania na wściekliznę u zwierząt
Wścieklizna u ssaków lądowych
Głównym rezerwuarem RABV w Europie jest lis rudy (Vulpes vulpes).5 W większości krajów UE/EOG wściekliznę u psów wyeliminowano na przełomie XIX i XX wieku. Po zakończeniu sukcesem działań ukierunkowanych na zwierzęta domowe w latach 40. XX wieku wybuchła epidemia wśród lisów rudych, będąca wynikiem przeniesienia wirusa ze zwierząt domowych na dzikie.6 Próby przerwania rozprzestrzeniania się wirusa poprzez zmniejszenie populacji lisa rudego poniżej wartości progowej (w celu zahamowania przenoszenia wewnątrzgatunkowego) nie powiodły się, ponieważ nie osiągnięto zakładanej liczebności.7
Po wielu udanych badaniach nad szczepionkami, pod koniec lat 80. XX wieku w krajach UE rozpoczęto szeroko zakrojoną akcję doustnych szczepień lisów rudych przeciwko wściekliźnie. UE wspierała te działania politycznie i finansowo, a akcją szczepień objęto także niektóre kraje sąsiadujące z UE od wschodu i południowego wschodu (tab. 2.).8,9 Do czasu rozpoczęcia tej kampanii niektóre kraje EOG, takie jak Islandia i Norwegia kontynentalna, wyeliminowały wściekliznę w populacji lisów rudych. Szczepienia w Liechtensteinie nie były współfinansowane przez UE, ale kraj ten rozpoczął akcję szczepień wspólnie ze Szwajcarią i w 1986 roku uzyskał status kraju wolnego od wścieklizny.10
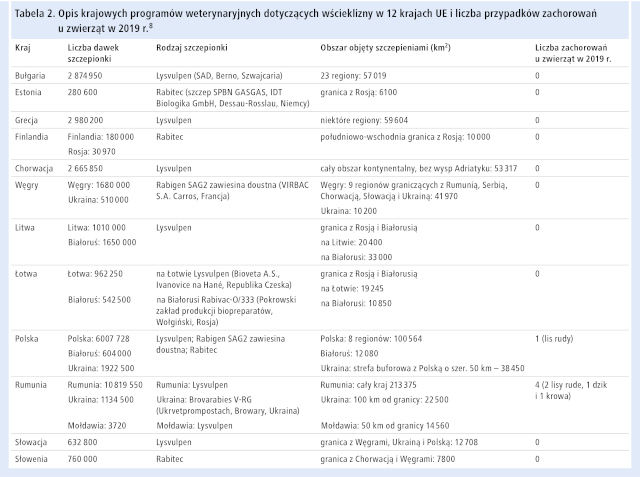
Akcje szczepień doustnych przeciwko wściekliźnie okazały się niezwykle skutecznym sposobem zwalczania zakażeń w populacji lisów rudych. W 2019 roku odnotowano niewielką liczbę przypadków wścieklizny u zwierząt na obszarze UE/EOG, wszystkie w krajach Europy Wschodniej, a do 2020 roku wyeliminowano wściekliznę u ssaków (brak enzootycznej cyrkulacji wirusa i mała liczba zawleczonych zachorowań).11 W latach 2010–2019 największy odsetek zakażonych zwierząt stanowiły lisy rude (tab. 3.). Na przestrzeni lat obserwowano stopniowe zmniejszanie się ogólnej liczby zachorowań u tego gatunku. Od 2017 roku całkowita roczna liczba przypadków wścieklizny utrzymuje się <10, a zgłoszenia zakażeń pochodzą tylko z 4 krajów UE: Litwy, Rumunii, Polski i Węgier.11 Wściekliznę wykryto też wśród lisów arktycznych na wyspach Svalbard i Jan Mayen należących do Norwegii.
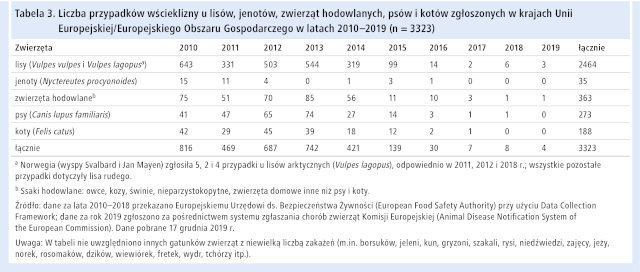
W 2019 roku odnotowano 5 przypadków wścieklizny u zwierząt – 4 w Rumunii (2 u lisów rudych, po 1 u krowy i dzika) i 1 w Polsce (u lisa rudego).12 Zakażenie w Polsce wykryto w pobliżu granicy z Białorusią i Ukrainą. W Rumunii 1 lisa rudego znaleziono w pobliżu granicy z Węgrami i Ukrainą, a pozostałe zakażenia u zwierząt wykryto w pobliżu granicy z Mołdawią. W 2019 roku na Ukrainie odnotowano 260 przypadków wścieklizny u zwierząt domowych – 101 u psów i 138 u kotów – oraz 262 przypadki u dzikich zwierząt, w tym 232 u lisów rudych. Nie ma żadnych danych dotyczących Mołdawii i Białorusi.
Wścieklizna u nietoperzy
Nie wykryto wirusa wścieklizny u nietoperzy bytujących w Europie. Zakażenia nietoperzy odnotowano na innych kontynentach, a w obu Amerykach są one głównym źródłem zakażeń u ludzi.13,14
Zakażenia innymi lyssawirusami
Na obszarze UE/EOG i w krajach sąsiadujących z UE wykrywano lyssawirusy inne niż RABV. Głównym rezerwuarem europejskiego wirusa wścieklizny nietoperzy typu 1 (EBLV-1) i 2 (EBLV-2) są nietoperze, rzadko wiązano go z zakażeniami innych zwierząt i ludzi. W 2018 roku wykryto łącznie 45 przypadków zakażenia EBLV-1 i EBLV-2 u nietoperzy we Francji, Niemczech, na Węgrzech, w Holandii, Polsce, Hiszpanii i Wielkiej Brytanii.15 EBLV-1 wykryto u owiec w Danii,16 kuny domowej w Niemczech17 oraz u kotów we Francji.18
W Europie odnotowano dotychczas 4 zgony u ludzi wywołane zakażeniem EBLV-1 i EBLV-2: na Ukrainie (1977 r.), w Rosji (1985 r.), Finlandii (1985 r.) i Wielkiej Brytanii (2002 r.).19
Jak dotąd w UE/EOG i krajach sąsiednich wykryto 4 inne gatunki wirusa wścieklizny nietoperzy: lyssawirus nietoperza Bokeloh (BBLV), lyssawirus nietoperza Lleida (LLEBV), lyssawirus nietoperza zachodnio-kaukaskiego i lyssawirus nietoperza Kotalahti (KBLV, wstępne określenie gatunku). Jak dotąd nie odnotowano zakażenia u ludzi wywołanego którymkolwiek z tych 4 gatunków lyssawirusa nietoperzy.20 W 2020 roku we Włoszech po raz pierwszy uzyskano pozytywny wynik testu w kierunku lyssawirusa nietoperza zachodnio-kaukaskiego u kota, u którego podejrzewano kontakt z nietoperzami.21
Ponadto w 2007 roku w Holandii stwierdzono 1 zgon z powodu zakażenia lyssawirusem Duvenhage u osoby ugryzionej przez nietoperza w trakcie pobytu w Parku Narodowym Tsavo West w Kenii.22
Ryzyko związane z zakażeniem wirusem wścieklizny
Ryzyko dla podróżnych odwiedzających obszary enzootyczne wścieklizny
W większości krajów UE/EOG wścieklizna stała się chorobą podróżnych, nabytą wskutek ugryzienia lub zadrapania przez psy lub koty w krajach, w których wścieklizna występuje w sposób niekontrolowany u obu gatunków tych zwierząt. W 2019 roku w krajach UE/EOG zgłoszono 4 przypadki wścieklizny u ludzi związane z podróżami. Jest to największa liczba zachorowań odnotowanych w ciągu roku, ale oznacza jedynie niewielkie zwiększenie w porównaniu z 2014 rokiem, w którym zgłoszono 3 przypadki. Uważa się, że to niewielkie zwiększenie nie wynika ze zmiany ryzyka dla podróżnych, ponieważ w krajach, w których doszło do zakażeń, w ostatnim czasie nie obserwowano zwiększenia zachorowalności na wściekliznę. W opinii autorów 4 zachorowania odnotowane w 2019 roku mogą jednak wskazywać, że podróżni z krajów UE/EOG są nieświadomi ryzyka, na co zwracali uwagę Marano i wsp.23
Na podstawie przedstawionych danych można wyróżnić dwie grupy osób potencjalnie narażonych na większe ryzyko zakażenia i/lub zachorowania na wściekliznę: (1) osoby zajmujące się szczeniętami i kociętami, które nie widzą w tym zagrożenia dla siebie oraz (2) osoby pogryzione lub podrapane przez psy lub koty, które nie zgłaszają się po pomoc medyczną.
W związku z tym ośrodki medycyny podróży oraz urzędy zajmujące się zdrowiem publicznym w krajach UE/EOG mogą zintensyfikować działania profilaktyczne, w tym kampanie informacyjne przeznaczone dla podróżnych odwiedzających kraje o umiarkowanym i dużym ryzyku wścieklizny: (1) uświadamiając im możliwość zakażenia RABV podczas kontaktu fizycznego z ssakami, (2) zalecając szczepienie przedekspozycyjne zgodnie z wytycznymi WHO i (3) zalecając niezwłoczne zwrócenie się o pomoc medyczną w przypadku ugryzień lub zadrapań przez ssaki. Należy opracować kampanie informacyjne kierowane do różnych grup podróżnych oraz zbadać poziom świadomości i wykorzystanie mediów społecznościowych w celu dotarcia do potencjalnych odbiorców. Podróżnym należy też przypomnieć o konieczności przestrzegania przepisów i zaleceń weterynaryjnych podczas podróży ze zwierzętami. Ponadto obywatele UE/EOG powinni nabywać zwierzęta tylko od legalnie działających podmiotów.
Szczepienie przed- i poekspozycyjne
Zgodnie z wiedzą autorów, w żadnym przypadku zarejestrowanej w UE/EOG wścieklizny nabytej w czasie podróży nie stosowano profilaktyki przedekspozycyjnej, a tylko w pojedynczych przypadkach zastosowano natychmiastową, ale niekompletną profilaktykę po ekspozycji. W kilku opisach przypadków podkreślono, że podróżni, którzy zwracali się po pomoc medyczną w krajach obarczonych średnim i dużym ryzykiem narażenia na wściekliznę, nie otrzymali odpowiedniej profilaktyki poekspozycyjnej, ponieważ szczepionki i/lub immunoglobuliny były niedostępne lub zostały nieprawidłowo podane.24-26 Trzy osoby z UE/EOG zgłosiły się po pomoc medyczną po narażeniu i otrzymały profilaktykę w kraju, w którym doszło do ekspozycji (Indie i Tanzania), ale wskutek niekompletnego schematu postępowania u wszystkich wystąpiła wścieklizna. Podróżni z krajów UE/EOG otrzymujący profilaktykę poekspozycyjną w krajach endemicznych powinni po powrocie do swojego kraju zgłosić się do lekarza w celu oceny zastosowanego leczenia.
W kilku badaniach oceniono, z jakich powodów podróżni nie otrzymują szczepień. Najczęstszą przyczyną był koszt szczepionki, nieświadomość ryzyka u podróżnych i pracowników służby zdrowia oraz stosunkowo długi czas potrzebny na ukończenie cyklu szczepień.27 Od 2018 roku WHO zaleca stosowanie schematu szczepienia obejmującego podanie tylko 2 dawek w tygodniowym odstępie, co ułatwia planowanie całego postępowania i zmniejsza koszty szczepienia.28 Cena szczepionki jest nadal raczej wysoka (do 100 EUR za dawkę), jednak pozwala ona uzyskać długotrwałą odporność, dzięki czemu osoby regularnie podróżujące do obszarów dotkniętych wścieklizną mogą potraktować to jako korzystną inwestycję.28 Ponadto u zaszczepionych osób można zastosować uproszczony schemat profilaktyki poekspozycyjnej, obejmujący 2 dawki szczepionki podanej w ciągu 3 dni, bez konieczności stosowania immunoglobuliny. Jest to bardzo ważna kwestia, którą lekarze z krajów UE/EOG powinni wziąć pod uwagę wobec obserwowanych niedawno czasowych, ale sporadycznie powtarzających się niedoborów szczepionek i/lub ludzkich immunoglobulin w krajach UE/EOG.29-31 Mimo uzupełnienia tych braków w poszczególnych krajach konieczne było przejściowe ograniczenie stosowania szczepionki tylko do profilaktyki poekspozycyjnej.32,33 W niektórych krajach poza EU/EOG (np. na Filipinach i w Chinach) ostatnio odkryto próby wprowadzenia do obrotu sfałszowanych szczepionek, co stanowi istotne zagrożenie zdrowia publicznego.34
W 2018 roku WHO wraz z organizacjami partnerskimi wystąpiły z inicjatywą „zero do 30”, której celem jest wyeliminowanie zgonów ludzi z powodu klasycznej wścieklizny do 2030 roku.35 Działania zaplanowane w ramach strategii „Jedno zdrowie” obejmują szczepienie zwierząt mięsożernych, kontrolę bezpańskich psów, zapewnienie dostępu do profilaktyki poekspozycyjnej osobom narażonym oraz edukację i zwiększenie świadomości na temat wścieklizny. Jednak aby ta inicjatywa odniosła sukces, konieczne jest udostępnienie niedrogich szczepionek i immunoglobulin w krajach obarczonych średnim i dużym ryzykiem zakażenia RABV.
Ryzyko związane z materiałem pochodzenia ludzkiego
Wirus wścieklizny nie jest wykrywany we krwi, niemniej jednak istnieje ryzyko związane z przeszczepieniem narządów i tkanek od zakażonych dawców, u których nie rozpoznano wścieklizny. Na szczęście dzięki obowiązującym w większości krajów kryteriom doboru dawców zdarza się to bardzo rzadko.36,37
Ryzyko związane z domowymi zwierzętami mięsożernymi
W krajach UE/EOG nadal istnieje znaczne ryzyko wścieklizny u ludzi w związku z nielegalnym przywozem domowych zwierząt mięsożernych (głównie psów) z krajów, które nie są wolne od wścieklizny, zwłaszcza z Afryki Północnej.38,39 Na przykład w lutym 2020 roku we Francji zidentyfikowano zakażonego wścieklizną psa nielegalnie przywiezionego z Maroka.40
Ryzyko związane z innymi lyssawirusami
Lyssawirusy nietoperzy stanowią potencjalne nowe zagrożenie na obszarze UE/EOG. W UE odnotowano kilka zgonów z powodu zakażenia EBLV-1 i EBLV-2 u ludzi, jednak najbardziej niepokojąca jest możliwość pojawienia się nowych gatunków lyssawirusów nietoperzy o nieznanej dla ludzi patogeniczności, wobec których szczepionka przeciwko wściekliźnie może nie wywoływać ochronnej odpowiedzi immunologicznej.20 Niedawne wykrycie we Włoszech lyssawirusa nietoperza zachodnio-kaukaskiego u kota z objawami wścieklizny wskazuje, że pojawiające się lyssawirusy mogą zakażać inne gatunki ssaków lądowych, w tym ludzi. Jest to przypadek odosobniony, jednak konieczne jest prowadzenie dalszych badań, w tym nad szczepionkami przeciwko wściekliźnie obejmującymi szeroki zakres lyssawirusów.
W krajach UE/EOG nietoperze mogą bytować na dachach lub strychach budynków, jednak można się spodziewać, że kontakty między nietoperzami a ludźmi będą rzadkie. Jako ogólny środek ostrożności zaleca się unikanie kontaktu z nietoperzami i ich odchodami oraz zwrócenie się do lekarza w razie przypadkowego narażenia.
Podsumowanie
Z uwagi na prawie całkowite wyeliminowanie wścieklizny u ssaków na obszarze UE/EOG, ryzyko zakażenia u mieszkańców tych krajów wiąże się głównie z podróżami do obszarów enzootycznych. Podróżni powinni być świadomi tego ryzyka i rozważyć szczepienie przedekspozycyjne zgodnie z zaleceniami WHO, natomiast osoby nieszczepione w przypadku ugryzienia lub zadrapania przez ssaki powinny natychmiast zwrócić się po pomoc do lekarza. Należy opracować specjalne kampanie informacyjne skierowane do podróżnych z grup ryzyka. Potencjalnie nowym zagrożeniem w krajach UE/EOG jest zakażenie lyssawirusem nietoperzy, choć ryzyko ekspozycji jest niewielkie.
W ramach wsparcia działań przygotowujących w krajach UE/EOG należy opracować wytyczne dotyczące oceny i postępowania w odniesieniu do ryzyka, jakie dla zdrowia publicznego stanowi wścieklizna oraz inne lyssawirusy. W celu wczesnego wykrycia i skutecznego postępowania w przypadku ponownego pojawienia się choroby niezbędne jest ścisłe monitorowanie występowania wścieklizny u zwierząt i ludzi w krajach lub regionach uznanych za wolne od tej choroby u zwierząt lądowych. Kontynuacja szczepień doustnych w regionach graniczących z UE/EOG, w których regularnie pojawia się wścieklizna, pozwoliłaby zmniejszyć ryzyko ponownego pojawienia się tej choroby. Jest to szczególnie ważne na terenach przy wschodnich granicach UE z uwagi na enzootyczne występowanie wścieklizny w krajach sąsiednich.
Oświadczenie: Yves Van der Stede i Inma Aznar są obecnie zatrudnieni
przez European Food Safety Authority (EFSA) w jednostce ALPHA Unit,
naukowo i administracyjnie wspierającej aktywności naukowe EFSA w obszarze „Zdrowie i dobrostan zwierząt”. Stanowiska i opinie
przedstawione w niniejszej publikacji wyrażają wyłącznie zdanie autorów i nie mają na celu reprezentowania poglądów ani prac naukowych EFSA.
Podziękowania: Autorzy dziękują Dragoslavowi Domanovicowi z ECDC
za pomoc w opisaniu zagadnienia dotyczącego donacji materiału
pochodzenia ludzkiego. Dziękujemy także Pedro Rosado Martinowi z Komisji Europejskiej za przegląd manuskryptu.
Deklaracja konfliktu interesów: Brak konfliktu interesów.
Udział poszczególnych autorów: C.M.G. przygotowała konspekt
publikacji, który przeglądali wszyscy autorzy. C.M.G. przygotowała
pierwszą wersję manuskryptu we współpracy z A.M. i I.A. A.M., E.D.,
J.E.E., S.L.F., H.L., F.P.M., P.P., J.P. dostarczyli szczegółowych informacji
na temat zakażeń u ludzi w swoich krajach. I.A., Y.V.dS. i J.E.E. dostarczyli
informacji dotyczących zakażeń u zwierząt w krajach EU/EEA. T.B. i J.E.E.
dostarczyli informacji dotyczących aspektów mikrobiologicznych
zakażenia. Wszyscy autorzy dokonali krytycznego przeglądu manuskryptu w celu poprawy jego jakości oraz kompleksowości. Wszyscy autorzy
zaakceptowali ostateczną wersję manuskryptu.
Piśmiennictwo:
1. World Health Organization (WHO). WHO expert consultation on rabies: third report. Geneva: WHO; 2018. Available from: https://apps.who.int/iris/handle/10665/2723642. Fekadu M., Shaddock J.H., Baer G.M.: Excretion of rabies virus in the saliva of dogs. J. Infect. Dis., 1982; 145 (5): 715–719
3. Vora N.M., Orciari L.A., Niezgoda M., et al.: Clinical management and humoral immune responses to rabies post-exposure prophylaxis among three patients who received solid organs from a donor with rabies. Transpl. Infect. Dis., 2015; 17 (3): 389–395
4. European Centre for Disease Prevention and Control (ECDC). The European Surveillance System (TESSy) [restricted access]. Stockholm: ECDC. [Accessed: 8 Jul 2020]. Available from: https://ecdc.europa.eu/en/publications-data/european-surveillance-system-tessy
5. Cliquet F., Aubert M.: Elimination of terrestrial rabies in Western European countries. Dev. Biol. (Basel), 2004; 119: 185–204
6. Finnegan C.J., Brookes S.M., Johnson N., et al.: Rabies in North America and Europe. J. R. Soc. Med., 2002; 95 (1): 9–13
7. European Commission (EC). Health and consumer protection directorate general. The oral vaccination of foxes against rabies. Report of the Scientific Committee on Animal Health and Animal Welfare. Adopted on 23 October 2002. Brussels: EC; 2002. Available from: https://ec.europa.eu/food/sites/food/files/safety/docs/sci-com_scah_out80_en.pdf
8. European Commission (EC). National Veterinary Programmes. Brussels: EC. [Accessed: 8 Jul 2020]. Available from: https://ec.europa.eu/food/funding/animal-health/national-veterinary-programmes_en
9. World Organisation for Animal Health (OIA). Ninth meeting of the standing group of experts on lumpy skin disease (SGE LSD9), 16–17 October 2019, Athens/Greece – additional session on rabies surveillance. Paris: OIE. [Accessed: 8 Jul 2020]. Available from: https://web.oie.int/RR-Europe/eng/Regprog/en_GF_TADS%20-%20Standing%20Group%20LSD.htm#LSD9
10. King A.A., Fooks A.R., Aubert M., Wandeler A.I.: Historical Perspective of Rabies in Europe and the Mediterranean Basin. Paris: OIE; 2004: 140–142. Available from: https://foxrabiesblueprint.org/IMG/pdf/pdf_106_king_et_al_2004.pdf
11. Robardet E., Bosnjak D., Englund L., Demetriou P., Martín P.R., Cliquet F.: Zero Endemic Cases of Wildlife Rabies (Classical Rabies Virus, RABV) in the European Union by 2020: An Achievable Goal. Trop. Med. Infect. Dis., 2019; 4 (4): 124
12. World Health Organization (WHO). Rabies Bulletin Europe – Rabies Information System – queries. Geneva: WHO. [Accessed: 8 Jul 2020]. Available from: https://rbe.fli.de/site-page/queries
13. Escobar L.E., Peterson A.T., Favi M., Yung V., Medina-Vogel G.: Bat-borne rabies in Latin America. Rev. Inst. Med. Trop. Sao Paulo, 2015; 57 (1): 63–72
14. Centers for Disease Control and Prevention (CDC). Bats Lead in U. S. Rabies Risk. Atlanta: CDC. [Accessed: 21 Sep 2020]. Available from: https://www.cdc.gov/media/releases/2019/p0611-bats-rabies.html#:~:text=Bats%20are%20responsible%20for%20roughly,for%20Disease%20Control%20and%20Prevention
15. European Food Safety Authority and European Centre for Disease Prevention and Control. The European Union One Health 2018 Zoonoses Report. EFSA J., 2019; 17 (12): 5926
16. Tjornehoj K., Fooks A.R., Agerholm J.S., Ronsholt L.: Natural and experimental infection of sheep with European bat lyssavirus type-1 of Danish bat origin. J. Comp. Pathol., 2006; 134 (2–3): 190–201
17. Müller T., Cox J., Peter W., et al.: Spill-over of European bat lyssavirus type 1 into a stone marten (Martes foina) in Germany. J. Vet. Med. B Infect. Dis. Vet. Public Health, 2004; 51 (2): 49–54
18. Dacheux L., Larrous F., Mailles A., et al.: European bat Lyssavirus transmission among cats, Europe. Emerg. Infect. Dis., 2009; 15 (2): 280–284
19. Fooks A.R., Brookes S.M., Johnson N., McElhinney L.M., Hutson A.M.: European bat lyssaviruses: an emerging zoonosis. Epidemiol. Infect., 2003; 131 (3): 1029–1039
20. Echevarría J.E., Banyard A.C., McElhinney L.M., Fooks A.R.: Current Rabies Vaccines Do Not Confer Protective Immunity against Divergent Lyssaviruses Circulating in Europe. Viruses, 2019; 11 (10): E892
21. Istituto Zooprofilattico Sperimentale delle Venezie (IZSVe). Caso di Lyssavirus in un gatto nel comune di Arezzo. [A case of Lyssavirus in a cat in the commune of Arezzo]. Legnaro: IZSVe; 29 Jun 2020. Italian. Available from: https://www.izsvenezie.it/caso-lyssavirus-gatto-comune-arezzo/
22. van Thiel P.-P.A.M., de Bie R.M.A., Eftimov F., et al.: Fatal human rabies due to Duvenhage virus from a bat in Kenya: failure of treatment with coma-induction, ketamine, and antiviral drugs. PLoS Negl. Trop. Dis., 2009; 3 (7): e428
23. Marano C., Moodley M., Melander E., De Moerlooze L., Nothdurft H.D.|: Perceptions of rabies risk: a survey of travellers and travel clinics from Canada, Germany, Sweden and the UK. J. Travel Med., 2019; 26 (Suppl. 1): S3–S9
24. De Benedictis P., Perboni G., Gentili C., et al.: Fatal case of human rabies imported to Italy from India highlights the importance of adequate post-exposure prophylaxis, October 2011. Euro Surveill., 2012; 17 (19): 20 168
25. Gautret P., Angelo K.M., Asgeirsson H., et al.: Rabies post-exposure prophylaxis started during or after travel: A GeoSentinel analysis. PLoS Negl. Trop. Dis., 2018; 12 (11): e0006951
26. Johnson N., Freuling C., Horton D., Muller T., Fooks A.R.: Imported rabies, European Union and Switzerland, 2001–2010. Emerg. Infect. Dis., 2011; 17 (4): 753–754 27. Gautret P., Parola P.: Rabies vaccination for international travelers. Vaccine, 2012; 30 (2): 126–133
28. World Health Organization (WHO). Rabies vaccines: WHO position paper – April 2018. Geneva: WHO; 20 Apr 2018. Available from: https://www.who.int/rabies/resources/who_wer9316/en/
29. Hermans F.: Nederlandse reiziger moet zonder inenting tegen hondsdolheid naar de tropen. [Dutch travellers must go to the tropics without vaccination against rabies]. Nijmegen: de Gelderlander; 21 Jun 2018. Dutch. Available from: https://www.gelderlander.nl/nijmegen/nederlandse-reiziger-moet-zonder-inenting-tegen-hondsdolheid-naar-de-tropen~afbe6d-4b/?referrer=https://www.google.com/
30. Folkehelseinstituttet (FHI). Slutt pa utleveringsrestriksjoner for rabiesvaksine. [End of rabies vaccine delivery restrictions]. Oslo: FHI; 27 Nov 2019. Norwegian. Available from: https://www.helsebiblioteket.no/samfunnsmedisin-og-folkehelse/helseradet/_attachment/265659?_ts=-16fa8a8a55d&download=true
31. Agence nationale de sécurité du médicament et des produits de santé (ANSM). Imogam rage 150 UI/ml, solution injectable – Tensions d’approvisionnement. [Imogam rage 150 UI/ml, injectable vaccine – Supply tensions]. Saint-Denis: ANSM;8 Apr 2019. French. Available from: https://ansm.sante.fr/S-informer/Informations-de-securite-Ruptures-de-stock-des-medicaments/IMOGAM-RAGE-150-UI-ml-solution-injectable-Tensions-d-approvisionnement
32. Institute of Tropical Medicine (ITM). Ajustement du traitement antirabique du a une rupture de stock du vaccin. [Adjustment of the treatment against rabies due to a shortage in the vaccine stockpile]. Antwerp: ITM; 12 Jun 2019. French. Available from: https://www.itg.be/F/Article/ajustement-du-traitement-antirabique-du-a-une-rupture-de-stock-du-vaccin
33. Mari E. Pénurie de vaccins contre la rage. [Shortage of rabies vaccines]. Paris: Le Parisien; 19 Jul 2018. French. Available from: https://www.leparisien.fr/societe/sante/penurie-de-vaccins-contre-la-rage-19-07-2018-7825983.php
34. Taylor E., Banyard A.C., Bourhy H., et al.: Avoiding preventable deaths: The scourge of counterfeit rabies vaccines. Vaccine, 2019; 37 (17): 2285–2287
35. Food and Agriculture Organization of the United Nations, World Organisation for Animal Health, World Health Organization, Global Alliance for Rabies Control. Zero by 30: the global strategic plan to end human deaths from dog-mediated rabies by 2030. Geneva: WHO, 2018. Available from: https://apps.who.int/iris/bitstream/handle/10665/272756/9789241513838-eng.pdf?ua=1
36. European Directorate for the Quality of Medicines and Healthcare. Guide to the quality and safety of organs for transplantation, 7th edition. Strasbourg: Council of Europe; 2018. Available from: https://www.edqm.eu/en/news/new-release-7th-edition-guide-quality-and-safety-organs-transplantation
37. European Directorate for the Quality of Medicines and Healthcare. Guide to the quality and safety of tissues and cells for human application, 4th edition. Strasbourg: Council of Europe; 2018. Available from: https://www.edqm.eu/en/organs-tissues-and-cells-technical-guides
38. Rabies confirmed in an illegally imported dog in France. Vet. Rec., 2015; 176 (22): 558
39. Pérez de Diego A.C., Vigo M., Monsalve J., Escudero A.: The One Health approach for the management of an imported case of rabies in mainland Spain in 2013. Euro Surveill., 2015; 20 (6): 21 033
40. Ministere de l’Agriculture et de l’Alimentation. Cas de rage importé détecté chez un chiot ramené du Maroc sur l’île de Ré. [Imported case if rabies in a puppy from Morocco on Ré island]. Paris: Ministere de l’Agriculture et de l’Alimentation. 15 Feb 2020. French. Available from: https://agriculture.gouv.fr/telecharger/107839?token=f1fb4beb809cb0918838431f0ec1f5a1
41. Schmiedel S., Panning M., Lohse A., et al.: Case report on fatal human rabies infection in Hamburg, Germany, March 2007. Euro Surveill., 2007; 12 (5): E0705315
42. Rimhanen-Finne R., Järvinen A., Kuusi M., et al.: Imported human rabies, the Philippines and Finland, 2007. Emerg. Infect. Dis., 2010; 16 (8): 1318–1319
43. Hunter M., Johnson N., Hedderwick S., et al.: Immunovirological correlates in human rabies treated with therapeutic coma. J. Med. Virol., 2010; 82 (7): 1255–1265
44. Santos A., Cale E., Dacheux L., Bourhy H., Gouveia J., Vasconcelos P.: Fatal case of imported human rabies in Amadora, Portugal, August 2011. Euro Surveill., 2012; 17 (12): 20 130
45. Pathak S., Horton D.L., Lucas S., et al.: Diagnosis, management and post-mortem findings of a human case of rabies imported into the United Kingdom from India: a case report. Virol. J., 2014; 11 (1): 63
46. Program for Monitoring Emerging Diseases (Pro-MED). Rabies – Netherlands ex Haiti, canine, human. Archive number: 2013; 1 791201 (20130625): 25. Available from: https://promedmail.org/promed-post/?id=1791201
47. Program for Monitoring Emerging Diseases (Pro-MED). Rabies – Netherlands ex India: (Tamil Nadu) canine, human. Archive number: 2014; 2 721553 (20140825): 25. Available from: https://promedmail.org/promed-post/?id=2721553
48. Contou D., Dacheux L., Bendib I., et al.: Severe ketoalkalosis as initial presentation of imported human rabies in France. J. Clin. Microbiol., 2015; 53 (6): 1979–1982
49. Lourido M.: Muere de rabia una mujer en Madrid. [A woman in Madrid dies from rabies]. Madrid: Cadena SER; 20 Jun 2014. Spanish. Available from: https://cadenaser.com/ser/2014/06/20/sociedad/1403230405_850215.html
50. Hommel C.: Cas de rage confirmé en France au retour du Sri Lanka. [One case of rabies in France in a travellers returning from Sri Lanka]. MesVaccins.net. [Accessed: 8 Jul 2020]. French. Available from: https://www.mesvaccins.net/web/news/11418-cas-de-rage-confirme-en-france-au-retour-du-sri-lanka
51. Program for Monitoring Emerging Diseases (Pro-MED). Rabies, human – UK: (England) ex Morocco, ex feline. Archive number: 20 181113.6142425.13 Nov 2018. Available from: https://promedmail.org/promed-post/?id=6142425
52. European Centre for Disease Prevention and Control (ECDC). Communicable Disease Threat Report, week 50, 8–14 December, Rabies imported cases – EU/EEA – 2019. Stockholm: ECDC; 13 Dec 2019. Available from: https://www.ecdc.europa.eu/en/publications-data/communicable-disease-threats-report-8-14-december-2019-week-50















