Translated from The American Journal of Gastroenterology Vol. 115 (9), Freddy Caldera, Mary S. Hayney, Francis A. Farraye, Vaccination in patients with inflammatory bowel disease: 1356–1361, doi: 10.14309/ajg.0000000000000713 © 2020 by The American College of Gastroenterology, with permission from Wolters Kluwer Health. Wolters Kluwer and its Societies take no responsibility for the accuracy of the translation from the published English original and are not liable for any errors which may occur.
Tłumaczyła: lek. Iwona Rywczak
Skróty: ACIP – Advisory Committee on Immunization Practices, CDC – Centers for Disease Control and Prevention, GKS – glikokortykosteroidy, IIV – inaktywowana szczepionka przeciwko grypie, NChZJ – nieswoiste choroby zapalne jelit, PCV-13 – 13-walentna skoniugowana szczepionka przeciwko pneumokokom, PPSV-23 – 23-walentna polisacharydowa szczepionka przeciwko pneumokokom, TNF – czynnik martwicy nowotworów
Wprowadzenie
Chorzy na nieswoiste choroby zapalne jelit (NChZJ) są narażeni na większe ryzyko zakażeń, co wynika z samej choroby podstawowej oraz stosowania niektórych leków immunosupresyjnych.1-3 Wielu takich zakażeń można uniknąć dzięki powszechnym szczepieniom. W czasie pandemii COVID-19 zapobieganie chorobom, dla których dostępne są szczepionki, jest szczególnie istotne.4 W artykule przedstawiono zasady optymalnej realizacji szczepień u chorych na NChZJ w celu ograniczenia obciążeń związanych z chorobami zakaźnymi w tej populacji.
Zwiększenie wyszczepialności chorych na NChZJ
U chorych na NChZJ obserwuje się mniejsze wskaźniki wyszczepialności niż w ogólnej populacji. Wynika to m.in. z braku jednoznacznych ustaleń dotyczących wyznaczania osób odpowiedzialnych za wydawanie zaleceń na temat szczepień u chorych na NChZJ oraz ich realizację. W celu ochrony swoich pacjentów odpowiedzialność za zalecanie i realizację szczepień powinni przejąć gastroenterolodzy, samodzielnie lub we współpracy z innymi lekarzami. Dodatkowo członkom rodziny chorego należy zalecić, aby na bieżąco realizowali wszystkie należne szczepienia w ramach tzw. strategii kokonu. W celu zwiększenia wskaźników wyszczepialności lekarze powinni rozważyć zastosowanie prostych interwencji, takich jak korzystanie z pomocy asystentów medycznych, którzy mogą sprawdzać historię szczepień pacjentów, lub kierowanie pacjentów na szczepienie przeciwko grypie i pneumokokom do innej placówki. Dzięki temu lekarz może się skupić na pacjencie, który obawia się szczepień, uspokoić go i omówić korzyści. Poza tym niektóre szczepionki (przeciwko grypie, pneumokokom, wirusowemu zapaleniu wątroby [WZW] typu B) są dostępne w przychodniach i podawane w trakcie wizyt u gastroenterologa, co również zwiększa wskaźniki wyszczepialności.
Sytuacje szczególne w realizacji szczepień u chorych na NChZJ
Autorzy artykułu zalecają, aby postępować zgodnie z zaleceniami Advisory Committee on Immunization Practices (ACIP) dotyczącymi szczepień dorosłych. Wyjątkiem są sytuacje, w których zaleca się szczepienie chorego na NChZJ z uwagi na większe ryzyko danej choroby zakaźnej (tab. 1.).5 Dodatkowo niektóre leki stosowane w leczeniu NChZJ mogą zmniejszać immunogenność szczepionek, co stwarza konieczność modyfikacji programu szczepień u dorosłych (tab. 2.).4
| Tabela 1. Szczepienia dorosłych chorych na NChZJ | |
|---|---|
| Szczepionka | Schemat szczepienia |
| 4-walentna IIV o standardowej dawce antygenów | 1 dawka corocznie, wszyscy chorzy w wieku 18–64 lat, którzy nie stosują leków anty-TNF w monoterapii |
| 4-walentna IIV o dużej dawce antygenówa,b | 1 dawka corocznie, wszyscy chorzy ≥65 lat lub w wieku 18–64 lat przyjmujący anty-TNF w monoterapiia |
| LAIVc | unikać u osób w trakcie leczenia immunosupresjnego |
| przeciwko tężcowi, błonicy, krztuścowi (Tdap lub Td) | u osób wcześniej szczepionych 1 dawką Tdap, następnie Td lub Tdap co 10 lat, 1 dawka Tdap w III trymestrze każdej ciąży |
| przeciwko półpaścowi, rekombinowana (preferowana)d | 2 dawki (w odstępie 2–6 mies.) u wszystkich osób ≥50 lat; rozważ u osób w wieku 40–49 lat z grupy ryzykae |
| przeciwko półpaścowi, „żywa”d | wyłącznie, gdy niedostępna jest szczepionka rekombinowana, u osób immunokompetentnych |
| 9-walentna przeciwko HPV | 3 dawki w schemacie 0, 1–2, 6 mies. u wszystkich chorych w wieku 18–26 lat; w grupie wiekowej 27–45 lat – 3 dawki, jeżeli pacjent może mieć nowych partnerów seksualnych |
| przeciwko pneumokokom, 13-walenta skoniugowana i 23-walentna polisacharydowa | wszyscy pacjenci w wieku ≥18 lat (p. ryc. 2.) |
| przeciwko WZW typu A | 2-dawkowy schemat (Havrix lub Vaqta, w odstępie 6–12 mies.) lub 3-dawkowy z użyciem skojarzonej szczepionki przeciwko WZW typu A i B (Twinrix, 0, 1, 6 mies.), lub 4-dawkowy (0, 7, 21–30 dni i 12 mies.)f |
| przeciwko WZW typu B | Engerix lub Recombivaxd: 3-dawkowy schemat (0, 1, 6 mies.)g lub 3-dawkowy schemat z użyciem skojarzonej szczepionki przeciwko WZW typu A i B (Twinrix, 0, 1, 6 mies.), lub 4-dawkowy schemat przyspieszony 0, 7, 21–30 dni i 12 mies.f,g (…) |
| MenACWY i MenB | szczepienie powinni otrzymać dorośli z grupy ryzyka;h jeżeli te czynniki ryzyka są nadal obecne, MenACWY należy powtarzać co 5 lat, a MenB rok po zakończeniu schematu podstawowego, a następnie co 2–3 lata |
| MMR | 2 dawki w odstępie ≥4 tyg. u osób nieszczepionych lub 1 dawka u osób, które w przeszłości otrzymały 1 dawkę MMR |
| przeciwko ospie wietrznej | 2 dawki w odstępie 4–8 tyg. u osób nieszczepionych (u osób urodzonych po 1979 r. lub przed 1980 r., które nie chorowały na ospę lub u których nie potwierdzono laboratoryjnie odporności na tę chorobę)i |
|
Zalecenia autorów artykułu wyszczególniono pogrubioną czcionką. a Szczepionka niedostępna w Polsce, w polskich warunkach należy zastosować preparat o standardowej dawce – przyp. red. b IIV o dużej dawce antygenów (niedostępna w Polsce – przyp. red.), która zawiera 4-krotnie większą dawkę hemaglutyniny niż szczepionka o standardowej dawce, zarejestrowano na podstawie badań wskazujących, że u osób w wieku ≥65 lat stymuluje ona produkcję przeciwciał w większym stężeniu i zapewnia lepszą ochronę przed grypą.8 W badaniu z randomizacją obejmującym chorych na NChZJ leczonych lekiem anty-TNF w monoterapii szczepienie preparatem o dużej dawce antygenów wzbudzało produkcję przeciwciał w istotnie większym stężeniu niż szczepienie standardową szczepionką.7 c W Polsce LAIV nie jest zarejestrowana u dorosłych – przyp. red. d Szczepionka niedostępna w Polsce – przyp. red. e grupy zwiększonego ryzyka półpaśca: (1) wszyscy pacjenci, którzy przebyli półpaśca; (2) osoby wymagające powtarzanego leczenia GKS; (3) osoby leczone tofacytynibem z grupy ryzyka półpaśca (np. równoczesne stosowanie GKS, pochodzenie azjatyckie, cukrzyca, w przeszłości niepowodzenie leczenia lekiem anty-TNF); (4) pacjenci na terapii skojarzonej, obejmującej GKS.3,11,12 f Schemat przyspieszony stosuje się u osób, które rozpoczynają szczepienie, lecz nie mogą ukończyć standardowego 3-dawkowego schematu z uwagi na bliski termin podróży związanej ze zwiększonym ryzykiem ekspozycji na wirusa zapalenia wątroby typu A lub B. g Sprawdź stężenie przeciwciał anty-HBs 4–8 tyg. po zakończeniu pełnego schematu szczepienia. h Osoby mieszkające w akademikach, nieszczepione przeciwko meningokokom w wieku nastoletnim, rekruci, osoby przebywające w ogniskach epidemicznych, z wybranymi niedoborami odporności, m.in. asplenią, niedoborem dopełniacza, zakażeniem HIV. i kryterium roku urodzenia dotyczy Stanów Zjednoczonych – przyp. red. GKS – glikokortykosteroidy, HPV – ludzki wirus brodawczaka, IIV – inaktywowana szczepionka przeciwko grypie, LAIV – „żywa” szczepionka przeciwko grypie, MenACWY – szczepionka przeciwko meningokokom grup A, C, W i Y, MenB – szczepionka przeciwko meningokokom grupy B, MMR – szczepionka przeciwko odrze, śwince i różyczce, TNF – czynnik martwicy nowotworów, WZW – wirusowe zapalenie wątroby | |
| Tabela 2. Wpływ leków immunosupresyjnych na immunogenność szczepionek | |
|---|---|
| Leki | Wpływ na odpowiedź na szczepienie |
| aminosalycylany lub tiopuryny | braka |
| leki anty-TNF | mogą osłabić odpowiedźa,b |
| leczenie skojarzone (leki immunomodulujące i anty-TNF) | mogą osłabić odpowiedź, ich stosowanie wiązało się z najmniejszą immunogennością szczepioneka |
| wedolizumab | dane z małego badania pilotażowego sugerują brak wpływu na odpowiedź na szczepieniea |
| ustekinumab lub tofacytynib | brak danych u chorych na NChZJc |
|
a dane z badań nad immunogennością szczepionek przeciwko grypie, WZW typu B i pneumokokom4,7,10 b dane z badania nad immunogennością szczepionki przeciwko grypie4 c W 2 badaniach oceniono immunogenność szczepionek u chorych na łuszczycę leczonych ustekinumabem lub tofacytynibem. Wyników tych badań nie można odnosić do chorych na NChZJ z uwagi na małą liczbę uczestników, brak grupy kontrolnej oraz dawki leków, które były mniejsze od dawek stosowanych w leczeniu NChZJ. NChZJ – nieswoiste choroby zapalne jelit, TNF – czynnik martwicy nowotworów | |
Grypa
Chorzy na NChZJ są narażeni na większe ryzyko zachorowania na grypę i hospitalizacji z jej powodu niż populacja ogólna.2 Poza tym u osób stosujących leki blokujące czynnik martwicy nowotworów (TNF) w monoterapii lub w skojarzeniu z lekiem immunomodulującym odpowiedź na inaktywowaną szczepionkę przeciwko grypie (IIV) może być zmniejszona.6 Wszystkim dorosłym zaleca się corocznie szczepienie IIV o standardowej dawce antygenów, jednak niektórzy chorzy na NChZJ mogą odnieść korzyść ze szczepienia innym preparatem. Zdrowe osoby w wieku >65 lat i chorzy na NChZJ otrzymujący w monoterapii anty-TNF po podaniu IIV o większej dawce antygenów (niedostępna w Polsce – przyp. red.) wytwarzają przeciwciała w większym mianie niż po podaniu szczepionki o standardowej dawce. Autorzy artykułu zalecają, aby chorzy na NChZJ w wieku >65 lat oraz pacjenci przyjmujący leki anty-TNF w monoterapii otrzymali IIV zawierającą większą dawkę antygenów.7,8
Zakażenia pneumokokowe
U chorych na NChZJ, w porównaniu z osobami z grupy kontrolnej dopasowanymi pod względem wieku, zaobserwowano również 1,5-krotnie większe ryzyko zapalenia płuc.9 W dużym badaniu populacyjnym stwierdzono, że zwiększone ryzyko inwazyjnej choroby pneumokokowej (IChP) występuje wiele lat przed rozpoznaniem NChZJ i utrzymuje się po jego ustaleniu. Leki immunosupresyjne, takie jak anty-TNF i glikokortykosteroidy (GKS), nie zwiększały ryzyka IChP, co sugeruje, że jest ono związane z upośledzeniem funkcji układu odpornościowego wynikającego z choroby podstawowej.1 Zgodnie z zaleceniami ACIP pacjentów, u których planuje się systemowe leczenie immunosupresyjne oraz u których już się je stosuje, należy szczepić przeciwko pneumokokom szczepionką skoniugowaną i polisacharydową (p. Którym grupom pacjentów szczególnie zaleca się szczepienie polisacharydową szczepionką przeciwko pneumokokom? – przyp. red.).5 Podobnie jak w przypadku szczepionek przeciwko grypie, leki anty-TNF podawane w monoterapii lub w skojarzeniu z innymi preparatami mogą upośledzać odpowiedź na szczepionki przeciwko pneumokokom.10 W związku z tym autorzy artykułu zalecają, aby obie szczepionki przeciwko pneumokokom podać tuż po ustaleniu rozpoznania, przed rozpoczęciem leczenia immunosupresyjnego, co pozwoli uzyskać prawidłową odpowiedź na szczepienie (ryc. 1.).
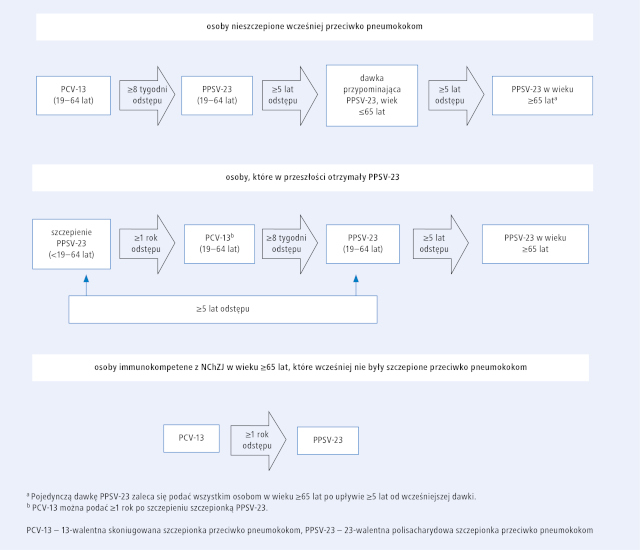
Ryc. 1. Zalecany schemat szczepienia przeciwko pneumokokom u chorych na NChZJ
Półpasiec
Ryzyko półpaśca u chorych na NChZJ jest 2-krotnie większe niż w populacji ogólnej, niezależnie od tego, czy przyjmują leki immunosupresyjne.11 Poza tym 40-letni chory na NChZJ jest narażony na większe ryzyko półpaśca niż zdrowy 50-latek, który – zgodnie z aktualnymi zaleceniami ACIP – powinien zostać zaszczepiony przeciwko tej chorobie.5 Niezależnym czynnikiem ryzyka jest leczenie immunosupresyjne (np. tiopurynami, GKS, lekami anty-TNF).11 W niedawno przeprowadzonym badaniu wykazano, że ryzyko wystąpienia półpaśca zwiększają zaostrzenia NChZJ i powtarzające się ekspozycje na GKS.3 Z większym ryzykiem rozwoju półpaśca wiąże się również stosowanie tofacytynibu (nowy inhibitor kinazy JAK), w porównaniu z konwencjonalnymi lekami.12
Zgodnie z zaleceniami ACIP u wszystkich immunokompetentnych osób w wieku ≥50 lat preferowana jest rekombinowana szczepionka przeciwko półpaścowi (niedostępna w Polsce – przyp. red.). ACIP nie wydał formalnych zaleceń dotyczących osób w immunosupresji, jednak szczepionka rekombinowana jest bezpieczna i immunogenna w innej grupie immunoniekompetentnych pacjentów (te wnioski pochodzą z badania, w którym uczestniczyli biorcy przeszczepu nerki – przyp. red.).13 Wszyscy chorzy na NChZJ, którzy ukończyli 50. rok życia, powinni zostać zaszczepieni rekombinowaną szczepionką przeciwko półpaścowi, lecz korzyści mogą odnieść również niektórzy pacjenci w młodszym wieku. Wśród osób w wieku 40–49 lat za grupę zwiększonego ryzyka uważa się osoby z półpaścem w wywiadzie, wymagające powtarzanego leczenia GKS, osoby przyjmujące terapię skojarzoną obejmującą GKS oraz leczone tofacytynibem obarczone 1 z takich czynników ryzyka, jak stosowanie doustnych GKS przed rozpoczęciem leczenia tofacytynibem, pochodzenie azjatyckie, cukrzyca, niepowodzenie leczenia lekiem anty-TNF lub przewlekłe stosowanie tofacytynibu w dawce 10 mg 2 razy/24 h.3,12 (…)
Ocena odporności na choroby, którym można zapobiegać poprzez szczepienia, u chorych na NChZJ
Dla większości inaktywowanych i „żywych” szczepionek nie są dostępne komercyjne testy serologiczne pozwalające ocenić odporność uzyskaną po szczepieniu. Ważnym wyjątkiem jest szczepionka przeciwko WZW typu B. Według zaleceń ACIP, oceniając odporność poszczepienną należy raczej polegać na udokumentowanej historii szczepień należnych dla wieku niż na wynikach badań serologicznych.14,15 W związku z pojawiającymi się ogniskami epidemicznymi odry lekarze i pacjenci obawiają się, czy chorzy na NChZJ będący w immunosupresji są odporni na tę chorobę. „Żywe” szczepionki stosowane u dzieci stymulują odpowiedź immunologiczną niemal identyczną z odpowiedzią na naturalne zakażenie, a odporność uzyskują prawie wszyscy zaszczepieni.16 Stężenie przeciwciał wytworzonych po szczepieniu jest zwykle mniejsze niż po pierwotnym zakażeniu, jednak ta mniejsza wartość nie oznacza, że odporność utrzymuje się krócej.14,15 Poza tym pomiar stężenia przeciwciał poszczepiennych za pomocą powszechnie dostępnych testów serologicznych może nie być wiarygodny. Naukowcy z Centers for Disease Control and Prevention (CDC) stwierdzili, że fałszywie ujemne wyniki komercyjnych testów immunoenzymatycznych, które porównano z testami o większej czułości, uzyskano w 34% przypadków.17 Poza tym zaobserwowano, że u dorosłych z NChZJ systemowe leczenie immunosupresyjnie raczej nie wpływa na utrzymywanie się swoistych przeciwciał po szczepieniu przeciwko odrze, śwince i różyczce, których stężenie oznaczono średnio 17 lat po zakończeniu szczepienia i porównano z grupą zdrowych osób.18 W związku z tym autorzy artykułu zalecają, aby postępować zgodnie z zaleceniami ACIP, w których za akceptowalny dowód odporności na odrę, świnkę, różyczkę i ospę wietrzną uznaje się prawidłowo wykonane szczepienie przeciwko tym chorobom. Nie zaleca się oznaczania swoistych przeciwciał u osób, które spełniają to kryterium odporności (ryc. 2.) z uwagi na możliwość otrzymania wyniku fałszywie ujemnego.14,15 Przy rozpoznaniu NChZJ należy ustalić pełną historię szczepień pacjenta. Powinna ona zawsze być dostępna przy przekazywaniu pacjenta do placówki dla dorosłych po osiągnięciu pełnoletniości lub przy przekazywaniu dorosłego chorego pod opiekę innego lekarza. (…)
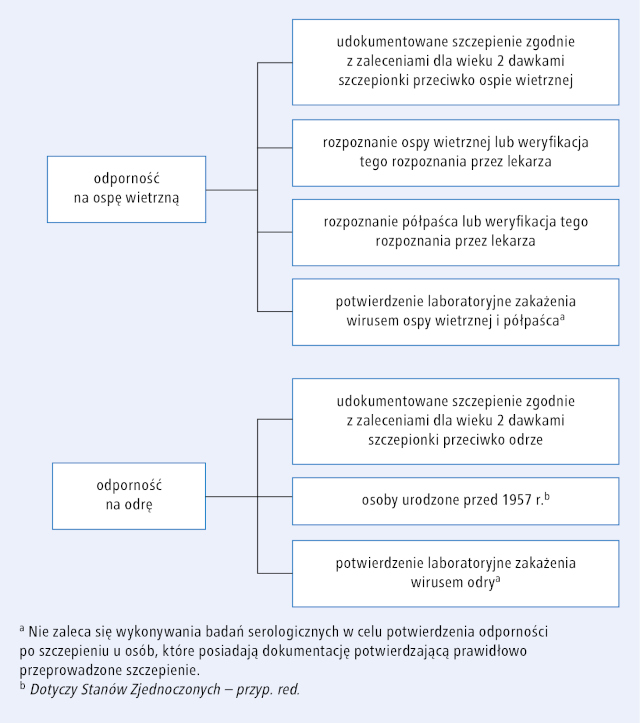
Ryc 2. Wskaźniki uznawane za potwierdzenie odporności na ospę wietrzną i odrę u chorych na NChZJ
Podawanie „żywych” szczepionek zalecanych przed podróżą zagraniczną
U chorych na NChZJ w immunosupresji mogą istnieć wskazania do podania „żywej” szczepionki w związku z podróżą zagraniczną. Autorzy artykułu zalecają, aby lekarze opiekujący się pacjentami z NChZJ znali zasady szczepień takich pacjentów przed podróżą, ponieważ jest to względnie częsta sytuacja kliniczna (tab. 3.).
| Tabela 3. Szczepionki stosowane w medycynie podróży u dorosłycha | |||
|---|---|---|---|
| Szczepionka | Typ szczepionki | Droga podania | Standardowy schemat szczepienia |
| przeciwko cholerze | „żywa” | p.o. | 1 dawka u osób w wieku 18– 64 lat, brak danych dotyczących stosowania szczepionki u osób w immunosupresji |
| przeciwko japońskiemu zapaleniu mózgu | inaktywowana, zawiera wirusy namnożone na komórkach vero | i.m. | wiek 18–64 lat: 2 dawki w schemacie 0, 7–28 dni wiek ≥65 lat: 2 dawki, 0, 28 dni |
| przeciwko polio | zawiera inaktywowane wirusy | s.c. | 1 dawka u osób, które otrzymały szczepienie podstawowe w dzieciństwie |
| przeciwko wściekliźnie | zawiera inaktywowane wirusy | i.m. | dla wszystkich dorosłych schemat szczepienia przedekspozycyjnego: 0, 7, 21 lub 28 dni |
| przeciwko durowi brzusznemu | inaktywowana, zawiera antygeny ściany komórkowej bakterii | i.m. | 1 dawka, u wszystkich dorosłych |
| przeciwko durowi brzusznemu | „żywa” (zawiera atenuowane bakterie) | p.o. | 1 kapsułka co drugi dzień (łącznie 4 kapsułki), u wszystkich dorosłych; nie stosować u osób w immunosupresji |
| przeciwko żółtej gorączce | „żywa” (zawiera atenuowane wirusy) | s.c. | 1 dawka dla wszystkich dorosłych, nie stosować u osób w immunosupresji, zachować ostrożność u osób w wieku >60 lat |
| przeciwko zapaleniu mózgu przenoszonemu przez kleszcze | zawiera inaktywowane wirusy | i.m. | 3 dawki: 0, 1–3 mies. i 5–12 mies. |
| a Kluczowe znacznie ma wizyta w poradni medycyny podróży, aby ustalić, które infekcje
występują endemicznie w regionie będącym celem podróży i jakie szczepienia są wskazane. i.m. – domięśniowo, p.o. – doustnie, s.c. – podskórnie | |||
Kluczowe znacznie ma wizyta w poradni medycyny podróży, aby ustalić, które infekcje występują endemicznie w regionie będącym celem podróży, jednak personel takich poradni może nie mieć wystarczającej wiedzy na temat ryzyka związanego z wstrzymaniem leczenia immunosupresyjnego w celu podania pacjentowi „żywej” szczepionki. W związku z tym lekarz prowadzący powinien poinformować chorego na NChZJ o ryzyku związanym z wstrzymaniem leczenia immosupresyjnego z uwagi na możliwość wystąpienia utraty odpowiedzi na leczenie biologiczne lub nawrotu choroby. Należy również przedyskutować z pacjentem, czy podróż w ogóle jest wskazana. Pojawiają się dane sugerujące, że „żywe” szczepionki są bezpieczne u niektórych osób w immunosupresji. Zależy to od schematu leczenia immunosupresyjnego i rodzaju „żywej” szczepionki.19 Jednak eksperci CDC nie zalecają podawania atenuowanych szczepionek chorym przyjmującym leki powodujące głęboką immunosupresję, dopóki nie będą dostępne prospektywne badania oceniające bezpieczeństwo takiego postępowania (ryc. 3.).

Ryc. 3. Stosowanie „żywych” szczepionek u chorych na NChZJ
Jeżeli wskazane jest szczepienie „żywą” szczepionką (np. przeciwko żółtej gorączce), eksperci CDC zalecają zachowanie 3-miesięcznego odstępu między zakończeniem leczenia immunosupresyjnego związanego ze znacznym upośledzeniem odporności a wykonaniem szczepienia.20
Podsumowując, lekarze opiekujący się chorymi na NChZJ mogą ograniczyć ryzyko związane z chorobami, którym można zapobiegać poprzez szczepienia, przejmując odpowiedzialność za właściwą realizację szczepień lub dzieląc ją z innymi lekarzami. Obciążenie chorobami zakaźnymi w tej grupie pacjentów można również zmniejszyć, odpowiednio modyfikując kalendarz szczepień.
Konflikt interesów: Osoby odpowiedzialne za treść artykułu: Freddy
Caldera, DO, MS, Mary S. Hayney, PharmD, MPH, Francis A. Farraye,
MD, MSc.
Udział autorów w powstaniu artykułu: koncepcja artykułu, wstępny
przegląd piśmiennictwa, napisanie manuskryptu: F.C., M.S.H.: edycja
manuskryptu, rewizja zaleceń.
Wsparcie finansowe: nie zgłoszono.
Potencjalny konflikt interesów: nie zgłoszono. F.C. otrzymał
dofinansowanie badawcze od firm Takeda Pharmaceuticals i Sanofi.
Pracował jako konsultant firm Takeda, GSK i Celgene. F.C. był
członkiem komitetu doradczego firmy Glaxo, Smith Kline, Janssen,
Merck, Pfizer i Takeda.
Piśmiennictwo:
1. Kantso B., Simonsen J., Hoffmann S., et al.: Inflammatory bowel disease patients are at increased risk of invasive pneumococcal disease: A Nationwide Danish Cohort Study 1977–2013. Am. J. Gastroenterol., 2015; 110: 1582–15872. Tinsley A., Navabi S., Williams E.D., et al.: Increased risk of influenza and influenza-related complications among 140,480 patients with inflammatory bowel disease. Inflamm. Bowel. Dis., 2018; 25: 369–376
3. Khan N., Patel D., Trivedi C., et al.: Overall and comparative risk of herpes zoster with pharmacotherapy for inflammatory bowel diseases: a Nationwide Cohort Study. Clin. Gastroenterol. Hepatol., 2018; 16: 1919–1927.e3
4. Farraye F.A., Melmed G.Y., Lichtenstein G.R., et al.: ACG clinical guideline: preventive care in inflammatory bowel disease. Am. J. Gastroenterol., 2017; 112: 241–258
5. Freedman M., Kroger A., Hunter P., et al.: Recommended adult immunization schedule, United States, 2020. Ann. Intern. Med., 2020; 172: 337–347
6. Launay O., Abitbol V., Krivine A., et al.: Immunogenicity and safety of influenza vaccine in inflammatory bowel disease patients treated or not with immunomodulators and/or biologics: A two-year prospective study. J. Crohns Colitis, 2015; 9: 1096–1107
7. Caldera F., Hillman L., Saha S., et al.: Immunogenicity of high dose influenza vaccine for patientswith inflammatory bowel disease on anti-TNF monotherapy: a randomized clinical trial. Inflamm. Bowel. Dis., 2020; 26: 593–602
8. Falsey A.R., Treanor J.J., Tornieporth N., et al.: Randomized, double-blind controlled phase 3 trial comparing the immunogenicity of high-dose and standard-dose influenza vaccine in adults 65 years of age and older. J. Infect. Dis., 2009; 200: 172–180
9. Long M.D., Martin C., Sandler R.S., et al.: Increased risk of pneumonia among patients with inflammatory bowel disease. Am. J. Gastroenterol., 2013; 108: 240–248
10. van Aalst M., Garcia Garrido H.M., van der Leun J., et al.: Immunogenicity of the currently recommended pneumococcal vaccination schedule in patients with inflammatory bowel disease. Clin. Infect. Dis., 2019; 70: 595–604
11. Long M.D., Martin C., Sandler R.S., et al.: Increased risk of herpes zoster among 108 604 patients with inflammatory bowel disease. Aliment. Pharmacol. Ther., 2013; 37: 420–429
12. Caldera F., Hayney M.S., Cross R.K.: Using number needed to harm to put the risk of herpes zoster from tofacitinib in perspective. Inflamm. Bowel. Dis., 2019; 25: 955–957
13. Vink P., Ramon Torrell J.M., Sanchez Fructuoso A., et al.: Immunogenicity and safety of the adjuvanted recombinant zoster vaccine in chronically immunosuppressed adults following renal transplant: A phase 3, randomized clinical trial. Clin. Infect. Dis., 2020; 70: 181–190
14. McLean H.Q., Fiebelkorn A.P., Temte J.L., et al.: Prevention of measles, rubella, congenital rubella syndrome, and mumps, 2013: Summary recommendations of the advisory committee on immunization practices (ACIP). MMWR Recomm. Rep., 2013; 62: 1–34
15. Marin M., Güris D., Chaves S.S., et al.; Advisory Committee on Immunization Practices, Centers for Disease Control and Prevention (CDC): Prevention of varicella: Recommendations of the advisory committee on immunization practices (ACIP). MMWR Recomm. Rep., 2007; 56: 1–40
16. Kroger A., Duchin J., Vazquez M.: General best practice guidelines for immunization of the advisory committee on immunization practice. 2017 (www.cdc.gov/vaccines/hcp/acip-recs/general-recs/index.html). (January 31, 2020)
17. Behrman A., Lopez A.S., Chaves S.S., et al.: Varicella immunity in vaccinated healthcare workers. J. Clin. Virol., 2013; 57: 109–114
18. Caldera F., Misch E.A., Saha S., et al.: Immunosuppression does not affect antibody concentrations to measles, mumps, and rubella in patients with inflammatory bowel disease. Dig. Dis. Sci., 2019; 64: 189–195
19. Croce E., Hatz C., Jonker E.F., et al.: Safety of live vaccinations on immunosuppressive therapy in patients with immune-mediated inflammatory diseases, solid organ transplantation or after bone-marrow transplantation – a systematic review of randomized trials, observational studies and case reports. Vaccine, 2017; 35: 1216–1226
20. Center for Disease Control and Prevention. CDC Yellow Book 2020: Health Information for International Travel. Oxford University Press, New York, 2017


























