Tłumaczyła mgr Małgorzata Ściubisz
Komentarz prof. dr hab. n. med. Leszek Szenborn, Klinika Pediatrii i Chorób Infekcyjnych Uniwersytetu Medycznego we Wrocławiu
Skróty: bOPV (bivalent oral polio vaccine) – 2-walentna OPV, cVDPV (circulating vaccine-derived poliovirus) – krążący zmutowany wirus polio pochodzenia szczepionkowego , cVDPV2 (serotype 2 circulating vaccine-derived poliovirus) – cVDPV typu 2, EPI (Expanded Programme on Immunization) – Rozszerzony Program Szczepień, GPEI (Global Polio Eradication Initiative) – Światowa Inicjatywa na rzecz Eradykacji Polio, IPV (inactivated polio vaccine) – inaktywowana szczepionka przeciwko polio, mOPV2 (monovalent serotype 2 oral poliovirus vaccine) – monowalentna OPV zawierająca typ 2 wirusa polio, nOPV (novel oral polio vaccine) – nowa OPV, nOPV2 (novel serotype 2 oral polio vaccine) – nOPV zawierająca typ 2 wirusa polio, OPV (oral polio vaccine) – doustna „żywa” szczepionka przeciwko polio, tOPV (trivalent oral polio vaccine) – 3-walentna OPV, USA (United States of America) – Stany Zjednoczone Ameryki, VAPP (vaccine-associated paralytic poliomyelitis) – porażenie wiotkie wywołane szczepami szczepionkowymi, VDPV (vaccine-derived poliovirus) – zmutowany wirus polio pochodzenia szczepionkowego, VDPV2 (serotype 2 vaccine-derived poliovirus) – zmutowany wirus polio typu 2 pochodzenia szczepionkowego, WHA (World Health Assembly) – Światowe Zgromadzenie Zdrowia, WHO (World Health Organization) – Światowa Organizacja Zdrowia, WPV (wilde polio virus) – dziki wirus polio, WPV1 (serotype 1 wilde polio virus) – WPV typu 1
Translated from The Journal of Infectious Diseases 224, Issue 12, Supplement 4, John F Modlin, Ananda S. Bandyopadhyay, Roland Sutter, Immunization against ppoliomyelitis and the cchallenges to worldwide poliomyelitis eradication: S398–S404, https://doi.org/10.1093/infdis/jiaa622. © The Authors 2021. Published by Oxford University Press for the Infectious Diseases Society of America. This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by/4.0/), which permits unrestricted reuse, distribution, and reproduction in any medium, provided the original work is properly cited.
Streszczenie
Zarówno IPV, jak i OPV przyczyniły się do szybkiej eradykacji postaci porażennej poliomyelitis w krajach rozwiniętych mimo różnych cech każdej z tych szczepionek. Zgodnie z EPI, ze względu na koszty, łatwość użycia i inne cechy, w 1974 r. do powszechnych programów szczepień niemowląt w krajach o niskich dochodach wprowadzono OPV, ale różnice wyszczepialności i osłabiona odpowiedź immunologiczna z powodu złych warunków sanitarnych ograniczyły jej korzystny efekt. Po rozpoczęciu w 1988 r. GPEI zapadalność na polio zmniejszyła się o >99%, a WPV2 i WPV3 zostały uznane za wyeradykowane. Postęp w walce z WPV1, który obecnie występuje tylko w Afganistanie i Pakistanie, został spowolniony m.in. z powodu konfliktów zbrojnych i bardzo ograniczonego dostępu do szczepień. W 2016 r. tOPV zastąpiono bOPV (zawierającą tylko typ 1 i 3 wirusa polio), co zmniejszyło zapadalność na VAPP. Było to działanie strategiczne i skoordynowane na całym świecie, ale pozwoliło „uciec” VDPV2 w regionach o małej wyszczepialności. W odpowiedzi na to zjawisko ponownie użyto mOPV2, wywołując nowe ogniska VDPV2 i przywracając endemiczność typu 2 wirusa polio. Obecnie prowadzone są badania kliniczne nad nową OPV zawierającą genetycznie stabilniejszy wirus polio typu 2. Być może wkrótce zostanie ona wprowadzona do użycia w celu ograniczenia występowania VDPV2.
Eradykację poliomyelitis uznaje się za jedno z największych osiągnieć nauki i medycyny XX wieku. Historia zachorowań jest dobrze znana. Okresowe epidemie polio obserwowano pod koniec XIX wieku w Skandynawii, Europie Zachodniej i USA, a ich częstotliwość i nasilenie stale się zwiększały aż do czasu rozpoczęcia w latach 50. i wczesnych latach 60. XX wieku, szczepień przeciwko polio, które początkowo realizowano szczepionką inaktywowaną (IPV), a następnie doustną „żywą”, atenuowaną (OPV). Dzięki tym działaniom natychmiast osiągnięto kontrolę nad zachorowaniami w USA oraz innych krajach uprzemysłowionych.1 W USA zapadalność na polio zmniejszyła się z 13,9/100 000 w 1954 roku do <0,5/100 000 w 1965 roku, endemiczna transmisja wirusa ustała w 1970 roku, a ostatni rodzimy przypadek choroby zgłoszono w 1979 roku. Następnie obserwowano już tylko przypadki zawleczone lub wywołane przez szczepy wirusa polio pochodzące z OPV (VAPP). Aktualnie, wraz z osiągnięciem kontroli zachorowań na polio na całym świecie i wprowadzeniem w wielu krajach programów szczepień wyłącznie z użyciem IPV (również w Polsce – przyp. red.), zawleczone przypadki polio obserwuje się sporadycznie.
Jednak w krajach o niskich dochodach, w których ludzie mieszkają w dużych skupiskach i złych warunkach sanitarnych, rzeczywistą sytuację epidemiczną polio przez wiele lat przysłaniały powszechne zakażenia w młodym wieku oraz przeświadczenie, że epidemicznie występujące polio jest chorobą zamożniejszych krajów, ponieważ ekspozycja na wirus polio w starszym wieku w krajach o lepszych warunkach sanitarnych zwiększa ryzyko postaci porażennej. To błędne przekonanie sprostowano po tym, jak w wielu badaniach dotyczących niepełnosprawności przeprowadzonych w lokalnych społecznościach lub w szkołach wykazano, że u 1/100 lub 1/200 dzieci w krajach o niskich dochodach stwierdzono powikłania porażennej postaci polio, co dorównywało wskaźnikom zapadalności obserwowanym w szczytowych latach epidemii w krajach rozwiniętych.2 Obserwacje te stanowiły poparcie dla decyzji Światowej Organizacji Zdrowia (WHO) o włączeniu OPV do Rozszerzonego Programu Szczepień (EPI), począwszy od 1974 roku.3
Szczepionki przeciwko polio
Korzyści ze stosowania IPV i OPV były przedmiotem dyskusji od czasu ich wprowadzenia do użytku, jednak obie przyczyniły się do osiągnięcia kontroli nad zachorowaniami na polio i – w optymistycznym scenariuszu – ostatecznej eradykacji choroby (p. tab. 1).
| Tabela 1. Aktualnie stosowane szczepionki oraz ich właściwości kluczowe dla całkowitej eradykacji polio | ||
|---|---|---|
| IPV (szczep Salka) | OPV (szczep Sabina) | |
| immunologiczne | ||
| odpowiedź immunologiczna związana z błoną śluzową jelit | minimalna | obecna |
| logistyczne | ||
| użycie w ramach SIA w odpowiedzi na ogniska epidemiczne | utrudnione | odpowiednie |
| ryzyko produkcyjne zagrażające kontroli zachorowań | duże | małe |
| koszt | wysoki | niski |
| zdarzenia niepożądane | ||
| ryzyko VAPP | brak | obecne |
| ryzyko VDPV | brak | obecne |
| IPV (inactivated polio vaccine) – inaktywowana szczepionka przeciwko polio, OPV (oral polio vaccine) – doustna, „żywa” szczepionka przeciwko polio, SIA (supplementary immunization activity) – programy szczepień wychwytujących, VAPP (vaccine-associated paralytic poliomyelitis) – porażenie wiotkie wywołane szczepami szczepionkowymi, VDPV (vaccine-derived poliovirus) – zmutowany wirus polio pochodzenia szczepionkowego | ||
Inaktywowana szczepionka przeciwko polio
Obecnie IPV produkuje się metodą opracowaną przez Jonasa Salka i Juliusa Youngnera, w której wykorzystali inaktywację formaliną dobrze scharakteryzowanych 3 różnych serotypów wirusa wyizolowanych od chorych na polio. Skuteczność pierwszych IPV oceniono w badaniu terenowym Francis Field Trial (prowadzonym w latach 1954–1955 przez Thomasa Francisa Jr. – przyp. red.), wykazując, że 3 dawki szczepionki podane w ciągu 5 tygodni zapewniały ochronę przed polio u 70% zaszczepionych dzieci.4 Dzięki udoskonaleniu technologii produkcji w latach 70. XX wieku, m.in. poprzez wykorzystanie mikronośników w celu zwiększenia gęstości komórek, opracowano preparaty o „zwiększonej sile działania”, zawierające odpowiednio 40, 8 i 32 jednostki antygenu D wirusa typu 1, 2 i 3 na dawkę, co jest uznawane za uniwersalny standard (tak jak w aktualnie stosowanych szczepionkach inaktywowanych – przyp. red.). Odpowiedź immunologiczna na IPV zależy od liczby podanych dawek, odstępu czasu między poszczególnymi dawkami oraz obecności przeciwciał matczynych, które osłabiają odpowiedź immunologiczną u niemowląt do 6. miesiąca życia.5-7 Wykrywalne miano przeciwciał neutralizujących w surowicy chroni przed chorobą, a jego ≥4-krotne zwiększenie jest powszechnie uznawane za standardową definicję serokonwersji.8 IPV podana zgodnie z powszechnymi zaleceniami w 3-dawkowym schemacie zapewnia serokonwersję dla każdego typu wirusa u 85–100% niemowląt.9 Pojedyncza dawka IPV – podana zgodnie z zaleceniami WHO w 14. tygodniu życia, jako uzupełnienie szczepienia 2-walentną OPV (bOPV) zawierającą typ 1 i 3 wirusa – zapewnia serokonwersję dla typu 2 wirusa polio u 65–70% niemowląt.10 IPV produkowana z atenuowanych szczepów Sabina z OPV jest aktualnie zarejestrowana w Japonii oraz Chinach, a niedługo będzie dostępna także w innych krajach (w Korei jako pierwszej).11
Doustna szczepionka przeciwko polio
„Żywe”, atenuowane szczepy Sabina zawarte w OPV uzyskano w wyniku pasażowania wirusów polio w hodowlach komórkowych pochodzących od naczelnych, a w przypadku typu 2 wirusa polio również od szympansów, z których następnie wybrano mutanty o małej zjadliwości dla naczelnych.12 Udane próby terenowe z użyciem OPV przeprowadzono w latach 1955–1959, a do rutynowego stosowania wprowadzono ją w latach 1961–1962, jako preparaty monowalentne podawane jeden po drugim. W 1964 roku zarejestrowano 3-walentną OPV (tOPV) i ze względu na większą immunogenność, w porównaniu z dostępnymi wówczas IPV, niższy koszt i łatwość podawania, szybko wprowadzono ją do programów powszechnych szczepień niemowląt w niemal wszystkich krajach. Chociaż wkrótce po rozpoczęciu szczepień z użyciem OPV rozpoznano rzadkie przypadki VAPP,13 w większości krajów tOPV stanowiła szczepionkę pierwszego wyboru do końca późnych lat 90. XX wieku i wczesnych lat XXI wieku. Wówczas, ze względu na brak przypadków polio wywołanych przez dziki wirus (WPV), a także wprowadzenie IPV jako składowej szczepionek skojarzonych przeciwko błonicy, tężcowi i krztuścowi (DTP) oraz innych szczepionek stosowanych u niemowląt w wielu krajach o średnich i wysokich dochodach, nawet niewielka liczba przypadków VAPP stała się nieakceptowalna.14
Niski koszt, łatwość podawania, transmisja wirusa szczepionkowego na osoby nieuodpornione (przez kilka tygodni po szczepieniu wirus szczepionkowy z OPV namnaża się w jelitach, jest wydalany i może się przenosić na osoby z kontaktu; oznacza to, że w regionach o niskim poziomie higieny i w gorszych warunkach sanitarnych szczepienie OPV może prowadzić do „biernego” uodpornienia osób niezaszczepionych – przyp. red.) oraz zdolność do stymulowania odporności miejscowej w przewodzie pokarmowym sprawiły, że dalsze stosowanie OPV w krajach o niskich dochodach było logicznym wyborem. W ramach EPI i Światowej Inicjatywy na rzecz Eradykacji Polio (GEPI) przez wiele lat tOPV stosowano do realizacji powszechnych programów szczepień. Po 2005 roku do kampanii szczepień wychwytujących w ostatnich krajach endemicznych wprowadzono monowalentną OPV zawierającą typ 1 wirusa (mOPV1) lub typ 3 (mOPV3), a następnie 2-walentną OPV zawierającą typ 1 i 3 wirusa (bOPV), aby rozwiązać problem interferencji (zjawisko to polega na braku możliwości namnożenia się wirusa lub innego typu tego samego wirusa w komórce w wyniku wcześniejszego zakażenia innym wirusem lub innym typem tego samego wirusa – przyp. red.) wywołanej przez typ 2 wirusa zawarty w tOPV oraz zwiększyć serokonwersję wobec typu 1 i 3 wirusa.15-17 W 2016 roku, po wykorzystaniu tych szczepionek w kampaniach wychwytujących, rozpoczęto skoordynowane na całym świecie „przejście” na stosowanie bOPV zamiast tOPV w ramach powszechnych szczepień, aby zwiększyć odpowiedź immunologiczną wobec typu 1 i 3 wirusa oraz zapobiec nowym przypadkom VAPP wywołanych wirusem typu 2 zawartym w OPV.18 Aktualnie tOPV jest już niedostępna, a mOPV zawierającą typ 2 wirusa można zastosować za zgodną Dyrektora Generalnego WHO wyłącznie w celu kontroli ognisk wywołanych wirusem polio typu 2 pochodzenia szczepionkowego (VDPV2).
W dużym badaniu przeprowadzonym w Indiach wykazano, że po podaniu 2 dawek bOPV (po urodzeniu i w 28. dż.) wskaźnik serokonwersji wyniósł 86 i 74% odpowiednio wobec typu 1 i 3 wirusa, był większy niż po podaniu tOPV i nie gorszy niż po podaniu mOPV1 i mOPV3.19 Podobnie mOPV charakteryzowała się dużą immunogennością u niemowląt, ze wskaźnikiem serokonwersji wynoszącym blisko 90% po podaniu 1 dawki.20,21 Oprócz zjawiska interferencji odpowiedź immunologiczną na OPV dodatkowo osłabia przewlekłe niedożywienie, enteropatia jelitowa, biegunka i współistniejące zakażenia innymi enterowirusami.22-24 W związku z tym w celu uzyskania odporności i ograniczenia transmisji wirusa polio dzieciom mieszkającym w niesprzyjających warunkach należy podać większą liczbę dawek OPV.25,26
VAPP jest rzadkim, ale ciężkim zdarzeniem niepożądanym OPV, które może wystąpić u osoby zaszczepionej lub z kontaktu. Klinicznie nie można go odróżnić od polio wywołanego przez dziki wirus. Przed 2014 rokiem w krajach stosujących tOPV zapadalność na VAPP szacowano na 2–4/1 000 000 kohorty urodzeniowej (250–500 przypadków) rocznie.27,28 Od czasu wycofania OPV2 i wprowadzenia do stosowania w ramach EPI szczepionki IPV zapadalność na VAPP zmniejszyła się <2/1 000 000 (niepublikowane dane WHO). Ryzyko VAPP było główną przyczyną rezygnacji ze stosowania OPV2 w 2016 roku i przyjęcia planu o całkowitym wycofaniu z użycia OPV w celu eradykacji polio na całym świecie.27
Światowa Inicjatywa na rzecz Eradykacji Polio
Sukces programu eradykacji ospy prawdziwej w latach 70. XX wieku przyczynił się do rozpoczęcia w 1974 roku EPI, kiedy eksperci zdrowia publicznego coraz bardziej starali się wykorzystać pełny potencjał szczepionek. Rotary International za priorytetowy cel obrała zapobieganie polio i sfinansowała zakup szczepionki przeciwko polio dla niektórych najbiedniejszych krajów. W 1985 roku Pan American Health Organization (PAHO) postanowiła wyeradykować polio z półkuli zachodniej. Szybki postęp w realizacji tego celu zachęcił światową społeczność ekspertów zdrowia publicznego do rozważenia, czy polio może być celem globalnej eradykacji. W tym samym czasie wielu polityków zaangażowało się osobiście w zapobieganie tej chorobie, obserwując jej wyniszczające skutki u dzieci. Wkrótce polio znalazło się na szczycie listy chorób, które potencjalnie można eradykować.
Te wydarzenia skłoniły Światowe Zgromadzenie Zdrowia (WHA), organ wykonawczy WHO, do podjęcia rezolucji o eradykacji polio do 2000 roku.29 Działania w tym kierunku realizowano w ramach specjalnie do tego powołanej GPEI, w skład której wchodziły: Rotary International, amerykańskie Centers for Disease Control and Prevention, United Nations Children’s Fund (UNICEF) oraz WHO. Później partnerem inicjatywy została Bill & Melinda Gates Foundation oraz Global Alliance for Vaccines and Immunization (GAVI). Kluczowe znaczenie dla powodzenia programu miało pełne zaangażowanie krajowych ministerstw zdrowia, organizacji pozarządowych, organizacji zbierających fundusze od darczyńców oraz instytucji charytatywnych.
Postępy w eradykacji polio
W 1988 roku, kiedy powołano GPEI, w >125 krajach na świecie rocznie notowano łącznie >350 000 przypadków poliomyelitis. Wdrożenie głównych strategii wstępnie opracowanych przez PAHO i dostosowanych do krajów endemicznego występowania polio w Azji i Afryce, w tym nadzoru epidemiologicznego nad ostrymi porażeniami wiotkimi, kampanii szczepień wychwytujących oraz wsparcia realizacji programów powszechnych szczepień niemowląt z użyciem tOPV, doprowadziło do szybkiego zmniejszenia zapadalności na polio na świecie, najpierw w krajach o lepiej rozwiniętych systemach opieki zdrowotnej, w tym w Regionie Ameryk (Ameryki Północnej i Środkowej oraz Południowej – przyp. red.), gdzie ostatni przypadek polio wywołany WPV zgłoszono w 1991 roku, w Regionie Zachodniego Pacyfiku, w tym w Chinach, gdzie ostatni przypadek odnotowano w 1997 roku, oraz w Regionie Europejskim, gdzie ten sam krok milowy osiągnięto w 1999 roku (p. ryc. 1).30,32
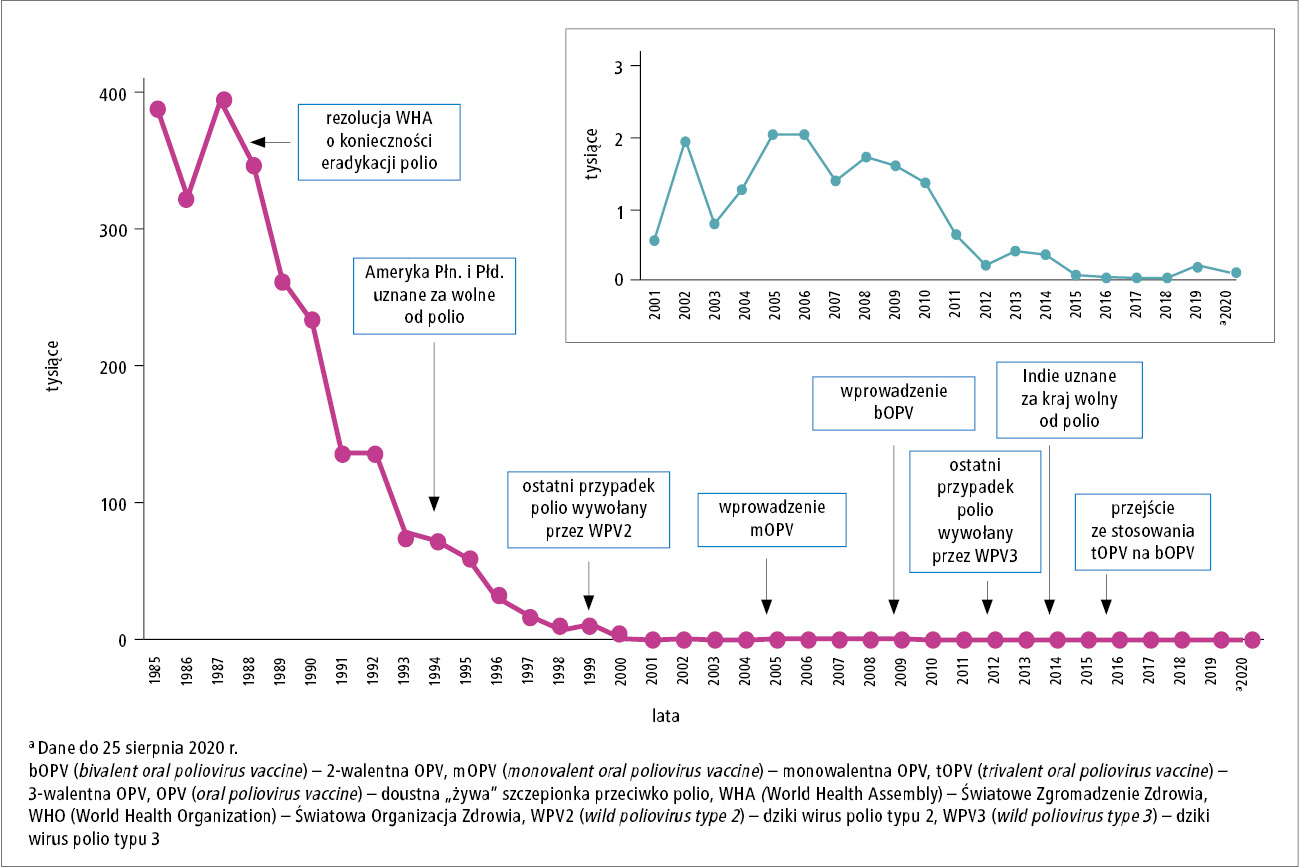
Ryc. 1. Przypadki polio wywołane przez dziki wirus zgłoszone na świecie w latach 1985–2020 (opracowano na podstawie danych WHO)
Do połowy lat 90. XX wieku wysiłki na rzecz eradykacji polio w pełni podjęto we wszystkich krajach endemicznych, w tym w Indiach, które odpowiadały za >50% wszystkich przypadków tej choroby na świecie, oraz w Afryce Subsaharyjskiej, gdzie w 1997 roku podjęto inicjatywę pod hasłem „wykopać polio z Afryki”, nawiązując do piłki nożnej. Wprawdzie do 2000 roku nie osiągnięto pierwotnie założonego celu, jednak liczba krajów zgłaszających przypadki polio zmniejszyła się do 20, a liczba zachorowań zmniejszyła się o >99%. Ponadto, w Indiach ostatni rodzimy przypadek polio wywołany dzikim wirusem typu 2 (WPV2) wykryto na północy kraju w 1999 roku.34
Szybki postęp w eradykacji wirusa polio typu 1 i 3 kontynuowano w nowym tysiącleciu – do 2010 roku liczba zachorowań na polio zmniejszyła się do kilkuset, a ich występowanie ograniczyło się do 4 krajów endemicznych (Afganistan, Indie, Nigeria, Pakistan). Główne działania związane z eradykacją skupiają się teraz w krajach o słabiej rozwiniętych systemach opieki zdrowotnej w Azji, Środkowym Wschodzie i Afryce, gdzie często zgłaszano przypadki polio wywołane WPV, zwłaszcza typu 1, zawleczone z krajów endemicznych. Stanowiło to szczególne wyzwanie, podobnie jak odkrycie, że w rozwijających się krajach tropikalnych, szczególnie na subkontynencie indyjskim, immunogenność tOPV była mniejsza.25 Aby poprawić odpowiedź immunologiczną na OPV podawaną w ramach dużych kampanii szczepień wychwytujących, w 2005 roku zaczęto stosować mOPV1 i mOPV3, a w 2009 roku zarejestrowano i po raz pierwszy użyto bOPV zawierającą typ 1 i 3 wirusa polio.35 Uważa się, że wprowadzenie do użytku mOPV i bOPV doprowadziło do wyeliminowania łańcuchów transmisji WPV w Indiach, gdzie ostatni rodzimy przypadek polio wywołany WPV typu 1 (WPV1) wykryto w styczniu 2011 roku i tym samym w 2014 roku niezależna komisja uznała cały Region Azji Południowej WHO za wolny od polio.36 Krążenie WPV typu 3 (WPV3) ostatni raz zgłoszono na północy Nigerii w 2012 roku, dzięki czemu w 2019 roku wydano certyfikat potwierdzający jego światową eradykację. Ostatni przypadek polio wywołany WPV w Afrykańskim Regionie WHO wykryto w Nigerii w 2016 roku i tym samym w 2020 roku region ten otrzymał certyfikat regionu wolnego od dzikiego wirusa polio (certyfikat regionu wolnego od polio przyznaje Światowa Komisja Certyfikująca Eradykację Polio; aby go otrzymać, wszystkie kraje w danym regionie muszą wykazać brak transmisji dzikiego wirusa polio przez ≥3 lata; aktualnie certyfikat regionu wolnego od polio otrzymały wszystkie regiony WHO, poza Wschodnim Regionem Morza Śródziemnego – przyp. red.).
W ostatniej dekadzie transmisja WPV1 ograniczała się do Afganistanu i Pakistanu, a w latach 2016–2018 liczba przypadków polio na świecie zmniejszyła się do <40/rok (p. ryc. 1). Niestety działania w zakresie kontroli wirusa polio w tych krajach uległy stagnacji z powodu ograniczonego dostępu do szczepień wynikającego z zamieszek, trwającej tam wojny domowej i powstań, niewystarczającej jakości działań związanych z eradykacją polio, zwłaszcza małego odsetka zaszczepionych, a aktualnie również w związku z pandemią COVID-19. Aby przerwać ostatnie łańcuchy transmisji WPV1 w Afganistanie i Pakistanie, należy rozwiązać problem braku bezpieczeństwa w tych krajach, dostępu do szczepionek i dezinformacji na temat szczepień. W połowie 2020 roku krążenie WPV1 nadal ograniczone było do Afganistanu i Pakistanu, gdzie potwierdzono łącznie 33, 176 i 146 przypadków polio odpowiednio w 2018, 2019 i 2020 roku (dane WHO na dzień 12.01.2021 r. [aktualnie transmisja WPV nadal ogranicza się do Pakistanu i Afganistanu; w 2021 r. łącznie potwierdzono tam 5 przypadków polio, a w okresie od 1 stycznia do 10 maja 2022 r. zgłoszono 2 przypadki polio w Pakistanie i 1 w Afganistanie – przyp. red.]).
VDPV i zamiana tOPV na bOPV
Wyzwania, których nie przewidziano w czasie przygotowywania rezolucji WHA w 1988 roku, w szczególności związane z pojawieniem się i rozprzestrzenieniem krążącego zmutowanego wirusa polio pochodzenia szczepionkowego (cVDPV), spowolniły postęp w eradykacji polio, wymuszając zaangażowanie do walki znacznie większych zasobów. Pod koniec lat 90. XX wieku dzięki technologii sekwencjonowania materiału genetycznego wirusów odkryto, że przyczyną ogniska polio na Haiti był cVDPV typu 1. Po raz pierwszy udowodniono wtedy, że atenuowany szczep Sabina wirusa polio może mutować, przyjmować zdolność do przenoszenia i neurowirulencji charakterystycznych dla WPV oraz inicjować łańcuch transmisji wirusa, co z kolei odpowiada za występowanie ognisk epidemicznych.37 Wkrótce okazało się, że ciągłe stosowanie szczepów Sabina nie pozwoli na całkowitą eradykację polio. W związku z tym podjęto trwające dekadę działania w celu określenia ryzyka związanego z pojawieniem się cVDPV (również z wykorzystaniem modelowania matematycznego) oraz uzupełniania pewnych informacji. Prowadzono też szeroko zakrojone konsultacje z ekspertami zajmującymi się zdrowiem na całym świecie. Opracowano plan strategiczny, który zakładał stopniowe odchodzenie od stosowania szczepów Sabina w OPV, począwszy od szczepów wirusa typu 2, i wprowadzenia ≥1 dawki IPV do EPI, aby zapewnić podstawową ochronę przed postacią porażenną polio i zmniejszyć ryzyko pojawienia się cVDPV.18 Za zgodą WHA, organu wykonawczego WHO, w 2016 roku w blisko 125 krajach wdrożono skoordynowany plan „przejścia” ze stosowania tOPV na bOPV (do kwietnia 2016 r. w Polsce szczepienie przeciwko polio obejmowało podanie 3 dawek IPV do ukończenia 2. rż. i dawki uzupełniającej tOPV w 6. rż.; biorąc pod uwagę zalecenia WHO, w Polsce całkowicie zrezygnowano ze stosowania OPV i dawkę uzupełniającą OPV w 6. rż. zastąpiono IPV; p. także Światowa rewolucja w powszechnych szczepieniach przeciwko poliomyelitis? – przyp. red.).38 Zmianie tej towarzyszyły opóźnienia we wprowadzaniu IPV do programów powszechnych szczepień z powodu ograniczonych dostaw tego preparatu, które dotknęły 43 kraje, jednak w większości z nich problem ten rozwiązano do końca 2019 roku.
Pojawienie się cVDPV oraz jego rozprzestrzenianie
Dzięki rezygnacji ze stosowania szczepu Sabina wirusa polio typu 2 oraz wprowadzeniu do programu powszechnych szczepień IPV zapadalność na VAPP zmniejszyła się o 60% (rocznie o 150–300 mniej zachorowań na świecie). Niestety, utrzymująca się transmisja cVDPV, który pojawił się jeszcze w okresie przed zmianą tOPV na bOPV, oraz coraz większa „luka” w odporności wobec typu 2 wirusa polio, która powstała w związku z tą zmianą, doprowadziły do wybuchu większej liczby ognisk VDPV2 niż przewidywano na podstawie ówczesnych modeli matematycznych, a użycie do kontroli tych ognisk monowalentnej OPV zawierającej tylko typ 2 wirusa polio (mOPV2) doprowadziło do pojawienia się kolejnych przypadków.39 W okresie od 2016 roku do września 2020 roku ogniska cVDPV typu 2 (cVDPV2) pojawiły się w 24 krajach, głównie w Afryce Subsaharyjskiej, ale również w Pakistanie, Afganistanie, Chinach, na Filipinach i w Malezji, co wymagało wielokrotnych kampanii szczepień z użyciem mOPV2 lub bOPV (p. ryc. 2).40 W 2020 roku za porażenia wiotkie u dzieci częściej odpowiadał cVDPV2 (918 przypadków) niż WPV (140 przypadków).41 Dopóki działania kontrolne nie pozwolą osiągnąć odpowiedniego poziomu odporności populacyjnej na dotkniętych obszarach, nowe ogniska cVDPV nadal będą się pojawiać w regionach, w których prowadzi się akcje szczepień z użyciem mOPV2. Stwarza to ryzyko przywrócenia endemicznej transmisji wirusa polio typu 2 na całym świecie.
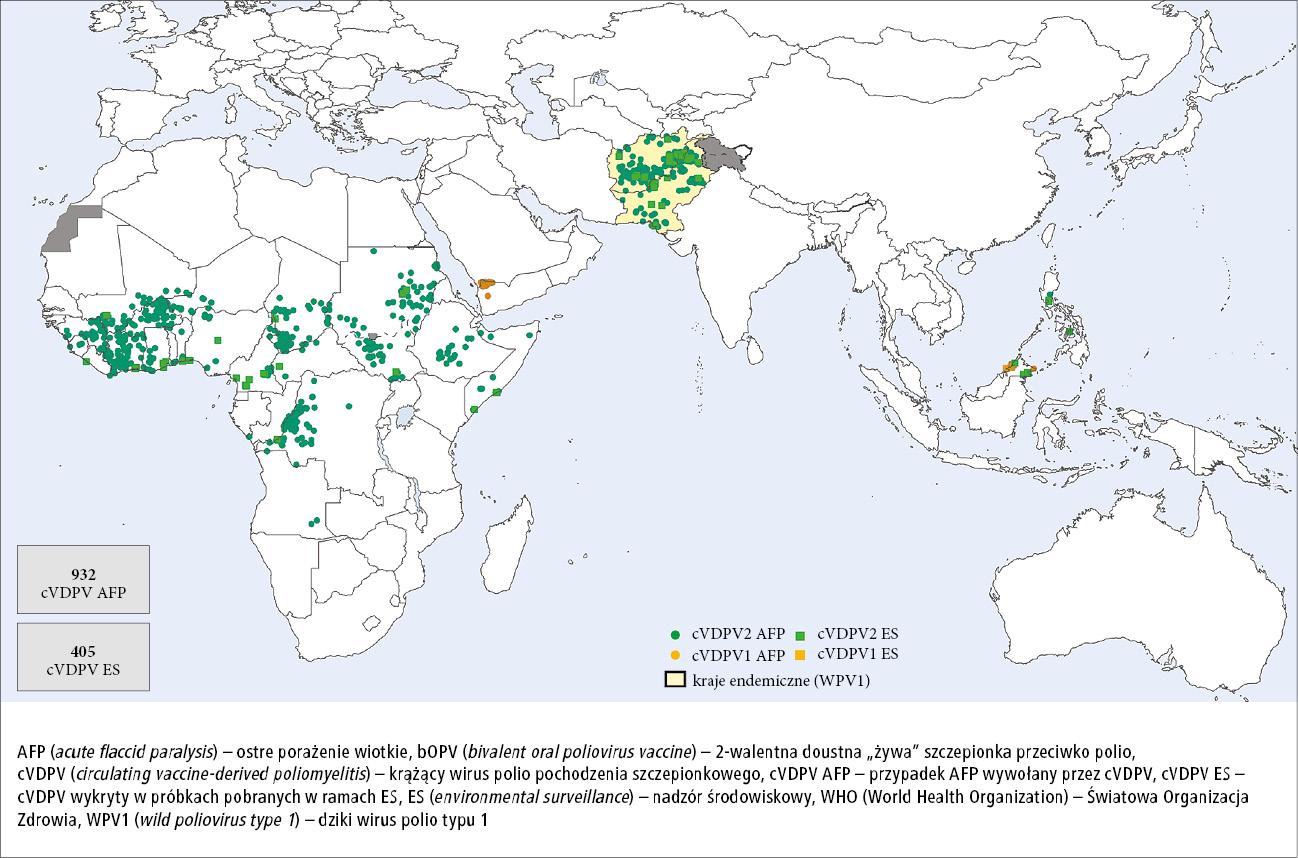
Ryc. 2. Izolaty krążącego wirusa polio pochodzenia szczepionkowego (przypadki AFP lub wykrycie wirusa w próbkach pobranych w ramach ES) w okresie od 1 stycznia do 31 grudnia 2020 r. (opracowali: Courtesy Ondrej Mach i Ajay Kumar Goel, WHO)
Przewlekłe zakażenie VDPV u osób z wrodzonymi niedoborami odporności
Inną przeszkodą na drodze do osiągnięcia i utrzymania długoterminowej eradykacji polio są rzadkie przypadki, w których osoby z wrodzonymi niedoborami odporności wydalają VDPV przez bardzo długi czas po szczepieniu, co stwarza ryzyko nowych ognisk w regionach, gdzie w innych warunkach transmisję by przerwano.42 Ponad 10 lat temu Task Force for Global Health rozpoczął badania nad opracowaniem leków przeciwwirusowych hamujących replikację wirusa. W badaniach tych wykazano, że pokapawir, inhibitor białek kapsydu opracowany przez konsorcjum Task Force for Global Health, jest skuteczny. Drugi lek przeciwwirusowy, inhibitor proteazy 3C, aktualnie jest w II fazie badań klinicznych.43 Wstępne dane sugerują, że być może konieczne będzie stosowanie kombinacji leków, aby zapewnić skuteczność leczenia i jednocześnie zmniejszyć ryzyko rozwoju oporności.
Nowe szczepionki przeciwko polio
Wyzwanie, jakim jest osiągnięcie i utrzymanie eradykacji, zrodziło ewidentną potrzebę opracowania nowych szczepionek przeciwko polio. W pracy nad nimi wykorzystano platformy technologiczne, które wcześniej posłużyły do opracowania IPV. Poczyniono także znaczne postępy w kierunku opracowania nowych IPV i OPV z adiuwantem, modyfikowanych genetycznie lub opartych na nowych technologiach produkcyjnych, odpowiadające zarówno na obecne, jak i przyszłe potrzeby (p. tab. 2).
| Tabela 2. Nowe szczepionki przeciwko polio | |||
|---|---|---|---|
| Rodzaj szczepionki | Cecha charakterystyczna | Przykłady preparatów | Aktualny status |
| pozajelitowe, inaktywowane | zmniejszenie ilości antygenu poprzez podanie mniejszej dawki | szczepionka śródskórna | stosowana w niektórych krajach |
| szczepionka domięśniowa | w trakcie badań klinicznych | ||
| zmniejszenie ilości antygenu poprzez dodanie adiuwantu | Alum (AJ Vaccines) | zarejestrowana w 2019 r., wstępnie zatwierdzona przez WHO | |
| adiuwant indukujący odporność związaną z błonami śluzowymi | dmLT-IPV | w trakcie badań klinicznych | |
| bezpieczniejsza produkcja | Sabin IPV | zarejestrowana w Japonii i Chinach, wstępnie zatwierdzona przez WHO inne szczepionki tego typu są w zaawansowanej fazie badań klinicznych | |
| S19 IPV | w trakcie badań klinicznych | ||
| zawierająca VLP | w trakcie badań przedklinicznych | ||
| doustna, „żywa” | większa stabilność genetyczna | nOPV | nOPV dopuszczona przez WHO do stosowania w sytuacjach wyjątkowych, nOPV1 i nOPV3 w trakcie badań przedklinicznych |
| dmLT (double-mutant labile toxin) – podwójnie modyfikowana niestabilna toksyna, IPV (inactivated polio vaccine) – inaktywowana szczepionka przeciwko polio, nOPV (novel oral polio vaccine) – nowa doustna szczepionka przeciwko polio, nOPV1 (novel serotype 1 oral polio vaccine) – nOPV zawierająca typ 1 wirusa polio, nOPV3 (novel serotype 3 oral polio vaccine) – nOPV zawierająca typ 3 wirusa polio, WHO (World Health Organization) – Światowa Organizacja Zdrowia, VLP (virus-like particles) – cząstki wirusopodobne | |||
Inaktywowane szczepionki przeciwko polio
Ryzyko transmisji wirusa polio jest coraz mniejsze, dlatego rutynowo stosowana OPV będzie zastępowana w poszczególnych krajach preparatem IPV, tak aby zapobiec pojawieniu się VDPV. Zgodnie z zaleceniami Komitetu doradczego WHO – Strategic Advisory Group of Experts (SAGE) – po wycofaniu OPV szczepienia z użyciem IPV należy kontynuować na całym świecie przez ≥10 lat i bezterminowo w krajach, w których znajduje się niezbędna dla wirusa polio infrastruktura, w tym zakłady produkcyjne IPV, aby zmniejszyć ryzyko nawrotu ognisk epidemicznych polio wywołanych przez niewykryty cVDPV oraz ograniczyć wydalanie wirusa szczepionkowego przez osoby z niedoborami odporności i narażenie środowiskowe w wyniku przypadkowego uwolnienia wirusa z zakładu produkcyjnego lub laboratorium.44 Realizacja tych założeń wiąże się z większym zapotrzebowaniem na IPV, ale po znacznie niższych kosztach niż obecnie, tak aby zapewnić dostęp do tej szczepionki wszystkim krajom o niskich i średnich dochodach. Opracowywane są różne strategie, które pozwolą sprostać tej potrzebie, łącznie ze zmniejszeniem ilości antygenu w szczepionkach oraz zastosowaniem nowych technologii do ich produkcji.
Jednym z praktycznych sposób na zmniejszenie ilości antygenu jest podawanie szczepionki w mniejszej dawce. Dwie dawki IPV po 0,1 ml każda (co stanowi 1/5 standardowej dawki) podane śródskórnie zapewniają co najmniej taki sam odsetek serokonwersji jak 1 dawka szczepionki o objętości 0,5 ml podana domięśniowo, jednocześnie pozwalając zaoszczędzić 60% dawki.45 W odpowiedzi na ograniczone dostawy IPV w Indiach i krajach Azji Południowej do programu powszechnych szczepień niemowląt wprowadzono wstrzyknięcia śródskórne. W niedawnym badaniu przeprowadzonym na Kubie wykazano, że ilość antygenu można także zmniejszyć, podając szczepionkę domięśniowo w mniejszej dawce, co nie wymaga posiadania specjalnego sprzętu i szkolenia personelu medycznego z techniki wstrzyknięć śródskórnych.46
Ilość antygenu potrzebnego do wzbudzenia odpowiedzi immunologicznej pozwalają również zmniejszyć adiuwanty (podobnej jak IPV bez adiuwantu). IPV z adiuwantem w postaci związków glinu zawierającą 1/10 antygenu znajdującego się w tradycyjnej IPV zarejestrowano niedawno w Danii i wkrótce będzie ona dostępna na całym świecie.47
W badaniu na modelach mysich wykazano, że silny adiuwant uzyskiwany z komórek bakterii Escherichia coli, podwójnie modyfikowana niestabilna toksyna (dmLT), nie tylko >5-krotnie zwiększa odpowiedź przeciwciał neutralizacyjnych w surowicy zarówno po podaniu śródskórnym, jak i domięśniowym, ale także w unikalny sposób indukuje wydzielanie przeciwciał IgA przeciwko wirusowi polio w jelitach, zwiększając prawdopodobieństwo, że – w przeciwieństwie do tradycyjnej IPV – szczepionka inaktywowana z adiuwantem będzie zmniejszać ryzyko transmisji wirusa polio podobnie jak OPV.48,49 Aktualnie prowadzone są pierwsze badania kliniczne z użyciem IPV zawierającej adiuwant w postaci dmLT (dmLT-IPV).
Poczyniono także znaczne postępy w kierunku zmniejszenia długoterminowych zagrożeń związanych z produkcją IPV, poprzez użycie nowych szczepów charakteryzujących się mniejszą zjadliwością niż dzikie typy wirusa wykorzystywane do produkcji tradycyjnej IPV. Szczepionki IPV z nowym szczepem Sabina (sIPVs) niosą ze sobą mniejsze ryzyko biologiczne, a ponadto zapewniają niezbędne dostawy na światowym rynku. sIPV po raz pierwszy zarejestrowano w Japonii w 2012 roku, jako preparat skojarzony z DTP. Do tego czasu w Chinach zarejestrowano również 2 nieskojarzone preparaty sIPV.50,51 Niektóre firmy, również w krajach rozwijających się, planują produkować sIPV na światowy rynek w ramach finansowanego przez WHO programu wymiany technologii. WHO zatwierdziła niedawno standaryzowane odczynniki, aby pomóc w opracowaniu i produkcji sIPV oraz przygotowaniu praktyk regulacyjnych.52
Szczepionki ze szczepem Sabina nadal wiążą się z ryzykiem odzyskania neurowirulencji, dlatego prowadzone są badania nad IPV produkowaną z wykorzystaniem „dodatkowo osłabionego” szczepu S19, pochodnej szczepu Sabina pozbawionej zdolności replikacji u ludzi.53,54
Poczyniono także znaczne postępy w kierunku opracowania IPV zawierających rekombinowane cząsteczki wirusopodobne (VLP), co pozwoliłoby uniknąć konieczności namnażania wirusa.55
Doustne szczepionki przeciwko polio
Projekt opracowania pochodnych szczepu Sabina pozbawionych zdolności przekształcenia w dzikie fenotypy zainicjowała Bill & Melinda Gates Foundation >10 lat temu. Wraz z pojawianiem się licznych ognisk VDPV2 w 2017 roku nabrał on szczególnego znaczenia. Opracowano potencjalne szczepy wszystkich 3 typów wirusa przeznaczonych do nowych doustnych szczepionek przeciwko polio (nOPV), przy czym priorytetem jest opracowanie nOPV2. Modyfikacje genomu szczepu Sabina w nOPV2, będącej obecnie w fazie badań klinicznych, mają na celu stabilizację kluczowych mutacji w rejonie 5’ niepodlegającym translacji odpowiadających za atenuację, tłumienie wymiany materiału genetycznego (rekombinacji) z innymi enterowirusami C i ograniczenie zdolności adaptacyjnej wirusów.56 We wstępnej fazie badań klinicznych wykazano, że nOPV2 jest bezpieczna, immunogenna i genetycznie stabilna przy przejściu przez przewód pokarmowy, ale wyniki te wymagają potwierdzenia w badaniach terenowych i w większych populacjach.57 Aktualnie WHO ocenia nOPV2 w celu wpisania jej na listę preparatów dopuszczonych do stosowania w sytuacjach wyjątkowych (EUL) i wcześniejszego użycia w regionach dotkniętych ogniskami VDPV2 (w listopadzie 2021 r. WHO wydała pozwolenie na użycie nOPV2 w ramach EUL w kilku krajach [Benin, Czad, Kongo, Liberia, Niger, Nigeria, Sierra Leone, Tadżykistan], które spełniły określone kryteria – przyp. red.).58 Ostatecznie dostępność nOPV dla każdego typu wirusa zwiększy szansę na skuteczną eradykację polio.
Podsumowanie
Od 1988 roku osiągnięto duży postęp w ograniczeniu zapadalności na polio i transmisji wirusa, jednak główny cel, jakim jest eradykacja, pozostaje nieuchwytny, a perspektywa jego osiągnięcia niejednoznaczna. Dwa spośród 3 typów WPV uznano za wyeradykowane. Wydaje się również, że zatrzymano transmisję WPV1 w Afrykańskim Regionie WHO, który niedawno otrzymał certyfikat regionu wolnego od transmisji dzikiego wirusa. Względne zwiększenie liczby przypadków polio wywołanych WPV1 w Afganistanie i Pakistanie nie powinno umniejszać dotychczasowych sukcesów, ale sygnalizuje konieczność podjęcia dalszych intensywnych wysiłków w celu całkowitego przerwania transmisji pozostałych typów WPV. Sukces, jaki udało się osiągnąć w walce z WPV1, należy zrównoważyć pojawieniem się cVDPV2 w Afryce i Azji, co wymaga użycia mOPV2, jedynej dostępnej szczepionki przeznaczonej do kontroli ognisk, oraz wymaganiami narzuconymi przez pandemię COVID-19. Pomimo dużych i trwałych postępów GPEI nie osiągnęła całkowitej eradykacji polio. Potrzebne są ogromne wysiłki, aby dokończyć te działania. W tym celu należy wprowadzić nowe strategie w zakresie nadzoru, opracować i dopuścić do stosowania nowe szczepionki, a także przerwać transmisję WPV1 w Azji i wirusa polio typu 2 pochodzącego z OPV.59,60
Materiały uzupełniające: Materiały uzupełniające są dostępne
na stronie internetowej „The Journal of Infectious Diseases”.
Zawierają dane dostarczone przez autorów do wykorzystania przez
Czytelników, nie zostały zredagowane i stanowią wyłączną
odpowiedzialność autorów, dlatego pytania lub uwagi należy
kierować do odpowiedniego autora.
Uwagi: Suplement, w którym ukazał się niniejszy artykuł, jest
sponsorowany przez Bill & Melinda Gates Foundation. Potencjalne
konflikty interesów: A.S.B. jest zatrudniony przez Bill & Melinda
Gates Foundation. J.F.M. jest byłym pracownikiem Bill & Melinda
Gates Foundation. R.S. jest byłym pracownikiem WHO. Wszyscy
autorzy złożyli formularz ICMJE dotyczący ujawnienia potencjalnych
konfliktów interesów. Ujawniono konflikty, które redakcja uznała
za istotne dla treści niniejszego artykułu.
Piśmiennictwo:
1. Paul J.R.: History of Poliomyelitis. New Haven, Yale University Press, 19712. Bernier R.H.: Some observations on poliomyelitis lameness surveys. Rev. Infect. Dis., 1984; 6: S371–S375
3. World Health A. The Expanded Programme on Immunization: the 1974 Resolution by the World Health Assembly. Assignment Child, 1985; 69–72: 87–88
4. Monto A.S.: Francis field trial of inactivated poliomyelitis vaccine: background and lessons for today. Epid. Rev., 1999; 21: 7–23
5. Sormunen H., Stenvik M., Eskola J., Hovi T.: Age- and dose-interval-dependent antibody responses to inactivated poliovirus vaccine. J. Med. Virol., 2001; 63: 305–310
6. Dayan G.H., Thorley M., Yamamura Y., et al.: Serologic response to inactivated poliovirus vaccine: a randomized clinical trial comparing 2 vaccination schedules in Puerto Rico. J. Infect. Dis., 2007; 195: 12–20
7. Salk J., Cohen H., Fillastre C., et al.: Killed poliovirus antigen titration in humans. Develop. Biol. Stand., 1978; 41: 119–132
8. Sutter R.W., Pallansch M.A., Sawyer L.A., Cochi S.L., Hadler S.C.: Defining surrogate serologic tests with respect to predicting protective vaccine efficacy: poliovirus vaccination. Ann. N Y Acad. Sci., 1995; 754: 289–299
9. Vidor E., Meschievitz C., Plotkin S.: Fifteen years of experience of Vero-produced enhanced potency inactivated poliovirus vaccine. Pediatr. Infect. Dis. J., 1997; 16: 312–322
10. Bandyopadhyay A.S., Modlin J.F., Wenger J., Gast C.: Immunogenicity of new primary immunization schedules with inactivated poliovirus vaccine and bivalent oral polio vaccine for the polio endgame: a review. Clin. Infect. Dis., 2018; 67: S35–S41
11. Sutter R.W., Okayasu H., Kieny M.P.: next generation inactivated poliovirus vaccine: the future has arrived. Clin. Infect. Dis., 2017; 64: 1326–1327
12. Sabin A.B.: Oral polio vaccine: History of its development and use and current challenge to eliminate poliomyelitis from the world. J. Infect. Dis., 1985; 151: 420–436
13. Henderson D.A., Witte J.J., Morris L., Langmuir A.D.: Paralytic disease associated with oral poliovaccines. J. Am. Med. Assn., 1964; 190: 153–160
14. Alexander L.N., Seward J.H., Santibanez T.A., et al.: Vaccine policy changes and epidemiology of poliomyelitis in the United States. J. Am. Med. Assn., 2004; 292: 1696–1701
15. Patriarca P.A., Wright P.F., John T.J.: Factors affecting the immunogenicity of oral poliovirus vaccine in developing countries. Rev. Infect. Dis., 1991; 13: 926–939
16. Jenkins H.E., Aylward R.B., Gasasira A., et al.: Effectiveness of immunization against paralytic poliomyelitis in Nigeria. N. Engl. J. Med., 2008; 359: 1666–1674
17. Waggie Z., Geldenhuys H., Sutter R.W., et al.: Randomized trial of type 1 and type 3 oral monovalent poliovirus vaccines in newborns in Africa. J. Infect. Dis., 2012; 205: 228–236
18. World Health Organization: Polio Eradication and Endgame Strategic Plan 2013–2018. Geneva, World Health Organization, 2013
19. Sutter R.W., John T.J., Jain H., et al.: Immunogenicity of bivalent types 1 and 3 oral poliovirus vaccine: a randomised, double-blind, controlled trial. Lancet, 2010; 376: 1682–1688
20. Caceres V.M., Sutter R.W.: Sabin monovalent oral polio vaccines: review of past experiences and their potential use after polio eradication. Clin. Infect. Dis., 2001; 33: 531–541
21. Zaman K., Estivariz C.F., Morales M., et al.: Immunogenicity of type 2 monovalent oral and inactivated poliovirus vaccines for type 2 poliovirus outbreak response: an open-label, randomised controlled trial. Lancet Infect. Dis., 2018; 18: 657–665
22. Posey D.L., Linkins R.W., Couto Oliveria M.J., Monteiro D., Patriarca P.A.: The effect of diarrhea on oral poliovirus vaccine failure in Brazil. J. Infect. Dis., 1997; 175: S258–S263
23. Parker E.P., Kampmann B., Kang G., Grassly N.C.: Influence of enteric infections on response to oral poliovirus vaccine: a systematic review and meta-analysis. J. Infect. Dis., 2014; 210: 853–864
24. Gilmartin A.A., Petri W.A., Jr: Exploring the role of environmental enteropathy in malnutrition, infant development and oral vaccine response. Philos. Trans. R. Soc. Lond. B. Biol. Sci., 2015; 370
25. Grassly N.C., Fraser C., Wenger J., et al.: New strategies for the elimination of polio from India. Science, 2006; 314: 1150–1153
26. Voorman A., Hoff N.A., Doshi R.H., et al.: Polio immunity and the impact of mass immunization campaigns in the Democratic Republic of the Congo. Vaccine, 2017; 35: 5693–5699
27. World Health Organization. Risk assessment: frequency and burden of VAPP, cVDPV and iVDPV. Report of the interim meeting of the Technical Consultative Group (TCG) on the Global Eradication of Poliomyelitis. Geneva, 2002
28. Platt L.R., Estivariz C.F., Sutter R.W.: Vaccine-associated paralytic poliomyelitis: a review of the epidemiology and estimation of the global burden. J. Infect. Dis., 2014; 210 (Suppl 1): S380–S389
29. World Health Organization. Global eradication of poliomyelitis by the year 2000. Week. Epidemiol. Rec., 1988; 63: 161–162
30. Centers for Disease Control and Prevention. Certification of poliomyelitis eradication – Western Pacific Region, October 2000. MMWR, 2000; 50: 1–5
31. Centers for Disease Control and Prevention. Progress towards global eradication of poliomyelitis, 2002. MMWR, 2003; 52: 366–369
32. The WHO European Region declared free of polio. Euro surveillance: bulletin Europeen sur les maladies transmissibles = European communicable disease bulletin. Euro Surveill., 2002; 7: 76–77
33. Kick polio out of Africa. World Health 1997; 50: 15
34. Bahl S., Bhatnagar P., Sutter R.W., Roesel S., Zaffran M.: Global polio eradication – way ahead. Indian J. Pediatr., 2018; 85: 124–131
35. Garon J., Seib K., Orenstein W.A., et al.: Polio endgame: the global switch from tOPV to bOPV. Expert Rev. Vaccines, 2016; 15: 693–708
36. Bahl S., Kumar R., Menabde N., et al.: Polio-free certification and lessons learned – South-East Asia region, March 2014. MMWR, 2014; 63: 941–946
37. Kew O., Morris-Glasgow V., Landaverde M., et al.: Outbreak of poliomyelitis in Hispaniola associated with circulating type 1 vaccine-derived poliovirus. Science, 2002; 296: 356–359
38. Patel M., Zipursky S., Orenstein W., Garon J., Zaffran M.: Polio endgame: the global introduction of inactivated polio vaccine. Exp. Rev. Vaccines, 2015: 1–14
39. Blake I.M., Pons-Salort M., Molodecky N.A., et al.: Type 2 poliovirus detection after global withdrawal of trivalent oral vaccine. N. Engl. J. Med., 2018; 379: 834–845
40. Macklin G.R., O’Reilly K.M., Grassly N.C., et al.: Evolving epidemiology of poliovirus serotype 2 following withdrawal of the serotype 2 oral poliovirus vaccine. Science, 2020; 368: 401–405
41. World Health Organization GPEI. Wild Poliovirus Weekly Update. Available at: www. polioeradication.org/Dataandmonitoring/Poliothisweek.aspx (Accessed 7/2 2019)
42. Macklin G., Liao Y., Takane M., et al.: Prolonged excretion of poliovirus among individuals with primary immunodeficiency disorder: an analysis of the World Health Organization registry. Front. Immunol., 2017; 8: 1103
43. McKinlay M.A., Collett M.S,. Hincks J.R., et al.: Progress in the development of poliovirus antiviral agents and their essential role in reducing risks that threaten eradication. J. Infect. Dis., 2014; 210 (supl. 1): S447–453
44. World Health Organization: Polio eradication. Week Epidemiol. Rec., 2017; 92: 308–310
45. Okayasu H., Sein C., Chang Blanc D., et al.: Intradermal administration of fractional doses of inactivated poliovirus vaccine: a dose-sparing option for polio immunization. J. Infect. Dis., 2017; 216: S161–S167
46. Resik S., Mach O., Tejeda A., et al.: Immunogenicity of intramuscular fractional dose of inactivated poliovirus vaccine. J. Infect. Dis., 2020; 221: 895–901
47. Rivera L., Pedersen R.S., Pena L., et al.: Immunogenicity and safety of three aluminium hydroxide adjuvanted vaccines with reduced doses of inactivated polio vaccine (IPV-Al) compared with standard IPV in young infants in the Dominican Republic: a phase 2, non-inferiority, observer-blinded, randomised, and controlled dose investigation trial. Lancet Infect. Dis., 2017; 17: 745–753
48. Norton E.B., Bauer D.L., Weldon W.C., Oberste M.S., Lawson L.B., Clements J.D.: The novel adjuvant dmLT promotes dose sparing, mucosal immunity and longevity of antibody responses to the inactivated polio vaccine in a murine model. Vaccine, 2015; 33: 1909–1915
49. Clements J.D., Freytag L.C.: Parenteral vaccination can be an effective means of inducing protective mucosal responses. Clin. Vaccine Immunol., 2016; 23: 438–441
50. Okada K., Miyazaki C., Kino Y., Ozaki T., Hirose M., Ueda K.: Phase II and III Clinical Studies of diphtheria-tetanus-acellular pertussis vaccine containing inactivated polio vaccine derived from Sabin strains (DTaP-sIPV). J. Infect. Dis., 2013; 208: 275–283
51. Okayasu H., Sein C., Hamidi A., Bakker W.A.M., Sutter R.W.: Development of inactivated poliovirus vaccine from Sabin strains: A progress report. Biologicals, 2016; 44: 581–587
52. Crawt L., Atkinson E., Tedcastle A., et al.: Differences in antigenic structure of inactivated polio vaccines made from Sabin live-attenuated and wild-type poliovirus strains: impact on vaccine potency assays. J. Infect. Dis., 2020; 221: 544–552
53. Knowlson S., Burlison J., Giles E., Fox H., Macadam A.J., Minor P.D.: New strains intended for the production of inactivated polio vaccine at low-containment after eradication. PLoS Pathog., 2015; 11: e1005316
54. Biological E.L.: Inactivated polio vaccine. Available at: www.biologicale.com/Vaccines_ Biologics/pipeline.html (Accessed 6/12/2020)
55. Fox H., Knowlson S., Minor P.D., Macadam A.J.: Genetically thermo-stabilised, immunogenic poliovirus empty capsids; a strategy for non-replicating vaccines. PLoS Pathology, 2017; 13: e1006117
56. Yeh M.-T., Bujaki E., Dolan P.T., et al.: Engineering the live-attenuated polio vaccine to prevent reversion to virulence. Cell Host & Microbe, 2020; 27: 1–16
57. Van Damme P., De Coster I., Bandyopadhyay A.S., et al.: The safety and immunogenicity of two novel live attenuated monovalent (serotype 2) oral poliovirus vaccines in healthy adults: a double-blind, single-centre phase 1 study. Lancet, 2019; 394: 148–158
58. Bandyopadhyay A.S.: Clinical data from novel type-2 oral polio vaccine trials and plan for emergency use listing. (In:) Meeting of the Strategic Advisory Group of Experts (SAGE) on Immunization, March – April 2020 (Geneva). World Health Organization
59. World Health Organization. The Polio Endgame Strategy 2019–2023: Eradication, integration, containment and certification. Vol. 2020. Geneva, World Health Organization, 2020
60. Bandyopadhyay A.S., Macklin G.R.: Final frontiers of the polio eradication endgame. Curr. Opin. Infect. Dis., 2020; 33 (5): 404–410
Komentarz
prof. dr hab. n. med. Leszek Szenborn
Klinika Pediatrii i Chorób Infekcyjnych Uniwersytetu Medycznego
we Wrocławiu
Zachorowań wywołanych dzikimi wirusami polio (WPV) już prawie nie ma. Jak wskazują sami Autorzy komentowanego artykułu, ten sukces zawdzięczamy obu szczepionkom przeciwko poliomyelitis – zarówno doustnej „żywej” (OPV), jak i inaktywowanej (IPV). Komentowany artykuł stanowi bardzo dobre podsumowanie wielu lat zmagań z eliminacją poliomyelitis (polio, choroba Heinego i Medina) w latach mojej działalności zawodowej. Szczegółowo przedstawiono w nim wyzwania na najbliższe lata oraz nowe narzędzia (szczepionki, strategie i leki przeciwwirusowe) do ich podjęcia. Jako uczniowi szkoły podstawowej i liceum, a następnie studentowi, towarzyszyli mi koleżanki i koledzy dotknięci chorobą Heinego i Medina. Będąc poczatkującym lekarzem, słuchałem wykładu o ostatnich zachorowaniach na polio we Wrocławiu, a ostatni przypadek tej choroby wywołany WPV zarejestrowano w Polsce w 1984 roku. W epoce szczepień OPV na podstawie wywiadu i zapisów w książeczce zdrowia kilkukrotnie rozpoznałem przypadki porażenia wiotkiego w związku czasowym z podaniem tej szczepionki (VAPP). U wszystkich pacjentów przyczynę niepełnosprawności (niedowład i zniekształcenia kończyn dolnych) rozpoznano z opóźnieniem, a zajmowali się nimi ortopedzi i neurolodzy usiłujący zminimalizować jej fizyczne następstwa. U żadnego dziecka nie oceniono stanu odporności humoralnej, która jest głównym czynnikiem ryzyka VAPP po podaniu OPV. U 5-letniego chłopca wykryłem agammaglobulinemię, a u pozostałych 3 pacjentów hipogammaglobulinemię. Należy również wspomnieć o mało znanym zespole post-polio (post polio syndrome – PPS), który jest późnym powikłaniem polio. Nowe niedowłady występują 20–40 lat po przebyciu polio w stadium względnej stabilizacji stanu neurologicznego. PPS obserwuje się również u osób, które przebyły nieporażenną postać polio, w związku z czym zespół ten jest pewnie niedostatecznie często rozpoznawany.
Do całkowitej eradykacji tej groźnej choroby i głównej przyczyny trwałej niepełnosprawności dążymy od 34 lat. Warto przypomnieć, jakie warunki należy spełnić, aby można było wyeradykować patogen. Są one następujące: jedynym rezerwuarem patogenu jest człowiek, co oznacza, że nie może bez ograniczenia przetrwać poza jego organizmem (wirus polio może przetrwać w ściekach do 14 dni). Dysponujemy skutecznymi szczepionkami przeciwko polio, a prowadzone programy szczepień obejmują całą populację ludzką. Najbardziej spektakularne efekty programu z użyciem OPV były widoczne jeszcze pod koniec XX wieku. Bardzo wymowne było również ogłoszenie eliminacji polio w Indiach w 2014 roku, jako dowodu na skuteczność programu szczepień z użyciem OPV w niedostatecznych warunkach higienicznych oraz silnego argumentu przeciwko antyszczepionkowcom twierdzącym, że do zaniku chorób zakaźnych doprowadziła higienizacja życia. Ostatnich 8 lat to okres zawiedzionych nadziei na ostateczny sukces i całkowitą eradykację polio na świecie z powodu wojen w Azji, Afryce i Syrii. Zachorowania na polio wywołane WPV aktualnie występują tylko w 2 krajach na świecie – w Afganistanie i Pakistanie. Notuje się także spektakularne zmniejszenie liczby dodatnich próbek pobranych ze środowiska. W Afganistanie potwierdzono tylko 4 zachorowania na polio w 2021 roku i 1 w 2022 roku, natomiast w Pakistanie zarejestrowano odpowiednio 1 i 2 przypadki. W ramach nadzoru środowiskowego nadal wykrywa się mały poziom transmisji WPV1 (w 2021 r. w Pakistanie uzyskano 7,6% próbek dodatnich, w porównaniu z 56% w 2020 r.). W drugiej połowie 2021 roku odsetek ten wyniósł zaledwie 1,5%.1,2
W epoce „po certyfikacji”, kiedy nie stwierdza się zachorowań wywołanych WPV oraz krążenia wirusa w środowisku, problem stanowią porażenia wiotkie wywołane szczepami wirusa pochodzącymi z OPV, które uległy rewersji do postaci wirulentnej i krążą w populacjach charakteryzujących się niedostatecznym odsetkiem zaszczepionych przeciwko polio (ocena wartości progowej dla eliminacji transmisji wirusa polio jest trudna, ale szacuje się, że odsetek uodpornionych powinien wynosić 50–95%3). Pierwsze ognisko zakażeń (30 przypadków) wywołane przez krążący VDPV (cVDPV) typu 2 (cVDPV2) opisano w Egipcie w latach 1988–1993, ale dopiero od zachorowań w Haiti (lata 2000–2001), wraz z upowszechnieniem badań metodą łańcuchowej reakcji polimerazy (PCR) badanie ognisk i śledzenie kontaktów stało się łatwiejsze i bardziej precyzyjne. Wojna w Ukrainie przybliżyła problem VDPV do granic Polski. Autorzy komentowanego artykuły nie mogli przewidzieć aktualnie toczącej się wojny w Ukrainie (2022 r.), gdzie już w 2015 roku Światowa Organizacja Zdrowia (WHO) potwierdziła zachorowania na poliomyelitis u 2 dzieci (4 lata i 10 lat) w obwodzie zakarpackim, w południowo-zachodniej części kraju, wywołane zmutowanym wirusem polio typu 1 wywodzącym się ze szczepionki OPV (cVDPV1). Były to pierwsze przypadki polio w europejskim regionie WHO od 2010 roku (wówczas zachorowania wystąpiły w Tadżykistanie). Ponownie w 2021 roku w Ukrainie u kilkorga dzieci wyizolowano wirus polio pochodzący z OPV ([cVDPV1 [w obwodzie zakarpackim] i cVDPV2 [w obwodzie rówieńskim]), w tym potwierdzono 2 przypadki ostrego porażenia wiotkiego wywołane przez cVDPV2. Szczególnie narażone były dzieci <6. roku życia. Jedna z dziewczynek miała 12 lat. Dzieci nie były szczepione przeciwko polio.4 Zjadliwe szczepy wirusów szczepionkowych wywodzących się z OPV krążące w populacji podlegają zmianom genetycznym, które upodabniają je do szczepów dzikich. Warunki do przetrwania VDPV istnieją w środowiskach o niskich standardach higienicznych i przede wszystkim w populacjach o niedostatecznym odsetku zaszczepionych przeciwko polio. Ten drugi czynnik jest istotny w przypadku Ukrainy – w zachodnich obwodach kraju odsetek populacji zaszczepionej przeciwko polio jest niezadawalający (ok. 60%). Dodatkowo w 2016 roku, zgodnie z ogólnie przyjętą polityką szczepień przeciwko polio na świecie, do programu szczepień wprowadzono OPV, która nie zawiera wirusa polio typu 2 (w miejsce OPV zawierającej wszystkie trzy typy wirusa – tOPV [w Polsce szczepionkę tOPV podawaną w 6. rż. zastąpiono wówczas szczepionką inaktywowaną]).
W Polsce zarówno lekarze pracujący w szpitalach, jak i pierwszego kontaktu (rodzinni, pediatrzy) muszą być gotowi na rozpoznawanie przyczyn niedowładów wiotkich u dzieci, których jest wiele. Najczęściej jest ono jednak wynikiem zespołu Guillaina i Barrégo, w przebiegu którego dochodzi do zapalenia i demielinizacji nerwów obwodowych (zwykle są to niedowłady wiotkie symetryczne). Przyczyną uszkodzenia neuronów (motor neuron disease) może być zakażenie enterowirusami 70 i 71, ECHO (D68) i Coxackie (CVA 7). Należy także uwzględnić inne przyczyny, na przykład toksyczne, poprzeczne zapalenie rdzenia albo stany po wstrzyknięciach domięśniowych.
Lekarz, który rozpoznał ostre porażenie wiotkie (OPW) u dziecka w wieku <15 lat:
- zgłasza OPW (druk ZLK-1) do powiatowej stacji sanitarno-epidemiologicznej (PSSE)
- uzupełnia dane w karcie zgłoszenia OPW do Zakładu Epidemiologii Narodowego Instytutu Zdrowia Publicznego–Państwowego Zakładu Higieny (NIZP–PZH) we współpracy z koordynatorem OPW z PSSE (p. ryc. [wzór karty dostępny jest również na stronie: wwwold.pzh.gov.pl/oldpage/epimeld/druki/2019/Form_pis_04.pdf])
- zleca pobranie od pacjenta 2 próbek kału w odstępie 24–48 h (każda próbka ok. 8–10 g), w ciągu 14 dni od wystąpienia porażeń (materiał należy zamrozić)
- obie próbki kału należy w ciągu 3 dni (zabezpieczone w temperaturze 4–8°C) przesłać do Zakładu Wirusologii NIZP–PZH (laboratorium referencyjne)
- 60–90 dni po wystąpieniu porażeń wykonuje badanie kontrolne pacjenta; koordynator OPW z PSSE we współpracy z lekarzem wypełnia raport końcowy i przesyła do Zakładu Epidemiologii NIZP–PZH.

Niestety w Polsce lekarze nie zachowują oczekiwanej czujności. Wykrywalność jest niedostateczna – roczna zapadalność jest za mała i nie odzwierciedla rzeczywistej częstości niedowładów wiotkich w tej grupie wiekowej, którą szacuje się 1/100 000/rok. Mam nadzieję, że lektura niniejszego artykułu uświadomi lekarzom wagę problemu i zachęci ich do współdziałania w ostatecznym pokonaniu tych wirusów. Pamiętajmy również o tym, jak ważna jest realizacja szczepienia przeciwko poliomyelitis u dzieci zgodnie z PSO.
Piśmiennictwo do komentarza:
1. WHO: Statement of the Thirty-first Polio IHR Emergency Committee. 11 March 2022 www.who.int/news/item/11-03-2022-statement-of-the-thirty-first-polio-ihr-emergency-committee (dostęp: 17.05.2022)2. Wild poliovirus list. https://polioeradication.org/polio-today/polio-now/wild-poliovirus-list/ (dostęp: 17.05.2022)
3. Anderson E.J., Daugherty M.A., Pickering L.K. i wsp.: Protecting the community through child vaccination. Clin. Infect. Dis., 2018; 67 (3): 464–471
4. Zachorowania na poliomyeltitis na Ukrainie. https://szczepienia.pzh.gov.pl/zachorowania-na-poliomyelitis-na-ukrainie/ (dostęp: 17.05.2022)

















