Tłumaczył dr n. med. Dariusz Stencel
Komentarz I: prof. dr hab. n. med. Jacek Wysocki, Katedra i Zakład Profilaktyki Zdrowotnej Uniwersytetu Medycznego im. K. Marcinkowskiego w Poznaniu
Komentarz II: prof. dr hab. n. med. Anna Bręborowicz, Klinika Pneumonologii, Alergologii Dziecięcej i Immunologii Klinicznej Uniwersytetu Medycznego im. K. Marcinkowskiego w Poznaniu
Skróty: α-Gal – galaktoza-alfa-1,3-galaktoza, HPV (human papillomavirus) – ludzki wirus brodawczaka, IIV (inactivated influenza vaccine) – inaktywowana szczepionka przeciwko grypie, LAIV (live attenuated influenza vaccines) – szczepionka „żywa” atenuowana przeciwko grypie, MenACWY – 4-walentna szczepionka przeciwko meningokokom grupy A, C, W i Y, MMR (measles, mumps, rubella) – szczepionka przeciwko odrze, śwince i różyczce, MMRV – szczepionka przeciwko odrze, śwince, różyczce i ospie wietrznej, PEG (polyethylene glycol) – glikol polietylenowy, WZW – wirusowe zapalenie wątroby
Translated from Alessandra Arcolaci, Rocco Scarmozzino, Giovanna Zanoni, A practical guide to address reactions to vaccines in children, Pediatr. Allergy Immunol., 34 (6): e13967, doi: 10.1111/pai.13967 © 2023 European Academy of Allergy and Clinical Immunology, with permission from John Wiley & Sons Ltd.
Streszczenie
Aktualnie dostępne szczepionki są bezpieczne, jednak każda szczepionka może wywołać reakcję alergiczną, a nawet anafilaksję. Choć reakcje te są rzadkie, dokładne postępowanie diagnostyczne w przypadku podejrzenia anafilaksji po szczepieniu ma ogromne znaczenie ze względu na potencjalne ryzyko poważnej reakcji po ponownej ekspozycji. Z kolei błędna diagnoza może się przyczynić do rezygnacji z dalszych szczepień, co wiąże się z niepotrzebnym ryzykiem utraty ochrony indywidualnej i zbiorowiskowej przed chorobami, którym można zapobiegać za pomocą immunoprofilaktyki. U większości pacjentów (nawet 85%) w postępowaniu diagnostycznym nie potwierdza się podejrzewanej alergii na szczepionkę, dlatego można kontynuować rozpoczęty schemat szczepienia z użyciem tego samego preparatu, oczekując dobrej tolerancji kolejnych dawek. Diagnostykę powinien prowadzić specjalista w dziedzinie szczepień – w zależności od procedur obowiązujących w danym kraju jest to zwykle alergolog lub immunolog. Ich zadaniem jest identyfikacja pacjentów z grupy ryzyka reakcji alergicznych, wykonanie odpowiednich badań w kierunku nadwrażliwości na szczepionki i ustalenie dalszego postępowania w celu zapewnienia bezpieczeństwa szczepień w praktyce klinicznej. W niniejszym artykule przedstawiono praktyczne wskazówki dotyczące bezpiecznego postępowania z dziećmi z alergią poddawanymi szczepieniom. Uwzględniono diagnostykę u dzieci z podejrzeniem reakcji alergicznej na konkretną szczepionkę i dalsze postępowanie w przypadku konieczności podania kolejnych dawek szczepionki, a także postępowanie u dzieci uczulonych na składnik podawanej szczepionki.
Wprowadzenie
Chociaż zarejestrowane szczepionki poddano rygorystycznym badaniom dotyczącym bezpieczeństwa, każda szczepionka może powodować reakcję alergiczną, a nawet, choć bardzo rzadko, reakcję anafilaktyczną.1 Według Institute of Medicine dane epidemiologiczne i mechanistyczne potwierdzają związek przyczynowy anafilaksji z różnymi szczepionkami, w tym przeciwko odrze, śwince i różyczce (MMR), ospie wietrznej, grypie, wirusowemu zapaleniu wątroby (WZW) typu B, meningokokom, ludzkiemu wirusowi brodawczaka (HPV) oraz ze skojarzoną szczepionką przeciwko błonicy, tężcowi i krztuścowi.2 Należy podkreślić, że u większości pacjentów (nawet 85%) z podejrzeniem alergii na szczepionkę nie potwierdzono jej w trakcie dalszej diagnostyki, dlatego można kontynuować schemat szczepień z użyciem tego samego preparatu, oczekując dobrej tolerancji kolejnych dawek.3
Analiza raportów przesłanych w ciągu 26 lat do działającego w USA systemu zgłaszania zdarzeń niepożądanych po szczepieniach (Vaccine Adverse Event Reporting System – VAERS) wykazała, że ostatecznie tylko 828 z prawie 500 000 zgłoszeń uznano za reakcję anafilaktyczną, biorąc pod uwagę rozpoznanie kliniczne lub definicję przypadku według Brighton Collaboration.4 W badaniu z 2016 roku wykorzystującym dane medyczne zgromadzone w bazie Vaccine Safety Datalink odnotowano łącznie 33 potwierdzone przypadki anafilaksji po podaniu 25 173 965 dawek szczepionek, co przekłada się na zapadalność wynoszącą 1,31 na milion dawek szczepionek.5 Gold i wsp.6 wykazali, że tylko u 10% dzieci z uogólnioną reakcją alergiczną wystąpiły reakcje niepożądane po ponownej ekspozycji, przy czym większość z nich nie sugerowała nadwrażliwości.
Reakcje alergiczne po szczepieniu mogą być wywołane dowolnym składnikiem szczepionki: antygenem drobnoustrojów, adiuwantem, stabilizatorem, konserwantem, emulgatorem, wypłukanym składnikiem opakowania, pozostałym antybiotykiem, materiałem do hodowli komórkowych i składnikiem inaktywującym. W związku z tym znajomość wszystkich składników szczepionki jest niezbędna do oceny podejrzewanego zdarzenia niepożądanego.
W praktyce klinicznej lekarze mogą mieć do czynienia z dwoma odrębnymi sytuacjami, które wiążą się z określonymi wyzwaniami: (1) dzieci z podejrzeniem reakcji alergicznej na szczepionkę: należy ocenić, czy reakcja ma charakter alergiczny, czy inny, i jak postępować, jeśli konieczna jest kontynuacja schematu szczepienia; (2) dzieci z alergią na składnik szczepionki w wywiadzie: konieczna jest ocena bezpieczeństwa podania konkretnej szczepionki.
Z punktu widzenia opieki zdrowotnej prawidłowe postępowanie w przypadku podejrzenia reakcji alergicznych ma kluczowe znaczenie zarówno dla jednostki, jak i społeczeństwa ze względu na potencjalne ryzyko częstszej rezygnacji ze szczepień, zwłaszcza w świetle faktu, że większość z tych pacjentów błędnie uznaje się za uczulonych.
Celem tego przeglądu jest przedstawienie praktycznych wskazówek dotyczących postępowania w przypadku alergii związanej ze szczepionkami w codziennej praktyce klinicznej.
Najważniejsze informacje
Celem tego przeglądu jest dostarczenie lekarzom zwięzłych i praktycznych wskazówek dotyczących postępowania z dziećmi z alergią, które mają być poddane szczepieniom. Przegląd podzielono na 2 części: pierwsza część dotyczy klinicznych aspektów reakcji alergicznych na szczepionki, a druga – postępowania w przypadku: (a) konieczności kontynuacji schematu szczepienia u dzieci z podejrzeniem reakcji alergicznej na wcześniejszą dawkę oraz (b) alergii na składnik szczepionki w wywiadzie.
Część 1: aspekty kliniczne
Reakcje natychmiastowe
Natychmiastowe reakcje nadwrażliwości na szczepionki występują rzadko, z zapadalnością w zakresie od 1/50 000 do 1/mln dawek.7,8 Zwykle pojawiają się w ciągu kilku minut do 4 godzin po szczepieniu, a najczęstszym objawem jest natychmiastowa pokrzywka (występuje 4 razy częściej niż anafilaksja).9 Inne reakcje skórne obejmują rumień, izolowany świąd i obrzęk naczynioruchowy, zwłaszcza w obrębie twarzy i ust. Rzadziej obserwuje się objawy ze strony układu oddechowego, takie jak zapalenie błony śluzowej nosa i spojówek, uczucie ucisku w gardle, duszność i świszczący oddech.10
Według European Academy of Allergy and Clinical Immunology (EAACI) anafilaksję definiuje się jako reakcję zagrażającą życiu, charakteryzującą się nagłym wystąpieniem objawów ze strony różnych układów i narządów, wymagających natychmiastowej interwencji medycznej.11 Reakcje anafilaktyczne, które mogą mieć związek z podaniem szczepionki, należy ocenić zgodnie z niedawno uaktualnionymi kryteriami grupy roboczej Brighton Collaboration, zwracającymi szczególną uwagę na obiektywne objawy przedmiotowe i podmiotowe.12 Kryteria te definiują anafilaksję jako zajęcie ≥2 narządów, a stopień pewności rozpoznania określa się na podstawie kombinacji kryteriów większych i mniejszych. W praktyce klinicznej powszechnie stosuje się kryteria kliniczne Sampsona i wsp., które różnią się od kryteriów Brighton Collaboration.
Ze względu na szeroki zakres możliwych objawów, wiele zdarzeń niepożądanych występujących bezpośrednio po szczepieniu może zostać błędnie rozpoznanych jako anafilaksja lub inne zaburzenie. W każdym przypadku sugerującym związek objawów z podaniem szczepionki należy rozważyć działanie innych potencjalnych czynników wyzwalających (tab. 1).13,14
| Tabela 1. Rozpoznania, które należy uwzględnić w diagnostyce różnicowej u dzieci z podejrzeniem anafilaksji |
|---|
| omdlenie wazowagalne zespół hipotoniczno-hiporeaktywny zanoszenie się przy płaczu zaburzenie czynności strun głosowych hipoglikemia niealergiczna wysypka skórna (osutka w przebiegu chorób z wykwitami itp.) |
Anafilaksja po podaniu szczepionek występuje bardzo rzadko, dlatego zwykle epizody te zgłasza się do biernych systemów raportowania funkcjonujących w ramach porejestracyjnego nadzoru nad bezpieczeństwem produktów leczniczych, a przekazywane dane obarczone są często błędami wynikającymi ze zbyt częstego lub zbyt rzadkiego raportowania, niekompletnych informacji i braku danych o liczebności populacji stanowiącej punkt odniesienia.13 W niedawno przeprowadzonej analizie Miller i wsp. oszacowali aktualną czułość VAERS w wychwytywaniu epizodów anafilaksji w zakresie 13–76%,15 co podkreśla potrzebę stosowania prawidłowych kryteriów diagnostycznych przez alergologów lub immunologów specjalizujących się w dziedzinie alergii na szczepionki w celu prawidłowej realizacji szczepień. Z uwagi na rzadkie występowanie anafilaksji autorzy poszczególnych badań podali różne wskaźniki zapadalności: Bohlke i wsp. odnotowali w populacji dzieci i młodzieży 5 przypadków anafilaksji po podaniu 7 644 049 dawek szczepionek, co przekłada się na ryzyko wynoszące 0,65 przypadku/mln dawek16; z kolei McNeil i wsp. rozpoznali 18 przypadków anafilaksji po podaniu 12 403 201 dawek szczepionek w grupie wiekowej 0–17 lat, co przekłada się na zapadalność 1,45 przypadku/mln dawek szczepionek.5
Postępowanie w przypadku anafilaksji po podaniu szczepionki jest takie samo jak w innych sytuacjach klinicznych i zostało szczegółowo omówione w wytycznych EAACI dotyczących anafilaksji.11
Mimo rzadkiego występowania, precyzyjne postępowanie diagnostyczne w przypadku podejrzenia anafilaksji po szczepieniu ma ogromne znaczenie ze względu na potencjalne ryzyko ciężkiej reakcji po ponownej ekspozycji oraz zbyt częste rozpoznawanie ciężkich reakcji alergicznych na szczepionki. Może to prowadzić do zwiększenia liczby dzieci, u których przerywa się szczepienia, co wiąże się z ryzykiem utraty ochrony indywidualnej i zbiorowiskowej przed chorobami, którym można zapobiegać za pomocą immunoprofilaktyki.
Reakcje opóźnione
Reakcje opóźnione definiuje się jako reakcje występujące kilka godzin lub dni po szczepieniu, najprawdopodobniej niezwiązane z IgE. Opóźnioną pokrzywkę i/lub obrzęk naczynioruchowy, a także nieswoiste osutki skórne zgłaszano u 5–13% pacjentów zaszczepionych szczepionką zawierającą toksoidy, ale wyniki kilku badań sugerują, że większość tych uogólnionych reakcji wynika z nieswoistej aktywacji układu odpornościowego przez znaczną ilość substancji pochodzenia drobnoustrojowego i nie zwiększa ryzyka nawrotu po ponownym podaniu tej samej szczepionki.17
Reakcje opóźnione ustępują zwykle samoistnie i nie są przeciwwskazaniem do podania kolejnych dawek tej samej szczepionki.18 Najczęstsze są reakcje miejscowe, niemające charakteru alergicznego, takie jak ból, zaczerwienienie i obrzęk, które rozwijają się w miejscu szczepienia w ciągu kilku godzin lub dni po immunizacji i nie wymagają żadnych badań w kierunku alergii. W przeciwieństwie do tego kontaktowe zapalenie skóry, guzki podskórne i osutka plamisto-grudkowa są miejscowymi reakcjami nadwrażliwości typu IV i zwykle pojawiają się >12 godzin po szczepieniu.19
Bolesność, zaczerwienienie i/lub obrzęk w miejscu wstrzyknięcia są na ogół łagodne i mogą wynikać z nieswoistego stanu zapalnego wywołanego samym wstrzyknięciem lub innymi składnikami szczepionki zastosowanymi jako adiuwanty. Duże reakcje w miejscu wstrzyknięcia obserwuje się rzadziej, zwykle pojawiają się w ciągu 24–72 godzin po szczepieniu i ustępują w ciągu kilku dni.17,20 Obrzęk o długości ≥10 cm i wykraczający poza staw łokciowy lub kolanowy definiuje się jako rozległy obrzęk kończyny.17 Zwykle występuje w ciągu pierwszych 24 godzin po szczepieniu, a jego patomechanizm nadal jest słabo poznany. Obrzęki te częściej obserwuje się po podaniu polisacharydowej szczepionki przeciwko pneumokokom oraz szczepionek zawierających toksoid błoniczy, tężcowy i bezkomórkowe komponenty pałeczki krztuśca. Objawy miejscowe mogą być również efektem reakcji Arthusa, czyli nadwrażliwości typu III, która rozwija się tylko u pacjentów wcześniej szczepionych, zwykle po czwartym lub piątym wstrzyknięciu.20
Opisywane nawet u 19% pacjentów guzki podskórne zazwyczaj pojawiają się kilka tygodni po podaniu szczepionki zawierające wodorotlenek glinu.1 Zmiany te zwykle ustępują samoistnie w ciągu kilku tygodni. Zgłoszono jednak kilka przypadków utrzymywania się guzków przez >6 miesięcy.21 Nadwrażliwość typu późnego na glin skutkująca powstaniem guzka w miejscu wstrzyknięcia zwykle nie jest jednak przeciwwskazaniem do kolejnego szczepienia.
Składnikiem wielu szczepionek są antybiotyki aminoglikozydowe (neomycyna, gentamycyna, streptomycyna i kanamycyna), które dodaje się w celu zapobiegania zanieczyszczeniu hodowli bakteriami lub grzybami. Są one zawarte m.in. w szczepionce MMR, przeciwko polio i grypie. Teoretycznie mogą wywoływać natychmiastowe reakcje alergiczne po podaniu szczepionki zawierającej taki antybiotyk, jednak często wiążą się z opóźnionymi reakcjami nadwrażliwości, takimi jak kontaktowe zapalenie skóry.17 Podawanie szczepionek zawierających gentamycynę, neomycynę, streptomycynę i kanamycynę jest przeciwwskazane u osób z reakcją anafilaktyczną po tych antybiotykach, natomiast pacjenci z alergicznym kontaktowym zapaleniem skóry mogą być bezpiecznie szczepieni.17,18
U dzieci obserwowano współistniejące ogólnoustrojowe zakażenia wirusowe, które mogą predysponować do wystąpienia opóźnionej reakcji skórnej po szczepieniu.17 Mechanizmy modyfikacji odpowiedzi immunologicznej na leki przez zakażenia wirusowe nie są jasne. Możliwy mechanizm obejmuje uogólnioną aktywację limfocytów T z obniżonym progiem ich reaktywności oraz duże stężenie cytokin.21
Część 2: diagnostyka i leczenie
Dzieci z podejrzeniem reakcji alergicznej na szczepionkę
Przeprowadzenie diagnostyki alergologicznej zaleca się zarówno w celu identyfikacji czynnika sprawczego wchodzącego w skład szczepionki, aby uniknąć reakcji krzyżowej z innymi szczepionkami lub pokarmami,22 jak i w celu podjęcia decyzji dotyczących podania kolejnych dawek szczepionki, jeśli będą potrzebne, aby uniknąć niepotrzebnych ograniczeń dotyczących stosowania szczepionki. Pełną listę wszystkich potencjalnych alergenów zawartych w szczepionkach można znaleźć na stronie internetowej Instytutu Bezpieczeństwa Szczepionek Uniwersytetu Johna Hopkinsa (Institute for Vaccine Safety of the John Hopkins University).23
Na rycinie przedstawiono algorytm wyboru szczepionki i sposobu postępowania u pacjentów z reakcją sugerującą alergię na szczepionkę w przeszłości. U pacjentów ze zdarzeniem niepożądanym po szczepieniu sugerującym reakcję nadwrażliwości należy zebrać szczegółowy wywiad w kierunku jakichkolwiek czynników ryzyka, takich jak alergia na pokarmy, ciężka niekontrolowana astma, mastocytoza itp. Należy dokładnie ocenić związek czasowy, a co za tym idzie rodzaj reakcji (natychmiastowa lub opóźniona), nazwę preparatu szczepionki (niezbędne do określenia dokładnego składu szczepionki), obecność chorób współistniejących i konieczność podania kolejnych dawek w celu indywidualnej oceny bilansu korzyści i ryzyka.
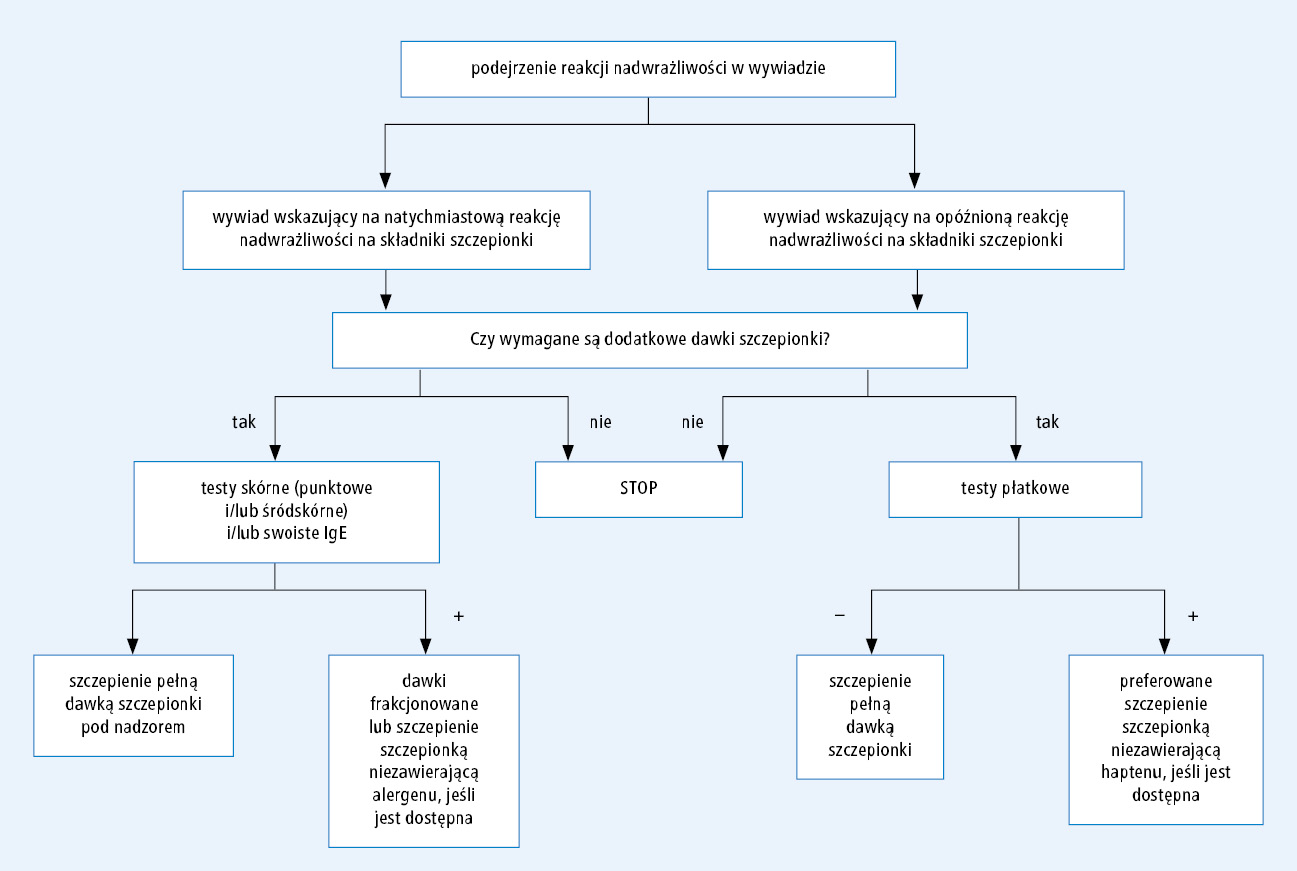
Ryc. Algorytm wyboru szczepionki i sposobu postępowania u pacjentów z reakcją sugerującą alergię na szczepionkę w przeszłości.
Jak stwierdzono powyżej, reakcje IgE-zależne można podejrzewać na podstawie krótkiego odstępu czasu między szczepieniem a wystąpieniem objawów (zwykle do 4 h).24 W przypadku podejrzenia natychmiastowej reakcji nadwrażliwości należy wykonać pełne testy skórne wrażliwości na szczepionki w placówce wyposażonej w zestaw przeciwwstrząsowy. W pierwszej kolejności należy przeprowadzić testy punktowe (prick test) z użyciem szczepionki bez rozcieńczenia, następnie, w przypadku uzyskania wyniku ujemnego, test śródskórny z podaniem 0,02 ml szczepionki rozcieńczonej w stosunku 1:100. W razie uzyskania kolejnego wyniku ujemnego można zastosować rozcieńczenie 1:10, chociaż według niektórych autorów takie stężenie może wywoływać podrażnienia i dawać fałszywie dodatnie reakcje.25 Zaleca są wykonanie testów z dodatnią i ujemną próbą kontrolną. Nie określono poziomu czułości i swoistości testów skórnych ze szczepionkami potwierdzających lub wykluczających alergię na szczepionkę lub jej składniki. Ujemne wyniki testów skórnych wskazują jednak na małe prawdopodobieństwo obecności IgE przeciwko szczepionce lub jej składnikom.17 W przypadku IgE-zależnych reakcji alergicznych na leki śladowe stężenie IgE w krążeniu, związane z ryzykiem fałszywie ujemnych wyników testów skórnych, można stwierdzić nawet po upływie ponad roku od wystąpienia reakcji26; takie zjawisko należy rozważyć w przypadku reakcji IgE-zależnej na szczepionki.
W dalszej kolejności ocenia się uczulenie na składniki szczepionki, aby zapobiec reakcjom z innymi szczepionkami zawierającymi te same składniki.17 W tabeli 2 wymieniono główne składniki szczepionek, które mogą odpowiadać za reakcje alergiczne. Dostęp do testów punktowych i/lub testów oznaczających swoiste IgE skierowane przeciwko składnikom podejrzanej szczepionki jest ograniczony (białka pokarmowe i toksoid tężcowy). Należy podkreślić, że interpretacja wyników oznaczenia swoistych IgE wymaga specjalistycznej wiedzy, ponieważ w przypadku niektórych składników, na przykład albuminy jaja kurzego i żelatyny, możliwość przewidywania reakcji na szczepionki jest raczej niewielka i można uzyskać wyniki fałszywie dodatnie. Znacznie więcej osób wykazuje uczulenie i nadwrażliwość na dany alergen niż reaguje klinicznie jawnie na minimalną ilość tego samego alergenu wchodzącego w skład szczepionki. Z kolei znajdujące się w surowicy swoiste IgE skierowane przeciwko antygenom drobnoustrojów zawartych w szczepionkach najczęściej są składową prawidłowej odpowiedzi immunologicznej i mają ograniczoną wartość predykcyjną w przypadku reakcji alergicznej.1
Po określeniu alergenu wywołującego reakcję u pacjentów wymagających dodatkowych dawek szczepionki należy przede wszystkim rozważyć zastosowanie innego preparatu niezawierającego szkodliwego składnika.
| Tabela 2. Składniki szczepionek, które mogą wywołać reakcję alergiczną | |||
|---|---|---|---|
| Składnik | Szczepionka | Zalecenia | Piśmiennictwo |
| jajo (owoalbumin i białko jaja) | przeciwko żółtej gorączce | diagnostyka w kierunku alergii na podstawie testów skórnych i sIgE; w przypadku dodatnich wyników podawać szczepionkę we frakcjonowanych dawkach w warunkach umożliwiających postępowanie przeciwwstrząsowe | Nilsson i wsp.,1 Dreskin i wsp.31 |
| przeciwko grypie | nie zaleca się diagnostyki w kierunku alergii; stosować szczepionki z małą zawartością albuminy | Turner i wsp.,32 Des Roches i wsp.,33 Kelso i wsp.,34 www.canada.ca/en/public-health/services/publi catio ns/healthy-living/canad ian-immunization-guide-statementseasonal-influenza-vaccine.2017–2018.html,36 Grohskopf i wsp.37 | |
| MMR | nie zaleca się diagnostyki w kierunku alergii; szczepienie w standardowych warunkach | Nilsson i wsp.1 | |
| żelatyna (α-Gal) | MMR, MMRV przeciwko ospie wietrznej | diagnostyka w kierunku alergii na podstawie testów skórnych i sIgE; w przypadku dodatnich wyników jako preparaty pierwszego wyboru preferuje się szczepionki niezawierające żelatyny, w przeciwnym razie podawanie w dawkach frakcjonowanych w warunkach umożliwiających postępowanie przeciwwstrząsowe | Nilsson i wsp.,1 Dreskin i wsp.31 |
| drożdże | przeciwko zapaleniu wątroby typu B przeciwko HPV | diagnostyka w kierunku alergii na podstawie testów skórnych i sIgE; w przypadku dodatnich wyników jako preparaty pierwszego wyboru preferuje się szczepionki niezawierające drożdży, w przeciwnym razie podawanie w dawkach frakcjonowanych w warunkach umożliwiających postępowanie przeciwwstrząsowe | Dreskin i wsp.,31 Franceschini i wsp.10 |
| antybiotyki (neomycyna, gentamycyna, streptomycyna i polimiksyna B) | MMR przeciwko ospie wietrznej inaktywowana przeciwko polio | szczepienie w standardowych warunkach; można wykonać testy płatkowe, w przypadku pozytywnego wyniku szczepienie nie jest przeciwwskazane, z wyjątkiem pacjentów z anafilaksją w wywiadzie | Nilsson i wsp.1 |
| HPV – ludzki wirus brodawczaka, MMR – szczepionka przeciwko odrze, śwince i różyczce, MMRV – szczepionka przeciwko odrze, śwince, różyczce i ospie wietrznej, sIgE – swoiste IgE | |||
Nieuodpornionych pacjentów z ujemnymi wynikami testów skórnych można zaszczepić pełną dawką szczepionki. Natomiast w przypadku wywiadu sugerującego anafilaksję bezpieczniejszą opcją jest zastosowanie metody podzielonej dawki, zgodnie z którą początkowo podaje się 10% dawki szczepionki, a następnie (30 min później) pozostałe 90%.1
U pacjentów z dodatnimi wynikami testów skórnych należy przeprowadzić odczulanie z użyciem stopniowo zwiększanych dawek. Coraz większe dawki szczepionki podaje się co 15–30 minut, upewniając się, że nie występują objawy reakcji alergicznej (0,05 ml w rozcieńczeniu 1:10, a następnie po: 0,05, 0,1, 0,15 i 0,2 ml z 0,5 ml nierozcieńczonej szczepionki).25 Pacjentów, którzy pomyślnie przeszli ten protokół, nadal należy traktować jak osoby uczulone na szczepionkę i powtórzyć opisaną procedurę przy podawaniu dawek przypominających. Pacjentów z podejrzewaną reakcją alergiczną na szczepionkę należy prowadzić wyłącznie w kontrolowanych warunkach, w których możliwe jest szybkie leczenie anafilaksji przez doświadczony personel.1
U większości osób z podejrzeniem reakcji opóźnionej szczepionkę można podać w konwencjonalny sposób.27 Testy płatkowe, chociaż nie są niezbędne do podjęcia decyzji terapeutycznych, mogą pomóc w identyfikacji składnika odpowiedzialnego za reakcję i uniknięciu go przy wyborze alternatywnego preparatu, niezawierającego haptenu. Na rynku dostępne są różne hapteny szczepionkowe do testów płatkowych: 2% chlorek glinowy sześciowodny, glin pierwiastkowy (pusta komora aluminiowa Finn Chamber®), polisorbat 80, formaldehyd, siarczan kanamycyny, polimyksyna B, gentamycyna, fenoksyetanol, neomycyna i fenol. Testy płatkowe należy usunąć po 48 godzinach i odczytać po 72 i/lub 96 godzinach lub po tygodniu (to ostatnie może być konieczne w przypadku uczulenia na sole glinu).
W celu oceny obecności nadwrażliwości typu IV należy wykonać testy płatkowe z użyciem 2% chlorku glinowego sześciowodnego i/lub pierwiastkowego glinu.28 Dodatnie wyniki wykazano u 95% dzieci z uporczywymi swędzącymi guzkami podskórnymi, które z czasem zanikają, co sugeruje ustąpienie nadwrażliwości.29
We wszystkich tych przypadkach ważna jest technika podawania, a głębsze wstrzyknięcie wiąże się z rzadszym występowaniem reakcji miejscowych, zwłaszcza u dzieci w wieku <3 lat.1
Szczepionki przeciwko odrze, śwince, różyczce i ospie wietrznej
Żywe, atenuowane wirusy zawarte w szczepionce przeciwko odrze, śwince i różyczce (MMR) oraz szczepionce przeciwko odrze, śwince, różyczce i ospie wietrznej (MMRV) są hodowane w fibroblastach zarodków kurzych i mogą zawierać śladowe ilości owoalbuminy. W przeszłości podejrzewano, że alergia na jaja jest przyczyną reakcji nadwrażliwości na te szczepionki, obecnie jednak MMR i MMRV uważa się za bezpieczne dla pacjentów uczulonych na jaja i można je podawać w standardowych warunkach.1
Niektóre preparaty MMR, MMRV i szczepionki przeciwko ospie wietrznej mogą zawierać śladową ilość żelatyny świńskiej lub bydlęcej jako stabilizator. Wykazano, że składnik ten sporadycznie wywołuje anafilaksję, choć opisano także inne niż natychmiastowe reakcje ogólnoustrojowe (np. w postaci objawów skórnych).30 W związku z tym osoby z alergią na żelatynę zwierzęcą lub galaktozę-alfa-1,3-galaktozę (α-Gal) zawartą w mięsie ssaków w pierwszej kolejności powinny otrzymywać szczepionki niezawierające żelatyny. Jeśli jednak taka szczepionka jest niedostępna, pacjentom z dodatnim wynikiem testów skórnych należy podawać szczepionki w dawkach frakcjonowanych (p. wyżej).31
Dzieci z alergią na jaja, także natychmiastową, z ciężkimi reakcjami, mogą otrzymać MMR i MMRV w standardowych warunkach w gabinecie szczepień.
Dzieci z potwierdzoną alergią na żelatynę lub α-Gal w pierwszej kolejności powinny otrzymać szczepionkę niezawierającą żelatyny. Jeśli jest to niemożliwe, szczepionki należy podawać w dawkach frakcjonowanych.
Szczepionki przeciwko grypie
Szczepionki przeciw grypie obejmują: 3-walentne i 4-walentne inaktywowane szczepionki (IIV), rekombinowaną szczepionkę podjednostkową (recombinant subunit influenza vaccine – RIV [niedostępna w Polsce – przyp. red.]) i szczepionki „żywe” atenuowane (LAIV). W produkcji większości z nich wykorzystuje się hodowlę na zarodkach kurzych, w związku z czym mogą zawierać niewielką ilość białek jaja, w szczególności owoalbuminy. Dawka ta zależy od producenta i partii szczepionki. W przeszłości alergię na jaja uważano za przeciwwskazanie do podawania szczepionek przeciwko grypie, jednak obecnie uznaje się, że pacjenci uczuleni na jaja mogą być bezpiecznie zaszczepieni.
Dostępne są mocne dane wskazujące, że dzieciom z alergią na jaja, także po przebyciu anafilaksji, można bezpiecznie podawać IIV zawierające <1 µg owoalbuminy na dawkę32 lub LAIV zawierające owoalbuminę w stężeniu <0,24 µg na dawkę 0,2 ml.33,34 W związku z tym nie trzeba już stosować zalecanych wcześniej środków ostrożności, takich jak wybór określonego preparatu szczepionki na podstawie zawartości owoalbuminy, wykonanie testów skórnych ze szczepionką oraz stosowanie dawki podzielonej lub frakcjonowanego dawkowania, przynajmniej w krajach, w których wszystkie dostępne IIV i LAIV zawierają niewielką ilość owoalbuminy.35,36
Osobom bez reakcji anafilaktycznej po spożyciu jaj w wywiadzie szczepionki przeciwko grypie można podawać bez specjalnych środków ostrożności, natomiast w przypadku osób z anafilaksją w wywiadzie niektóre wytyczne również zalecają podanie szczepionki bez szczególnych środków ostrożności,37,38 a inne proponują wydłużenie obserwacji do 60 minut w miejscu wyposażonym w zestaw przeciwwstrząsowy.33,34
Dostępne są również szczepionki wytworzone z ludzkich komórek diploidalnych, bez użycia jaj. Jednak z medycznego punktu widzenia nie są one konieczne ani preferowane u osób z alergią na jaja, nawet jeśli uzyskały rejestrację w danych grupach wiekowych.32
Dzieci z alergią na jaja, w tym po przebyciu anafilaksji, mogą bezpiecznie otrzymać szczepionkę przeciwko grypie z małą zawartością owoalbuminy.
Szczepionka przeciwko żółtej gorączce
Do produkcji szczepionki przeciwko żółtej gorączce wykorzystuje się zarodki kurze. Mogą one zawierać znamienną ilość resztkowej owoalbuminy, dlatego podczas szczepienia osób uczulonych na jaja należy podjąć odpowiednie środki ostrożności,1 które obejmują ocenę przez alergologa, łącznie z wykonaniem testów uczuleniowych ze szczepionką i podawaniem frakcjonowanych dawek w przypadku uzyskania dodatniego wyniku.31
Przed szczepieniem przeciwko żółtej gorączce dzieci z alergią na jaja wymagają konsultacji, ponieważ ze względu na możliwą zawartość dużej ilości owoalbuminy szczepionka ta może wywołać reakcję alergiczną.
Szczepionka przeciwko rotawirusom
Od czasu jej wprowadzenia podano już setki milionów dawek i nie zgłoszono żadnych problemów związanych z bezpieczeństwem w odniesieniu do alergii.1 Ciężkie reakcje sugerujące mechanizm alergiczny po podaniu wcześniejszej dawki należy uznać za przeciwwskazanie do podania kolejnej dawki. Taka sytuacja wymaga szczegółowej oceny.39
Szczepionki przeciwko błonicy, tężcowi i krztuścowi
Potwierdzone reakcje alergiczne na szczepionki przeciwko błonicy, tężcowi i krztuścowi (DTP) występują bardzo rzadko i obejmują zarówno pokrzywkę i osutkę skórną,40 jak i anafilaksję.41 Rzadko zgłaszano reakcje w miejscu wstrzyknięcia szczepionki DTPa – według niektórych autorów są one związane z opóźnioną nadwrażliwością na glin zawarty w szczepionce jako adiuwant.42 Szczepionki DTPa i Tdap mogą zawierać śladową ilość białek mleka krowiego, zwłaszcza aminokwasów kazeiny. Zgłoszono kilka przypadków reakcji anafilaktycznych na dawki przypominające DTPa lub Tdap u dzieci i młodzieży z udokumentowaną ciężką alergią na mleko w wywiadzie,43 chociaż większość z nich tolerowała takie szczepionki. Tym samym szczepienie dzieci uczulonych na mleko krowie uważa się za bezpieczne.1,17
Dzieci z alergią na mleko krowie mogą otrzymać szczepionki przeciwko błonicy, tężcowi i krztuścowi w standardowym gabinecie szczepień.
Szczepionki przeciwko zapaleniu wątroby typu B
Szczepionki przeciwko WZW typu B mogą zawierać białka wirusów hodowanych na drożdżach Saccharomyces cerevisiae, a u dzieci z alergią na drożdże w wywiadzie zgłaszano rzadkie reakcje anafilaktyczne na szczepionkę przeciwko WZW typu B (tab. 2).10,44
Szczepionki przeciwko polio
Niektóre preparaty doustnej szczepionki przeciw polio (opracowane wg Sabina) zawierają α-laktoalbuminę. W przeszłości zgłoszono reakcje alergiczne u 4 pacjentów z alergią na mleko krowie w wywiadzie.45 Niemniej jednak u większości dzieci uczulonych na mleko nie obserwuje się powikłań po podaniu takich szczepionek, co sugeruje, że α-laktoalbumina występuje w ilości niewystarczającej do wywołania reakcji. Szczepienie pacjentów uczulonych na mleko nie wymaga żadnych specjalnych środków ostrożności.1
Inaktywowane szczepionki przeciwko polio mogą zawierać śladową ilość aminoglikozydów (streptomycyny i neomycyny) i/lub polimiksyny B, dlatego nie należy ich podawać osobom z anafilaksją na te składniki w wywiadzie, natomiast nie ma przeciwwskazań do szczepienia osób z alergicznym kontaktowym zapaleniem skóry wywołanym przez aminoglikozydy lub polimiksynę B.1
Dzieci z alergicznym kontaktowym zapaleniem skóry wywołanym przez aminoglikozydy lub polimiksynę B w wywiadzie można bezpiecznie szczepić w standardowych warunkach.
Szczepionki przeciwko pneumokokom
Skoniugowane szczepionki przeciwko pneumokokom zawierają inaktywowaną toksynę błoniczą (CRM 197), stosowaną jako białko nośnikowe, oraz polisorbat 80 (PS80), adsorbowane na fosforanie glinu. W 1 przypadku uznano, że CRM 197 był przyczyną anafilaksji po podaniu skoniugowanej szczepionki przeciwko pneumokokom.46 Fosforan glinu może być przyczyną nadwrażliwości typu późnego w postaci guzków w miejscu wstrzyknięcia,42 ale nie jest ona przeciwwskazaniem do podania kolejnej dawki szczepionki. Jedynym przeciwwskazaniem do stosowania szczepionek przeciwko pneumokokom są wcześniejsze ciężkie reakcje nadwrażliwości na te same szczepionki lub ich składniki, głównie CRM 197.1
Szczepionki przeciwko meningokokom
Do tej grupy należą szczepionki przeciwko meningokokom grupy B (MenB), meningokokom grupy C (MenC) i 4-walentna szczepionka przeciwko meningokokom grupy A, C, W i Y (MenACWY). Większość stosowanych w praktyce klinicznej szczepionek MenC i MenACWY zawiera jako nośnik zmodyfikowany toksoid błoniczy (CRM 197) lub tężcowy. Zgłaszano reakcje nadwrażliwości po podaniu szczepionki MenACWY lub MenB, w tym anafilaksję.47,48 Jedynymi alergicznymi przeciwwskazaniami do podania szczepionki przeciwko meningokokom jest dodatni wywiad w kierunku ciężkich reakcji nadwrażliwości na szczepionkę lub jej składniki, głównie toksoid tężcowy lub błoniczy.
Szczepionki przeciwko HPV
Szczepionki przeciwko HPV mogą zawierać śladową ilość drożdży. U osób z ciężką alergią na drożdże w wywiadzie po podaniu tej szczepionki może teoretycznie wystąpić ciężka reakcja alergiczna.49 Zaleca się, aby u pacjentów z alergią na drożdże przeprowadzić pełną diagnostykę w tym kierunku.
Niektóre preparaty szczepionek przeciwko HPV zawierają PS80 jako stabilizator, który może odpowiadać za reakcje nadwrażliwości.50 Dzieci z ciężką reakcją alergiczną na tę substancję należy zaszczepić preparatami niezawierającymi PS80 lub skierować do specjalistycznego ośrodka alergologicznego w celu przeprowadzenia testów skórnych i ustalenia protokołu szczepienia zgodnie z wynikami badań diagnostycznych.
Szczepionki przeciwko COVID-19
Mimo korzystnego profilu bezpieczeństwa szczepionek przeciwko COVID-19, wkrótce po rozpoczęciu kampanii szczepień władze ds. zdrowia na całym świecie, zachowując bardzo rygorystyczne środki ostrożność, musiały je uznać za przeciwwskazane u osób z dodatnim wywiadem w kierunku natychmiastowej reakcji alergicznej na pierwszą dawkę szczepionki lub którąkolwiek substancję pomocniczą, glikol polietylenowy (PEG) w szczepionkach mRNA i PS80 w szczepionkach wektorowych.51,52 W celu opracowania odpowiednich wytycznych zalecano wykonywanie testów skórnych u osób z alergią na PEG/PS80 lub reakcją alergiczną na wcześniejszą dawkę szczepionki.53 Jednak coraz więcej danych wskazuje, że testy skórne z użyciem substancji pomocniczych nie ułatwiają postępowania u tych osób, ponieważ nie wpływają na tolerancję drugiej dawki. Z dostępnych danych wiadomo też, że osoby z reakcją po pierwszej dawce mogą bezpiecznie otrzymać drugą dawkę szczepionki.54-58 Etiologia anafilaksji w tych przypadkach nie jest w pełni poznana i nadal stanowi obszar aktywnych badań. Należy podkreślić, że w przeciwieństwie do tego, czego można by oczekiwać w związku z podejrzeniem patogenezy o charakterze IgE-zależnej reakcji alergicznej, przypadki anafilaksji zgłaszano częściej po pierwszej dawce niż po drugiej.59 Możliwe też, że była to reakcja IgE-niezależna, związana na przykład z aktywacją układu dopełniacza.14
Nie ma przekonujących danych wskazujących, że PEG i/lub PS80 są alergenami odpowiadającymi za reakcje alergiczne na szczepionki przeciwko SARS-CoV-2.
Dzieci z alergią na składnik szczepionki w wywiadzie
Nie ma danych wskazujących na zwiększone ryzyko reakcji alergicznych po szczepieniu u dzieci z atopią, dlatego powinny one otrzymać wszystkie zalecane szczepionki bez konieczności podejmowania dodatkowych środków ostrożności.60,61 U dzieci, u których w przeszłości wystąpiła natychmiastowa reakcja alergiczna na szczepionkę lub którykolwiek jej składnik, ryzyko może być większe, dlatego obowiązkowo wymagają pełnej oceny w kierunku alergii. Diagnostykę tę muszą przeprowadzać eksperci w zakresie alergii związanej ze szczepieniami, alergolodzy lub immunolodzy, ponieważ dodatnie wyniki testu nie są podstawą rozpoznania alergii, a jedynie wskazują na obecność uczulenia, które należy ocenić z uwzględnieniem wywiadu klinicznego.
Wystąpienie w przeszłości reakcji opóźnionych lub alergii kontaktowej na składnik szczepionki, a także uzyskanie dodatnich wyników testów płatkowych nie stanowi bezwzględnego przeciwwskazania do szczepień, ponieważ ryzyko związane z niewykonaniem szczepienia przewyższa ryzyko związane z reakcjami typu późnego.1
U dzieci z atopią nie stwierdza się zwiększonego ryzyka reakcji alergicznych na szczepionki i można je szczepić w standardowych warunkach.
Alergia na jaja
Alergia na jaja jest najczęstszym typem alergii na pokarmy u dzieci, występującej u około 2,5% dzieci w pierwszych 2 latach życia,62 natomiast reakcje alergiczne na szczepionki zawierające śladową ilość białka jaja są zgłaszane bardzo rzadko.
Diagnostyka alergiczna w kierunku uczulenia na białka jaja obejmuje: (1) punktowe testy skórne z użyciem ekstraktów z białka jaja i owoalbuminy, (2) badania serologiczne oznaczające IgE swoiste dla białka jaja i owoalbuminy (nGal d2). W obu przypadkach wynik dodatni wskazuje na uczulenie i nie pozwala jednoznacznie rozpoznać alergii na pokarmy, dlatego każdy wynik musi ocenić specjalista.
Alergia na mleko krowie
W niektórych szczepionkach wykazano śladową ilość kazeiny. Alergia na białko mleka krowiego jest częsta u dzieci, ale w ciągu ostatnich 10-leci u zdecydowanej większości dzieci z ciężką alergią na mleko nie obserwuje się reakcji na takie szczepionki.17 Obecnie szczepienie dzieci uczulonych na mleko krowie uważa się za bezpieczne.1,17
Alergia na żelatynę
Żelatyna jest białkiem zwierzęcym pochodzącym z tkanki łącznej bydła i świń. W ilości od mikrogramów do miligramów jest stosowana jako stabilizator w atenuowanych („żywych”) szczepionkach wirusowych w celu ich ochrony przed niekorzystnymi warunkami.60 Mimo że występuje niezwykle rzadko, u pacjentów z alergią na żelatynę zwierzęcą lub α-Gal zawarty w mięsie ssaków w pierwszej kolejności należy zastosować szczepionkę niezawierającą żelatyny. Niemniej jednak diagnostyka alergologiczna w kierunku uczulenia na żelatynę obejmuje: (1) punktowe testy skórne wykonane z 5 g żelatyny w proszku rozcieńczonej w 5 ml soli fizjologicznej60 i ekstraktu z mięsa ssaków, (2) oznaczenie w surowicy IgE swoistych dla mięsa ssaków i α-Gal.
Alergia na antybiotyki
Szczepionki, zwłaszcza zawierające żywe, atenuowane wirusy, mogą zawierać śladową ilość antybiotyków, takich jak neomycyna, gentamycyna, streptomycyna i polimyksyna B, które dodaje się w celu zapobiegania zanieczyszczeniom bakteryjnym w procesie produkcyjnym. U pacjentów z alergią na te antybiotyki w wywiadzie najczęściej stwierdza się reakcje miejscowe, takie jak kontaktowe zapalenie skóry, które do wywołania objawów klinicznych wymaga podania neomycyny w ilości znacznie większej niż zwykle jest zawarta w szczepionkach i które nie stanowi żadnego przeciwwskazania do szczepień.17 W przypadku podejrzenia alergii dostępne są testy płatkowe, które można wykonać w celu potwierdzenia uczulenia i wyboru alternatywnych szczepionek, chociaż ponowne szczepienie nie jest przeciwwskazane nawet w przypadku dodatnich wyników testów płatkowych, z wyjątkiem bardzo rzadkich przypadków anafilaksji.1,22 Komercyjnie dostępne hapteny obejmują siarczan kanamycyny, streptomycynę, gentamycynę i neomycynę.
Alergia na drożdże
Pozostałości drożdży można znaleźć w szczepionkach przeciwko WZW typu B i HPV wytwarzanych z kultur komórkowych Saccharomyces cerevisiae.44,49 Alergia na drożdże występuje bardzo rzadko, zwłaszcza u młodych osób, a diagnostyka w przypadku podejrzenia alergii obejmuje: (1) punktowe testy skórne z ekstraktem drożdżowym, (2) oznaczenie IgE swoistych dla drożdży. W przypadku pozytywnych wyników konieczne jest szczepienie dawkami frakcjonowanymi.
Alergia na dekstran
Dekstran wywoływał ciężkie natychmiastowe IgG-zależne reakcje nadwrażliwości na preparat MMR, który wycofano z rynku.63 Obecnie dostępne szczepionki nie zawierają resztkowych ilości dekstranu.
Alergia na lateks
U pacjentów z alergią na lateks należy stosować szczepionki i materiały niezawierające lateksu. Diagnostyka alergologiczna w przypadku podejrzenia uczulenia na lateks obejmuje: (1) punktowe testy skórne z ekstraktem lateksu, (2) oznaczenie surowicy IgE swoistych dla lateksu (rHev b1, rHev b3 i rHev b5), heweiny (rHev b6.02), profiliny (rHev b8) i chitynazy klasy I (rHev b11).
Mastocytoza
Dzieci chore na mastocytozę są obarczone zwiększonym ryzykiem uwolnienia mediatorów komórek tucznych pod wpływem różnych czynników wyzwalających, w tym po szczepieniach.1,64 W celu minimalizacji ryzyka natychmiastowych reakcji dzień przed szczepieniem i przez 5 dni po szczepieniu należy podawać inhibitor receptora histaminowego H1. Zaleca się też podawanie szczepionki w pojedynczych wstrzyknięciach, pod nadzorem lekarza przez 30 minut po szczepieniu.65
Informacje dotyczące finansowania: Brak wsparcia finansowego.
Konflikt interesów: Autorzy nie zgłaszają konfliktu interesów
związanego z treścią artykułu.
Piśmiennictwo:
1. Nilsson L., Brockow K., Alm J., et al.: Vaccination and allergy: EAACI position paper, practical aspects. Pediatr. Allergy Immunol., 2017; 28 (7): 628–6402. Institute of Medicine (US). Committee to Review Adverse Effects of Vaccines; Stratton K.R., Clayton E.W.: Adverse effects of vaccines: evidence and causality. The National Academies Press, 2012
3. Micheletti F., Peroni D., Piacentini G., et al.: Vaccine allergy evaluation and management at the specialized Green Channel Consultation Clinic. Clin. Exp. Allergy, 2012; 42 (7): 1088–1096
4. Su J.R., Moro P.L., Ng C.S., et al.: Anaphylaxis after vaccination reported to the vaccine adverse event reporting system, 1990–2016. J. Allergy Clin. Immunol., 2019; 143 (4): 1465–1473
5. McNeil M.M., Weintraub E.S., Duffy J., et al.: Risk of anaphylaxis after vaccination in children and adults. J. Allergy Clin. Immunol., 2016; 137 (3): 868–878
6. Gold M., Goodwin H., Botham S., et al.: Re-vaccination of 421 children with a past history of an adverse vaccine reaction in a special immunisation service. Arch. Dis. Child., 2000; 83 (2): 128–131
7. Wood R.A.: Allergic reactions to vaccines. Pediatr. Allergy Immunol., 2013; 24 (6): 521–526
8. Kimberlin D.W., Brady M.T., Jackson M.A., Long S.S.; Academy of Pediatrics. Red book: 2015 report of the Committee on Infectious Diseases. Am. Acad. Pediatr., 2015; 432: 445
9. Halsey N.A., Griffioen M., Dreskin S.C., et al.: Immediate hypersensitivity reactions following monovalent 2009 pandemic influenza A (H1N1) vaccines: reports to VAERS. Vaccine, 2013; 31 (51): 6107–6112
10. Franceschini F., Bottau P., Caimmi S., et al.: Evaluating children with suspected allergic reactions to vaccines for infectious diseases. Allergy Asthma Proc., 2018; 39 (3): 177–183
11. Muraro A., Worm M., Alviani C., et al.: EAACI guidelines: anaphylaxis (2021 update). Allergy, 2022; 77 (2): 357–377
12. Gold M.S., Amarasinghe A., Greenhawt M., et al.: Anaphylaxis: revision of the brighton collaboration case definition. Vaccine, 2023; 41 (15): 2605–2614
13. Arcolaci A., Bronte V., Zanoni G.: Immunization practices and risk of anaphylaxis: a current update, comprehensive of COVID-19 vaccination data. Curr. Opin. Allergy Clin. Immunol., 2021; 21 (5): 418–425
14. Castells M.C., Phillips E.J.: Maintaining safety with SARS-CoV-2 vaccines. N. Engl. J. Med., 2021; 384 (7): 643–649
15. Miller E.R., McNeil M.M., Moro P.L., et al.: The reporting sensitivity of the Vaccine Adverse Event Reporting System (VAERS) for anaphylaxis and for Guillain Barre syndrome. Vaccine, 2020; 38: 7458–7463
16. Bohlke K., Davis R.L., Marcy S.M., et al.: Risk of anaphylaxis after vaccination of children and adolescents. Pediatrics, 2003; 112 (4): 815–820
17. Caubet J.C., Ponvert C.: Vaccine allergy. Immunology and allergy. Clinics, 2014; 34 (3): 597–613
18. Echeverría-Zudaire L.A., Ortigosa-del Castillo L., Alonso-Lebrero E., et al.: Consensus document on the approach to children with allergic reactions after vaccination or allergy to vaccine components. Allergol. Immunopathol., 2015; 43 (3): 304–325
19. Aytekin E.S., Şekerel B.E., Şahiner Ü.M.: Allergic reactions during childhood vaccination and management. Turk. J. Pediatr., 2021; 63 (6): 941–954
20. Sarti L., Lezmi G, Mori F, Giovannini M, Caubet JC. Diagnosis and management of hypersensitivity reactions to vaccines. Expert Rev. Clin. Immunol., 2020; 16 (9): 883–896
21. Zanoni G., Migliorini M., Gallo T., et al.: Recurrent injection site reactions to vaccines: two clinical patterns of presentation. Vaccine, 2020; 38 (45): 6985–6989
22. Caubet J.C., Rudzeviciene O., Gomes E., et al.: Managing a child with possible allergy to vaccine. Pediatr. Allergy Immunol., 2014; 25 (4): 394–403
23. www.hopkinsvaccine.org/cc-mmr.html
24. Kelso J.M., Greenhawt M.J., Li J.T., et al.: Adverse reactions to vaccines practice parameter 2012 update. J. Allergy Clin. Immunol., 2012; 130: 25–43
25. Wood R.A., Setse R., Halsey N.: Clinical immunization safety assessment (CISA) network hypersensitivity working group. Irritant skin test reactions to common vaccines. J. Allergy Clin. Immunol., 2007; 120: 478–481
26. Lopez-Serrano M.C., Caballero M.T., Barranco P., Martinez-Alzamora F.: Booster responses in the study of allergic reactions to beta-lactam antibiotics. J. Investig. Allerg. Clin. Immunol., 1996; 6 (1): 30–35
27. Wood R.A., Berger M., Dreskin S.C., et al.: An algorithm for treatment of patients with hypersensitivity reactions after vaccines. Pediatrics, 2008; 122 (3): e771–e777
28. Bergfors E., Inerot A., Falk L., et al.: Patch testing children with aluminium chloride hexahydrate in petrolatum: a review and a recommendation. Contact Dermatitis, 2019; 81 (2): 81–88
29. Bergfors E., Trollfors B.: Sixty-four children with persistent itching nodules and contact allergy to aluminium after vaccination with aluminium-adsorbed vaccines-prognosis and outcome after booster vaccination. Eur. J. Pediatr., 2013; 172 (2): 171–177
30. Miyazawa H., Inouye S., Sakaguchi M.: Sensitization to gelatin in children with systemic non-immediate-type reactions to varicella vaccines. Ann. Allergy Asthma Immunol., 2000; 84 (3): 341–344
31. Dreskin S.C., Halsey N.A., Kelso J.M., et al.: International consensus (ICON): allergic reactions to vaccines. World Allergy Organ. J., 2016; 9: 32
32. Greenhawt M., Turner P.J., Kelso J.M.: Administration of influenza vaccines to egg allergic recipients: a practice parameter update 2017. Ann. Allergy Asthma Immunol., 2018; 120 (1): 49–52
33. Turner P.J., Southern J., Andrews N.J., et al.: Safety of live attenuated influenza vaccine in atopic children with egg allergy. J. Allergy Clin. Immunol., 2015; 136 (2): 376–381
34. Des Roches A., Samaan K., Graham F., et al.: Safe vaccination of patients with egg allergy by using live attenuated influenza vaccine. J. Allergy Clin. Immunol. Pract., 2015; 3 (1): 138–139
35. Kelso J.M., Greenhawt M.J., Li J.T.: Update on influenza vaccination of egg allergic patients. Ann. Allergy Asthma Immunol., 2013; 111 (4): 301–302
36. Committee on Infectious Diseases, & American Academy of Pediatrics: Recommendations for prevention and control of influenza in children, 2015–2016. Pediatrics, 2015; 136 (4): 792–808
37. www.canada.ca/en/public-health/services/publications/healthy-living/canadian-immunization-guide-statement-seasonal-influenza-vaccine.2017–2018.html
38. Grohskopf L.A., Alyanak E., Broder K.R., et al.: Prevention and control of seasonal influenza with vaccines: recommendations of the advisory committee on immunization practices – United States, 2019–20 influenza season. MMWR Recomm. Rep., 2019; 68 (3): 1–21
39. World Health Organization. Rotavirus vaccines: WHO position paper – January 2013. Wkly Epidemiol. Rec., 2013; 88 (5): 49–64
40. Jackson L.A., Carste B.A., Malais D., Froeschle J.: Retrospective population-based assessment of medically attended injection site reactions, seizures, allergic responses and febrile episodes after acellular pertussis vaccine combined with diphtheria and tetanus toxoids. Pediatr. Infect. Dis. J., 2002; 21 (8): 781–786
41. Cheng D.R., Perrett K.P., Choo S., et al.: Pediatric anaphylactic adverse events following immunization in Victoria, Australia from 2007 to 2013. Vaccine, 2015; 33 (13): 1602–1607
42. Beveridge M.G., Polcari I.C., Burns J.L., et al.: Local vaccine site reactions and contact allergy to aluminum. Pediatr. Dermatol., 2012; 29 (1): 68–72
43. Kattan J.D., Konstantinou G.N., Cox A.L., et al.: Anaphylaxis to diphtheria, tetanus, and pertussis vaccines among children with cow’s milk allergy. J. Allergy Clin. Immunol., 2011; 128 (1): 215–218
44. DiMiceli L., Pool V., Kelso J.M., et al.; VAERS Team: Vaccination of yeast sensitive individuals: review of safety data in the US vaccine adverse event reporting system (VAERS). Vaccine, 2006; 24 (6): 703–707
45. Parisi C.A.S., Smaldini P.L., Gervasoni M.E., et al.: Hypersensitivity reactions to the Sabin vaccine in children with cow’s milk allergy. Clin. Exp. Allergy, 2013; 43 (2): 249–254
46. Arroabarren E., Anda M., Sanz M.L.: Anaphylaxis to pneumococcal vaccine; CRM (197): novel cause of vaccine allergy. Pediatr. Allergy Immunol., 2016; 27 (4): 433–437
47. Myers T.R., McNeil M.M., Ng C.S., et al.: Adverse events following quadrivalent meningococcal CRM-conjugate vaccine (Menveo®) reported to the Vaccine Adverse Event Reporting system (VAERS), 2010–2015. Vaccine, 2017; 35 (14): 1758–1763
48. Perez-Vilar S., Dores G.M., Marquez P.L., et al.: Safety surveillance of meningococcal group B vaccine (Bexsero®), Vaccine Adverse Event Reporting System, 2015–2018. Vaccine, 2022; 40 (2): 247–254
49. Markowitz L.E., Dunne E.F., Saraiya M., et al.: Human papillomavirus vaccination: recommendations of the Advisory Committee on Immunization Practices (ACIP). Morb. Mortal. Wkly Rep. Recomm. Rep., 2014; 63 (5): 1–30
50. Badiu I., Geuna M., Heffler E., Rolla G.: Hypersensitivity reaction to human papillomavirus vaccine due to polysorbate 80. BMJ Case Rep., 2012; 2012: bcr0220125797
51. Greenhawt M., Abrams E.M., Shaker M., et al.: The risk of allergic reaction to SARS-CoV-2 vaccines and recommended evaluation and management: a systematic review, meta-analysis, GRADE assessment, and international consensus approach. J. Allergy Clin. Immunol. Pract., 2021; 9 (10): 3546–3567
52. Greenhawt M., Abrams E.M., Oppenheimer J., et al.: The COVID-19 pandemic in 2021: avoiding overdiagnosis of anaphylaxis risk while safely vaccinating the world. J. Allergy Clin. Immunol. Pract., 2021; 9: 1438–1441
53. Banerji A., Wickner P.G., Saff R., et al.: mRNA vaccines to prevent COVID-19 disease and reported allergic reactions: current evidence and suggested approach. J. Allergy Clin. Immunol. Pract., 2021; 9: 1423–1437
54. Greenhawt M., Shaker M., Golden D.B.: PEG/polysorbate skin testing has no utility in the assessment of suspected allergic reactions to SARS-CoV-2 vaccines. J. Allergy Clin. Immunol. Pract., 2021; 9 (9): 3321–3322
55. Wolfson A.R., Robinson L.B., Li L., et al.: First-dose mRNA COVID-19 vaccine allergic reactions: limited role for excipient skin testing. J. Allergy Clin. Immunol. Pract., 2021; 9 (9): 3308–3320
56. Picard M., Drolet J.P., Masse M.S., et al.: Safety of COVID-19 vaccination in patients with polyethylene glycol allergy: a case series. J. Allergy Clin. Immunol. Pract., 2022; 10 (2): 620–625
57. Kaplan B., Farzan S., Coscia G., et al.: Allergic reactions to coronavirus disease 2019 vaccines and addressing vaccine hesitancy: Northwell health experience. Ann. Allergy Asthma Immunol., 2022; 128 (2): 161–168
58. Chu D.K., Abrams E.M., Golden D.B., et al.: Risk of second allergic reaction to SARS-CoV-2 vaccines: a systematic review and meta-analysis. JAMA Intern. Med., 2022; 182 (4): 376–385
59. American Academy of Pediatrics: Active and passive immunization. (In:) Pickering L.K., (ed.): Red Book: 2009 Report of the Committee on Infectious Diseases. 28th ed. American Academy of Pediatrics; 2009: 48
60. Kelso J.M.: Update on vaccination guidelines for allergic children. Expert Rev. Vaccines, 2009; 8: 1541–1546
61. Zent O., Arras-Reiter C., Broeker M., Hennig R.: Immediate allergic reactions after vaccinations – a post-marketing surveillance review. Eur. J. Pediatr., 2002; 161: 21–25
62. Eggesbo M., Botten G., Halvorsen R., Magnus P.: The prevalence of allergy to egg: a population-based study in young children. Allergy, 2001; 56: 403–411
63. Zanoni G., Puccetti A., Dolcino M., et al.: Dextran-specific IgG response in hypersensitivity reactions to measles-mumps-rubella vaccine. J. Allergy Clin. Immunol., 2008; 122 (6): 1233–1235
64. Zanoni G., Zanotti R., Schena D., et al.: Vaccination management in children and adults with mastocytosis. Clin. Exp. Allergy, 2017; 47 (4): 593–596
65. Gallo G., Mel R., Ros E., Filia A.: Guide to contraindications to vaccination (2018 update). Rapporti ISTISAN-Istituto Superiore di Sanita, 2019; 19/3: 111
Komentarz I
prof. dr hab. n. med. Jacek Wysocki
Katedra i Zakład Profilaktyki Zdrowotnej Uniwersytetu Medycznego
im. Karola Marcinkowskiego w Poznaniu
Punkt widzenia pediatry, wakcynologa
W procesie kwalifikacji do szczepienia ochronnego najwięcej wątpliwości u pacjentów lub ich rodziców wzbudza kwestia alergii na daną szczepionkę lub jej składniki. Niepokój często budzą informacje zawarte w ulotce dołączonej do szczepionki dotyczące nadwrażliwości na substancje czynne, na którąkolwiek substancję pomocniczą lub składnik, który może być obecny w ilościach śladowych (pozostałość składników jaja kurzego), jako przeciwwskazania do szczepienia. Przykładem może być ulotka jednej ze szczepionek przeciwko grypie stosowanej w Polsce.1 Należy pamiętać, że treść Charakterystyki Produktu Leczniczego lub ulotki dla pacjenta proponuje producent, a zatwierdza organ rejestrujący lek. Jednak dokumenty te nie zawsze uwzględniają najnowszą wiedzę medyczną i wytyczne. Według aktualnych zaleceń amerykańskiego Advisory Committee on Immunization Practices (ACIP) przeciwwskazanie do szczepienia stanowią tylko ciężkie reakcje alergiczne (np. wstrząs anafilaktyczny) po podaniu poprzedniej dawki szczepionki lub na jakikolwiek jej składnik.2 Przedstawiony artykuł Arcolaci i wsp. wychodzi naprzeciw wszystkim tym wątpliwościom. Jego istotną część stanowi wyjaśnienie kryteriów rozpoznania wstrząsu anafilaktycznego. Do poradni konsultacyjnych ds. szczepień ochronnych zgłasza się wielu pacjentów, u których po szczepieniu doszło do omdlenia lub rozwinęła się inna reakcja, które przez rodziców są określane jako „wstrząs anafilaktyczny” po podaniu szczepionki. W celu weryfikacji, czy objawy zgłaszane po podaniu szczepionki rzeczywiście były reakcją anafilaktyczną, można wykorzystać kryteria Brighton Collaboration Working Group, zgodnie z którymi do ustalenia takiego rozpoznania konieczne jest wystąpienie objawów ze strony ≥2 narządów.
Postępowanie diagnostyczne po przebyciu reakcji o prawdopodobnym podłożu alergicznym w związku z podaniem szczepionki powinien przeprowadzić specjalista alergolog, który również znajdzie cenne wskazówki w omawianym artykule. Osoby wykonujące szczepienia muszą natomiast rozstrzygać, czy rzeczywiście istnieją przeciwwskazania do podania kolejnych szczepionek przewidzianych w Programie Szczepień Ochronnych (PSO). Do poradni konsultacyjnych ds. szczepień ochronnych trafia bardzo dużo dzieci z podejrzeniem alergii na białka jaja kurzego (BJK) w celu przeprowadzenia szczepienia przeciwko odrze, śwince i różyczce (MMR) w warunkach szpitalnych. W omawianym artykule przypomniano, że aktualnie stosowane szczepionki MMR zawierają „żywe” wirusy namnażane na fibroblastach zarodków kurzych i mogą zawierać tylko śladowe ilości owoalbuminy. Z tego względu dzieci z alergią na jaja, nawet te z ciężkimi reakcjami natychmiastowymi po ekspozycji na BJK, można bezpiecznie szczepić w standardowym punkcie szczepień, zachowując standardowe środki ostrożności (w placówkach wyposażonych w zestaw przeciwwstrząsowy i pod nadzorem personelu mającego doświadczenie w leczeniu ciężkich reakcji alergicznych). Natomiast większej ostrożności wymagają dzieci, u których obserwowano reakcje anafilaktyczne na żelatynę.
W wielu krajach istotnym problemem praktycznym jest szczepienie przeciwko grypie osób z alergią na jaja. Jednak w Polsce przeciwko grypie szczepi się bardzo mały odsetek osób, dlatego pacjenci z takim problemem rzadko trafiają na konsultacje do poradni szczepień, prawdopodobnie znacznie częściej w ogóle rezygnując ze szczepienia przeciwko tej chorobie. Warto jednak zapamiętać, że jeśli u pacjenta nie obserwowano reakcji anafilaktycznej po spożyciu jaja, szczepienie przeciwko grypie można wykonać w standardowych warunkach. Chciałbym także przypomnieć Czytelnikom zalecenia ACIP, zgodnie z którymi osób z reakcją alergiczną po spożyciu jaja inną niż pokrzywka nie trzeba już szczepić przeciwko grypie w warunkach szczególnego nadzoru (np. w szpitalu). Wszystkie szczepionki powinno się podawać w placówkach, w których personel jest odpowiednio przygotowany i wyposażony do szybkiego rozpoznania i rozpoczęcia leczenia w razie wystąpienia ostrych objawów nadwrażliwości.3
Dla praktyki szczepień istotne jest także podkreślenie, że szczepionki zawierające białka mleka krowiego (BMK) są bezpieczne dla dzieci z alergią na mleko krowie, co wynika z faktu, że ten typ uczulenia jest bardzo częsty u dzieci, które są normalnie szczepione i nie obserwuje się u nich ciężkich reakcji alergicznych. Ważne jest także stwierdzenie, że u dzieci z atopią nie obserwuje się zwiększonego ryzyka reakcji alergicznych związanych z podawaniem szczepionek, a takich pacjentów w swojej praktyce bardzo często spotykają pediatrzy i lekarze rodzinni.
W wakcynologii spotykamy się niekiedy z pacjentami, u których ryzyko reakcji anafilaktycznej jest zwiększone, ale szczepionka, która ma być podana, jest ważna dla zdrowia pacjenta (np. istnieje duże ryzyko zachorowania na chorobę, której szczepionka ma zapobiegać, lub duże ryzyko ciężkiego przebiegu choroby). W takich przypadkach należy ocenić bilans korzyści i ryzyka związanego z podaniem szczepionki, wybierając najkorzystniejsze rozwiązanie. W omawianym artykule takim przykładem jest szczepienie przeciwko żółtej gorączce – ważne, a niekiedy niezbędne dla osób podróżujących w strefy endemiczne. Także i w tym przypadku w artykule bardzo przejrzyście przedstawiono zasady postępowania.
Praktyczne wskazówki Arcolaci i wsp. będą bardzo przydatne dla wszystkich lekarzy zajmujących się na co dzień szczepieniami, a także dla współpracujących z nimi specjalistów alergologów.
Piśmiennictwo do komentarza:
1. Charakterystyka Produktu Leczniczego Vaxigrip Tetra (07/2023) www.sanofi.pl/dam/jcr:fe42a563-dfde-4c2d-b55b-3bf190dd4bbd/VaxigripTetra_ChPL_07.2023.pdf (dostęp: 30.10.2023)2. Ogólne wytyczne dotyczące szczepień ochronnych – cz. 2. Aktualne (2021) zalecenia Advisory Committee on Immunization Practices (ACIP). Na podstawie: Kroger A., Bahta L., Hunter P.: General best practice guidelines for immunization (updated May 4, 2021). www.mp.pl/szczepienia/artykuly/wytyczne/287503 (dostęp: 30.10.2023)
3. Prevention and control of seasonal influenza with vaccines: recommendations of the Advisory Committee on Immunization Practices – United States, 2023–24 Influenza Season. MMWR Recomm. Rep., 2023; 72: 1–25
Komentarz II
prof. dr hab. n. med. Anna Bręborowicz
Klinika Chorób Płuc i Reumatologii Dziecięcej Uniwersytetu
Medycznego im. Karola Marcinkowskiego w Poznaniu
Punkt widzenia alergologa
Skuteczność szczepień ochronnych w profilaktyce chorób infekcyjnych jest niekwestionowana, czego kolejnym dowodem w ostatnich latach była kontrola pandemii COVID-19 dzięki szybkiemu opracowaniu i wprowadzeniu do stosowania swoistej immunizacji. Przed dopuszczeniem do powszechnego stosowania szczepionki podlegają rygorystycznej ocenie w badaniach z randomizacją pod kątem ich bezpieczeństwa, co oczywiście nie wyklucza w 100% ryzyka zdarzeń niepożądanych, w tym także reakcji alergicznych i anafilaksji. Dotychczas raportowana częstość tych zdarzeń mieści się w szerokim zakresie (1–20/mln podanych dawek), przy czym najcięższe reakcje, w postaci anafilaksji, występują jeszcze rzadziej (0,65–1,45/mln podanych dawek). Weryfikacja tych zgłoszeń wskazuje jednak na ich nadrozpoznawalność w praktyce klinicznej (np. 828 przypadków potwierdzonych na 500 000 zgłoszonych). Niemniej jednak reakcje alergiczne na szczepionki mogą wystąpić, zwłaszcza że zwiększa się zapadalność na choroby alergiczne i pojawiają się nowe uczulenia (np. zespół α-gal, czyli uczulenie na galaktozo-α-1,3-galaktozę z ryzykiem anafilaksji po podaniu preparatów żelatyny), a na ich ujawnianie się czasami wpływają dodatkowe okoliczności (np. działanie kofaktorów: infekcja, stres, wysiłek). Ponadto wprowadzane są nowe szczepionki, zwiększa się popularność niektórych szczepionek stosowanych już wcześniej. W tej sytuacji szczególnie ważne jest ustalenie takich zasad postępowania, które zapewnią maksymalne bezpieczeństwo szczepień w ogólnej populacji i w grupach zwiększonego ryzyka. W świetle opublikowanych w 2016 roku wytycznych World Allergy Organization (WAO)1 i opublikowanego w 2017 stanowiska European Academy of Allergy and Clinical Immunology (EAACI)2 wszyscy mają prawo do czynnej profilaktyki chorób zakaźnych, choroby alergiczne nie stanowią przeszkody w realizacji szczepień ochronnych, ale u chorych ze swoistym uczuleniem na wybrane składniki szczepionki oraz po przebyciu reakcji alergicznej konieczna jest indywidualizacja postępowania. Praktyczne podejście do problemu omówiono w komentowanym artykule, którego współautorka należała do zespołu ekspertów EAACI.
W pierwszej części artykułu krótko scharakteryzowano reakcje nadwrażliwości typu natychmiastowego i opóźnionego. Za granicę czasową pierwszych objawów reakcji natychmiastowej przyjęto 4 godziny. Zwrócono uwagę, aby w rozpoznawaniu anafilaksji po szczepieniu korzystać ze słabo rozpowszechnionych kryteriów Brighton Collaboration Working Group, które uwzględniają lokalizację zmian w ≥2 narządach (podobnie jak w wytycznych WAO oraz EAACI), ale dodatkowo wprowadzają kryteria duże i małe w celu określenia pewności rozpoznania.3 Ze względu na złożoność ich przydatność w stanach ostrych może być ograniczona, choć mogą/powinny służyć weryfikacji rozpoznania. Pacjenci z objawami sugerującymi reakcję alergiczną wymagają dokładnej analizy (m.in. należy wykluczyć mastocytozę, alergię na pokarmy, niekontrolowaną astmę, ustalić rodzaj szczepionki oraz jej skład) i szczegółowej specjalistycznej diagnostyki.
Postępowanie przeprowadzone po wystąpieniu reakcji o prawdopodobnym podłożu alergicznym w związku z podaniem szczepionki powinno potwierdzić lub wykluczyć to podejrzenie (testy skórne z kolejnymi rozcieńczeniami szczepionki) i wykryć potencjalnie uczulający składnik szczepionki (p. tab. 3). Wykonywanie testów ze szczepionkami może być trudne z uwagi na ich ograniczony dostęp i koszty. W dalszej kolejności należy odpowiedzieć na pytania: czy jest alternatywa dla szczepionki odpowiedzialnej za anafilaksję, jeśli nie, to czy kontynuować szczepienia i w jakich warunkach oraz czy bezpieczne jest podawanie innych szczepionek zawierających wspólne składniki (a nawet unikanie pokarmów zawierających ten składnik, np. żelatyna w zespole α-gal, chociaż wartość predykcyjna dodatnich oznaczeń alergenowo swoistych IgE [asIgE] jest mała). Przy wyborze alternatywnych szczepionek konieczna jest współpraca alergologa ze specjalistą chorób zakaźnych. Omawiając w drugiej części artykułu algorytm postępowania w tej grupie chorych, autorzy nie wskazali, w jakich warunkach należy realizować procedury diagnostyczne i ewentualnie dalsze szczepienia. Wydaje się, że ze względu na specyfikę problemu i aspekty bezpieczeństwa pacjentów tych należy objąć opieką doświadczonych specjalistów w placówkach przygotowanych do realizacji procedur o zwiększonym ryzyku powikłań (np. baza szpitalna, zespół anestezjologiczny). Konieczna jest precyzyjna znajomość składników szczepionek, ich właściwości uczulających i dotychczasowych doniesień w piśmiennictwie, bowiem niektóre z nich są bardzo kazuistyczne. Należy do nich anafilaksja po szczepionce DTP zawierającej śladową ilość BMK (chociaż nie ujawniono tego problemu u dzieci nawet z najcięższymi postaciami alergii na BMK) lub po szczepionce przeciwko wirusowemu zapaleniu wątroby (WZW) typu B zawierającej alergen drożdży Saccharomyces cerevisiae. Drożdże są także obecne w szczepionce przeciwko ludzkiemu wirusowi brodawczaka (HPV), a dodatkowo niektóre mogą zawierać stabilizator PS80 o potencjale anafilaktogennym (p. tab. 3). Anafilaksja może również wystąpić po podaniu skoniugowanej szczepionki przeciwko pneumokokom, z uwagi na zawartość inaktywowanej toksyny błoniczej CRM197 jako nośnika białka, oraz po szczepieniu przeciwko meningokokom, również z powodu zawartości nośników CRM197 lub toksoidu tężcowego. W artykule omówiono syntetycznie skład poszczególnych szczepionek pod kątem ryzyka uczulenia. Wydaje się, że szeroko dyskutowany problem zawartości alergenów jajka (owalbuminy) jest już nieaktualny w odniesieniu do szczepionki MMR i MMRV ze względu na hodowlę wirusów na fibroblastach zarodków kurzych i nieistotną zawartość alergenu, dlatego szczepionkę tę można podawać w standardowych warunkach. Podobna sytuacja dotyczy szczepionek przeciwko grypie, w których określono bezpieczne stężenia owalbuminy (szczepionka inaktywowana <1 µg/dawkę, szczepionka „żywa” <0,24 µg/dawkę). Największe ryzyko dla pacjentów z alergią na jajka stanowi szczepionka przeciwko żółtej gorączce, w przypadku której należy rozważyć podanie metodą szczepienia frakcjonowanego, stopniowo zwiększając dawki w warunkach szczególnego nadzoru.
| Tabela 3. Substancje pomocnicze lub śladowe pozostałości z procesu produkcyjnego zawarte w szczepionkacha | |
|---|---|
| Nazwa substancjib | Szczepionkac |
| chlorotetracyklina | przeciwko KZM (Encepur Adults, Encepur K) |
| gentamycyna | przeciwko KZM (Encepur Adults, Encepur K, FSME-IMMUN Junior, FSME-IMMUN) przeciwko grypie (Fluenz Tetra, Influvac Tetra) |
| neomycyna | Tdap-IPV (Adacel polio, Boostrix polio) Td-IPV (Dultavax) szczepionki wysoce skojarzone (Infanrix hexa, Infanrix-IPV-Hib, Pentaxim, Hexacima) DTPa-IPV (Infanrix-IPV, Tetraxim) przeciwko polio (Imovax polio) MMR (M-M-RvaxPro, Priorix) przeciwko ospie wietrznej (Varilrix, Varivax) przeciwko WZW typu A i B (Twinrix Adult) przeciwko WW typu A (Havrix 720 Junior, Havrix Adult) przeciwko KZM (Encepur Adults, Encepur K, FSME-IMMUN Junior, FSME-IMMUN) przeciwko grypie (Vaxigrip Tetra) przeciwko wściekliźnie (Verorab) |
| polimyksyna B | Tdap-IPV (Adacel polio, Boostrix polio) Td-IPV (Dultavax) szczepionki wysoce skojarzone (Hexacima, Infanrix hexa, Infanrix-IPV, Infanrix-IPV-Hib, Pentaxim) DTPa-IPV (Tetraxim) przeciwko polio (Imovax polio) przeciwko wściekliźnie (Verorab) |
| streptomycyna | Tdap-IPV (Adacel polio) Td-IPV (Dultavax) DTPa-IPV (Tetraxim) szczepionki wysoce skojarzone (Hexacima, Pentaxim) przeciwko polio (Imovax polio) przeciwko wściekliźnie (Verorab) |
| albumina ludzka | MMR (M-M-RvaxPro) przeciwko KZM (FSME-IMMUN Junior, FSME-IMMUN) przeciwko wściekliźnie (Verorab) |
| albumina surowicy bydlęcej | Tdap-IPV (Adacel polio) przeciwko japońskiemu zapaleniu mózgu (Ixiaro) |
| białka jaja kurzego | przeciwko KZM (Encepur Adults, Encepur K, FSME-IMMUN Junior, FSME-IMMUN) MMR (M-M-RvaxPro, Priorix) przeciwko grypie (Fluenz Tetra, Influvac Tetra, Vaxigrip Tetra) przeciwko żółtej gorączce (Stamaril) |
| białka drożdży | szczepionki wysoce skojarzone (Hexacima, Infanrix hexa) przeciwko WZW typu B (Engerix B, Euvax B) przeciwko WZW typu A i B (Twinrix Adult) przeciwko HPV (Gardasil, Gardasil 9) przeciwko żółtej gorączce (Stamaril) |
| toksoid błoniczy (jako nośnik białka) | przeciwko pneumokokom (Synflorix, Prevenar 13, Apexxnar) |
| toksoid tężcowy (jako nośnik białka) | przeciwko pneumokokom (Synflorix) przeciwko meningokokom grupy A, C, W, Y (Nimenrix) przeciwko meningokokom grupy C (NeisVac-C) |
| protamina | przeciwko KZM (FSME-IMMUN Junior, FSME-IMMUN) przeciwko japońskiemu zapaleniu mózgu (Ixiaro) |
| żelatyna | MMR (M-M-RvaxPro) przeciwko ospie wietrznej (Varivax) przeciwko grypie (Fluenz Tetra) |
| lateks (w elementach opakowania) | przeciwko Hib (Act-HIB) Tdap (Adacel) przeciwko KZM (Encepur Adults, Encepur K) |
| polisorbat 20 | przeciwko WZW typu A (Havrix Adult, Havrix 720 Junior) |
| polisorbat 80 | Tdap-IPV (Adacel polio) przeciwko pneumokokom (Prevenar 13, Apexxnar) przeciwko WZW typu A (AVAXIM 160 U) przeciwko meningokokom grupy B (Trumenba) przeciwko HPV (Gardasil, Gardasil 9) przeciwko grypie (Influvac Tetra) przeciwko rotawirusom (RotaTeq) przeciwko półpaścowi (Shingrix) przeciwko RSV (Arexvy) przeciwko COVID-19 (Nuvaxovid) |
| polietylenoglikol (PEG) | przeciwko COVID-19 (Comirnaty, Spikevax) |
| związki glinu | Tdap-IPV (Adacel polio, Boostrix polio) Tdap (Adacel, Boostrix, Tdap Szczepionka) Td-IPV (Dultavax) Td (Clodivac) DTPa-IPV (Infanrix-IPV, Tetraxim) szczepionki wysoce skojarzone (Hexacima, Infanrix hexa, Pentaxim, Infanrix-IPV-Hib) d – Szczepionka błonicza adsorbowana, D – Szczepionka błonicza adsorbowana DTPw (DTP – Szczepionka błoniczo-tężcowo-krztuścowa) przeciwko HPV (Cervarix, Gardasil, Gardasil 9) przeciwko KZM (Encepur Adults, Encepur K, FSME-IMMUN Junior, FSME-IMMUN) przeciwko pneumokokom (Prevenar 13Synflorix Apexxnar) przeciwko meningokokom grupy B (Bexsero, Trumenba) przeciwko meningokokom grupy C (NeisVac-C) przeciwko WZW typu B (Engerix B, Euvax B) przeciwko WZW typu A (Havrix Adult, AVAXIM 160 U) przeciwko WZW typu A i B (Twinrix Adult) przeciwko RSV (Arexvy) przeciwko półpaścowi (Shingrix) |
| tiomersal | d – Szczepionka błonicza adsorbowana, D – Szczepionka błonicza adsorbowana, DTPw (DTP – Szczepionka błoniczo-tężcowo-krztuścowa) |
| 2-fenoksyetanol | Tdap (Adacel) DTPa-IPV (Tetraxim) przeciwko pneumokokom (Prevenar 13, Synflorix) |
| formaldehyd | przeciwko Hib (Act-HIB) Tdap-IPV (Adacel polio, Boostrix polio) Tdap (Adacel, Boostrix, Tdap Szczepionka) Td-IPV (Dultavax) DTPa-IPV (Infanrix-IPV) przeciwko polio (Imovax polio) szczepionki wysoce skojarzone (Hexacima, Infanrix hexa, Pentaxim Infanrix-IPV-Hib) przeciwko KZM (Encepur Adults, Encepur K, FSME-IMMUN Junior, FSME-IMMUN) przeciwko WZW typu A (AVAXIM 160 U, Havrix 720 Junior) przeciwko grypie (Influvac Tetra, Vaxigrip Tetra) przeciwko japońskiemu zapaleniu mózgu (Ixiaro) przeciwko cholerze (Dukoral) przeciwko durowi brzusznemu (Typhim Vi) |
| aldehyd glutarowy | Tdap-IPV (Adacel polio) Tdap (Adacel) |
| a Opracowano na podstawie ChPL poszczególnych szczepionek. Aktualne dokumenty pobrano
ze strony Europejskiej Agencji Leków lub Rejestru Produktów Leczniczych (dostęp: 03.11.2023 r.) b Pełny wykaz substancji czynnych i pomocniczych, a także zawartych w szczepionkach w ilościach śladowych znajduje się w ChPL poszczególnych szczepionek c Uwzględniono również szczepionki zarejestrowane tylko dla dorosłych. ChPL – Charakterystyka Produktu Leczniczego, DTPa – skojarzona szczepionka przeciwko błonicy, tężcowi i krztuścowi (bezkomórkowa), dTpa – szczepionka zawierająca toksoid tężcowy, zmniejszoną dawkę toksoidu błoniczego i bezkomórkowych komponentów pałeczki krztuśca, DTPw – skojarzona szczepionka przeciwko błonicy, tężcowi i krztuścowi (całokomórkowa), Hib – Haemophilus influenzae typu b, HPV – ludzki wirus brodawczaka, IPV – inaktywowana szczepionka przeciwko polio, KZM – odkleszczowe zapalenie mózgu, MMR – szczepionka skojarzona przeciwko odrze, śwince i różyczce, RSV – wirus syncytium nabłonka oddechowego, WZW – wirusowe zapalenie wątroby | |
Trzecia część artykułu poświęcona jest problemowi szczepień u chorych z częstszymi swoistymi uczuleniami na substancje/alergeny często zawarte w szczepionkach (białko jajka, mleko, żelatyna, antybiotyki, drożdże [p. tab. 3). Podjęcie odpowiedzialnej decyzji o ich kwalifikacji do szczepień wymaga znajomości pacjenta, profilu jego uczuleń, ciężkości przebiegu i aktualnego stopnia kontroli choroby alergicznej, a więc kompleksowej oceny alergologicznej na podstawie wywiadu, badania przedmiotowego i ewentualnie dostępnych badań pomocniczych (w diagnostyce reakcji natychmiastowych – oznaczenie asIgE, punktowe testy skórne; w diagnostyce nadwrażliwości opóźnionej – testy płatkowe). Reakcje opóźnione na składniki szczepionki zarówno znane z przeszłości, jak i występujące po podaniu szczepionek na ogół nie są przeciwwskazaniem do realizacji szczepień, aczkolwiek można rozważyć zmianę preparatu. Reakcje te częściej występują po podaniu kolejnych dawek szczepionek zawierających toksoidy i wykazują tendencję do ustępowania. W przypadku nadwrażliwości typu natychmiastowego na składniki szczepionki należy rozważyć szczepionkę alternatywną lub podanie szczepionki metodą frakcjonowaną. Autorzy artykułu zalecają, aby decyzje skonsultować z alergologiem i immunologiem, a w mojej opinii także ze specjalistą chorób zakaźnych. Te decyzje powinny uwzględniać nie tylko rodzaj szczepionki, ale sposób i miejsce/warunki jej podania.
Podsumowując, większość szczepień ochronnych można realizować w standardowych warunkach, zakładając, że placówki realizujące szczepienia ochronne mogą zareagować w razie wystąpienia bardzo rzadkich reakcji natychmiastowych. Natomiast u pacjentów, u których wystąpiły reakcje poszczepienne sugerujące podłoże alergiczne lub występują reakcje alergiczne na składniki szczepionki, konieczna jest konsultacja specjalistyczna – alergologa i specjalisty chorób zakaźnych, a ewentualnie także immunologa. Nasilenie reakcji poszczepiennej i choroby/uczulenia u pacjenta powinny determinować warunki udzielania konsultacji (ambulatorium lub szpital).
Piśmiennictwo do komentarza:
1. Dreskin S.C., Halsey N.A., Kelso J.M. i wsp.: International Consensus (ICON): allergic reactions to vaccine. World Allergy Org. J., 2016; 9: 322. Nilsson L., Brockow K., Alm J. i wsp.: Vaccination and allergy: EAACI position paper, practical aspects. Pediatr. Allergy Immunol., 2017; 28: 628–640
3. Gold M.S., Amarasinghe A., Greenhawt M. i wsp.: Anaphylaxis: revision of the Brighton collaboration case definition. Vaccine, 2023; 41: 2605–2614

















