1 Klinika Pediatrii z Oddziałem Obserwacyjnym, Warszawski Uniwersytet Medyczny, 2 Polskie Towarzystwo Wakcynologii (p przewodniczący), 3 Katedra i Klinika Dermatologii, Warszawski Uniwersytet Medyczny, 4 Polskie Towarzystwo Dermatologiczne (p prezes), 5 Zakład Badania i Leczenia Bólu Katedry Anestezjologii i Intensywnej Terapii, Uniwersytet Jagielloński Collegium Medicum w Krakowie, 6 Polskie Towarzystwo Badania Bólu (p prezes), 7 Zakład Medycyny Społecznej i Zdrowia Publicznego, Warszawski Uniwersytet Medyczny, 8 Polskie Towarzystwo Medycyny Rodzinnej, 9 Katedra i Klinika Neurologii, Uniwersytet Medyczny w Lublinie, 10 Polskie Towarzystwo Neurologiczne (p prezes), 11 Oddział Obserwacyjno-Zakaźny Specjalistycznego Zespołu Opieki Zdrowotnej nad Matką i Dzieckiem w Poznaniu; Katedra i Zakład Profilaktyki Zdrowotnej, Uniwersytet Medyczny w Poznaniu, 12 Zakład Edukacji i Badań w Naukach o Zdrowiu, Warszawski Uniwersytet Medyczny, 13 Katedra i Zakład Medycyny Rodzinnej, Uniwersytet Medyczny im. Piastów Śląskich we Wrocławiu, konsultant krajowy w dziedzinie medycyny rodzinnej, 14 Katedra i Klinika Pediatrii i Chorób Infekcyjnych, Uniwersytet Medyczny im. Piastów Śląskich we Wrocławiu, 15 Klinika Neurologii i Oddział Udarowy, Uniwersytecki Szpital Kliniczny w Białymstoku, 16 Katedra i Klinika Dermatologii, Uniwersytet Jagielloński Collegium Medicum w Krakowie, 17 Katedra Kosmetologii i Dermatologii Estetycznej w Bydgoszczy, Uniwersytet Mikołaja Kopernika w Toruniu, 18 Katedra i Klinika Dermatologii, Uniwersytet Medyczny im. Karola Marcinkowskiego w Poznaniu, 19 Katedra i Kliniki Dermatologii, Wenerologii i Alergologii, Gdański Uniwersytet Medyczny
Jak cytować: Kuchar E., Rudnicka L., Kocot-Kępska M. i wsp.: Szczepienie przeciwko półpaścowi. Zalecenia grupy ekspertów Polskiego Towarzystwa Wakcynologii, Polskiego Towarzystwa Medycyny Rodzinnej, Polskiego Towarzystwa Dermatologicznego, Polskiego Towarzystwa Badania Bólu i Polskiego Towarzystwa Neurologicznego. Med. Prakt., 2023; 5: 64–72
Skróty: HIV (human immunodeficiency virus) – ludzki wirus nabytego niedoboru odporności, HSCT (hematopoietic stem cell transplantation) – przeszczepienie macierzystych komórek krwiotwórczych, VZV (varicella zoster virus) – wirus ospy wietrznej i półpaśca
Streszczenie
Półpasiec jest zakaźną chorobą wirusową, objawową reaktywacją latentnego zakażenia wirusem ospy wietrznej i półpaśca (VZV). Zazwyczaj przebiega pod postacią pęcherzyków na rumieniowym podłożu, poprzedzonych dolegliwościami bólowymi zajmującymi obszar jednego dermatomu. Na wystąpienie półpaśca szczególnie narażone są osoby po 50. roku życia oraz należące do grup ryzyka. W przebiegu choroby może dojść do rozwoju ciężkich powikłań, spośród których najistotniejsza klinicznie jest neuralgia popółpaścowa. Występuje ona u nawet 30% chorych i prowadzi do znacznego obniżenia jakości życia i przewlekłego cierpienia. Jej leczenie jest długotrwałe, często nieskuteczne i stanowi duże wyzwanie dla systemu ochrony zdrowia. Najskuteczniejszą metodą ochrony przed półpaścem i jego powikłaniami są szczepienia. Ze względu na epidemiologię zachorowań na półpasiec i występowania jego powikłań, szczepienie zaleca się wszystkim osobom >50. roku życia oraz młodszym dorosłym (≥18 lat), u których występują czynniki ryzyka rozwoju tej choroby.Wstęp
Patomechanizm półpaśca
Półpasiec jest chorobą zakaźną wywoływaną przez reaktywację wirusa ospy wietrznej i półpaśca (VZV; inna nazwa – ludzki wirus herpes typu 3 [human herpesvirus 3 – HHV-3]). Choroba ta rozwija się wyłącznie u osób, które w przeszłości przebyły pierwotne zakażenie VZV – najczęściej w postaci przechorowania ospy wietrznej lub (rzadziej) zakażenia wewnątrzmacicznego albo skąpoobjawowego, a sporadycznie w wyniku szczepienia przeciwko ospie wietrznej. VZV pozostaje uśpiony w zwojach rdzeniowych i zwojach czuciowych nerwów czaszkowych, jednak może się uaktywnić przy zmniejszeniu odporności komórkowej związanej ze swoistymi limfocytami T.1 Do takiego obniżenia odporności dochodzi z wiekiem oraz w przebiegu niektórych chorób lub leczenia immunosupresyjnego.2,3 W czasie reaktywacji VZV szerzy się wzdłuż włókien czuciowych, powodując objawy w obszarze skóry unerwianym przez dany nerw rdzeniowy (dermatomie) lub w innych niż skóra lokalizacjach (w przypadku zajęcia nerwów czaszkowych).
Obraz kliniczny półpaśca
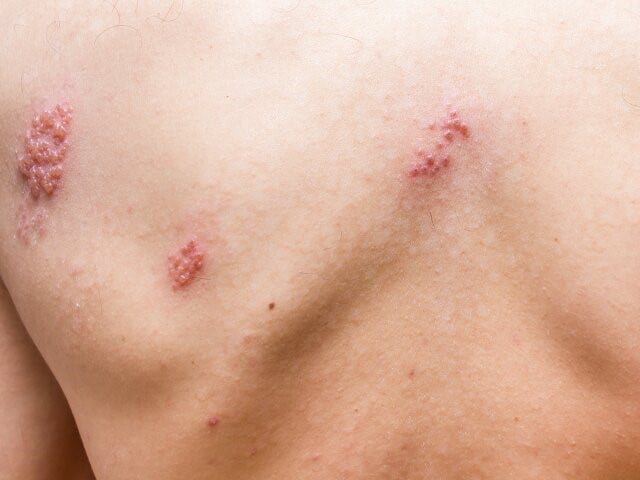
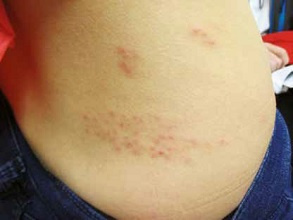
Półpasiec najczęściej przebiega w zlokalizowanej postaci skórnej, która cechuje się powstaniem w zajętym obszarze rumienia przy nieadekwatnie nasilonych dolegliwościach subiektywnych, a następnie pojawieniem się pęcherzyków z surowiczą treścią zawierającą zakaźne cząsteczki VZV. Objawy przeważnie są ograniczone i zajmują obszar od 1 do 2 dermatomów unerwionych przez zajęte nerwy. Pojawienie się zmian skórnych zazwyczaj poprzedzają nieswoiste objawy zwiastunowe, takie jak: świąd, pieczenie, mrowienie, przeczulica lub ból (ciągły lub napadowy). Z kolei w czasie ustępowania choroby dochodzi do zasychania pęcherzyków, pękania i powstawania nadżerek pokrytych surowiczymi lub surowiczo-krwotocznymi strupami, które odpadają (często pozostawiając przebarwienia w miejscu ustępujących wykwitów).4
Opisana wyżej postać skórna półpaśca, zajmująca jeden dermatom (przeważnie w obrębie tułowia), jest najczęstszym obrazem klinicznym tej choroby.
U 8–20% chorych, w przypadku reaktywacji VZV ze zwoju trójdzielnego i jego rozprzestrzeniania się przez nerw oczny, rozwija się postać oczna półpaśca. W tym przypadku zmiany wirusowe mogą pojawić się zarówno na skórze powieki górnej, grzbietu nosa i okolicy czołowej, spojówce, jak i na samej rogówce, co może prowadzić do powstania w niej bardzo bolesnych owrzodzeń.5
Inną charakterystyczną postacią choroby jest półpasiec uszny, będący wynikiem reaktywacji VZV ze zwoju kolanka. Tę postać rozpoznajemy przy zajęciu małżowiny usznej (zwłaszcza muszli), przewodu słuchowego zewnętrznego oraz błony bębenkowej.6 Jeśli zmianom tym towarzyszą ból ucha i objawy niedowładu obwodowego nerwu twarzowego po tej samej stronie, mamy do czynienia z zajęciem nie tylko włókien czuciowych, ale także ruchowych nerwu VII (tzw. zoster motoricus) pod postacią zespołu Ramsaya Hunta.7
W rzadkich przypadkach – przeważnie u osób z istotnym niedoborem odporności – półpasiec może zajmować ≥3 dermatomy – mówimy wówczas o półpaścu uogólnionym (rozsianym).8
Jednym z podstawowych objawów w ostrej fazie półpaśca jest ból, który u około 40% chorych może mieć duże nasilenie, oceniane na 6 lub 7 punktów w 10-punktowej skali numerycznej (NRS). Ból ten może mieć charakter receptorowy zapalny (spowodowany lokalnym stanem zapalnym w odpowiedzi na uszkodzenie tkanki nieneuronalnej) lub neuropatyczny (pod postacią ostrego nerwobólu w wyniku uszkodzenia tkanki neuronalnej).9
Grupy ryzyka
Ryzyko zachorowania na półpasiec zwiększa się wraz z wiekiem, a szczególnie gwałtownie po ukończeniu 50. roku życia.10 Zwiększone ryzyko dotyczy również osób z chorobami współistniejącymi prowadzącymi do upośledzenia funkcji układu odpornościowego lub wymagającymi leczenia immunosupresyjnego (p. ramka). Warunkiem koniecznym do wystąpienia półpaśca jest przebycie pierwotnego zakażenia VZV w przeszłości, najczęściej jako ospy wietrznej, rzadziej jako zakażenia skąpoobjawowego lub wewnątrzmacicznego, a – sporadycznie – po szczepieniu przeciwko ospie wietrznej preparatem „żywym”, zawierającym atenuowany szczep Oka VZV. Na podstawie badań populacyjnych przeprowadzonych w USA przyjmuje się, że ponad 99% osób po ukończeniu 40. roku życia jest podatnych na zachorowanie na półpasiec w wyniku pierwotnego zakażenia VZV.3
Czynniki i grupy ryzyka zachorowania na półpasiec
1) wiek >50 lat
2) wrodzony lub nabyty niedobór odporności, w tym: immunosupresja jatrogenna, zakażenie
wirusem ludzkiego nabytego niedoboru odporności
(HIV), choroba nowotworowa (białaczka,
chłoniak, szpiczak mnogi), przeszczepienie narządu
miąższowego lub macierzystych komórek
krwiotwórczych (HSCT)
3) przewlekła choroba serca
4) przewlekła choroba wątroby
5) przewlekła choroba płuc
6) przewlekła choroba nerek
7) choroby autoimmunizacyjne
8) cukrzyca
9) depresja
Dotychczas przeprowadzone badania umożliwiły określenie dodatkowych czynników zwiększających ryzyko zachorowania na półpasiec. Należą do nich m.in.: płeć żeńska, leczenie immunosupresyjne, biologiczna terapia celowana anty-CD20, przeszczepienie macierzystych komórek krwiotwórczych (HSCT) lub narządu miąższowego, zakażenie ludzkim wirusem nabytego niedoboru odporności (HIV), choroby nowotworowe, toczeń rumieniowaty układowy, reumatoidalne zapalenie stawów, przewlekła obturacyjna choroba płuc, choroby układu sercowo-naczyniowego, nieswoiste choroby zapalne jelit, przewlekła choroba nerek, astma oskrzelowa, cukrzyca, depresja, przewlekły stres psychologiczny lub urazy fizyczne (np. zabieg operacyjny lub uraz fizyczny).11,12 Wykazano również, że przechorowanie COVID-19 może zwiększać ryzyko wystąpienia półpaśca.13
Zachorowanie na półpasiec nie chroni przed kolejnym epizodem choroby – oszacowano, że ryzyko nawrotu półpaśca w ciągu 8 lat od pierwszego epizodu wynosi 6–8%.14,15
Powikłania i leczenie
Leczenie w fazie ostrej
W leczeniu objawowym półpaśca w fazie ostrej stosuje się leki miejscowe, które pomagają łagodzić objawy subiektywne (np. pieczenie), a ponadto działają przeciwbólowo (np. preparaty zawierające tlenek cynku i benzokainę). Istotne jest także stosowanie analgetyków systemowo, zgodnie z drabiną analgetyczną Światowej Organizacji Zdrowia, w celu zmniejszenia nasilenia bólu oraz techniki analgezji regionalnej (blokady z zastosowaniem leku znieczulającego miejscowo z dodatkiem glikokortykosteroidu).16 Dostępne opcje farmakoterapii w przypadku bólu o lekkim lub umiarkowanym nasileniu obejmują paracetamol, niesteroidowe leki przeciwzapalne (NSLPZ) i metamizol, a w przypadku bólu umiarkowanego i ciężkiego leki opioidowe (odpowiednio tramadol, kodeina, oksykodon, morfina lub buprenorfina). W razie wystąpienia objawów ostrego bólu neuropatycznego zalecane są leki adiuwantowe przeciwpadaczkowe (gabapentyna lub pregabalina) i/lub przeciwdepresyjne (trójpierścieniowe [takie jak amitryptylina] lub inhibitory zwrotnego wychwytu serotoniny i noradrenaliny [np. duloksetyna]).
Stosowanie leków przeciwwirusowych, przede wszystkim acyklowiru (ogólnie, najczęściej p.o.), rzadziej walacyklowiru lub famcyklowiru, łagodzi przebieg choroby oraz hamuje replikację i rozprzestrzenianie się wirusa. Acyklowir nie zmniejsza jednak ryzyka rozwoju neuralgii popółpaścowej.9,17,18
Powikłania półpaśca
Półpasiec nie tylko powoduje dyskomfort (w ostrej fazie), lecz często prowadzi także do powikłań. Najczęstszym jest neuralgia popółpaścowa – ryzyko jej rozwoju zwiększa się wraz z wiekiem, a szczególnie narażone są osoby po ukończeniu 50. roku życia. Rozpoznaje się ją, gdy ból w obrębie zajętego dermatomu utrzymuje się przez >3 miesiące od wystąpienia zmian na skórze. U około 20% chorych istotny klinicznie ból utrzymuje się przez >1 rok.9 Ma on charakter głównie neuropatyczny, powoduje znaczne cierpienie i istotnie obniża jakość życia chorego (opisywano nawet podejmowane pod jego wpływem próby samobójcze), a przy tym nierzadko jest niedostatecznie kontrolowany, do czego się przyczynia względnie mała skuteczność leczenia objawowego.19 Powikłanie to generuje również duże koszty dla systemu ochrony zdrowia.19 Szacuje się, że neuralgia popółpaścowa rozwija się nawet u 30% osób, które przechorowały półpasiec, przy czym 80% tych przypadków dotyczy osób po ukończeniu 50. roku życia.20,21
W leczeniu bólu neuropatycznego zaleca się w ramach leczenia:
- 1. wyboru: leki miejscowe (5% lidokaina w plastrze), leki przeciwpadaczkowe z grupy gabapentynoidów, leki przeciwdepresyjne z grupy trójpierścieniowych lub inhibitorów wychwytu zwrotnego serotoniny i noradrenaliny
- 2. wyboru: słabe analgetyki opioidowe
- 3. wyboru: silne analgetyki opioidowe, iniekcje toksyny botulinowej oraz plastry zawierające 8% kapsaicynę.
W wyniku takiego leczenia częściowe złagodzenie nasilenia bólu udaje się uzyskać jedynie u 30–50% chorych, a dodatkowym ograniczeniem farmakoterapii są objawy niepożądane, szczególnie często występujące u osób w wieku podeszłym.22
W postaci ocznej półpaśca może dojść do uszkodzenia rogówki i powstania na jej powierzchni owrzodzeń, a następnie blizn, sporadycznie zdarza się także uszkodzenie siatkówki. Z kolei zajęcie i uszkodzenie nerwu VIII może prowadzić do częściowego ubytku słuchu lub wystąpienia szumów usznych.
Po przechorowaniu półpaśca względnie często notuje się są wtórne zakażenia bakteryjne skóry i tkanek miękkich, powodowane przede wszystkim przez Staphylococcus aureus lub Streptococcus pyogenes. W niektórych przypadkach rozwija się aseptyczne zapalenie opon mózgowo-rdzeniowych lub zapalenie płuc.23,24 Wykazano również, że przechorowanie półpaśca przed 40. rokiem życia zwiększa w przyszłości ryzyko udaru mózgu, przejściowego epizodu niedokrwiennego (TIA) lub zawału serca.25
Profilaktyka
Najskuteczniejszą metodą zapobiegania półpaścowi i jego powikłaniom są szczepienia ochronne. Aktualnie w Unii Europejskiej (UE) zarejestrowane są 2 szczepionki przeciwko półpaścowi:
- szczepionka „żywa” zawierająca atenuowany szczep Oka VZV (preparat Zostavax),
- szczepionka rekombinowana białkowa (podjednostkowa), zawierająca glikoproteinę E VZV i system adiuwantowy AS01B (preparat Shingrix).
Szczepionki przeciwko półpaścowi nie są przeznaczone do profilaktyki poekspozycyjnej ani do leczenia półpaśca lub ospy wietrznej. Nie są również zarejestrowane do zapobiegania ospie wietrznej i nie oceniono ich skuteczności u osób seroujemnych wobec VZV. Osobom, o których wiadomo, że są seroujemne wobec VZV (na podstawie badań laboratoryjnych wykonanych z innego powodu, np. po bliskim kontakcie z chorym na ospę wietrzną), należy proponować szczepienie przeciwko ospie wietrznej.26,27
Szczepionka rekombinowana
Aktualnie w Polsce dostępna jest tylko szczepionka rekombinowana (zarejestrowana w UE w 2018 r., na polskim rynku od II kwartału 2023 r.), przeznaczona do profilaktyki półpaśca oraz neuralgii popółpaścowej u osób >50. roku życia i osób w wieku ≥18 lat należących do grup zwiększonego ryzyka zachorowania na półpasiec (p. ramka). Pełny schemat szczepienia obejmuje podanie 2 dawek.
Szczepionka charakteryzuje się bardzo dużą skutecznością. Wykazano, że u osób w wieku ≥50 lat zmniejsza ryzyko zachorowania na półpasiec o >90% w ciągu średnio 3,1 roku obserwacji, a także zmniejsza ryzyko neuralgii popółpaścowej – o 91,2% w ciągu średnio 3,1 roku obserwacji u osób w wieku ≥50 lat i o 88,8% w ciągu 4 lat u osób w wieku ≥70 lat.28,29 U osób, które zachorowały na półpasiec mimo szczepienia, skraca czas utrzymywania się bólu (o 38,5%) oraz zmniejsza użycie leków przeciwbólowych (o 39,6%).30 Bezpieczeństwo, immunogenność lub skuteczność szczepionki wykazano także w grupach zwiększonego ryzyka zachorowania na półpasiec: biorców autologicznego HSCT, pacjentów z nowotworami układu krwiotwórczego lub litymi, zakażonych HIV lub po przeszczepieniu nerki.31-35
Szczepionka „żywa”
„Żywa” szczepionka przeciwko półpaścowi, zarejestrowana w USA i UE w 2006 roku, jest aktualnie niedostępna w Polsce. Jej skuteczność w zapobieganiu półpaścowi wynosi 51%, a neuralgii popółpaścowej – 67% w ciągu średnio 3,1 roku obserwacji.36 Zarejestrowana jest do stosowania u osób w wieku ≥50 lat, ale ponieważ zawiera zdolne do replikacji atenuowane wirusy, można ją podawać wyłącznie osobom immunokompetentnym.
Zalecenia dotyczące szczepienia przeciwko półpaścowi
Grupy osób, którym zaleca się szczepienie przeciwko półpaścowi
Osoby po 50. roku życia
Głównym czynnikiem ryzyka zachorowania na półpasiec jest wiek. Ryzyko rozwoju choroby gwałtownie się zwiększa po ukończeniu 50. roku życia – szacuje się, że w wieku 85 lat sięga 50%.37 Osoby >50. roku życia są również obciążone większym ryzykiem powikłań, przede wszystkim neuralgii popółpaścowej,38 która znacznie obniża jakość życia chorych oraz generuje duże koszty dla systemu ochrony zdrowia, ponieważ może wymagać wielokrotnych wizyt specjalistycznych związanych z terapią bólu.39,40
Immunosupresja
Szczególnie zagrożone półpaścem są osoby dorosłe (≥18. rż.), u których w wyniku chorób współistniejących lub stosowanego leczenia dochodzi do upośledzenia odporności. Do tej grupy zalicza się chorych:
- przewlekle przyjmujących glikokortykosteroidy lub inne leki immunosupresyjne41,42
- w trakcie chemioterapii lub radioterapii powodującej immunosupresję43,44
- leczonych immunosupresyjnie po przeszczepieniu narządu miąższowego.45
Szczepienie przeciwko półpaścowi tych osób należy optymalnie przeprowadzić co najmniej 2 tygodnie przed rozpoczęciem leczenia immunosupresyjnego lub w najbliższym możliwym terminie, jeśli leczenie zostało już rozpoczęte (optymalnie w okresie, kiedy prawdopodobieństwo uzyskania odpowiedzi immunologicznej jest największe, np. kiedy choroba jest w remisji lub dobrze kontrolowana, a chory przyjmuje mniejszą dawkę leków immunosupresyjnych).
Choroby przewlekłe
Szczepienie przeciwko półpaścowi należy rozważyć także u wszystkich dorosłych z chorobami współistniejącymi prowadzącymi do upośledzenia odporności, takimi jak: choroby nowotworowe (ze szczególnym uwzględnieniem nowotworów układu krwiotwórczego i chłonnego), stan po HSCT lub przeszczepieniu narządu miąższowego, wrodzone lub nabyte niedobory odporności lub zakażenie HIV.
Profilaktykę półpaśca sugerujemy również zastosować u chorych na przewlekłą obturacyjną chorobę płuc, z przewlekłą chorobą nerek, z niewydolnością serca, chorych na chorobę niedokrwienną serca, astmę, cukrzycę, choroby autoimmunizacyjne (ze szczególnym uwzględnieniem reumatoidalnego zapalenia stawów, tocznia rumieniowatego układowego, nieswoistych chorób zapalnych jelit, łuszczycy i stwardnienia rozsianego) oraz depresję (p. ramka).11,12
Rekombinowana szczepionka przeciwko półpaścowi charakteryzuje się korzystnym profilem bezpieczeństwa.28 Z tego powodu można ją stosować także w innych grupach dorosłych, którzy w opinii lekarza kwalifikującego do szczepienia są szczególnie obciążeni zachorowaniem na półpasiec w przebiegu stosowanego leczenia lub z powodu chorób współistniejących.
Przed podaniem rekombinowanej szczepionki przeciwko półpaścowi nie jest konieczne wykonywanie badań laboratoryjnych oceniających funkcję układu odporności.
Wskazania epidemiologiczne
Wykwity skórne (pęcherzyki) występujące w przebiegu półpaśca zawierają zaraźliwe wirusy i mogą wywoływać ospę wietrzną u podatnych na zakażenie pierwotne VZV osób z bliskiego kontaktu (nieszczepionych przeciwko ospie wietrznej lub tych, które nie chorowały na ospę).46 Należy pamiętać, że szczepionkę przeciwko ospie wietrznej można stosować dopiero po ukończeniu 9. miesiąca życia dziecka (optymalnie po ukończeniu 12. mż.). Z tego powodu niemowlęta i starsze nieszczepione dzieci są narażone na zakażenie VZV w wyniku bliskiego kontaktu z osobą z półpaścem. Szczepienie przeciwko półpaścowi szczególnie zalecamy więc osobom dorosłym z grup ryzyka, które jednocześnie mają regularny kontakt zawodowy lub rodzinny z małymi dziećmi (np. personelowi placówek opieki zdrowotnej lub żłobków i przedszkoli).
Kwalifikacja do szczepienia
Półpasiec występuje tylko u osób, które w przeszłości przechorowały ospę wietrzną lub – choć znamiennie rzadziej – były szczepione przeciwko ospie wietrznej. Odsetek osób w populacji dorosłych wciąż podatnych na zakażenie pierwotne VZV jest bardzo mały (i zmniejsza się z wiekiem), dlatego nie zalecamy wykonywania przed szczepieniem badań serologicznych w celu potwierdzenia przebycia pierwotnego zakażenia VZV w przeszłości. Badania epidemiologiczne wskazują, że ponad 90% dorosłych w wieku 20 lat, a ponad 99% po 40. roku życia przechorowało ospę wietrzną, dlatego każdego dorosłego należy traktować jak potencjalnie zagrożonego rozwojem półpaśca.3,47
Przeciwwskazania do szczepienia i sytuacje wymagające zachowania szczególnej ostrożności
Dostępna w Polsce rekombinowana szczepionka przeciwko półpaścowi jest zarejestrowana do stosowania wyłącznie u dorosłych.
Jedynym trwałym przeciwwskazaniem do jej podania jest nadwrażliwość na którykolwiek składnik szczepionki lub zarejestrowana po podaniu poprzedniej dawki.
Podobnie jak w przypadku innych szczepień, u osób z umiarkowaną lub ciężką chorobą (przebiegającą z gorączką lub bez niej), lub z zaostrzeniem choroby przewlekłej, szczepienie przeciwko półpaścowi sugeruje się opóźnić do czasu ustąpienia objawów choroby i stabilizacji stanu klinicznego, choć zalecenie to oparto na słabych podstawach naukowych.48
Przechorowanie półpaśca nie chroni przed ponownym wystąpieniem tej choroby, dlatego osoby, które przebyły półpasiec, zalecamy szczepić zgodnie z ogólnymi zaleceniami.49,50 Nie należy jednak podawać szczepionki w czasie aktywnego półpaśca, w takiej sytuacji szczepienie zalecamy opóźnić do czasu ustąpienia objawów choroby (w przypadku półpaśca ocznego, z uwagi na możliwość zaostrzenia i ponownych rzutów zapalenia naczyniówki lub siatkówki, o ≥12 mies. od ustąpienia zmian zapalnych w obrębie gałki ocznej).51 Szczepionki przeciwko półpaścowi można podawać osobom zaszczepionym w przeszłości przeciwko ospie wietrznej.
Schemat szczepienia i sposób podawania szczepionki
Pełny schemat szczepienia przeciwko półpaścowi z użyciem dostępnego na polskim rynku preparatu rekombinowanego wymaga podania 2 dawek w odstępie 2–6 miesięcy. U osób z niedoborem odporności, dla których korzystne byłoby uzyskanie optymalnego uodpornienia w krótszym czasie, można zastosować skrócony schemat obejmujący podanie 2 dawek w odstępie ≥1 miesiąca.48 Szczepionkę należy podawać wyłącznie we wstrzyknięciu domięśniowym, optymalnie w mięsień naramienny.
Rozpoczętego schematu szczepienia nie trzeba powtarzać, jeżeli od podania pierwszej dawki minęło >6 miesięcy. W takiej sytuacji drugą dawkę szczepionki należy podać jak najszybciej. Jeżeli drugą dawkę szczepionki podano <4 tygodni po pierwszej, należy ją powtórzyć.27 Aktualnie nie ma danych dotyczących konieczności podawania dawek przypominających.
Koadministracja z innymi szczepionkami lub lekami
Szczepionkę rekombinowaną przeciwko półpaścowi można podawać jednocześnie z innymi szczepionkami na jednej wizycie. Ze względu na podobne wskazania i grupy ryzyka sugerujemy zaproponowanie osobom dotąd nieszczepionym szczepień przeciwko pneumokokom i grypie oraz szczepienia przypominającego przeciwko krztuścowi, błonicy i tężcowi (dTap). Przeprowadzone do tej pory badania kliniczne nie wykazały interakcji przy jednoczesnym podaniu preparatu rekombinowanego (Shingrix) z inaktywowaną szczepionką przeciwko grypie sezonowej bez adiuwantu,52 23-walentną polisacharydową szczepionką przeciwko pneumokokom (PPSV-23),53 13-walentną szczepionką skoniugowaną przeciwko pneumokokom (PCV-13)54 oraz inaktywowaną szczepionką przeciwko błonicy, tężcowi i krztuścowi (bezkomórkową) o zmniejszonej zawartości antygenów błoniczych i krztuścowych (dTap)55. Nie oceniono natomiast bezpieczeństwa i skuteczności koadministracji rekombinowanej szczepionki przeciwko półpaścowi z innymi szczepionkami zawierającymi nowe adiuwanty (np. takie jak w szczepionce Nuvaxovid przeciwko COVID-19 lub 2-walentnej szczepionce przeciwko HPV).
Rekombinowana szczepionka przeciwko półpaścowi należy do kategorii „nieżywych” (nie zawiera zdolnych do replikacji wirusów), dlatego można ją podawać w dowolnym odstępie od leków przeciwwirusowych (np. acyklowiru), preparatów krwi lub immunoglobulin (IVIG).
Podsumowanie
Półpasiec jest częstą chorobą, którą szczególnie zagrożone są osoby starsze i osoby z upośledzoną odpornością. W jej przebiegu może dojść do rozwoju poważnych powikłań, najczęściej przewlekłego bólu neuropatycznego. Są one trudne w leczeniu i w istotny sposób obniżają jakość życia chorego. Stosowane w trakcie półpaśca leczenie przeciwwirusowe łagodzi przebieg samej choroby, jednak nie zmniejsza ryzyka występowania powikłań, w tym neuralgii popółpaścowej.
Najskuteczniejszym sposobem zapobiegania półpaścowi i jego powikłaniom są szczepienia ochronne, które zaleca się wszystkim osobom po ukończeniu 50. roku życia, a także młodszym dorosłym należącym do grup zwiększonego ryzyka zachorowania na półpasiec (p. ramka).
Piśmiennictwo:
1. Schmader K.: Herpes zoster. Clin. Geriatr. Med., 2016; 32: 539–5532. John A.R., Canaday D.H.: Herpes zoster in the older adult. Infect. Dis. Clin. North Am., 2017; 31: 811–826
3. Centers for Disease Control and Prevention. Clinical Overview of Herpes Zoster (Shingles). https://www.cdc.gov/shingles/hcp/clinical-overview.html (dostęp: 12.12.2022)
4. Patil A., Goldust M., Wollina U.: Herpes zoster: A review of clinical manifestations and management. Viruses, 2022; 14: 192
5. Shaikh S., Ta C.N.: Evaluation and management of herpes zoster ophthalmicus. Am. Fam. Physician, 2002; 66: 1723–1730
6. Muecke M., Amedee R.G.: Herpes zoster oticus: diagnosis and management. J. La State Med. Soc., 1993; 145: 333–335
7. Bakshi S.S., Ramesh S., Annam C.S.: Ramsay hunt syndrome. Am. J. Med., 2022; 135: e125–e126
8. Chiriac A., Chiriac A.E., Podoleanu C., Stolnicu S.: Disseminated cutaneous herpes zoster – a frequently misdiagnosed entity. Int. Wound. J., 2020; 17: 1089–1091
9. Gross G.E., Eisert L., Doerr H.W. i wsp.: S2k guidelines for the diagnosis and treatment of herpes zoster and postherpetic neuralgia. JDDG J. Dtsch. Dermatol Ges., 2020; 18: 55–78
10. Johnson R.W., Alvarez-Pasquin M.-J., Bijl M. i wsp.: Herpes zoster epidemiology, management, and disease and economic burden in Europe: a multidisciplinary perspective. Ther. Adv. Vaccines, 2015; 3: 109–120
11. Chen S.-Y., Suaya J.A., Li Q. i wsp.: Incidence of herpes zoster in patients with altered immune function. Infection, 2014; 42: 325–334
12. Marra F., Parhar K., Huang B., Vadlamudi N.: Risk factors for herpes zoster infection: a meta-analysis. Open Forum Infect. Dis., 2020; 7: ofaa005
13. Bhavsar A., Lonnet G., Wang C. i wsp.: Increased risk of herpes zoster in adults ?50 years old diagnosed with COVID-19 in the United States. Open Forum Infect. Dis., 2022; 9: ofac118
14. Yawn B.P., Wollan P.C., Kurland M.J. i wsp.: Herpes zoster recurrences more frequent than previously reported. Mayo Clin. Proc., 2011; 86: 88–93
15. Tseng H.F., Bruxvoort K., Ackerson B. i wsp.: The epidemiology of Herpes zoster in immunocompetent, unvaccinated adults ?50 years old: incidence, complications, hospitalization, mortality, and recurrence. J. Infect. Dis., 2020; 222: 798–806
16. Cui J., Zhang X., Zhu P. i wsp.: Effect of repetitive intracutaneous injections with local anesthetics and steroids for acute thoracic herpes zoster and incidence of postherpetic neuralgia. Pain Med., 2017; 18: 1566–1572
17. Chen N., Li Q., Yang J. i wsp.: Antiviral treatment for preventing postherpetic neuralgia. Cochrane Database Syst Rev., 2014; doi: 10.1002/14 651 858.CD006 866.pub3
18. Werner R.N., Nikkels A.F. i wsp.: European consensus-based (S2k) Guideline on the Management of Herpes Zoster – guided by the European Dermatology Forum (EDF) in cooperation with the European Academy of Dermatology and Venereology (EADV), Part 2: Treatment. J. Eur. Acad. Dermatol. Venereol., 2017; 31: 20–29
19. Johnson R.W., Bouhassira D., Kassianos G. i wsp.: The impact of herpes zoster and post-herpetic neuralgia on quality-of-life. BMC Med., 2010; 8: 37
20. Saguil A., Kane S., Mercado M., Lauters R.: Herpes zoster and postherpetic neuralgia: prevention and management. Am. Fam. Physician., 2017; 96: 656–663
21. Kawai K., Gebremeskel B.G., Acosta C.J.: Systematic review of incidence and complications of herpes zoster: towards a global perspective. BMJ Open, 2014; 4: e004 833
22. Moisset X., Bouhassira D., Avez Couturier J. i wsp.: Pharmacological and non-pharmacological treatments for neuropathic pain: Systematic review and French recommendations. Rev. Neurol. (Paris), 2020; 176: 325–352
23. Koshy E., Mengting L., Kumar H., Jianbo W. Epidemiology, treatment and prevention of herpes zoster: a comprehensive review. Indian J. Dermatol. Venereol. Leprol., 2018; 84: 251–262
24. Zaborowski P. Półpasiec. W: Interna – mały podręcznik. www.mp.pl/interna/chapter/B16.II.18.1.7. (dostęp: 12.12.2022)
25. Breuer J., Pacou M., Gauthier A., Brown M.M.: Herpes zoster as a risk factor for stroke and TIA: a retrospective cohort study in the UK. Neurology, 2014; 82: 206–212
26. Dooling K.L., Guo A., Patel M. i wsp.: Recommendations of the Advisory Committee on Immunization Practices for Use of Herpes Zoster Vaccines. MMWR, 2018; 67: 103–108
27. Anderson T.C., Masters N.B., Guo A. i wsp.: Use of Recombinant Zoster Vaccine in Immunocompromised Adults Aged ?19 Years: Recommendations of the Advisory Committee on Immunization Practices – United States, 2022. MMWR, 2022; 71: 80–85
28. Lal H., Cunningham A.L., Godeaux O. i wsp.: Efficacy of an adjuvanted herpes zoster subunit vaccine in older adults. N. Engl. J. Med., 2015; 372: 2087–2096
29. Cunningham A.L., Lal H., Kovac M. i wsp.: Efficacy of the herpes zoster subunit vaccine in adults 70 years of age or older. N. Engl. J. Med., 2016; 375: 1019–1032
30. Kim J.H., Johnson R., Kovac M. i wsp.: Adjuvanted recombinant zoster vaccine decreases herpes zoster-associated pain and the use of pain medication across 3 randomized, placebo-controlled trials. Pain, 2023; 164: 741–748
31. Bastidas A., de la Serna J., El Idrissi M. i wsp.: Effect of recombinant zoster vaccine on incidence of herpes zoster after autologous stem cell transplantation: a randomized clinical trial. JAMA, 2019; 322: 123–133
32. Dagnew A.F., Ilhan O., Lee W.-S. i wsp.: Immunogenicity and safety of the adjuvanted recombinant zoster vaccine in adults with haematological malignancies: a phase 3 shingrix ded, clinical trial and post-hoc efficacy analysis. Lancet Infect. Dis., 2019; 19: 988–1000
33. Vink P., Delgado Mingorance I., Maximiano Alonso C. i wsp.: Immunogenicity and safety of the adjuvanted recombinant zoster vaccine in patients with solid tumors, vaccinated before or during chemotherapy: a randomized trial. Cancer, 2019; 125: 1301–1312
34. Vink P., Ramon Torrell J.M., Sanchez Fructuoso A. i wsp.: Immunogenicity and safety of the adjuvanted recombinant zoster vaccine in chronically immunosuppressed adults following renal transplant: a phase 3, randomized clinical trial. Clin. Infect. Dis., 2020; 70: 181–190
35. Berkowitz E.M., Moyle G., Stellbrink H.-J. i wsp.: Safety and immunogenicity of an adjuvanted herpes zoster subunit candidate vaccine in HIV-infected adults: a phase 1/2a randomized, placebo-controlled study. J. Infect. Dis., 2015; 211: 1279–1287
36. Gabutti G., Valente N., Sulcaj N., Stefanati A.: Evaluation of efficacy and effectiveness of live attenuated zoster vaccine. J. Prev. Med. Hyg., 2014; 55: 130–136
37. Thomas S.L,. Hall A.J.: What does epidemiology tell us about risk factors for herpes zoster? Lancet Infect Dis., 2004; 4: 26–33
38. Forbes H.J., Bhaskaran K., Thomas S.L. i wsp.: Quantification of risk factors for herpes zoster: population based case-control study. BMJ, 2014; doi: 10.1136/bmj.g2911.
39. Matthews S., De Maria A., Passamonti M. i wsp.: The economic burden and impact on quality of life of herpes zoster and postherpetic neuralgia in individuals aged 50 years or older in Italy. Open Forum Infect. Dis., 2019; doi: 10.1093/ofid/ofz007
40. Friesen K.J., Chateau D., Falk J. i wsp.: Cost of shingles: population based burden of disease analysis of herpes zoster and postherpetic neuralgia. BMC Infect. Dis., 2017; 17: 69
41. Hu S.C., Yen F.L., Wang T.N. i wsp.: Immunosuppressive medication use and risk of herpes zoster (HZ) in patients with systemic lupus erythematosus (SLE): a nationwide case-control study. J. Am. Acad. Dermatol., 2016; 75: 49–58
42. Marra F., Lo E., Kalashnikov V., Richardson K.: Risk of herpes zoster in individuals on biologics, disease-modifying antirheumatic drugs, and/or corticosteroids for autoimmune diseases: a systematic review and meta-analysis. Open Forum Infect. Dis., 2016; 3: ofw205
43. Henze L., Buhl C., Sandherr M. i wsp.: Management of herpesvirus reactivations in patients with solid tumours and hematologic malignancies: update of the Guidelines of the Infectious Diseases Working Party (AGIHO) of the German Society for Hematology and Medical Oncology (DGHO) on herpes simplex virus type 1, herpes simplex virus type 2, and varicella zoster virus. Ann. Hematol., 2022; 101: 491–511
44. Hansson E., Forbes H.J., Langan S.M. i wsp.: Herpes zoster risk after 21 specific cancers: population-based case–control study. Br. J. Cancer., 2017; 116: 1643–1651
45. Kho M.M.L., Roest S., Bovée D.M. i wsp.: Herpes zoster in solid organ transplantation: incidence and risk factors. Front. Immunol., 2021; doi: 10.3389/fimmu.2021.645 718
46. Centers for Disease Control and Prevention: How shingles spreads. www.cdc.gov/shingles/about/transmission.html (dostęp: 13.12.2022)
47. Bollaerts K., Riera-Montes M., Heininger U. i wsp.: A systematic review of varicella seroprevalence in European countries before universal childhood immunization: deriving incidence from seroprevalence data. Epidemiol. Infect., 2017, 145: 2666–2677
48. Charakterystyka Produktu Leczniczego Shingrix. www.ema.europa.eu/en/documents/product-information/shingrix-epar-product-information_pl.pdf (dostęp: 13.12.2022)
49. Kim Y.J., Lee C.N., Lee M.S. i wsp.: Recurrence rate of herpes zoster and its risk factors: a population-based cohort study. J. Korean Med. Sci., 2018; doi: 10.3346/jkms.2019.34.e1
50. Godeaux O., Kovac M., Shu D. i wsp.: Immunogenicity and safety of an adjuvanted herpes zoster subunit candidate vaccine in adults ? 50 years of age with a prior history of herpes zoster: a phase III, non-randomized, open-label clinical trial. Hum. Vaccin. Immunother., 2017; 13: 1051–1058
51. Zoster (herpes zoster/shingles). W: New Zealand Ministry of Health: Immunisation Handbook 2020; www.health.govt.nz/our-work/immunisation-handbook-2020 (dostęp: 19.04.2023)
52. Schwarz T.F., Aggarwal N., Moeckesch B. i wsp.: immunogenicity and safety of an adjuvanted herpes zoster subunit vaccine coadministered with seasonal influenza vaccine in adults aged 50 years or older. J. Infect. Dis., 2017; 216: 1352–1361
53. Wyman M.J., Stabi K.L. Concomitant administration of pneumococcal-23 and zoster vaccines provides adequate herpes zoster coverage. Ann. Pharmacother., 2013; 47: 1064–1068
54. Min J.Y., Mwakingwe-Omari A., Riley M. i wsp.: The adjuvanted recombinant zoster vaccine co-administered with the 13-valent pneumococcal conjugate vaccine in adults aged ≥50 years: a randomized trial. J. Infect. 2022; 84: 490–498
55. Strezova A., Lal H., Enweonye I. i wsp.: The adjuvanted recombinant zoster vaccine co-administered with a tetanus, diphtheria and pertussis vaccine in adults aged ?50 years: a randomized trial. Vaccine, 2019; 37: 5877–5885