Skróty: COVID-19 (coronavirus disease) – choroba spowodowana przez SARS-CoV-2, SARS-CoV-2 (severe acute respiratory syndrome coronavirus 2) – koronawirus zespołu ostrej niewydolności oddechowej 2
Pytanie 1. Na czym polega mechanizm działania szczepionek mRNA i wektorowych przeciwko COVID-19? Czy się różni od dotychczas stosowanych powszechnie w ramach programu szczepień ochronnych (PSO) preparatów szczepionkowych?
Klasyczne szczepienia opierają się na dostarczeniu do organizmu gotowych antygenów w postaci osłabionych (atenuowanych) drobnoustrojów (szczepionki „żywe”), inaktywowanych (zabitych) patogenów lub ich izolowanych białek (szczepionki podjednostkowe). Celem stosowania szczepionek zawierających matrycowy RNA (mRNA) lub zmodyfikowanych genetycznie wektorów wirusowych jest dostarczenie do komórek osoby szczepionej materiału genetycznego kodującego pożądany antygen drobnoustroju chorobotwórczego (antygen „szczepionkowy”) i produkcja tego antygenu przez komórki gospodarza. Taka szczepionka dostarcza więc precyzyjny „przepis” na antygen, ale nie zawiera gotowego białka lub drobnoustroju.
Wiele z testowanych aktualnie w badaniach klinicznych szczepionek przeciwko COVID-19, a także wszystkie zarejestrowane obecnie w Unii Europejskiej, Wielkiej Brytanii lub Ameryce Północnej preparaty szczepionkowe, to szczepionki oparte na technologii mRNA (Comirnaty firmy Pfizer/ BioNTech, mRNA Moderny) lub wektorach wirusowych (preparat AZD1222 firmy AstraZeneca), najczęściej zmodyfikowanych adenowirusach niezdolnych do replikacji w organizmie człowieka.1
Adenowirusy wykorzystywane są jako nośnik genów kodujących antygeny „szczepionkowe”. Do genomu wektora metodami inżynierii genetycznej wprowadza się obce geny kodujące pożądane antygeny „szczepionkowe” (tzw. geny heterologiczne; ryc. 1). Genetycznie modyfikowane wektory wnikają do komórek poprzez interakcje z receptorami zakotwiczonymi w błonach komórkowych komórek gospodarza (ryc. 2), wprowadzając materiał genetyczny, który następnie ulega ekspresji przez maszynerię komórkową, co prowadzi do produkcji określonych białek (ryc. 3). Wektor ChAdOx1 nCoV-19 znajdujący się w szczepionce AZD 1222 (AstraZeneca), będący zmodyfikowanym adenowirusem szympansów, i inne wektory adenowirusowe (zawierające adenowirusy ludzkie) oceniane aktualnie w badaniach klinicznych kilku szczepionek przeciwko COVID-19, to wektory niezdolne do replikacji (tzw. replikacyjnie defektywne). Są zmodyfikowane w taki sposób, aby nie były zdolne do przeprowadzenia pełnego cyklu replikacyjnego i do produkcji wirusowych cząstek potomnych w komórkach gospodarza. Komórki produkują białka na podstawie dostarczonego przez wektor materiału genetycznego, ale nie produkują nowych cząstek wirusowych. Zapobiega to nieograniczonemu namnażaniu się wektorów i ich rozprzestrzenianiu w organizmie, co znacząco zwiększa bezpieczeństwo takiej szczepionki.2 Namnażanie takich wektorów wirusowych w celu produkcji szczepionki wymaga zastosowania specjalnej laboratoryjnej linii komórek tzw. komplementujących, które dostarczają wektorom brakujące składniki umożliwiające przeprowadzenie pełnego cyklu replikacyjnego z produkcją kompletnych potomnych cząsteczek wektora (p. także pyt. 4. – przyp. red.).
Do szczepionek genetycznych, niosących sekwencje kodujące antygeny, zaliczamy również szczepionki mRNA. W biologii komórek mRNA jest produktem pośrednim pozwalającym na przeniesienie informacji genetycznej z DNA w jądrze komórkowym do cytoplazmy, gdzie powstają białka (ryc. 3). Szczepionkowy mRNA jest natomiast produkowany w reakcji transkrypcji in vitro.3 Informacja genetyczna zostaje przepisana w probówce z liniowego kwasu DNA na RNA przy użyciu enzymu – polimerazy RNA. Otrzymany RNA jest modyfikowany enzymatycznie tak, aby zawierał modyfikacje charakterystyczne dla dojrzałych cząstek mRNA, które służą komórce jako gotowa matryca syntezy białek. Taki dojrzały mRNA nie może się zwrotnie przedostać z cytoplazmy do jądra komórkowego. Szczepionkowy mRNA jest pakowany do nośników, na przykład do nanocząsteczek lipidowych (NLP), które chronią go przed szybką degradacją po wstrzyknięciu domięśniowym szczepionki i umożliwiają wniknięcie mRNA do komórek na drodze endocytozy (ryc. 4). Cząstki wnikają głównie do komórek mięśniowych oraz komórek prezentujących antygeny (APC, np. komórek dendrytycznych) w okolicy wstrzyknięcia. Bezpośrednio po uwolnieniu mRNA do cytoplazmy zachodzi proces biosyntezy białek na dostarczonej matrycy mRNA (szczepionkowy mRNA nie wnika do jądra komórkowego!). Wyprodukowane białka są modyfikowane potranslacyjnie i transportowane zgodnie z ich właściwościami biochemicznymi. W krótkim czasie po translacji cząsteczka mRNA ulega degradacji przez rybonukleazy cytoplazmatyczne występujące naturalnie w komórkach człowieka. 4
Po szczepieniu wektorem wirusowym (ryc. 2) lub szczepionką mRNA (ryc. 4) produkcja antygenów szczepionkowych odbywa się w komórkach gospodarza, w taki sam sposób, w jaki dzieje się to w trakcie naturalnego zakażenia. Antygeny szczepionkowe prezentowane są w postaci krótkich peptydów w połączeniu z cząstkami MHC klasy I lub II, co prowadzi do stymulacji zarówno odpowiedzi humoralnej, jak i komórkowej. Dzięki temu szczepionki wektorowe i mRNA wykazują immunogenność i skuteczność podobną do szczepionek zawierających atenuowane drobnoustroje (czyli szczepionek „żywych”). Uznaje się je jednak za bezpieczniejsze od szczepionek „żywych”, które zazwyczaj są przeciwwskazane u pacjentów w stanie immunosupresji i u kobiet w ciąży, a ponadto wiążą się z pewnym (choć niewielkim) ryzykiem utraty atenuacji.4
Piśmiennictwo:
1. WHO: Draft landscape of COVID-19 candidate vaccines. https://www.who.int/publications/ m/item/draft-landscape-of-covid-19-candidate-vaccines (dostęp: 6.01.2021)2. Tatsis N., Ertl H.C.: Adenoviruses as vaccine vectors. Mol. Ther., 2004; 10: 616–629
3. Pardi N., Muramatsu H., Weissman D. i wsp.: In vitro transcription of long RNA containing modified nucleosides. Methods Mol. Biol., 2013; 969: 29–42
4. Pardi N., Hogan M.J., Porter F.W. i wsp.: mRNA vaccines – a new era in vaccinology. Nat. Rev. Drug Discov., 2018; 17: 261–279
Pytanie 2. Na czym polega i czemu służy modyfikacja mRNA w aktualnie zarejestrowanych szczepionkach mRNA przeciwko COVID-19? Czy podobną modyfikację genu białka S wprowadzono w szczepionce wektorowej ChAdOx1 nCoV-19? Czy taka modyfikacja może mieć potencjalne negatywny wpływ na zdrowie osób szczepionych?
Preparat Comirnaty zawiera mRNA otrzymany drogą transkrypcji in vitro (p. pyt. 1 – przyp. red.), mRNA w tej szczepionce koduje pełnej długości białko kolca (S) wirusa SARS-CoV-2. Do sekwencji wprowadzono 2 mutacje skutkujące włączeniem do białka S produkowanego na tej matrycy mRNA 2 reszt proliny – aminokwasu o sztywnej strukturze. Zapewnia to utrzymanie tzw. przedfuzyjnej konformacji białka kolca, takiej jaka naturalnie występuje na zakaźnych cząstkach wirusowych przed ich związaniem się z receptorem na komórce gospodarza. Ponadto mRNA w szczepionce Comirnaty jest optymalizowany pod względem doboru kodonów. Kodony to trójki reszt nukleotydowych, czyli „liter” alfabetu genetycznego. Kodon, czyli 3 „litery”, determinuje, jaki aminokwas będzie przyłączany do łańcucha polipeptydowego w procesie syntezy białek. W naturze występuje 20 aminokwasów, a z czteronukleotydowego „alfabetu” genetycznego RNA (guanina – G, adenina – A, uracyl – U, cytozyna – C) utworzyć można 64 różne kodony. W związku z tym aminokwasy mogą być kodowane przez więcej niż jeden kodon. Optymalizacja sekwencji genetycznej polega na dobraniu tych kodonów, które z największą wydajnością przepisywane są na aminokwasy w danym organizmie. Prowadzi to do znacznego zwiększenia wydajności syntezy białka. Trzeba podkreślić, że optymalizacja sekwencji RNA w żaden sposób nie zmienia składu aminokwasowego wyprodukowanego w komórce antygenu szczepionkowego.1,2
Dodatkowo, mRNA jest modyfikowany przez włączenie do sekwencji nukleozydu 1-metylo-pseudourydyny podczas reakcji transkrypcji in vitro. 1-metylo-pseudourydyna jest analogiem urydyny, 1 z 4 nukleozydów włączanych do nici RNA. Modyfikowane nukleozydy występują również naturalnie w mRNA komórkowych, a pseudourydyna jest najczęściej występującym modyfikowanym nukleozydem. Naturalne modyfikacje RNA w komórkach prowadzą do uzyskania cząstek o nowych właściwości zarówno pod względem struktury, jak i funkcjonalności.3 Włączenie 1-metylo-pseudourydyny do RNA prowadzi do zwiększenia wydajności translacji białek in vivo i redukcji stanu zapalnego wywołanego wykryciem obcego RNA w organizmie przez receptory TLR.4,5
Szczepionka mRNA-1273 (mRNA Moderny) pod wieloma względami jest podobna do Comirnaty: zawiera mRNA kodujący pełnej długości białko kolca (S) z 2 mutacjami skutkującymi wprowadzeniem reszt proliny, co pozwala na zachowanie natywnej, przedfuzyjnej struktury białka S. Do szczepionkowego mRNA włączane są modyfikowane nukleotydy w celu wydłużenia czasu ekspresji i modulacji odpowiedzi immunologicznej. W obu szczepionkach mRNA jest dostarczany w nanocząsteczkach lipidowych, które różnią się nieco składem.6,7
Szczepionka ChAdOx1 nCoV-19 (AZD 1222 [AstraZeneca]) jest oparta na innej platformie technologicznej – replikacyjnie defektywnym adenowirusie niosącym sekwencję DNA. Również tutaj sekwencja kodująca pełnej długości białko kolca (S) została zoptymalizowana pod względem kodonów w celu uzyskania jak najbardziej wydajnej syntezy białka in vivo. Natomiast reszty nukleotydowe nie są modyfikowane – wektory wirusowe produkowane są w hodowlach komórkowych (p. pyt. 4. – przyp. red.), niesiony przez nie DNA jest więc syntetyzowany w komórkach z wykorzystaniem ich maszynerii molekularnej. Po szczepieniu wektorem adenowirusowym wprowadzona do komórek gospodarza sekwencja DNA jest przepisywana na mRNA w jądrze komórki gospodarza, wobec tego mRNA ulega wszystkim modyfikacjom potranskrypcyjnym już w komórkach, tak samo jak wszystkie inne komórkowe cząstki mRNA (ryc. 3).8 Natomiast do sekwencji kodującej białko S w tym wektorze dołączono fragment kodujący sekwencję sygnałową tkankowego aktywatora plazminogenu (tPA), ludzkiego enzymu o aktywności proteazy. Po wprowadzeniu materiału genetycznego do komórek gospodarza produkowane jest białko fuzyjne – białko kolca z dołączoną na N-końcu krótką sekwencją sygnałową tPA, która kieruje białko S na drogę sekrecji, zwiększając jego immunogenność.9
Zastosowanie modyfikowanych reszt nukleotydowych ma się przyczyniać do zwiększenia bezpieczeństwa szczepionki przez zmniejszanie odczynu zapalnego wywołanego stymulacją mechanizmów odporności wrodzonej. Bezpieczeństwo wszystkich 3 omawianych szczepionek pozytywnie oceniono w badaniach klinicznych 3. fazy, które stały się podstawą ich rejestracji. Nie ma natomiast doniesień o potencjalnych niepożądanych skutkach zastosowanych modyfikacji genetycznych.
Piśmiennictwo:
1. Vogel B.A., Kanevsky I., Che Y. i wsp.: A prefusion SARS-CoV-2 spike RNA vaccine is highly immunogenic and prevents lung infection in non-human primates. https://www. biorxiv.org/content/10.1101/2020.09.08.280818v1.full2. Latanova A.A., Petkov S., Kilpelainen A. i wsp.: Codon optimization and improved delivery/immunization regimen enhance the immune response against wild-type and drug-resistant HIV-1 reverse transcriptase, preserving its Th2-polarity. Sci. Rep., 2018; 8: 8078. doi: 10.1038/s41 598-018-26 281-z
3. Zhao B.S., He C.: Pseudouridine in a new era of RNA modifications. Cell Res., 2015; 25: 153–154
4. Svitkin Y.V., Cheng Y.M., Chakraborty T. i wsp.: N1-methyl-pseudouridine in mRNA enhances translation through eIF2?-dependent and independent mechanisms by increasing ribosome density. Nucleic Acids Res., 2017; 45: 6023–6036
5. Karikó K., Muramatsu H., Welsh F.A. i wsp.: Incorporation of pseudouridine into mRNA yields superior nonimmunogenic vector with increased translational capacity and biological stability. Mol. Ther., 2008; 16: 1833–1840
6. Jackson L.A., Anderson E.J., Rouphael N.G. i wsp.: An mRNA Vaccine against SARS-CoV-2 – Preliminary Report. N. Engl. J. Med. 2020; 383: 1920–1931
7. Castells M.C., Phillips E.J.: Maintaining safety with SARS-CoV-2 vaccines. NEJM, 2020; DOI: 10.1056/NEJMra2 035 343
8. van Doremalen N., Lambe T., Spencer A. i wsp: ChAdOx1 nCoV-19 vaccine prevents SARS-CoV-2 pneumonia in rhesus macaques. Nature, 2020; 586: 578–582
9. Wang J.Y., Song W.T., Li Y. i wsp.: Improved expression of secretory and trimeric proteins in mammalian cells via the introduction of a new trimer motif and a mutant of the tPA signal sequence. Appl. Microbiol. Biotechnol., 2011; 91: 731–740
Pytanie 3. Ile kopii białka S powstaje z 1 cząsteczki mRNA podanej w szczepionce lub z 1 cząsteczki wektora adenowirusowego? Czy taka matryca może być wykorzystywana wielokrotnie przez długi czas, prowadząc do nieograniczonej produkcji antygenów szczepionkowych?
W przypadku wektorów adenowirusowych niesiony przez nie DNA jest transportowany do jądra, gdzie pozostaje w formie episomalnej, czyli nie integruje się z chromosomem i nie jest replikowany razem z chromosomalnym DNA w fazie S cyklu komórkowego. W jądrze DNA jest przepisywany na RNA w reakcji transkrypcji. Z jednego genu może powstać wiele cząsteczek RNA, a wydajność tego procesu zależy między innymi od użytego promotora. Promotor to odcinek regulatorowy DNA znajdujący się powyżej sekwencji kodującej, który jest rozpoznawany przez polimerazę RNA, enzym przeprowadzający reakcję transkrypcji. W wektorze ChAdOx1 nCoV-19 użyto bardzo wydajnego promotora CMV – promotora genów natychmiastowych wczesnych cytomegalowirusa. Promotor ten jest powszechnie stosowany do ekspresji genów w biologii molekularnej. Jego użycie zapewnia bardzo wydajną transkrypcję, czyli otrzymanie wielu kopii RNA, które następnie, po transporcie do cytoplazmy, służą jako matryca do syntezy białek. Pozwala to na uzyskanie wydajnej produkcji antygenu szczepionkowego i wzbudzenie silnej odpowiedzi immunologicznej.1,2 Krótkotrwała ekspresja genów wprowadzanych w wektorze adenowirusowym wiąże się z działaniem odpowiedzi immunologicznej gospodarza. Komórki w okolicy wstrzyknięcia szczepionki domięśniowo, wykazujące ekspresję antygenu szczepionkowego są eliminowane przez limfocyty cytotoksyczne T CD8+ (ryc. 2), podobnie jak w przebiegu naturalnego zakażenia. Dodatkowo, komórki transdukowane wektorem adenowirusowym wchodzą na drogę apoptozy (zaprogramowanej śmierci komórkowej) indukowanej przez ekspresję genów adenowirusowych. Z tych powodów wektory adenowirusowe są obecnie badane głównie jako wektory szczepionkowe i onkolityczne, a nie jako wektory klasycznej terapii genowej, gdzie potrzebna jest długoterminowa ekspresja kodowanego białka.3,4
Cząsteczki mRNA mogą być również wykorzystywane wielokrotnie, a na bazie jednej matrycy może powstawać wiele łańcuchów polipeptydowych równolegle. Matryca mRNA będzie ulegać translacji, dopóki nie zostanie zdegradowana przez rybonukleazy komórkowe, co regulują różne mechanizmy wewnątrzkomórkowe. Liczba cząstek białka wyprodukowanych na bazie transkryptu mRNA jest determinowana przez wydajność translacji i okres półtrwania mRNA w cytoplazmie. Ponieważ wszystkie cząstki mRNA w końcu ulegają degradacji, ekspresja wprowadzonego genu jest przejściowa i krótkotrwała. W przypadku szczepionek mRNA również pobudzana jest immunologiczna odpowiedź komórkowa, która za pośrednictwem limfocytów cytotoksycznych eliminuje z organizmu komórki prezentujące obce antygeny w okolicy wstrzyknięcia (ryc. 4).5,6
Piśmiennictwo:
1. van Doremalen N., Lambe T., Spencer A. i wsp.: ChAdOx1 nCoV-19 vaccine prevents SARS-CoV-2 pneumonia in rhesus macaques. Nature, 2020; 586: 578–5822. Xia W., Bringmann P., McClary J. i wsp.: High levels of protein expression using different mammalian CMV promoters in several cell lines. Protein Expr. Purif., 2006; 45: 115–124
3. Bilbao G., Contreras J.L., Zhang H.G. i wsp.: Adenovirus-mediated gene expression in vivo is enhanced by the antiapoptotic bcl-2 gene. J. Virol., 1999; 73: 6992–7000
4. Okuyama T., Li X.K., Funeshima N. i wsp.: Fas-mediated apoptosis is involved in the elimination of gene-transduced hepatocytes with E1/E3-deleted adenoviral vectors. J. Gastroenterol. Hepatol., 1998; 13 (supl.): S113–S118
5. Bicknell A.A., Ricci E.P.: When mRNA translation meets decay. Biochem. Soc. Trans., 2017; 45: 339–351
6. Pardi N., Hogan M.J., Porter F.W., Weissman D.: mRNA vaccines – a new era in vaccinology. Nat. Rev. Drug Discov., 2018; 17: 261–279
Pytanie 4. Jak się produkuje szczepionki mRNA i wektorowe przeciwko COVID-19?
Szczepionkowy mRNA jest produkowany w reakcji transkrypcji in vitro, na drodze syntezy biochemicznej. Informacja genetyczna zostaje przepisana w probówce z liniowego kwasu DNA na RNA przy użyciu enzymu – polimerazy RNA. Otrzymany RNA jest modyfikowany enzymatycznie tak, aby zawierał elementy naturalnych cząstek mRNA – czapeczkę guanylową na końcu 5’ nici oraz sekwencję poliA na końcu 3’. Dzięki temu preparat odpowiada w pełni dojrzałym komórkowym cząstkom mRNA, które służą komórce jako matryca syntezy białek. mRNA jest oczyszczany z innych składowych reakcji, a następnie pakowany do nośników – nanocząsteczek lipidowych (NLP).1,2 W procesie produkcyjnym nie wykorzystuje się hodowli komórkowych, a produkcja takich preparatów jest szybka i bardzo wydajna.
Wektory adenowirusowe namnaża się przy użyciu tzw. klonów molekularnych. W systemie tym cały genom adenowirusowy wprowadzony zostaje do plazmidu, czyli kolistej cząstki DNA (ryc. 1). Pozwala to na łatwe powielanie genomów w komórkach bakteryjnych oraz szybkie wprowadzanie nowych modyfikacji (jak usuwanie i wprowadzanie nowych genów) prostymi metodami inżynierii genetycznej. Aby otrzymać zakaźne cząstki wektorów, liniowe genomy adenowirusów wycina się z plazmidów enzymami o aktywności endonukleaz i wprowadza przez transfekcję do komórek pakujących. Na podstawie wprowadzonej sekwencji komórki produkują białka adenowirusowe, a następnie dochodzi do składania zakaźnych cząstek adenowirusowych. Cząstki wektorów uwalniane są do pożywki przez lizę komórek. Użycie klonów molekularnych wyklucza zanieczyszczenie preparatu adenowirusowego innymi patogenami, co jest szczególnie ważne w przypadku adenowirusów pochodzenia zwierzęcego, jak ChAdOx1 nCoV-19 (zmodyfikowany adenowirus szympansów). W celu wyprodukowania szczepionki wektor ChAdOx1 nCoV-19 namnaża się następnie w komórkach T-rex HEK293 – laboratoryjnej linii wywiedzionej z ludzkich komórek zarodkowych (zarodkowe komórki nerki) pozyskanych w latach 70. XX wieku i pasażowanych do tej pory w warunkach laboratoryjnych. Są to komórki komplementujące, ich genom zawiera fragment genomu adenowirusowego zawierający region wczesny E1, którego pozbawione są genomy replikacyjnie defektywnych wektorów (jak ChAdOx1 nCoV-19). Dzięki temu wektor może namnażać się w tych komórkach, korzystając z białek kodowanych przez rejon E1 umieszczony w genomie komórkowym. Z kolei w komórkach gospodarza (tj. osoby zaszczepionej), które nie zawierają rejonu E1, wektor nie jest zdolny do replikacji. Po namnożeniu w warunkach laboratoryjnych cząstki wirusowe w odpowiedniej dawce zostają następnie oczyszczone z zawiesiny komórkowej i zawieszone w roztworze odpowiednim do zastosowania klinicznego.3-5
Piśmiennictwo:
1. Pardi N., Hogan M.J., Porter F.W., Weissman D.: mRNA vaccines – a new era in vaccinology. Nat. Rev. Drug Discov., 2018; 17: 261–2792. Iavarone C., O’hagan D.T., Yu D. i wsp.: Mechanism of action of mRNA-based vaccines. Expert Rev. Vaccines, 2017; 16: 871–881
3. van Doremalen N., Lambe T., Spencer A. i wsp.: ChAdOx1 nCoV-19 vaccine prevents SARS-CoV-2 pneumonia in rhesus macaques. Nature, 2020; 586: 578–582
4. Ertl H.C.: Viral vectors as vaccine carriers. Curr. Opin. Virol., 2016; 21: 1–8
5. Tatsis N., Ertl H.C.: Adenoviruses as vaccine vectors. Mol. Ther., 2004; 10: 616–629
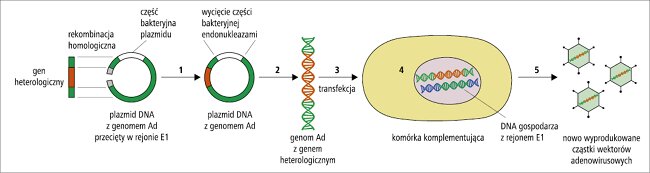
Ryc. 1. Konstrukcja rekombinowanych wektorów adenowirusowych. 1. Gen heterologiczny kodujący antygen „szczepionkowy” (kolor czerwony) wprowadza się do genomu adenowirusa w miejsce rejonu E1 (kolor szary) znajdującego się na plazmidzie DNA metodą rekombinacji homologicznej w komórkach bakterii. Plazmid posiada też sekwencje umożliwiające propagację w bakteriach (kolor biały). 2. Endonukleazami swoistymi dla określonych sekwencji z plazmidu wycięty zostaje liniowy genom wektora adenowirusowego, zawierający gen heterologiczny. 3. Genom wektora adenowirusowego wprowadza się do komórek komplementujących drogą transfekcji (p. wyjaśnienie w tekście). 4. Wprowadzony genom ulega ekspresji, powstają białka adenowirusowe. Białka kodowane przez rejon E1 są produkowane przez komórkę na podstawie sekwencji obecnej w genomie komórkowym. 5. Z białek strukturalnych powstają cząstki wirusowe (kapsydy), do których „pakowane” są powielone genomy wektorów adenowirusowych. Genomy wektorów zawierają gen heterologiczny, ale pozbawione są rejonu E1. Wektory uwalniane są do pożywki
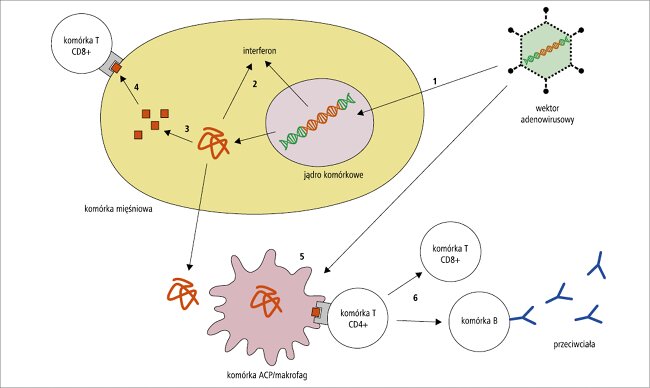
Ryc. 2. Reakcje immunologiczne wywołane szczepionką zawierającą wektor replikacyjnie defektywny (na przykładzie wektora adenowirusowego; opis – p. tekst). 1. Wektor wnika do komórki mięśniowej w miejscu wstrzyknięcia i.m. przez wiązanie ze swoistym receptorem na błonie komórkowej. DNA wektora transportowany jest do jądra komórkowego. 2. Na podstawie wprowadzonego DNA syntetyzowany jest antygen (białko) szczepionkowy. Kwasy nukleinowe i białka wektorów, jako wzorce molekularne związane z patogenami (PAMP), mogą pobudzać odporność wrodzoną poprzez indukcję wydzielania interferonów. Nie powstają jednak nowe cząstki wektorów. 3. Proteazy komórkowe degradują białka do krótkich peptydów, które wiążą się z cząstkami MHC klasy I. 4. Komórka prezentuje antygeny związane z cząstkami MHC klasy I limfocytom T cytotoksycznym (CD8+). 5. Cząstki wirusowe i białka sekrecyjne ulegają fagocytozie przez komórki prezentujące antygeny (APC). Komórki APC prezentują antygeny limfocytom T pomocniczym (CD4+), które stymulują limfocyty B produkujące przeciwciała oraz limfocyty T cytotoksyczne, które eliminują „zakażone” (tzn. prezentujące antygen „szczepionkowy”) komórki. 6. Limfocyty B i T, jako komórki pamięci immunologicznej, pozostają w organizmie przez miesiące lub lata. Przy ponownym zetknięciu z antygenem wykazują bardzo silną odpowiedź immunologiczną
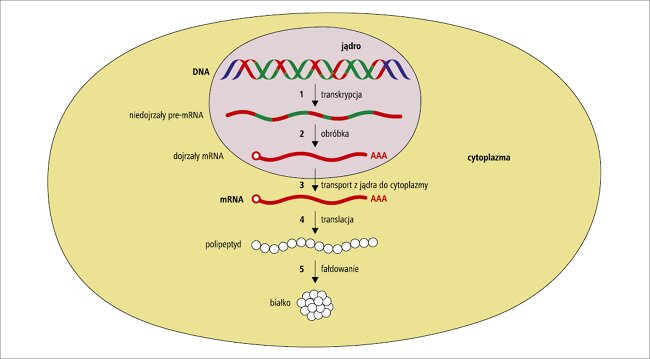
Ryc. 3. Mechanizm ekspresji genów w komórkach eukariotycznych. 1. Geny ulegaja transkrypcji (przepisaniu) z dwuniciowego DNA tworzącego genom komórkowy na niedojrzały pre-mRNA. 2. Niedojrzały pre-mRNA ulega modyfikacjom potranskrypcyjnym. Wycinane są introny, dołączana czapeczka guanylowa i ogon poliA. Powstaje dojrzały matrycowy RNA – mRNA. 3. mRNA transportowany jest przez pory jądrowe do cytoplazmy. 4. W cytoplazmie mRNA jest matrycą do syntezy łańcuchów polipeptydowych w procesie translacji. 5. Łańcuchy polipeptydowe ulegają fałdowaniu, tworząc białka, które transportowane są do odpowiednich organelli komórkowych
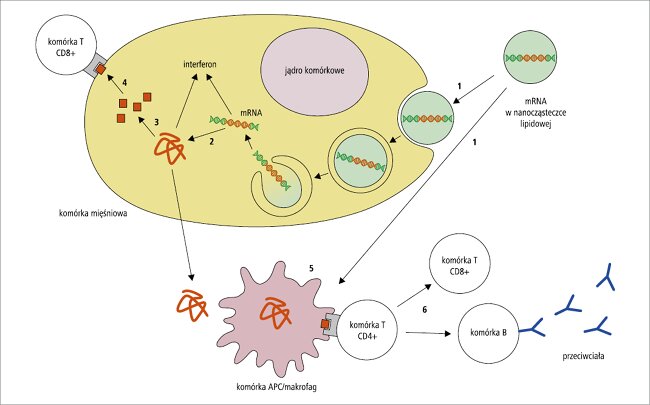
Ryc. 4. Reakcje immunologiczne wywołane szczepionką zawierającą niereplikujący się kwas mRNA w nanocząsteczkach lipidowych (NLP): 1. mRNA w NLP wnika drogą endocytozy do komórki mięśniowej w miejscu wstrzyknięcia. mRNA zostaje uwolniony z endosomu do cytoplazmy. 2. Na podstawie mRNA w cytoplazmie na rybosomach syntetyzowany jest antygen szczepionkowy. Sama cząsteczka mRNA może również pobudzać odporność wrodzoną poprzez indukcję wydzielania interferonów. 3. Proteazy komórkowe degradują wyprodukowane białka do krótkich peptydów, które wiążą się z cząstkami MHC klasy I. 4. Komórka prezentuje antygeny związane z cząstkami MHC klasy I limfocytom T cytotoksycznym (CD8+). 5. mRNA w NLP wnika także na drodze endocytozy do komórek prezentujących antygeny (APC) w okolicy wstrzyknięcia szczepionki. Ponadto, APC mogą fagocytować białka antygenowe i komórki prezentujące obce epitopy. 6. Transfekowane APC prezentują antygeny limfocytom T cytotoksycznym, które eliminują „zakażone” (tzn. prezentujące antygen „szczepionkowy”) komórki. APC mogą prezentować krzyżowo fagocytowane antygeny limfocytom T pomocniczym (CD4+), które stymulują limfocyty B produkujące przeciwciała oraz limfocyty T cytotoksyczne. Limfocyty B i T, jako komórki pamięci immunologicznej, pozostają w organizmie przez miesiące lub lata, zapewniając szybką odpowiedź anamnestyczną po ponownym kontakcie z drobnoustrojem