Czytelnicy „Medycyny Praktycznej – Szczepienia” i serwisu „Szczepienia” często zwracają się do Redakcji z pytaniami dotyczącymi opóźnionej realizacji szczepienia przeciwko meningokokom grupy B preparatem Bexsero. W Charakterystyce Produktu Leczniczego (ChPL) tej szczepionki wskazano różne schematy szczepienia w zależności od wieku pacjenta, w którym rozpoczyna się szczepienie (p. tab.).1 O ile schemat szczepienia pierwotnego nie budzi wątpliwości (w pierwszym półroczu życia 2 lub 3 dawki, później zawsze 2 dawki), to zasady podawania dawek uzupełniających zmieniają się diametralnie w zależności od wieku dziecka w momencie rozpoczęcia szczepień. Schematy szczepienia preparatem Bexsero zgodne z ChPL przedstawiono w tabeli, a zalecane odstępy pomiędzy szczepieniem pierwotnym a dawką uzupełniają oraz wiek podania dawki uzupełniającej podsumowano na rycinie. Jak wspomniano, czas podania dawki uzupełniającej zależy od wieku dziecka, w którym rozpoczęto szczepienie, i wynosi ≥6, ≥2 lub 12–23 miesięcy. U dzieci rozpoczynających szczepienie w pierwszym półroczu życia za górną granicę wieku podania dawki uzupełniającej przyjęto 24 miesiące (p. tab. i ryc.). W przypadku opóźnień w realizacji szczepienia jego kontynuacja może być utrudniona, zwłaszcza że nie dysponujemy żadnymi krajowymi zaleceniami dotyczącymi kontynuacji przerwanego schematu szczepienia preparatem Bexsero, a wytyczne Światowej Organizacji Zdrowia odnoszą się tylko do szczepionek przeciwko meningokokom grupy A i C oraz skoniugowanej szczepionki przeciwko meningokokom grupy A, C, W i Y.2 Sposób postępowania omówiono na przykładach.
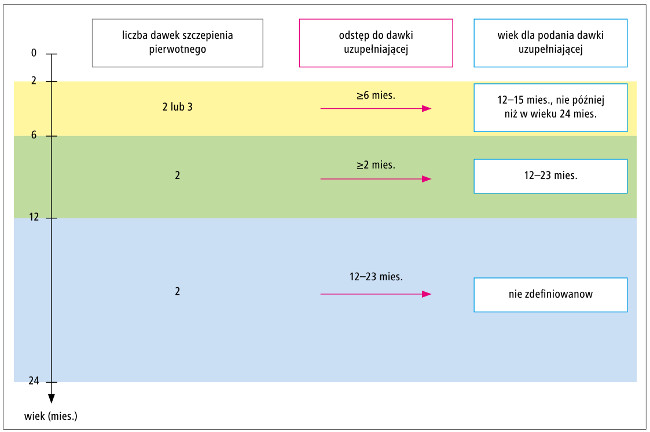
Ryc. Zalecane odstępy między szczepieniem pierowtnym a dawką uzupełniającą oraz wiek podania dawki uzupeniającej (na podstawie ChPL Bexsero)
| Tabela. Schematy szczepienia przeciwko meningokokom grupy B preparatem Bexseroa | |||
|---|---|---|---|
| Wiek w czasie podania pierwszej dawki | Szczepienie pierwotne | Odstępy między dawkami w ramach szczepienia pierwotnego | Dawka uzupełniająca |
| 2–5 mies.b | 3 dawki | ≥1 mies. | 1 dawka w wieku 12–15 mies., z zachowaniem odstępu ≥6 mies. między cyklem szczepienia pierwotnego a dawką uzupełniającąc,d |
| 2 dawki | ≥2 mies. | ||
| 6–11 mies. | 2 dawki | ≥2 mies. | tak, jedna dawka w 2. rż., z zachowaniem odstępu ≥2 mies. między cyklem szczepienia pierwotnego a dawką uzupełniającąd |
| 12–23 mies. | 2 dawki | ≥2 mies. | 1 dawka z zachowaniem odstępu 12–23 mies. między cyklem szczepienia pierwotnego a dawką uzupełniającąd |
| ≥2 lat | 2 dawki | ≥1 mies. | u osób narażonych w sposób ciągły na ryzyko ekspozycji na chorobę meningokokową należy rozważyć podanie dawki uzupełniającej, zgodnie z oficjalnymi zaleceniami |
| a Opracowano na podstawie Charakterystyki Produktu Leczniczego Bexsero. b Pierwszą dawkę należy podać nie wcześniej niż w wieku 2 mies. Nie określono dotychczas bezpieczeństwa stosowania ani skuteczności szczepionki Bexsero u niemowląt w wieku <8 tyg. Brak dostępnych danych. c W przypadku opóźnienia dawki uzupełniającej nie powinno się podawać później niż w wieku 24 mies. d Nie określono dotychczas potrzeby i schematu podawania kolejnych dawek uzupełniających. | |||
Przykład 1.
Obecnie 9-miesięczne dziecko otrzymało pierwszą dawkę szczepionki przeciwko meningokokom grupy B w wieku 2 miesięcy, a drugą w wieku 3 miesięcy (po upływie mies. od pierwszej dawki). Rodzice nie zgłosili się na kolejne wizyty. Czy należy uznać te 2 dawki jako zakończony schemat szczepienia pierwotnego i podać tylko dawkę uzupełniającą, czy należy podać jeszcze 1 dawkę szczepienia pierwotnego, a w przyszłości dawkę uzupełniającą?
Dziecko opisane w pytaniu w pierwszym półroczu życia otrzymało 2 dawki szczepionki w miesięcznym odstępie, a więc zaplanowano u niego schemat 3+1 (p. tab.). Nie możemy więc uznać tych 2 dawek jako wystarczających dla szczepienia podstawowego w schemacie 2+1, ponieważ odstęp pomiędzy nimi był zbyt krótki. W związku z tym należy podać jeszcze 1 (trzecią) dawkę szczepienia pierwotnego (teraz), a następnie po upływie ≥6 miesięcy (optymalnie nie później niż w wieku 24 mies. [szczegóły – p. Przykład 2]) podać dawkę przypominającą.
Przykład 2.
Obecnie 3-letnie dziecko otrzymało w pierwszym półroczu życia 3 dawki szczepionki w odstępie miesiąca, a potem nie zgłosiło się na kolejne wizyty. Jak kontynuować szczepienie?
W opisanym przypadku nie zrealizowano w pełni schematu 3+1 rozpoczętego w pierwszym półroczu życia. W ChPL precyzyjnie zdefiniowano maksymalny wiek dla podania dawki uzupełniającej w tym schemacie, jako: „nie później niż w wieku 24 miesięcy” (p. tab.). Teoretycznie nie można więc zakończyć szczepienia zgodnie z zamierzonym schematem, ponieważ dziecko ukończyło już 24. miesiąc życia. W tej sytuacji można zaproponować dwa rozwiązania. Pierwsze, zgodne z ChPL, polega na zaplanowaniu szczepienia tak, jakby było rozpoczynane teraz, czyli w wieku >2 lat, i obejmuje podanie 2 dawek szczepionki w odstępie ≥1 miesiąca.
Drugie rozwiązanie będzie wynikać z ogólnych zasad uzupełniania zaległych szczepień, zgodnie z ktorymi: „każda dawka szczepionki się liczy”, a więc rozpoczętego, ale niezakończonego schematu szczepień nie trzeba zaczynać od początku.3,4 W opisanej sytuacji dochodzi zatem do sprzeczności między zapisami w ChPL a zasadami ogólnymi. Światło na to zagadnienie rzuca analiza piśmiennictwa, na którym oparto zapis w ChPL dotyczący górnego limitu wieku (24 mies.) dla podania dawki uzupełniającej u dzieci, które rozpoczęły szczepienie w pierwszym półroczu życia. Okazuje się, że nie przeprowadzono badań, w których u dzieci szczepionych w schemacie pierwotnym w pierwszym półroczu życia dawkę przypominającą podawano później niż w wieku 24 miesięcy.5-16 Ograniczenie wiekowe w ChPL nie wynika więc z tego, że wykazano, że podanie dawki przypominającej po 24. miesiącu życia wiąże się z większym ryzykiem niepożądanych odczynów poszczepiennych lub mniejszą skutecznością (opóźnia się jednak moment uzyskania najlepszej możliwej ochrony). W związku z tym wydaje się, że można zastosować ogólne zasady uzupełniania szczepień i zakończyć schemat, podając 1 dawkę (czwartą) szczepionki. Będzie to prostsze w realizacji i bardziej ekonomiczne rozwiązanie.
Przykład 3.
Dziecko otrzymało w pierwszym półroczu życia 2 dawki szczepionki w odstępie miesiąca, ale rodzice nie zgłosili się na kolejne wizyty. Jak kontynuować szczepienie? Obecnie dziecko ma 19 miesięcy.
W opisanym przypadku nie można już zachować odstępów proponowanych w ChPL, ponieważ:
- dziecko otrzymało 2 dawki w pierwszym półroczu życia w odstępie jak dla schematu 3+1, który jest zbyt krótki, aby uznać te 2 dawki za zakończony schemat szczepienia pierwotnego
- dziecko ma 19 miesięcy, a więc do ukończenia 2 lat, które zgodnie z ChPL stanowią górną granicę wieku dla podania dawki uzupełniającej, pozostało niespełna 6 miesięcy.
Teoretycznie w tej sytuacji nie ma rozwiązania. Zgodnie z ChPL nie można już kontynuować rozpoczętego schematu 3+1, ponieważ w przypadku podania należnej dla niego trzeciej dawki i zachowania zalecanego odstępu ≥6 miesięcy, do czasu podania dawki uzupełniającej (czwartej) dziecko ukończy 24 miesiące życia. Natomiast w przypadku podania dawki uzupełniającej (czwartej) zanim dziecko osiągnie 24. miesiąc życia skróci się zalecany odstęp ≥6 miesięcy od zakończenia schematu pierwotnego. Podobnie jak w przykładzie 2., w tym przypadku także nie można zrealizować szczepienia zgodnie z zapisami ChPL. Należy jednak pamiętać, że ograniczenia w ChPL wynikają z braku badań klinicznych oceniających wszystkie możliwe warianty szczepienia – jak dotąd oceniono tylko przedziały wieku i interwały czasu, które wymieniono w dokumencie.
W tej trudnej sytuacji można jedynie ustalić indywidualny schemat szczepienia, nieujęty w ChPL.
Dziecko otrzymało już 2 dawki szczepionki. Drugą dawkę można uznać za nieważną ze względu na jej zbyt szybkie podanie, ale na pewno ważna jest pierwsza dawka szczepionki. Należy więc podać jeszcze 2 dawki szczepionki. Pozostaje pytanie: w jakim odstępie?
Pierwszym możliwym rozwiązaniem jest podanie 2 dawek szczepionki w odstępie 6 miesięcy, zakładając, że drugą dawkę dziecko otrzyma po ukończeniu 24. miesiąca życia (podobnie jak w Przykładzie 2. – p. wyżej). Możliwe jest też drugie rozwiązanie. W badaniach oceniono skrócenie odstępu między szczepieniem pierwotnym a dawką uzupełniającą u dzieci, u których szczepienie rozpoczęto w drugim półroczu życia. W takim przypadku dawkę uzupełniającą można podać już 2 miesiące po zakończeniu szczepienia pierwotnego (pod warunkiem że dziecko ukończy 1. rż. [p. tab.]). Można więc przypuszczać, że w opisanej sytuacji wystarczy podać 2 kolejne dawki szczepionki w odstępie <6 miesięcy (pierwszą z nich jak najszybciej, a drugą w odstępie ≥2 mies.). W opinii autorki artykułu takie postępowanie wydaje się rozsądne i równorzędne z pierwszą propozycją. Choć nie ma na to bezpośrednich dowodów naukowych, ekstrapolując dane dotyczące schematów szczepień dla innych przedziałów wieku, można przypuszczać, że taki schemat będzie wystarczająco immunogenny, dlatego można go zaproponować rodzicom. Należy pamiętać, że ostateczną decyzję o szczepieniu dziecka zawsze podejmują rodzice, po tym jak lekarz przedstawi im wszystkie możliwe schematy.
Oba przedstawione wyżej rozwiązania nie mieszczą się w schematach proponowanych w ChPL, ponieważ w opisanym przypadku opóźnionego schematu nie można kontynuować zgodnie z ChPL. Niezależnie od wyboru rozwiązania w dokumentacji medycznej dziecka należy odnotować, że w związku z opóźnieniami w realizacji szczepienia dalszy schemat ustalono w trybie off-label za zgodą rodziców.
Podsumowanie
Realizacja szczepień przeciwko meningokokom grupy B w „prawdziwym życiu” często odbiega od schematów przewidzianych w ChPL Bexsero. Algorytm szczepień proponowany przez producenta nie obejmuje wielu wyjątków, które wykraczają poza zdefiniowane przez niego ramy. W razie opóźnienia realizacji szczepienia mogą się więc zdarzyć sytuacje uniemożliwiające kontynuację szczepienia zgodnie z ChPL. W takim przypadku należy rozważyć, czy można zaplanować dalsze szczepienia w schemacie jak najbardziej zbliżonym do wskazanego przez producenta, czy jednak jest to niemożliwe. W wyjątkowych sytuacjach szczepienia należy kontynuować według ogólnych zasad, choć czasami wykluczają się one z zapisami ChPL. Rozpoczynając szczepienie przeciwko meningokokom grupy B, należy uczulić rodziców, aby terminowo zgłaszali się na kolejne wizyty szczepienne, ponieważ opóźnienie realizacji tego szczepienia będzie generowało problemy z jego kontynuacją.
Piśmiennictwo:
1. Charakterystyka Produktu Leczniczego Bexsero2. WHO recommendations for routine immunization – summary tables. Table 3: Recommendations for Interrupted or Delayed Routine Immunization Summary of WHO Position Papers. https://cdn.who.int/media/docs/default-source/immunization/immunization_schedules/immunization-routine-table3.pdf (dostęp: 30.11.2021)
3. Timing and Spacing of Immunobiologics. General Best Practice Guidelines for Immunization: Best Practices Guidance of the Advisory Committee on Immunization Practices (ACIP). www.cdc.gov/vaccines/hcp/acip-recs/general-recs/timing.html (dostęp: 30.11.2021)
4. Matkowska-Kocjan A., Stryczyńska-Kazubska J.: Jak ułożyć indywidualny kalendarz szczepień u zdrowego dziecka z opóźnieniami w realizacji szczepień? Med. Prakt. Szczepienia, 2019; 3: 74–86
5. NCT00381615. Prevention, randomized, open label, active control, parallel assignment, safety/efficacy study. https://clinicaltrials.gov/ct2/show/study/NCT00381615 (dostęp: 29.11.2021)
6. Findlow J., Borrow R., Snape M.D. i wsp.: Multicenter, open-label, randomized phase II controlled trial of an investigational recombinant meningococcal serogroup B vaccine with and without outer membrane vesicles, administered in infancy. Clin. Infect. Dis., 2010; 51 (10): 1127–1137
7. NCT01027351. Extension study evaluating antibody persistence and safety, tolerability and immunogenicity of booster doses of Novartis rMenBąOMV NZ vaccine in healthy UK children who previously received one or four doses of the same vaccine. https://clinicaltrials.gov/ct2/show/results/NCT01027351 (dostęp: 29.11.2021)
8. McQuaid F., Snape M.D., John T.M. i wsp.: Persistence of specific bactericidal antibodies at 5 years of age after vaccination against serogroup B meningococcus in infancy and at 40 months. Can. Med. Assoc. J., 2015; 187 (7): E215–223
9. NCT00944034. Safety, tolerability and immunogenicity of meningococcal B recombinant vaccine administered as booster dose at 12, 18 or 24 months of age in toddlers (12–24 Months) primed with a three-dose immunization series as infants in study V72P12. https://clinicaltrials.gov/ct2/show/results/NCT00944034 (dostęp: 29.11.2021)
10. Snape M.D., Voysey M., Finn A. i wsp.: Persistence of bactericidal antibodies after infant serogroup B meningococcal immunization and booster dose response at 12, 18 or 24 months of age. Pediatr. Infect. Dis. J., 2016; 35 (4): e113–e123
11. NCT01717638. Persistence of antibody levels and response to fifth or third meningococcal B recombinant vaccine in 4-year old healthy children who previously participated in study V72P12E1. www.clinicaltrials.gov/ct2/show/NCT01717638 (dostęp: 29.11.2021)
12. Iro M.A., Snape M.D., Voysey M. i wsp.: Persistence of bactericidal antibodies following booster vaccination with 4CMenB at 12, 18 or 24months and immunogenicity of a fifth dose administered at 4years of age – a phase 3 extension to a randomised controlled trial. Vaccine, 2017; 35 (2): 395–402
13. NCT00847145. Extension Study of V72P13 to evaluate the safety, tolerability and immunogenicity of Novartis meningococcal B recombinant vaccine when administered as a booster or as a two-dose catch-up to healthy toddlers. https://clinicaltrials.gov/ct2/show/results/NCT00847145 (dostęp: 29.11.2021)
14. Vesikari T., Esposito S., Prymula R. i wsp.: Immunogenicity and safety of an investigational multicomponent, recombinant, meningococcal serogroup B vaccine (4CMenB) administered concomitantly with routine infant and child vaccinations: results of two randomised trials. Lancet, 2013; 381 (9869): 825–835
15. NCT01339923. A phase 3B, open label, multi-center study to evaluate the safety, tolerability and immunogenicity of Novartis meningococcal B recombinant vaccine when administered alone to healthy infants according to different immunization schedules and to healthy children aged 2 to 10 years. https://clinicaltrials.gov/ct2/show/results/NCT01339923 (dostęp: 29.11.2021)
16. Martinon-Torres F., Safadi M.A.P., Martinez A.C. i wsp.: Reduced schedules of 4CMenB vaccine in infants and catch-up series in children: immunogenicity and safety results from a randomised open-label phase 3b trial. Vaccine, 2017; 35 (28): 3548–3557





















