Tłumaczył dr n. med. Dariusz Stencel
Komentarz prof. dr hab. n. med. Leszek Szenborn, Klinika Pediatrii i Chorób Infekcyjnych Uniwersytetu Medycznego we Wrocławiu
Skróty: ACIP – Advisory Committee on Immunization Practices, ART – terapia przeciwretrowirusowa, BCG – szczepionka przeciwko gruźlicy, FDA – Food and Drug Administration, gE – glikoproteina E, GKS – glikokortykosteroidy, HSCT – przeszczepienie macierzystych komórek krwiotwórczych, NOP – niepożądany odczyn poszczepienny, PHN (postherpetic neuralgia) – nerwoból popółpaścowy, RCT (randomized clinical trail) – badanie z randomizacją, RZS – reumatoidalne zapalenie stawów, RZV (recombinant zoster vaccine) – rekombinowana szczepionka przeciwko półpaścowi (Shingrix), TNF-α – czynnik martwicy nowotworów α, vOka – szczepionkowy szczep Oka VZV, VZV (varicella-zoster virus) – wirus ospy wietrznej i półpaśca, VZV-CMI (VZV-specific T cell-mediated immunity) – odporność komórkowa związana z limfocytami T swoistymi dla VZV, ZGB – zespołu Guillaina i Barrégo, ZVL (zoster vaccine live) – „żywa” szczepionka przeciwko półpaścowi (Zostavax)
Translated from J. Infect. Dis. 2021; 224 (12 Suppl. 2), Harbecke R., Cohen J.I., Oxman M.N., Herpes Zoster Vaccines: S429–S442, doi: 10.1093/infdis/jiab387. Copyright © The Author(s) 2021. Published by Oxford University Press for the Infectious Diseases Society of America. This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by/4.0/), which permits unrestricted reuse, distribution, and reproduction in any medium, provided the original work is properly cited.
Streszczenie
W ciągu całego życia na półpasiec zachoruje ok. 1 na 3 osoby, a ryzyko zachorowania zwiększa się wraz z wiekiem. Najczęstszym i najbardziej uciążliwym powikłaniem półpaśca jest przewlekły ból neuropatyczny związany z PHN. Aktualnie zarejestrowano 2 szczepionki przeciwko półpaścowi: (1) „żywą” szczepionkę zawierającą atenuowany szczep VZV – nazwa handlowa Zostavax (ZVL [szczepionka zarejestrowana w UE, ale niedostępna w Polsce – przyp. red.]) oraz (2) szczepionkę rekombinowaną, z adiuwantem, zawierającą podjednostkę glikoproteiny E wirusa ospy wietrznej i półpaśca – nazwa handlowa Shingrix (RZV [szczepionka zarejestrowana w UE i dostępna w Polsce od marca 2023 r. – przyp. red.]). Bezpieczeństwo i skuteczność obu szczepionek wykazano w badaniach z udziałem dorosłych osób immunokompetentnych oraz dorosłych z wybranymi stanami niedoboru odporności lub chorobami o podłożu immunologicznym. W wielu badaniach obserwacyjnych przeprowadzonych po zarejestrowaniu szczepionek potwierdzono ich bezpieczeństwo i skuteczność rzeczywistą. Wykazano, że RZV charakteryzuje się większą skutecznością w zapobieganiu półpaścowi niż ZVL. Ponadto RZV nie zawiera VZV zdolnego do replikacji, dlatego można ją bezpiecznie stosować u osób z niedoborami odporności. Kolejne szczepionki przeciwko półpaścowi są na różnych etapach opracowywania. Szersza dystrybucja bezpiecznych i skutecznych szczepionek przeciwko półpaścowi przyczyni się do poprawy stanu zdrowia i samopoczucia szybko zwiększającej się populacji osób starszych na całym świecie.
Wprowadzenie
Wirus ospy wietrznej i półpaśca (VZV) jest neurotropowym ludzkim herpeswirusem wywołującym 2 różne choroby: ospę wietrzną i półpasiec. Pierwotne zakażenie VZV powoduje ospę wietrzną charakteryzującą się uogólnioną swędzącą osutką, która szybko ewoluuje od plamek, przez grudki, do zmian pęcherzykowych, a następnie strupów. Zmiany są pojedyncze i rozproszone, co odzwierciedla rozprzestrzenianie się wiremii na skórze. U zdrowych dzieci ospa wietrzna na ogół ma łagodny przebieg.1,2 W klimacie umiarkowanym, w przypadku braku szczepień ochronnych, zachorowania na ospę wietrzną występują zwykle we wczesnym dzieciństwie: >90% dzieci ulega zakażeniu przed okresem dojrzewania.2-4 W klimacie tropikalnym do pierwotnego zakażenia VZV dochodzi później, często u młodzieży i dorosłych, co wiąże się z powikłaniami i zwiększoną śmiertelnością.3,5,6 W związku z tym w krajach tropikalnych obserwowano ogniska zachorowań na ospę wietrzną wśród pracowników opieki zdrowotnej, którzy dotychczas nie chorowali na ospę wietrzną.7-9
Podczas pierwotnego zakażenia VZV ulega uśpieniu (latencji) i w postaci utajonej przebywa całe życie w komórkach zwojowych rdzenia i zwojach nerwów czaszkowych.10,11 VZV w postaci utajonej przebywa również w zwojach jelitowego układu nerwowego, który może ulec zakażeniu w trakcie wiremii lub w wyniku transportu aksonalnego wirusów z neuronów w zwojach czuciowych.12 Pacjenci po przechorowaniu ospy wietrznej nabywają odporność komórkową związaną z limfocytami T swoistymi dla VZV (VZV-CMI), która jest również niezbędna do ograniczenia reaktywacji utajonego zakażenia VZV i jego replikacji, a tym samym do zapobiegania zachorowaniom na półpasiec.13 Mechanizmy wywoływania i utrzymywania latencji VZV oraz jego reaktywacji nie są dobrze poznane.
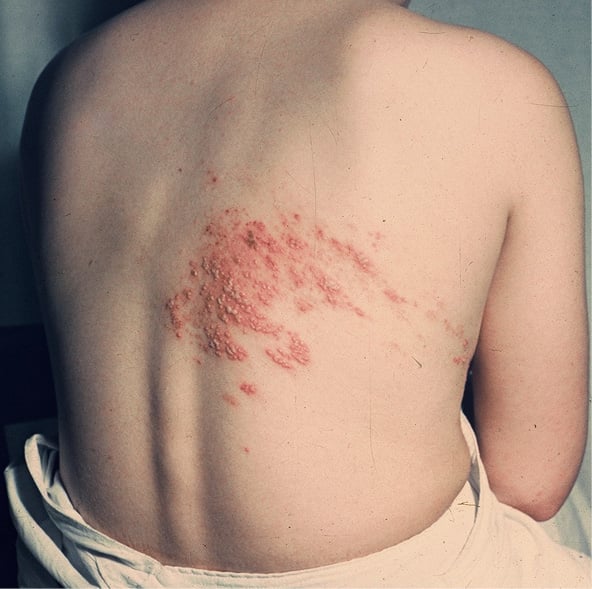
Ryc. 1. Klasyczny półpasiec obejmujący dermatomy w odcinku piersiowym po stronie prawej. Należy zwrócić uwagę na koncentrację zmian w obszarach dermatomu unerwionych przez tylną główną gałąź prawego nerwu rdzeniowego na tej wysokości (zdjęcie z kolekcji Kliniki Pediatrii i Chorób Infekcyjnych UM we Wrocławiu, dzięki uprzejmości prof. L. Szenborna [od Redakcji: z uwagi na ograniczenia praw autorskich zdjęcie oryginalne zastąpiono podobnym za zgodą wydawcy]).
Reaktywacja VZV i jego późniejsza replikacja wywołuje półpasiec – zlokalizowaną chorobę obejmującą zwoje czuciowe, nerwy i skórę. Półpasiec objawia się jednostronnym bólem korzeniowym i osutką pęcherzykową, która na ogół ogranicza się do dermatomu unerwionego przez pojedynczy korzeń grzbietowy lub zwój nerwu czaszkowego.14-17 Zmiany skórne tworzą skupiska odzwierciedlające transmisję wewnątrznerwową do skóry (p. ryc. 1). Półpasiec występuje sporadycznie przez cały rok (nie sezonowo), niezależnie od ospy wietrznej. Nie ma dowodów na to, że półpasiec jest wynikiem egzogennego zakażenia VZV, tzn. że można go nabyć drogą kontaktu z chorym na ospę wietrzną lub półpasiec. Zachorowalność na półpasiec wynika raczej z działania czynników wpływających na relację wirus–gospodarz, przede wszystkim VZV-CMI gospodarza, która utrzymuje VZV w postaci utajonej.
Przebieg naturalny półpaśca
Podstawę opracowania szczepionki przeciwko półpaścowi i jego powikłaniom stanowiły obserwacje Roberta Edgara Hope-Simpsona,15 które opisał w przełomowej publikacji w 1965 roku. Uważnie śledząc każdy przypadek ospy wietrznej i półpaśca, z jakim spotkał się w swojej praktyce klinicznej w ciągu 16 lat, Hope-Simpson zauważył, że zachorowalność na półpasiec i nerwoból popółpaścowy (PHN) oraz ich nasilenie zwiększają się wraz z wiekiem.15 Postawił hipotezę, że pierwotne zakażenie VZV (ospa wietrzna) prowadzi do utrzymującego się przez całe życie utajonego zakażenia VZV w neuronach czuciowych i wywołuje odporność, która ogranicza zdolność utajonego VZV do reaktywacji i namnażania się w celu wywołania półpaśca (p. ryc. 2). Postulował też, że odporność na VZV zmniejsza się wraz z upływem czasu aż do krytycznego poziomu, który umożliwia reaktywację utajonego VZV, jego namnażanie się i rozprzestrzenianie, a ostatecznie prowadzi do rozwoju półpaśca. Hope-Simpson15 zaproponował również tezę, że zarówno bezobjawowa reinfekcja VZV w wyniku kontaktu z chorym na ospę wietrzną, jak i samoistne reaktywacje zwojowe, hamowane przez nabytą wcześniej swoistą odporność na VZV (zatrzymanie reaktywacji), stymulują odporność gospodarza na VZV i opóźniają jej zmniejszenie do poziomu umożliwiającego reaktywację i replikację utajonego VZV i rozwój półpaśca. Hope-Simpson zauważył też, że drugi epizod półpaśca zdarza się rzadko, ponieważ duża liczba cząstek wirusa pojawiających się w trakcie półpaśca prawdopodobnie zwiększa odporność na VZV i utrzymuje ją na poziomie zapobiegającym kolejnemu zachorowaniu.15 Ta obserwacja stała się paradygmatem skutecznego szczepienia osób starszych przeciwko półpaścowi. Wielu badaczy potwierdziło przełomowe obserwacje i hipotezy Hope-Simpsona.15,18-25
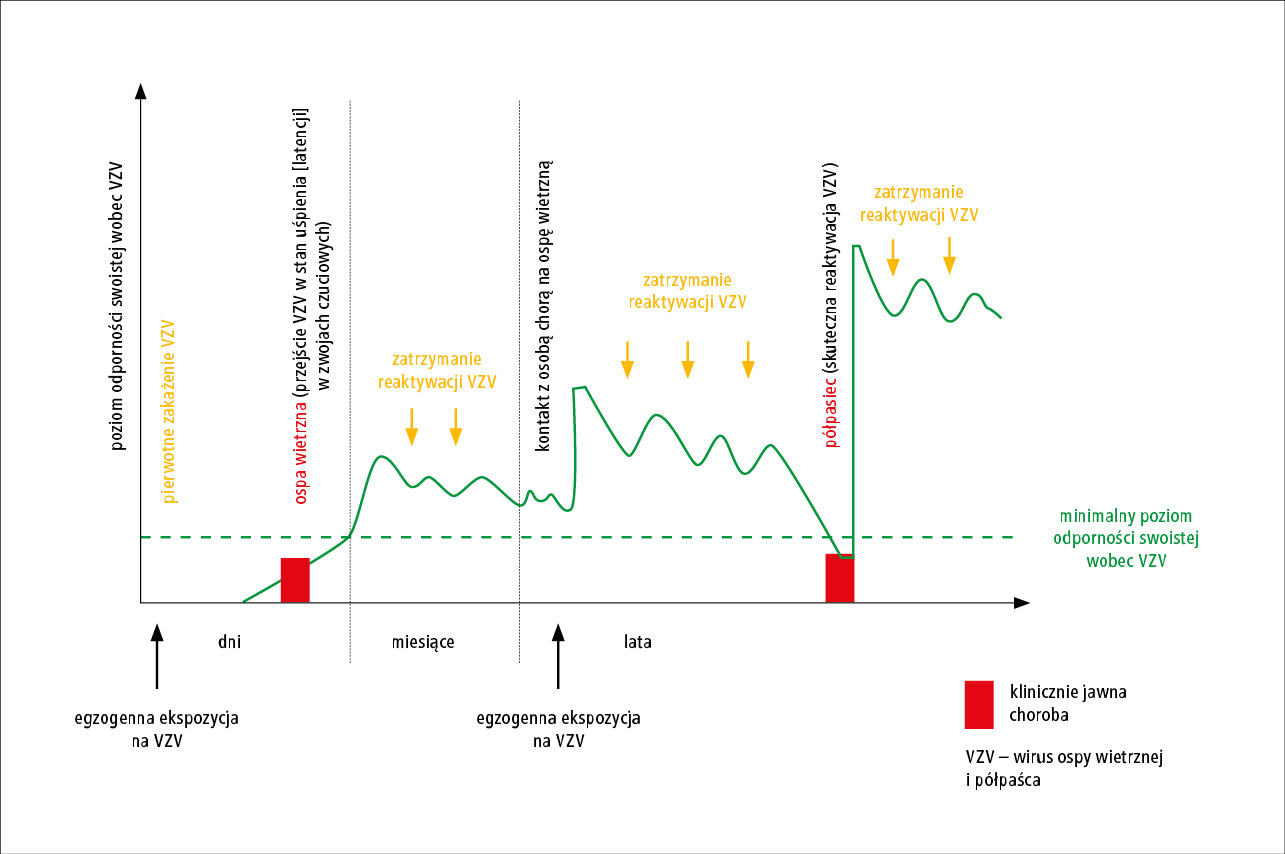
Ryc. 2. W przebiegu ospy wietrznej wirus ospy wietrznej i półpaśca (VZV) przechodzi w trwający całe życie stan utajnienia (latencji) w neuronach zwojów czuciowych. Półpasiec rozwija się w wyniku reaktywacji utajonego VZV, jego namnażania w zwoju i rozprzestrzenia się na obwód wzdłuż nerwu czuciowego. Przebycie ospy wietrznej wywołuje odporność na VZV, która zapobiega namnażaniu się reaktywowanego wirusa, zapobiegając w ten sposób półpaścowi. Jednak odporność ta zmniejsza się wraz z upływem czasu aż do krytycznego poziomu, który umożliwia reaktywację VZV, jego namnażanie i wywołanie półpaśca. Zmniejszenie odporności swoistej dla VZV wraz z wiekiem jest spowalniane przez okresową stymulację w wyniku kontaktu z chorym na ospę wietrzną (egzogenna ekspozycja na VZV) oraz przez epizody reaktywacji utajonego VZV, w których nabyta wcześniej swoista odporność hamuje namnażanie się wirusa, zanim wywoła on półpasiec (zatrzymanie reaktywacji). Zmodyfikowano na podstawie 15. pozycji piśmiennictwa.
Odpowiedź immunologiczna gospodarza na VZV
Pierwotne zakażenie VZV (ospa wietrzna) indukuje produkcję swoistych przeciwciał anty-VZV oraz odpowiedź komórkową. Przeciwciała anty-VZV uczestniczą w ochronie gospodarza w przypadku ponownego kontaktu z chorym na ospę wietrzną lub półpasiec, ale wydaje się, że w razie zachorowania mają niewielki udział w ochronie przed ciężką postacią ospy wietrznej (zaobserwowano, że niedobory odporności przebiegające z zaburzeniami produkcji przeciwciał [np. agammaglobulinemia] nie zwiększają ryzyka zachorowania na ospę wietrzna o ciężkim przebiegu lub drugiego epizodu choroby).26,27 Duże stężenie swoistych przeciwciał anty-VZV (z niewielkimi zmianami) utrzymuje się przez całe życie.28 W odpowiedzi komórkowej wobec VZV uczestniczą limfocyty T, w tym limfocyty T efektorowe i limfocyty pamięci CD4+ i CD8+, a także komórki NK.29-31 Nasilenie VZV-CMI jest odwrotnie skorelowane z nasileniem ospy wietrznej6,32 i półpaśca.33 VZV-CMI jest niezbędna do utrzymania VZV w postaci utajonej.
Po reaktywacji utajonego VZV anamnestyczna odpowiedź immunologiczna gospodarza zwykle hamuje replikację wirusa i zapobiega rozwojowi półpaśca (wówczas reaktywacja przebiega bezobjawowo). Jednak replikacja VZV, do której dochodzi, jest wystarczająca do wzmocnienia odporności gospodarza wobec VZV.15,19-21,23,25,34-36 Zjawisko zatrzymania reaktywacji (p. ryc. 2) utrzymuje odporność na ospę wietrzną i opóźnia jej zmniejszanie się wraz z wiekiem, a tym samym zmniejsza ryzyko zachorowania na półpasiec. Podobne wzmocnienie odporności obserwuje się w wyniku ponownego kontaktu z chorym na ospę wietrzną (egzogenna ekspozycja na VZV).15,25,34,37-47 Kiedy rozwija się półpasiec, jego nasilenie ogranicza nabyta wcześniej VZV-CMI (pamięć immunologiczna), a nie swoiste przeciwciała anty-VZV.33
Rola utajonego VZV w utrzymaniu odporności gospodarza przeciwko półpaścowi
Zakładając, że egzogenne wzmocnienie odporności swoistej wobec VZV jest niezbędne do jej utrzymania i zapobiegania półpaścowi, na podstawie modelowania epidemiologicznego48,49 przypuszczano, że powszechne szczepienia przeciwko ospie wietrznej znacznie zmniejszą zapadalność na tę chorobę. W konsekwencji zmniejszy to prawdopodobieństwo kontaktu z chorym na ospę wietrzną (egzogenna ekspozycja na VZV), co w ciągu kolejnych 50 lat mogłoby się przełożyć na 21 mln dodatkowych zachorowań na półpasiec i 5000 dodatkowych zgonów. Z tego powodu w wielu krajach, w tym w Anglii, wstrzymywano się z rozpoczęciem programu powszechnych szczepień dzieci przeciwko ospie wietrznej.25,49
Po wprowadzeniu takiego programu w USA, który zmniejszył zachorowalność na ospę wietrzną (a tym samym ekspozycję na VZV) o >95%, nie stwierdzono jednak znacznego zwiększenia zachorowalności na półpasiec. Zjawisko to zaobserwowano natomiast na długo przed zarejestrowaniem w USA pierwszej szczepionki przeciwko ospie wietrznej, a rozpoczęcie powszechnych szczepień dzieci nie przyspieszyło go, mimo że zapadalność na ospę wietrzną zmniejszyła się o >95% (p. Skuteczność rzeczywista szczepionki przeciwko ospie wietrznej – przyp. red.).49-57 Ponadto tempo zwiększania się zapadalności na półpasiec wraz z wiekiem jest podobne do obserwowanego w krajach, w których prowadzono powszechne szczepienia dzieci przeciwko ospie wietrznej, oraz w krajach, w których nie wprowadzono takich programów.58-60 Sugeruje to, że egzogenna ekspozycja na VZV nie jest konieczna do utrzymania odporności i ograniczenia zwiększającej się z wiekiem zachorowalności na półpasiec. Zaobserwowano również, że zachorowalność na półpasiec u mnichów i mniszek klauzurowych, którzy nie mają żadnego kontaktu z dziećmi, jest taka sama jak w populacji ogólnej (grupa kontrolna), co wskazuje, że endogenne stymulowanie odporności jest wystarczające do zapobiegania półpaścowi.61
Epidemiologia półpaśca
Ryzyko zachorowania na półpasiec w ciągu całego życia wynosi >30%. Na świecie zapadalność na półpasiec ogółem wynosi 3–5/1000 osobolat,58 natomiast u osób w wieku ≥50 lat aż 5,23–10,9/1000 osobolat.62 Szacunki te opierają się jednak na danych pochodzących tylko z kilku krajów. W USA każdego roku notuje się >1 mln zachorowań na półpasiec.64,91 Zarówno zapadalność na półpasiec, jak i jego nasilenie zwiększają się wraz z wiekiem – do ukończenia 85. roku życia na półpasiec zachoruje 50% osób,15,58,65,66 a powikłania rozwiną się niemal u połowy osób starszych chorych na półpasiec.58 Nie wiadomo dokładnie, jakie cechy odróżniają chorych na półpasiec od osób, które nigdy na niego nie zachorują, jednak istotną rolę na pewno odgrywa wiek, starzenie się układu immunologicznego i uwarunkowania genetyczne.15,67-77
Wyniki wielu badań epidemiologicznych wskazują, że nawet w krajach, w których dzięki szczepieniom przeciwko ospie wietrznej praktycznie wyeliminowano tę chorobę, od 70 lat zwiększa się zachorowalność na półpasiec wśród osób starszych.49-57 Wskazuje to, że za utrzymanie odpowiedniej VZV-CMI u osób starszych odpowiada jej endogenne wzmacnianie przez zatrzymanie reaktywacji, a nie wzmacnianie egzogenne w wyniku kontaktu z chorym na ospę wietrzną (p. ryc. 2). Obserwowane w ostatnich latach w USA zmniejszenie zachorowalności na półpasiec u dzieci w wieku do 18 lat i starszych dorosłych w wieku ≥60 lat wynika ze stosowania szczepionki przeciwko ospie wietrznej (utajony szczepionkowy szczep Oka VZV [vOka] rzadziej ulega reaktywacji niż utajony dziki VZV) oraz szczepionek przeciwko półpaścowi.55-57,78
Konsekwencje półpaśca i nerwobólu popółpaścowego
Półpasiec i jego powikłania mogą znacznie pogarszać jakość życia79 i prowadzić do nieodwracalnej utraty samodzielności. Najczęstszym i najbardziej uciążliwym powikłaniem półpaśca jest PHN charakteryzujący się utrzymywaniem się bólu neuropatycznego i dysestezji przez tygodnie, miesiące, a nawet lata po ustąpieniu osutki.80-84 Zapadalność na PHN wyraźnie zwiększa się wraz z wiekiem.80,81,85 Na świecie ryzyko rozwoju PHN wynosi 5 do >30% (w zależności od metodyki badania, rozkładu grup wiekowych i definicji PHN),58 przy czym u >30% pacjentów z PHN ból utrzymuje się przez >1 rok.58 Inne ciężkie powikłania półpaśca obejmują zajęcie oczu, objawy neurologiczne i udar mózgu.34,86 Szacuje się, że w USA zachorowania na półpasiec wiążą się z utratą >60 000 lat życia skorygowanych o jakość i 2,4 miliarda USD w związku z bezpośrednimi kosztami leczenia i zmniejszeniem produktywności.87
Przewlekły ból neuropatyczny w PHN jest często oporny na leczenie88 i może poważnie upośledzać jakość życia oraz sprawność funkcjonalną.79 Pacjenci z PHN często zgłaszają zaburzenia snu, przewlekłe zmęczenie, zmniejszenie masy ciała, zmniejszenie łaknienia, niepokój i depresję. PHN ogranicza też zdolność do codziennego funkcjonowania.79,84,89 Zwiększająca się wraz z wiekiem zachorowalność na półpasiec oraz występowanie uciążliwych powikłań stały się impulsem do opracowania szczepionek chroniących osoby starsze przed tą chorobą.
Aktualne szczepionki przeciwko półpaścowi oraz ich skuteczność
Przełomowe obserwacje i hipotezy Hope-Simpsona,15 a także opracowanie i ocena vOka szczepionki przeciwko ospie wietrznej przez Takahashiego i wsp.18,25,92 przyczyniły się do opracowania i upowszechnienia bezpiecznych i skutecznych szczepionek przeciwko ospie wietrznej i półpaścowi.
Aktualnie zarejestrowane są 2 szczepionki przeciwko półpaścowi (p. tab. 1):
- „żywa” zawierająca atenuowany szczep Oka VZV (ZVL [nazwa handlowa Zostavax]) oraz
- rekombinowana zawierająca glikoproteinę E (gE) VZV (RZV [nazwa handlowa Shingrix]).
W 2006 roku amerykański Advisory Committee on Immunization Practices (ACIP) zalecił rutynowe szczepienie z użyciem ZVL dorosłych w wieku ≥60 lat w celu zapobiegania półpaścowi i jego powikłaniom, zwłaszcza PHN. W 2018 roku dokonano rewizji zaleceń i wskazano, że w szczepieniu dorosłych w wieku ≥50 lat bez niedoborów odporności preferuje się RZV, ponieważ preparat ten charakteryzuje się większą skutecznością.90
| Tabela 1. Szczepionki przeciwko półpaścowi zarejestrowane w USAa | ||
|---|---|---|
| „Żywa” szczepionka przeciwko półpaścowi (nazwa handlowa Zostavax) | Rekombinowana szczepionka przeciwko półpaścowi (nazwa handlowa Shingrix) | |
| typ szczepionki | „żywa” zawierająca atenuowany szczep Oka VZV (≥19 400 PFU) | podjednostkowa, zawierająca rekombinowaną gE VZV, z adiuwantem |
| skład szczepionki | – proszek (liofilizowana szczepionka) – jałowy rozpuszczalnik | – proszek (liofilizowany antygen gE) – zawiesina adiuwantu AS01B |
| warunki przechowywania | przechowywać w temp. od -50 do -15°C | przechowywać w temp. 2–8°C |
| okres ważności | 18 mies. od daty produkcji, pod warunkiem że jest przechowywania w temp. ≤-15°C | 36 mies. od daty produkcji, pod warunkiem że jest przechowywania w temp. 2–8°C |
| dawkowanie i sposób podawania | 1 dawka (0,65 ml), podskórnie, w okolicę mięśnia naramiennego | 2 dawki w odstępie 2–6 mies., każda po 0,5 ml, domięśniowo, w okolicę mięśnia naramiennego |
| reaktogenność | mała | duża |
| skuteczność w zapobieganiu półpaścowi | 51,3% | 97,2% |
| skuteczność w zapobieganiu PHN | 66,5% | 91,2% |
| czas utrzymywania się ochrony przed półpaścem | do 8 lat | ≥10 lat (maks. czas obserwacji w badaniach wynosił 10 lat) |
| rejestracja przez FDAa | – 25 maja 2006 r. dla dorosłych w wieku ≥60 lat – 24 marca 2011 r. dla dorosłych w wieku 50–59 lat |
– 20 października 2017 r. dla dorosłych w wieku ≥50 lat – 23 lipca 2021 r. dla dorosłych w wieku ≥18 lat, którzy są lub będą narażeni na zwiększone ryzyko zachorowania na półpasiec z powodu niedoboru odporności lub immunosupresji w związku z chorobą lub terapią |
| zalecenia ACIP | do stosowania u dorosłych w wieku ≥60 lat bez niedoborów odporności | do stosowania u: – dorosłych w wieku ≥50 lat bez niedoborów odporności – dorosłych w wieku ≥50 lat bez niedoborów odporności, którzy otrzymali wcześniej Zostavax szczepionka Shingrix jest preferowana w porównaniu z Zostavax (osobom, które uprzednio otrzymały Zostavax, Shingrix można podać po upływie ≥8 tyg.) |
| a EMA zarejestrowała szczepionkę Zostavax w krajach UE w grudniu 2019 r., a szczepionkę Shingrix w marcu 2018 r. Aktualnie w Polsce dostępna jest tylko szczepionka Shingrix – przyp. red. ACIP – Advisory Committee on Immunization Practices, FDA – Food and Drug Administration, gE – glikoproteina E, PFU – jednostka tworząca łysinkę, PHN – nerwoból popółpaścowy, VZV – wirus ospy wietrznej i połpaśca | ||
Wyzwanie związane ze szczepieniem przeciwko półpaścowi
Większość szczepionek, w tym przeciwko ospie wietrznej, podaje się osobom podatnym przed zakażeniem danym patogenem. Szczepionki wywołują wówczas odporność, która zapobiega pierwotnemu zakażeniu lub chorobie. Natomiast szczepienie przeciwko półpaścowi wykonuje się u osób, które przeszły już zakażenie VZV i nabyły silną odporność przeciwko ospie wietrznej, ale są nosicielami utajonego VZV, który może ulec reaktywacji i wywołać półpasiec.18,91 Aby szczepionka przeciwko półpaścowi była skuteczna, musi działać jak „szczepionka terapeutyczna”, tzn. aby zapobiec reaktywacji utajonego VZV u osoby już zakażonej, która nabyła odporność na VZV, musi wywoływać silniejszą odpowiedź immunologiczną.
„Żywa” szczepionka przeciwko półpaścowi
Zespół naukowców pod kierownictwem Takahashiego wyizolował szczep Oka VZV od pochodzącego z Japonii ogólnie zdrowego dziecka, które zachorowało na ospę wietrzną. Następnie szczep poddano atenuacji przez wielokrotne pasażowanie w komórkach ludzkich i świnek morskich w temperaturze 34°C.18,92-94 Dzięki temu uzyskano wrażliwy na temperaturę, „żywy”, atenuowany szczepionkowy szczep Oka VZV (vOka). W badaniach klinicznych prowadzonych w Japonii, a następnie w USA, wykazano bezpieczeństwo, immunogenność i skuteczność kliniczną vOka u dzieci i dorosłych z prawidłową i obniżoną odpornością.37,95-107 Doprowadziło to do zarejestrowania w 1995 roku w USA „żywej”, atenuowanej szczepionki przeciwko ospie wietrznej zawierającej vOka i ostatecznie do wydania w 2007 roku przez tamtejsze Centers for Disease Control and Prevention zalecenia rutynowego szczepienia przeciwko ospie wietrznej dzieci w schemacie 2-dawkowym.25,108 Dzięki temu w USA wyszczepialność przeciwko ospie wietrznej w populacji zdrowych dzieci wynosi obecnie >90%, a zachorowalność na ospę wietrzną i liczba zgonów z jej powodu zmniejszyły się o >90% (p. Skuteczność rzeczywista szczepionki przeciwko ospie wietrznej – przyp. red.).25,49,109-111
Wyniki te stały się podstawą rozpoczęcia dużego badania z randomizacją (RCT) o akronimie SPS (Shingles Prevention Study), którego celem była ocena hipotezy Hope-Simpsona15 zakładającej, że poprawa zmniejszającej się z wiekiem VZV-CMI dzięki szczepieniom uchroni starsze osoby przed półpaścem i jego powikłaniami, zwłaszcza PHN.91 Ponieważ niemal wszyscy dorośli są odporni na ospę wietrzną, ilość vOka w szczepionce przeciwko półpaścowi zwiększono >14-krotnie w porównaniu ze szczepionką przeciwko ospie wietrznej.91
Badanie SPS przeprowadzono metodą podwójnie ślepej próby z placebo w grupie kontrolnej, w 22 ośrodkach zlokalizowanych w kontynentalnych USA. Wzięło w nim udział 38 546 dorosłych w wieku ≥60 lat, przydzielonych losowo do jednej z 2 grup, w których otrzymali: 1 dawkę ZVL podskórnie lub placebo.91 Wykazano, że ZVL zmniejszyła: o 61,1% „obciążenie związane z zachorowaniem na półpasiec” (główny punkt końcowy, klinicznie istotna miara ciężkości choroby określona na podstawie oceny nasilenia bólu wywołanego półpaścem w czasie112), o 66,5% „zapadalność na klinicznie istotny PHN” (ból i dyskomfort związany z półpaścem oceniany na ≥3 pkt w 10-punktowej skali i utrzymujący się przez >90 dni po wystąpieniu osutki) oraz o 51,3% ryzyko zachorowania na półpasiec.91 W analizie przeprowadzonej w podgrupach wykazano, że skuteczność ZVL w zapobieganiu półpaścowi wyniosła 64% u osób w wieku 60–69 lat, ale tylko 37,6% u osób w wieku ≥70 lat. Choć redukcja zapadalności na PHN wynikała głównie ze zmniejszenia zapadalności na półpasiec u osób szczepionych, to jednak ZVL zmniejszyła również ryzyko PHN o 31% u osób, które zachorowały na półpasiec mimo szczepienia, a ten korzystny efekt obserwowano głównie u pacjentów w wieku ≥70 lat, obarczonych największym ryzykiem tego powikłania. Ponadto ZVL znacznie zmniejszyła niekorzystny wpływ półpaśca na jakość życia i codzienne funkcjonowanie.113 Miejscowe niepożądane odczyny poszczepienne (NOP) częściej występowały u osób szczepionych niż w grupie placebo, jednak zazwyczaj miały one łagodne nasilenie. Poważne zdarzenia niepożądane oraz hospitalizacje i zgony występowały z podobną częstością w obu grupach.91,114
Na podstawie wyników tego badania w maju 2006 roku amerykański Food and Drug Administration (FDA) zarejestrował ZVL, a w październiku 2006 roku ACIP zalecił jej rutynowe stosowanie w profilaktyce półpaśca i jego powikłań, głównie PHN, u osób w wieku ≥60 lat bez przeciwwskazań do szczepienia.64 Zalecenie to dotyczyło wszystkich dorosłych, niezależnie od tego, czy wcześniej chorowali na półpasiec.64 Jego zasadność potwierdzono w 2 kolejnych badaniach.115,116
W RCT o akronimie ZEST (Zostavax Efficacy and Safety Trial)117 z placebo w grupie kontrolnej, w którym uczestniczyło 22 439 osób w wieku 50–59 lat, wykazano, że w okresie obserwacji wynoszącym średnio 1,3 roku ZVL zmniejszała ryzyko zachorowania na półpasiec o 69,8%. Profil bezpieczeństwa szczepionki był podobny do obserwowanego w badaniu SPS, choć miejscowe NOP występowały częściej (49,5%), co odzwierciedla silniejszą odpowiedź immunologiczną na ZVL u młodszych osób.91,114,118,119
Na podstawie wyników tego badania FDA rozszerzyła wskazania wiekowe do stosowania ZVL u osób w wieku ≥50 lat. Jednak ACIP nie zmienił swoich zaleceń, obawiając się zmniejszania skuteczności szczepionki wraz z upływem czasu, co naraziłoby osoby zaszczepione już w wieku 50–59 lat na zachorowanie na półpasiec w późniejszym wieku, a także skutkowało zwiększeniem ryzyka choroby o ciężkim przebiegu i niepomyślnym bilansem korzyści i ryzyka.120 W 2021 roku ZVL usunięto z kalendarza szczepień dla dorosłych, ponieważ nie jest już dostępna w USA.121 Jednak nadal jest i będzie dostępna w wielu innych krajach na świecie.
Utrzymywanie się skuteczności ZVL
Skuteczność ZVL zmniejsza się wraz z upływem czasu. W badaniu SPS wykazano, że skuteczność szczepionki w odniesieniu do ocenianych punktów końcowych otrzymywała się przez 4 lata.91 W 2 kolejnych badaniach obejmujących uczestników badania SPS skuteczność ZVL oceniono w 11-letniej obserwacji.122,123 Wykazano, że skuteczność ZVL wobec „obciążenia związanego z zachorowaniem na półpasiec” zmniejszyła się z 61,1 do 37,3%, skuteczność w zapobieganiu PHN zmniejszyła się z 66,5 do 35,4%, a skuteczność w zapobieganiu półpaścowi z 51,3 do 21,1%. Ogółem skuteczność szczepionki w odniesieniu do obciążenia związanego z zachorowaniem na półpasiec i zapobiegania PHN utrzymywała się do 10 lat, a skuteczność w zapobieganiu półpaścowi do 8 lat.
Skuteczność rzeczywistą ZVL w zapobieganiu półpaścowi, półpaścowi ocznemu i PHN w populacji ogólnej potwierdzono także w kilku badaniach obserwacyjnych z prospektywnym i retrospektywnym zbieraniem danych.124-132 W większości z nich skuteczność rzeczywista ZVL była podobna do obserwowanej w RCT o akronimie SPS, choć w 1 dużym badaniu kohortowym z prospektywnym zbieraniem danych wykazano, że skuteczność szczepionki w zapobieganiu zachorowaniom na półpasiec u osób w wieku ≥80 lat i 60–79 lat była podobna.130
W badaniach obserwacyjnych, podobnie jak w RCT, skuteczność ZVL w zapobieganiu PHN była większa niż w zapobieganiu zachorowaniom na półpasiec, co sugeruje, że zapobieganie PHN jest dodatkową korzyścią ze szczepienia (i nie wynika tylko ze zmniejszenia ryzyka zachorowania na półpasiec).129-131
ZVL zmniejsza również nasilenie i czas utrzymywania się PHN, a także ryzyko innych powikłań u osób, które mimo szczepienia zachorowały na półpasiec, takich jak półpasiec oczny. Największa redukcja ryzyka dotyczy półpaśca o najcięższym przebiegu i hospitalizacji z powodu półpaśca.129,132
Rekombinowana, podjednostkowa szczepionka przeciwko półpaścowi
Rekombinowaną, podjednostkową szczepionkę przeciwko półpaścowi (RZV), zawierającą rekombinowaną glikoproteinę E (gE) VZV i system adiuwantowy AS01B, opracowała belgijska firma GlaxoSmithKline Vaccines. gE VZV jest najbardziej rozpowszechnioną glikoproteiną w wirionach wirusa i zakażonych komórkach. Jest niezbędna do replikacji wirusa i jego rozprzestrzeniania się między komórkami, a także jest głównym celem odpowiedzi limfocytów T CD4+ swoistych dla VZV.133,134 System adiuwantowy AS01B oparty na liposomach zawiera 2 immunostymulatory: (1) monofosforylolipid A, agonistę receptorów TLR4, który stymuluje transkrypcję NF-κB i wytwarzanie cytokin, a także aktywuje komórki prezentujące antygen oraz (2) QS-21, naturalną saponinę, która promuje odpowiedzi związane z wytwarzaniem przeciwciał swoistych dla antygenu i aktywnością limfocytów T CD4+.135,136
Skuteczność RZV w zapobieganiu półpaścowi i PHN u dorosłych w wieku ≥50 lat oceniono w 2 RCT z placebo w grupie kontrolnej (badanie ZOE-50137 i ZOE-70138) przeprowadzonych w ośrodkach zlokalizowanych w 18 krajach w Ameryce Północnej, Europie, Azji, Australii i Ameryce Łacińskiej. Wykazano w nich, że RZV zmniejsza ryzyko zachorowania na półpasiec o 97,2% u dorosłych w wieku ≥50 lat137 i o 89,8% u dorosłych w wieku ≥70 lat.138 W zbiorczej analizie danych z obu badań obejmującej 16 596 osób w wieku ≥70 lat wykazano, że skuteczność RZV w zapobieganiu zachorowaniom na półpasiec wyniosła 91,3%, a w zapobieganiu PHN – 88,8%. W obu RCT skuteczność RZV w zapobieganiu zachorowaniom na półpasiec była podobna w zależności od wieku i utrzymywała się przez cały okres obserwacji wynoszący średnio 3,7 roku.
RZV charakteryzowała się większą reaktogennością niż placebo, a najczęściej obserwowanymi zdarzeniami niepożądanymi były reakcje miejscowe (ból, zaczerwienienie, obrzęk) oraz ból mięśni i zmęczenie.137-139 W zbiorczej analizie danych z badania ZOE-50 i ZOE-70, obejmującej łącznie 14 645 osób, którym podano RZV, i 14 660 osób, którym podano placebo, otrzymano podobne wyniki. Ogółem w ciągu 30 dni po szczepieniu zdarzenia niepożądane występowały częściej w grupie szczepionej niż placebo (50,5 vs 32,0%), głównie były to typowe reakcje miejscowe i ogólnoustrojowe. Najczęstszym miejscowym NOP był ból, który wystąpił odpowiednio u 68,1 i 6,9% osób, przy czym ból utrudniający codzienną aktywność dotyczył zaledwie 3,8 i 0,2% osób. Częstość ciężkich zdarzeń niepożądanych, w tym zgonów i potencjalnych chorób o podłożu immunologicznym, była podobna w obu grupach.140
W październiku 2017 roku FDA zarejestrował RZV (Shingrix) do stosowania w profilaktyce półpaśca u dorosłych w wieku ≥50 lat (p. tab. 1). Pełny schemat szczepienia obejmował podanie domięśniowo 2 dawek w odstępie 2–6 miesięcy. Następnie ACIP wydał zalecenie szczepienia przeciwko półpaścowi z użyciem RZV w schemacie 2-dawkowym: (1) dorosłych w wieku ≥50 lat bez niedoborów odporności oraz (2) dorosłych bez niedoborów odporności, którzy uprzednio otrzymali ZVL. Uznano, że preferowana jest szczepionka RZV, w porównaniu z ZVL.90 W lipcu 2021 roku FDA rozszerzyła wskazania rejestracyjne RZV o profilaktykę półpaśca u osób w wieku ≥18 lat z grup ryzyka tej choroby z powodu niedoboru odporności lub immunosupresji związanej z chorobą lub terapią (p. www.fda.gov/vaccines-blood-biologics/vaccines/shingrix [dostęp: 09.08.2021]).
W wieloośrodkowym RCT przeprowadzonym metodą próby otwartej wykazano, że 2 dawki RZV podawane w odstępie 2 miesięcy dorosłym w wieku ≥50 lat z rozpoznanym przez lekarza półpaścem w wywiadzie są bezpieczne i immunogenne,141 co potwierdziło zalecenia ACIP dotyczące szczepienia dorosłych po przechorowaniu półpaśca.90
W badaniu kohortowym, w którym porównano osoby w wieku ≥65 lat szczepione i nieszczepione przeciwko półpaścowi objęte publicznym programem ubezpieczenia zdrowotnego w USA, wykazano, że 2 dawki RZV zmniejszały ryzyko zachorowania na półpasiec o 70,1%, a 1 dawka o 56,9%. Skuteczność 2 dawek była podobna u osób w wieku ≥80 lat lub nawet gdy drugą dawkę podano ≥180 dni po pierwszej dawce.142 Skuteczność 2 dawek RZV w zapobieganiu PHN wyniosła 76%, a w zapobieganiu półpaścowi ocznemu – 66,8%.142 Skuteczność pełnego schematu szczepienia z użyciem RZV wyniosła 64,1% u pacjentów z przewlekłymi stanami upośledzającymi odporność lub przyjmujących leki immunosupresyjne, podczas gdy u osób immunokompetentnych – 70,9% i była także podobna u pacjentów z chorobami autoimmunizacyjnymi.142
W badaniu kohortowym z retrospektywnym zbieraniem danych za lata 2018–2019, obejmującym populację 4 769 819 osób w wieku >50 lat, z których 3,6% otrzymało 2 dawki RZV, wykazano, że w okresie7-miesięcznej obserwacji u osób w wieku 50–79 lat skuteczność szczepionki w zapobieganiu półpaścowi wyniosła 85,5%. U osób w wieku ≥80 lat wyniosła 80,2% i była podobna do wyników uzyskanych w RCT ZOE-70 (89,8%).143
Utrzymywanie się skuteczności RZV
W wielu badaniach fazy I, I/II i II134,144-146 wykazano, że u osób w wieku ≥50 lat 2 dawki RZV podawane w odstępie 1 lub 2 miesięcy były dobrze tolerowane i znacznie silniej indukowały wytwarzanie limfocytów T CD4+ swoistych dla VZV i gE VZV oraz swoistych przeciwciał anty-VZV niż ZVL.134 Wyniki te miały swoje odzwierciedlenie w badaniu, w którym bezpośrednio porównano odpowiedź immunologiczną na ZVL i RZV. Wykazano w nim, że RZV silniej stymuluje odpowiedź komórkową i humoralną swoistą dla VZV i gE VZV niż ZVL.147,148 Stężenie swoistych przeciwciał anty-gE i nasilenie odpowiedzi CMI swoistych dla gE VZV (ocena na podstawie liczby limfocytów T CD4+ wykazujących ekspresję ≥2 z 4 markerów aktywacji [interferon-γ, interleukina-2, czynnik martwicy nowotworów α [TNF-α], ligand CD40])134 utrzymywały się przez 6 lat po szczepieniu.146,149 W 9. roku po szczepieniu mediana odpowiedzi limfocytów T CD4+ swoistych dla gE i mediana stężenia swoistych przeciwciał anty-gE były podobne do obserwowanych w 6. roku po szczepieniu (były odpowiednio 3,4 i 7,4-krotnie większe niż przed szczepieniem).150 Po 10 latach mediana liczby limfocytów T CD4+ i stężenia swoistych przeciwciał anty-gE były odpowiednio 3,3- i 5,9-krotnie większe niż przed szczepieniem.151,152 Zaobserwowano jednak, że u ≥25% osób w starszym wieku odpowiedź CMI zmniejszała się wraz z upływem czasu (p. ryc. 1C w 150. pozycji piśmiennictwa), a w ciągu pierwszych 4 lat odpowiedź komórkowa i humoralna znacznie się zmniejszyły u wszystkich osób szczepionych RZV.150,152 Wskazuje to, że w celu zapewnienia długotrwałej ochrony poszczepiennej konieczne może być podanie dawki przypominającej RZV, zwłaszcza u osób starszych.
Szczepienie przypominające przeciwko półpaścowi
Aby wzmocnić VZV-CMI i tym samym odwrócić zjawisko zmniejszania się skuteczności ZVL, dawkę szczepionki podano 201 dorosłym w wieku ≥70 lat, którzy 10 lat wcześniej otrzymali szczepienie podstawowe, oraz 199 dorosłym dotąd nieszczepionym z ujemnym wywiadem w kierunku półpaśca. Wykazano, że po podaniu drugiej dawki ZVL (przypominającej) odpowiedź VZV-CMI była bardziej nasilona przed szczepieniem niż odpowiedź VZV-CMI u osób szczepionych po raz pierwszy, a różnica ta utrzymywała się przez rok po szczepieniu.153,154
Wykazano także, że podanie 2 dawek RZV osobom w wieku ≥65 lat, które ≥5 lat wcześniej otrzymały ZVL, było bezpieczne, a stężenie swoistych przeciwciał anty-gE i limfocytów T CD4 swoistych dla gE były podobne jak u osób zaszczepionych tylko RZV i utrzymywały się przez ≥12 miesięcy po drugiej dawce.155,156 Podobne były także profile markerów aktywacji.155,156 Nie oceniono krótszych odstępów między ZVL a RZV (<5 lat), jednak nie ma powodu by sądzić, że takie postępowanie będzie zwiększać ryzyko zdarzeń niepożądanych lub będzie mniej immunogenne. W związku z tym ACIP wydał zalecenie, aby dorosłym w wieku ≥50 lat, którzy ≥8 tygodni wcześniej otrzymali ZVL, podać również RZV.90
W badaniu kohortowym obejmującym populację osób w wieku ≥65 lat objętych publicznym programem ubezpieczenia w USA wykazano, że podanie 2 dawek RZV ≥5 lat po ZVL, w porównaniu z podaniem jedynie ZVL, zmniejszało ryzyko zachorowania na półpasiec tylko o 63%. Wskazuje to na ochronne działanie ZVL w grupie kontrolnej.142
W niedużym badaniu obejmującym 62 osoby oceniono bezpieczeństwo i immunogenność 2 dawek RZV podanych 10 lat po 2-dawkowym schemacie podstawowym. Wykazano, że miano swoistych przeciwciał anty-gE oraz liczba limfocytów T CD4+ swoistych wobec gE znacznie się zwiększyły i były większe niż po schemacie podstawowym.152 Zaobserwowano jednak, że aby osiągnąć ten efekt, wystarczy podać 1 dawkę przypominającą RZV (druga dawka nie zwiększała immunogenności).152
Szczepienie przeciwko półpaścowi u osób z niedoborami odporności
Chociaż półpaśca można leczyć za pomocą leków przeciwwirusowych, szczepienie przeciwko półpaścowi jest szczególnie ważne u osób z niedoborami odporności, ponieważ należą one do grupy ryzyka ciężkiego przebiegu tej choroby i rozwoju powikłań,157,158 a nawet wcześnie rozpoczęta terapia nie zapobiega rozwojowi PHN. ACIP zaleca szczepienie przeciwko półpaścowi z użyciem ZVL lub RZV osób, które przyjmują leki immunosupresyjne w małej dawce (np. prednizon w dawce <20 mg/24 h, inne glikokortykosteroidy [GKS] w równoważnej dawce, GKS wziewnie lub miejscowo), prawdopodobnie w przyszłości będą w immunosupresji lub przebyły chorobę związaną z upośledzeniem odporności.90 W RCT dotyczących oceny skuteczności klinicznej szczepionek przeciwko półpaścowi (badania: SPS, ZOE-50 i ZOE-70) nie uczestniczyły osoby z niedoborami odporności oraz przyjmujące leki immunosupresyjne w umiarkowanej lub dużej dawce.91,137,138 W lipcu 2021 roku FDA zarejestrował RZV do stosowania u osób w wieku ≥18 lat, które z powodu niedoboru odporności lub immunosupresji związanej z chorobą lub terapią należą do grupy ryzyka zachorowania na półpasiec (p. www.fda.gov/vaccinesblood-biologics/vaccines/shingrix [dostęp: 09.08.2021]).
„Żywa” szczepionka przeciwko półpaścowi
ZVL, podobnie jak szczepionka przeciwko ospie wietrznej i inne „żywe” szczepionki, jest przeciwwskazana u pacjentów z niedoborami odporności ze względu na teoretyczne ryzyko zakażenia wirusem szczepionkowym i ciężkiej choroby. Jednak >95% dorosłych w USA i w większości innych krajów o wysokich dochodach przechorowało ospę wietrzną w dzieciństwie. Zatem istnieje szansa utrzymywania się resztkowej VZV-CMI, co zmniejszyłoby ryzyko zdarzeń niepożądanych w wyniku replikacji i rozsiewu vOka.158,159 Mimo przeciwwskazań w ramach rutynowych szczepień ZVL podawano wielu dorosłym z niedoborami odporności125,159-168 i odnotowano niewielką liczbę ciężkich zdarzeń niepożądanych.
Bezpieczeństwo i immunogenność ZVL potwierdzono u pacjentów w wieku ≥18 lat ze schyłkową niewydolnością nerek, którym szczepionkę podano przed przeszczepieniem nerki.169 U dializowanych pacjentów w wieku ≥60 lat ze schyłkową niewydolnością nerek ZVL zmniejszała ryzyko półpaśca o 51%.170 Ogółem skuteczność ZVL u osób z niedoborami odporności była podobna do obserwowanej u immunokompetentnych osób w tym samym wieku, ale była większa u pacjentów dializowanych od <2 lat niż u pacjentów dializowanych od dłuższego czasu i wyniosła odpowiednio 72 i 36%.170
Ponieważ ZVL jest przeciwwskazana u osób z niedoborami odporności, opracowano szczepionki przeciwko półpaścowi zawierające vOka inaktywowane ciepłem (ZVHT) lub promieniowaniem γ, które w ramach badania klinicznego podawano dorosłym z niedoborem odporności (p. tab. 1 w materiałach uzupełniających).171-178 Wykazano, że obie szczepionki były dobrze tolerowane, ale ich immunogenność różniła się w zależności od choroby podstawowej i stosowanego leczenia. ZVHT nie wywoływała odpowiedzi humoralnej u osób po autologicznym lub allogenicznym przeszczepieniu macierzystych komórek krwiotwórczych (HSCT), a odpowiedź limfocytów T była słaba u osób po allogenicznym HSCT.173 Skuteczność ZVIN w zapobieganiu półpaścowi i PHN u biorców autologicznego HSCT i pacjentów z guzami litymi była podobna do skuteczności ZVL176,177 i wynosiła 83,7%,176 natomiast nie zapobiegała półpaścowi u pacjentów z nowotworami złośliwymi układu krwiotwórczego.177,178
Rekombinowana szczepionka przeciwko półpaścowi
RZV oceniono w badaniach obejmujących pacjentów z różnymi stanami upośledzającymi odporność179-185 (p. tab. 1 w materiałach uzupełniających). Podawano ją także osobom w immunosupresji w ramach rutynowych szczepień.142 Bezpieczeństwo i immunogenność RZV potwierdzono u biorców autologicznego HSCT,179 pacjentów z guzami litymi przed chemioterapią lub w jej trakcie,183 z nowotworami układu krwiotwórczego w trakcie terapii immunosupresyjnej lub po jej zakończeniu182 oraz u osób po przeszczepieniu nerki przewlekle przyjmujących leki immunosupresyjne.184 Humoralna i komórkowa odpowiedź immunologiczna utrzymywała się przez ≥1 rok po szczepieniu.179,182-184 Wykazano także, że podanie 2 dawek RZV 9–24 miesięcy po allogenicznym HSCT było bezpieczne i nie zwiększało ryzyka choroby przeszczep przeciwko gospodarzowi (teoretyczne ryzyko związane z silnie działającym adiuwantem AS01B).186 W okresie obserwacji wynoszącym 11,1 miesiąca skuteczność RZV w zapobieganiu zachorowaniom na półpasiec u pacjentów z nowotworami układu krwiotwórczego wyniosła 87,2%.182 W RCT III fazy o akronimie ZOE_HSCT obejmującym 1846 pacjentów po niedawnym autologicznym HSCT wykazano, że w 21-miesięcznej obserwacji skuteczność RZV w zapobieganiu zachorowaniom na półpasiec wyniosła 68,2%181 i była podobna do skuteczności ZVL w analogicznej populacji (63,8%).176 RZV zmniejszyła również niekorzystny wpływ półpaśca na jakość życia u biorców HSCT.185
Szczepienie przeciwko półpaścowi osób zakażonych HIV
Osoby zakażone ludzkim wirusem niedoboru odporności (HIV) są znacznie bardziej narażone na zachorowanie na półpasiec, rozwój jego powikłań oraz nawrót choroby niż populacja ogólna.157,187 Powikłania półpaśca występują około 3-krotnie częściej u osób zakażonych HIV niż w populacji ogólnej w tym samym wieku.180 Aktualnie ani ACIP, ani Światowa Organizacja Zdrowia (WHO) nie wydali zaleceń dotyczących szczepienia przeciwko półpaścowi osób zakażonych HIV, nawet z liczbą limfocytów T CD4 ≥200/µl.188 Wytyczne Infectious Diseases Society of America (IDSA) dotyczące szczepienia osób z niedoborami odporności uwzględniają szczepienie przeciwko półpaścowi – ZVL zalecana jest osobom w wieku ≥60 lat z bezobjawowym zakażeniem HIV, u których liczba limfocytów T CD4 wynosi ≥200/µl i które są serododatnie względem VZV.189 Podobnie British HIV Association zaleca szczepienie przeciwko półpaścowi z użyciem ZVL osobom w wieku ≥70 lat z bezobjawowym zakażeniem HIV, serododatnim względem VZV, u których liczba limfocytów T CD4 wynosi ≥200/µl.190 Zgodnie z najnowszą aktualizacją wytycznych HIV Medicine Association IDSA dotyczących podstawowej opieki zdrowotnej u osób zakażonych HIV zaleca się szczepienie szczepionką RZV w schemacie 2-dawkowym wszystkich osób zakażonych HIV w wieku ≥50 lat z liczbą limfocytów T CD4 wynoszącą ≥200/µl.191
„Żywa” szczepionka przeciwko półpaścowi
W USA ZVL jest przeciwwskazana u osób zakażonych HIV z liczbą limfocytów T CD4+ <200/µl189 ze względu na teoretyczne ryzyko ciężkiej choroby wywołanej przez atenuowany vOka. Dorośli zakażeni HIV z liczbą limfocytów T CD4+ >400/µl i liczbą kopii RNA HIV <1000/ml dobrze tolerowali szczepienie 2 dawkami szczepionki przeciwko ospie wietrznej, jednak jej immunogenność była umiarkowana.192 Z kolei u dorosłych zakażonych HIV z liczbą limfocytów T CD4+ ≥200/µl 4 dawki ZVHT indukowały słabą, choć istotną odpowiedź limfocytów T oraz swoistych przeciwciał anty-VZV i charakteryzowały się korzystnym profilem bezpieczeństwa.173
Bezpieczeństwo i immunogenność 2 dawek ZVL podanych w odstępie 6 tygodni wykazano u dorosłych w wieku ≥18 lat zakażonych HIV, serododatnich względem VZV, będących w trakcie terapii przeciwretrowirusowej (ART), u których liczba limfocytów T CD4+ wynosiła ≥200/µl, a liczba kopii RNA HIV <75/ml.193
Mimo dowodów na bezpieczeństwo i immunogenność ZVL u zakażonych HIV, wyszczepialność w tej populacji była mała, co przynajmniej częściowo wynika z braku jasnych wytycznych.194,195 W analizie wyszczepialności przeciwko półpaścowi z użyciem ZVL wśród zakażonych HIV weteranów w wieku ≥50 lat będących w trakcie ART, z liczbą limfocytów T CD4 ≥200/µl, wykazano, że choć w latach 2006–2015 odsetek zaszczepionych stale się zwiększał, to nadal był o >50% mniejszy niż u niezakażonych weteranów.196
Rekombinowana szczepionka przeciwko półpaścowi
W RCT fazy I/IIa przeprowadzonym metodą podwójnie ślepej próby z placebo uwzględniono 3 grupy pacjentów w wieku ≥18 lat zakażonych HIV: (1) 94 pacjentów w trakcie ART z dużą liczbą limfocytów T CD4+ (≥200/µl), (2) 14 pacjentów w trakcie ART z mała liczbą limfocytów T CD4+ (50–199/µl) oraz (3) 15 pacjentów z dużą liczbą limfocytów T CD4+ (≥500/µl), którzy dotąd nie otrzymali ART.180 We wszystkich 3 grupach wykazano, że szczepienie z użyciem RZV w schemacie 3-dawkowym było bezpieczne i immunogenne, a humoralna i komórkowa odpowiedź immunologiczna utrzymywała się przez ≥1 rok po podaniu trzeciej dawki. Ponadto rok po podaniu trzeciej dawki RZV odpowiedź immunologiczna związana z limfocytami T CD4+ swoistymi dla gE VZV była większa niż po przechorowaniu półpaśca. Nie odnotowano ciężkich NOP. RZV nie miała także wpływu na liczbę kopii RNA HIV lub liczbę limfocytów T CD4+.180
Szczepienie osób z chorobami o podłożu immunologicznym
Ogólnie zaleca się, aby pacjentów z chorobami o podłożu immunologicznym szczepić przed rozpoczęciem leczenia immunosupresyjnego z dwóch powodów: (1) w porównaniu z populacją ogólną, pacjenci z chorobami autoimmunizacyjnymi, takimi jak reumatoidalne zapalenie stawów (RZS), nieswoiste choroby zapalne jelit (IBD) i toczeń rumieniowaty układowy (SLE), są obciążeni większym ryzykiem zachorowania na półpasiec,197 dlatego mogą odnieść korzyść ze szczepienia, (2) leki immunosupresyjne, które przyjmują ci pacjenci, dodatkowo zwiększają ryzyko zachorowania na półpasiec.159 Przykładem może być tofacytynib, lek immunomodulujący, hamujący kinazy janusowe, który 2-krotnie zwiększa ryzyko zachorowania na półpasiec u pacjentów z RZS otrzymujących leki przeciwko TNF-α i inne leki biologiczne.198
„Żywa” szczepionka przeciwko półpaścowi
W kilku badaniach obserwacyjnych z retrospektywnym zbieraniem danych wykazano, że ZVL jest bezpieczna u pacjentów z chorobami autoimmunizacyjnymi, w tym u przyjmujących leki biologiczne, i zmniejsza ryzyko zachorowania na półpasiec.161,163,199,200 Wykazano także, że ZVL była bezpieczna i immunogenna u pacjentów chorych na RZS przyjmujących metotreksat oraz którym 2–3 tygodni po szczepieniu podano tofacytynib.201 Ciężkie zdarzenia niepożądane stwierdzono u 3 z 55 pacjentów leczonych tofacytynibem (5,5%), w tym u 1 pacjenta bez wykładników wcześniejszego zakażenia VZV rozpoznano ospę wietrzną. Ogółem pacjentów obserwowano przez 27 miesięcy po szczepieniu, ale zbyt mała liczba uczestników badania nie pozwalała na ocenę długoterminowej ochrony przed zachorowaniem na półpasiec.202
W RCT z placebo w grupie kontrolnej, w którym oceniono bezpieczeństwo, immunogenność i skuteczność ZVL u 617 dorosłych w wieku ≥50 lat z chorobami autoimmunizacyjnymi otrzymujących leki przeciwko TNF-α, wykazano, że szczepionka była bezpieczna. W czasie 6-tygodniowej obserwacji nie stwierdzono osutki skórnej przypominającej zmiany w przebiegu ospy wietrznej lub półpaśca spowodowanej przez vOka.203 Bezpieczeństwo ZVL potwierdzono też w małym badaniu pilotażowym obejmującym chorych na SLE, w którym w czasie 12-tygodniowej obserwacji nie stwierdzono ciężkich działań niepożądanych ani zaostrzenia choroby podstawowej.204 W innym RCT (faza IV) z placebo w grupie kontrolnej również wykazano, że ZVL jest bezpieczna i immunogenna u pacjentów chorych na SLE.205
Rekombinowana szczepionka przeciwko półpaścowi
Istnieje teoretyczne ryzyko, że adiuwanty, takie jak AS01B, mogą wywołać chorobę autoimmunizacyjną lub zaostrzyć jej przebieg.206
W RCT ZOE-50 i ZOE-70 częstość zaostrzeń u osób z rozpoznaną wcześniej chorobą o podłożu immunologicznym była podobna w grupie otrzymującej RZV i placebo, a odpowiednio 1,6 i 2,4% osób zgłosiło pierwszy epizod innej choroby z tej grupy.140 W zbiorczej analizie danych obu RCT wykazano, że u osób z rozpoznaną wcześniej chorobą o podłożu immunologicznym RZV zmniejszała ryzyko zachorowania na półpasiec o 90,5%, a częstość ciężkich zdarzeń niepożądanych była podobna w grupie szczepionej i placebo.207 Jednak do badań ZOE-50 i ZOE-70 nie kwalifikowano osób, które przyjmowały leki immunosupresyjne lub modyfikujące układ odpornościowy przez >15 kolejnych dni w ciągu 6 miesięcy poprzedzających szczepienie, oraz osób, które przyjmowały prednizon w dawce ≥20 mg/24 h lub inny GKS w równoważnej dawce.
W badaniu kohortowym obejmującym populację osób wieku ≥65 lat korzystających z publicznego programu ubezpieczenia zdrowotnego w USA, szczepionych RZV i nieszczepionych wykazano, że skuteczność szczepionki w zapobieganiu zachorowaniom na półpasiec u osób z chorobami autoimmunizacyjnymi była podobna do skuteczności obserwowanej w populacji ogólnej.142
W 2 badaniach obserwacyjnych z retrospektywnym zbieraniem danych w grupie pacjentów będących pod opieką poradni reumatologicznych zidentyfikowano 762 osoby z ogólnoustrojowymi chorobami reumatycznymi zaszczepione RZV.208,209 W 12-tygodniowym okresie obserwacji zaostrzenie choroby podstawowej wystąpiło odpowiednio u 6,7208 i 16,4%209 badanych, przy czym większość przypadków miała miejsce po podaniu pierwszej dawki RZV (z powodu zaostrzenia choroby część pacjentów mogła odmówić przyjęcia drugiej dawki).208 U 9 pacjentów doszło do zaostrzenia po obu dawkach RZV. W obu badaniach zaostrzenia najczęściej obserwowano u pacjentów z RZS. W pierwszym z nich208 częstość zaostrzeń choroby autoimmunizacyjnej u pacjentów szczepionych RZV była mniejsza niż ogólna częstość zaostrzeń RZS u pacjentów tej przychodni. Natomiast w drugim badaniu209 wykazano, że występowanie zaostrzeń po podaniu RZV związane było z przyjmowaniem GKS w okresie szczepienia. U 18 z 59 pacjentów szczepionych RZV zaostrzenie choroby reumatycznej zbiegło się w czasie ze zmianą sposobu jej leczenia. Według autorów badania RZV może przynieść więcej korzyści pacjentom z chorobami o podłożu immunologicznym, jeśli poda się ją w okresie remisji choroby podstawowej. W obu badaniach wykazano, że RZV była ogólnie dobrze tolerowana, a łagodne miejscowe i ogólnoustrojowe NOP wystąpiły odpowiednio u 12,7 i 8,5% pacjentów.
W badaniu obserwacyjnym z prospektywnym zbieraniem danych oceniono bezpieczeństwo RZV (mediana okresu obserwacji wynosiła 207 dni po każdej z 2 dawek szczepionki) u 67 pacjentów z zespołem jelita drażliwego (IBD).210 Profil bezpieczeństwa szczepionki był podobny do obserwowanego w RCT ZOE-50 i ZOE-70,137,138 przy czym nie odnotowano zachorowań na półpasiec. U 1 pacjenta z wrzodziejącym zapaleniem jelita grubego 3 dni po podaniu drugiej dawki RZV odnotowano ciężkie zaostrzenie choroby.210
W RCT ZOE-50 i ZOE-70 w 30-dniowym okresie obserwacji łącznie u 27 pacjentów szczepionych RZV i 8 pacjentów otrzymujących placebo wystąpił epizod dny moczanowej lub ostrego zapalenia stawów z powodu dny moczanowej.211 U 19 z 35 pacjentów szczepionych RZV i 3 pacjentów otrzymujących placebo był to pierwszy epizod dny moczanowej, natomiast u 8 pacjentów szczepionych RZV i 5 pacjentów otrzymujących placebo było to zaostrzenie wcześniej rozpoznanej choroby.212 W badaniu obserwacyjnym z retrospektywnym zbieraniem danych obejmującym pacjentów z dną moczanową rozpoznaną w jednej poradni reumatologicznej wykazano, że w ciągu 12 tygodni po podaniu RZV do zaostrzenia choroby podstawowej doszło u 18% z nich.209 Zaostrzenia dny moczanowej obserwowano także po podaniu innych szczepionek przeciwko półpaścowi.213
Dane o bezpieczeństwie z nadzoru porejestracyjnego
„Żywa” szczepionka przeciwko półpaścowi
W przeglądzie ogólnoświatowych danych z populacyjnego nadzoru nad bezpieczeństwem ZVL (Zostavax) z okresu pierwszych 10 lat (2006–2016) jej stosowania, w którym rozdystrybuowano >34 mln dawek,214 wykazano, że jej profil bezpieczeństwa był podobny do obserwowanego w RCT i badaniach obserwacyjnych prowadzonych po rejestracji. W niedawno opublikowanym przeglądzie gromadzonych elektronicznie danych dotyczących zdarzeń niepożądanych po podaniu ZVL u dorosłych w wieku 70–79 lat, korzystających z podstawowej opieki zdrowotnej w Australii,215 nie zidentyfikowano żadnych nowych niepokojących sygnałów dotyczących jej bezpieczeństwa.
W 2014 roku Tseng i wsp.216 opisali pierwszy laboratoryjnie potwierdzony przypadek półpaśca wywołanego przez vOka u 68-letniej zdrowej kobiety, która otrzymała ZVL 10 miesięcy wcześniej. Pacjentka całe życie mieszkała w USA, a zatem prawdopodobnie chorowała na ospę wietrzną, choć nie potwierdzono u niej wcześniejszego pierwotnego zakażenia dzikim VZV. Może to być rzadki przypadek półpaśca wywołanego przez vOka u osoby, która nie przeszła zakażenia dzikim VZV przed podaniem ZVL. Z kolei u 49-letniego biorcy przeszczepu nerki 3 tygodnie po podaniu ZVL pojawiła się rozległa osutka skórna spowodowana przez vOka.217 Pacjent otrzymał dożylnie acyklowir i całkowicie wyzdrowiał.
Opublikowano również kilka opisów przypadków zgonów w wyniku rozsianego zakażenia vOka po podaniu ZVL: 2 przypadki dotyczyły pacjentów z przewlekłą białaczką limfocytową,218,219 natomiast 1 dotyczył pacjenta z chorobą układu sercowonaczyniowego, przewlekłą obturacyjną chorobą płuc i RZS,220 który przyjmował m.in. GKS i metotreksat w małych dawkach.
Rekombinowana szczepionka przeciwko półpaścowi
W analizie danych z okresu pierwszych 8 miesięcy stosowania RZV, w którym rozdystrybuowano około 3,2 mln dawek szczepionki, pochodzących z systemu biernego zgłaszania podejrzenia NOP (Vaccine Adverse Event Reporting System – VAERS), wykazano, że profil bezpieczeństwa szczepionki był podobny do profilu obserwowanego w przedrejestracyjnych RCT.137,138
Opublikowano kilka doniesień o ciężkich zdarzeniach niepożądanych po podaniu RZV, w tym kilku zachorowaniach na półpasiec zarówno u osób immunokompetentnych, jak i z niedoborem odporności.222-229 Jednak obserwowany związek miał charakter czasowy i nie potwierdzono, aby ich przyczyną było podanie RZV.
W dużym badaniu obserwacyjnym, przeprowadzonym wspólnie przez FDA, Centers for Medicare and Medicaid Services oraz CDC, oceniono ryzyko zespołu Guillaina i Barrégo (ZGB) po podaniu RZV (wykorzystano dane dotyczące roszczeń pacjentów korzystających z programu publicznego ubezpieczenia w USA).230 Ustalono, że istnieje związek między RZV a ZGB, jednak dostępne dane były niewystarczające, aby ustalić związek przyczynowy. Za sugestią FDA producent RZV zamieścił w Charakterystyce Produktu Leczniczego (ChPL) ostrzeżenie o ryzyku ZGB.230,231
Koadministracja szczepionek przeciwko półpaścowi z innymi szczepionkami
„Żywa” szczepionka przeciwko półpaścowi
Istotnym utrudnieniem realizacji szczepień zalecanych u osób starszych jest fakt, że rzadziej zgłaszają się one na wizyty lekarskie. Dlatego ważne jest, aby podczas jednej wizyty podać więcej niż jedną szczepionkę. FDA i ACIP potwierdziły, że jednoczesne podawanie, w różne okolice anatomiczne, szczepionek „żywych” i inaktywowanych jest bezpieczne i nie ma negatywnego wpływu na ich skuteczność.232
W 1 RCT233 wykazano, że przy jednoczesnym podaniu ZVL i polisacharydowej 23-walentnej szczepionki przeciwko pneumokokom (Pneumovax23) miano swoistych przeciwciał anty-VZV było mniejsze niż w przypadku podania tych szczepionek w odstępie 4 tygodni, przy czym nie oceniono odpowiedzi komórkowej wobec VZV. Mimo dowodów na to, że w ochronie przed półpaścem kluczowe znacznie ma odpowiedź komórkowa, a nie humoralna, w 2009 roku w ChPL ZVL zamieszczono zalecenie o unikaniu koadministracji tych 2 szczepionek ([...] w ChPL Zostavax przygotowaną dla krajów UE [p. www.ema.europa.eu/en/documents/product-information/zostavax-epar-product-information_pl.pdf] wskazano, że koadministracja z PPSV-23 może się wiązać z mniejszą immunogennością Zostavax; jednak w dużym badaniu obserwacyjnym nie stwierdzono zwiększonego ryzyka półpaśca po jednoczesnym podaniu obu tych szczepionek – przyp. red.). Prawdopodobnie sprawiło to, że stracono wiele okazji na realizację szczepień.234 W 2 badaniach kohortowych235,236 wykazano, że skuteczność ZVL w zapobieganiu półpaścowi u osób, które otrzymały ZVL i PPSV-23 na jednej wizycie, oraz u osób, którym szczepionki podano osobno, była podobna. Mimo bezpośrednich dowodów na to, że koadministracja obu tych szczepionek nie miała negatywnego wpływu na skuteczność ZVL, w ChPL szczepionki nadal jest zalecenie, aby rozważyć ich podawanie w odstępie ≥4 tygodni.237
Bezpieczeństwo i immunogenność ZVL u dorosłych w wieku ≥50 lat były podobne w przypadku jej koadministracji z 3-walentną inaktywowaną szczepionką przeciwko grypie, podobnie jak po ich podaniu w ≥4-tygodniowym odstępie.238 Podobne wyniki otrzymano w badaniu, w którym oceniono koadministrację ZVL i 4-walentnej inaktywowanej szczepionki przeciwko u osób w wieku ≥50 lat.239
Rekombinowana szczepionka przeciwko półpaścowi
W badaniu, w którym oceniono bezpieczeństwo i immunogenność jednoczesnego podania RZV i PPSV-23 (Pneumovax23) u dorosłych w wieku ≥50 lat,240 wykazano, że takie postępowanie nie miało negatywnego wpływu na immunogenność szczepionek, nie stwierdzono również żadnych niepokojących sygnałów w zakresie bezpieczeństwa.
Z kolei w badaniu, w którym dorosłym wieku ≥50 lat pierwszą dawkę RZV podano jednocześnie z dawką bezkomórkowej szczepionki przeciwko błonicy, tężcowi i krztuścowi o zmniejszonej zawartości antygenów (Tdap)241 wykazano, że immunogenność wobec wszystkich antygenów Tdap, z wyjątkiem pertaktyny krztuścowej, była nie gorsza niż w przypadku osobnego podania tych szczepionek. Jednak odpowiedź immunologiczna swoista dla pertaktyny po jednoczasowym podaniu RZV i Tdap była większa niż odpowiedź immunologiczna zapewniająca ochronę przed krztuścem po kontakcie domowym, którą stwierdzono w 1 badaniu przeprowadzonym w Niemczech.242 Uznano, że obserwacje dotyczące interferencji RZV i Tdap nie mają znaczenia klinicznego. Nie stwierdzono również żadnych niepokojących sygnałów dotyczących bezpieczeństwa takiego postępowania.
W RCT III fazy oceniono koadministrację RZV i IIV4 bez adiuwantu u dorosłych w wieku ≥50 lat.243 Wykazano, że w przypadku koadministracji obie szczepionki wzbudzały nie gorszą odpowiedź humoralną niż gdy podawano je na osobnych wizytach. Nie stwierdzono również żadnych niepokojących sygnałów dotyczących bezpieczeństwa takiego postępowania.243 Aktualnie nie ma zaleceń dotyczących jednoczesnego podawania szczepionki przeciwko grypie z adiuwantem MF59 (preparat niedostępny w Polsce – przyp. red.) i RZV, ponieważ nie przeprowadzono badań oceniających jednoczesne podanie 2 szczepionek z adiuwantem.244
Dostępność i stosowanie szczepionek przeciwko półpaścowi na świecie
Aktualnie ZVL (Zostavax) i RZV (Shingrix) są zarejestrowane lub dostępne w 62 krajach na świecie (p. tab. 2 w materiałach uzupełniających). Obie szczepionki są zarejestrowane we wszystkich 28 krajach Unii Europejskiej (UE), jednak tylko w 9 z nich opracowano krajowe zalecenia dotyczące szczepienia przeciwko półpaścowi (aktualnie w Polsce dostępna jest tylko rekombinowana szczepionka przeciwko półpaścowi Shingrix – przyp. red.).245-250
| Tabela 2. Inne szczepionki przeciwko półpaścowi i preparaty w trakcie opracowywaniaa | ||||
|---|---|---|---|---|
| Nazwa firmy | Kraj | Nazwa szczepionki | Rodzaj szczepionki (technologia) | Faza badań |
| SK Bioscience | Korea Południowa | SKY Zoster (NBP608) | „żywa” zawierająca atenuowany szczep Oka VZV/SK | NCT03120364 faza III (zakończona); zarejestrowana w 2017 r. w Korei Południowej do stosowania u osób w wieku ≥50 lat |
| Curevo/GC Pharma/IDRI | USA i Korea Południowa | CRV-101 | podjednostkowa, zawierająca gE z zastrzeżonym systemem adiuwantowym | NCT03820414 faza I (zakończona) |
| EyeGene / Novotech | Korea Południowa i Australia | EG-HZ | zawierająca rekombinowaną gE VZV | NCT04210752 faza I (zakończona) |
| BCHT Biotechnology | Chiny | „żywa” szczepionka zoster | „żywa” zawierająca atenuowany szczep Oka VZV | NCT04334577 faza III (jeszcze nie rozpoczęto rekrutacji) |
| NCT04334577Vaccitech/CanSino Biologics | Wielka Brytania/Hongkong | VTP-400 (CSB016) | wektor adenowirusowy (konstrukt ChAdOx1) z ekspresją gE VZV | faza przedkliniczna |
| GeneOne Life Science | Korea Południowa | GLS-5100 | plazmidowy DNA zawierający gen kodujący białko VZV; podawany metodą elektroporacjib | faza przedkliniczna |
| Akshaya Bio | Kanada | Chimigen ShingVax | białkowa, rekombinowana (antygeny połączone z fragmentem Fc mysiego przeciwciała monoklonalnego przez opatentowane wiązania peptydowe) | faza przedkliniczna |
| Merck/Moderna | USA | mRNA kodujące gE VZV (LNP jako nośnik) | mRNA z ekspresją skróconego gE VZV w LNP | faza przedkliniczna (u naczelnych innych niż ludzie) |
| CPL Biologicals | Indie | VZV Vaccine | z wykorzystaniem technologii nanocząsteczek firmy Novavax (szczepionka przeciwko ospie wietrznej i półpaścowi) | etap opracowywania |
| a Opracowano na podstawie: (1) Choi W.S., Choi J.H., Jung D.S. i wsp.: Immunogenicity and safety of a new live attenuated herpes zoster vaccine (NBP608) compared to Zostavax(R) in healthy adults aged 50 years and older. Vaccine, 2019; 37: 3605–3610; (2) https://curevovaccine.com/2020/09/ curevo-vaccine-announces-robustantibodyresponse-results-of-phase-i-clinical-trial-ofinvestigational-vaccine-for-shingles-crv-101/; (3) http://eyegene.co.kr/ eng/product_pipeline/EG_HZ/?lang = en_US; (4) https://ichgcp.net/clinical-trials-registry/ NCT04334577; (5) www.vaccitech.co.uk/pipeline/; (6) www.genels.com/en/sub/technology/vaccine.asp; (7) www.akshayabio.com/technology.html; (8) Monslow M.A., Elbashir S., Sullivan N.L. i wsp.: Immunogenicity generated by mRNA vaccine encoding VZV gE antigen is comparable to adjuvanted subunit vaccine and better than live attenuated vaccine in nonhuman primates. Vaccine, 2020; 38: 5793–802; (9) http://cplbio.com/rd/rd-pipeline/
b Elektroporacja – metoda polegająca na zastosowaniu pola elektrycznego lub elektromagnetycznego do odwracalnego uszkodzenia błony komórkowej w celu wprowadzenia do komórek kwasów nukleinowych; po raz pierwszy zastosowano ją w latach 80. XX w. jako alternatywę dla zmodyfikowanych genetycznie wektorów wirusowych i wykorzystywanych w tym celu metod chemicznych – przyp. red. gE – glikoproteina E, IDRI – Infectious Disease Research Institute, LNP – nanocząsteczki lipidowe, mRNA – matrycowy kwas rybonukleinowy, VZV – wirus ospy wietrznej i półpaśca | ||||
„Żywa” szczepionka przeciwko półpaścowi
ZVL (Zostavax) jest zarejestrowana w 57 krajach na świecie, natomiast dostępna jest w 41 krajach (na podstawie pisemnych informacji przekazanych przez firmę Merck w dniu 11 marca 2021 r. [p. tab. 2 w materiałach uzupełniających]). Do lutego 2021 roku na całym świecie rozdystrybuowano 51 mln dawek ZVL, w tym 30,5 mln w USA, a 20,5 mln w pozostałych krajach. Tylko w 2020 roku wykorzystano 2,2 miliona dawek ZVL, z czego >90% we Włoszech, Wielkiej Brytanii, Grecji, Australii/Nowej Zelandii i Korei (na podstawie informacji przekazanych przez firmę Merck).
W 2016 roku Ontario było pierwszą kanadyjską prowincją, która objęła szczepionkę ZVL publicznym finansowaniem dla dorosłych w wieku 65–70 lat.215,251 W listopadzie 2016 roku bezpłatne szczepienie przeciwko półpaścowi z użyciem ZVL dla osób w wieku ≥70 lat oraz szczepienia wychwytujące w populacji w wieku 71–79 lat wprowadzono do australijskiego Programu Szczepień Ochronnych. Program finansowano ze środków publicznych do października 2021 roku.215
W marcu 2016 roku w Japonii rozszerzono wskazania rejestracyjne szczepionki przeciwko ospie wietrznej (Biken), zawierającej większe miano vOka niż ZVL, o profilaktykę półpaśca u osób w wieku ≥50 lat.252-254
W październiku 2017 roku koreańskie Ministerstwo ds. Bezpieczeństwa Żywności i Leków zarejestrowało „żywą” szczepionkę przeciwko półpaścowi NBP608 (SKY Zoster) zawierającą vOka produkowaną przez koncern SK Bioscience. W RCT III fazy wykazano, że u zdrowych dorosłych w wieku ≥50 lat immunogenność szczepionki NBP608 była nie gorsza niż szczepionki Zostavax. Podobny był również profil bezpieczeństwa obu preparatów.255
Rekombinowana szczepionka przeciwko półpaścowi
RZV (Shingrix) jest zarejestrowana w 35 krajach na świecie, a dostępna jest w 8 krajach, w tym w USA (na podstawie pisemnych informacji przekazanych przez firmę GlaxoSmithKline 8 lutego 2021 r. [p. tab. 2 w materiałach uzupełniających]). W 2018 roku kanadyjski National Advisory Committee on Immunization (NACI) zaktualizował zalecenia i wskazał, że w profilaktyce półpaśca preferuje się RZV względem ZVL.256 NACI dopuszcza podanie ZVL osobom immunokompetentnym, jeżeli stwierdza się u nich przeciwwskazania do podania RZV lub jeżeli jest ona niedostępna.
RZV jest zarejestrowana we wszystkich krajach UE, a także w Japonii (od marca 2018 r.), w Chinach (od maja 2019 r.), w Nowej Zelandii (od stycznia 2020 r.), w Hongkongu (od października 2020 r.) oraz w Singapurze (od stycznia 2021 r.). W Austrii szczepienie przeciwko półpaścowi z użyciem RZV w schemacie 2-dawkowym zaleca się wszystkim dorosłym w wieku >50 lat (niezależnie od stanu układu immunologicznego), natomiast u osób z ciężkimi niedoborami odporności można rozważyć podanie RZV poza wskazaniami rejestracyjnymi. RZV nie jest dostępna w Austrii, ale można ją zamówić w aptekach w innych krajach europejskich.248 Niemiecki Stały Komitet ds. Szczepień (STIKO) zaleca szczepienie 2 dawkami RZV podawanymi w odstępie 2–6 miesięcy u zdrowych dorosłych w wieku ≥60 lat oraz dorosłych w wieku ≥50 lat z niedoborami odporności lub z chorobami przewlekłymi, takimi jak cukrzyca, RZS, IBD, przewlekła obturacyjna choroba płuc i astma.257
Jednak trudność w produkcji dużej ilości RZV, konieczność podania 2 dawek oraz reaktogenność stanowią istotne przeszkody w upowszechnieniu jej stosowania.
Inne szczepionki przeciwko półpaścowi
Obie aktualnie zarejestrowane szczepionki przeciwko półpaścowi mają swoje wady. Skuteczność ZVL jest mniejsza niż RZV, a dodatkowo zmniejsza się w ciągu kilku lat po szczepieniu. Ponadto, jako szczepionka „żywa” nie może być stosowana u pacjentów z ciężkimi niedoborami odporności. Z kolei RZV wymaga podania 2 dawek w odstępie 2–6 miesięcy, a silny adiuwant AS01B sprawia, że jest bardziej reaktogenna. Niepokojący jest również związek między RZV a występowaniem ZGB, choć aktualnie nie ma dowodów, że ma on charakter przyczynowy. Ponadto, ze względu na znaczne ograniczenia dostaw, RZV jest niedostępna w większości krajów, w których jest zarejestrowana. W związku z tym trwają prace nad innymi szczepionkami przeciwko półpaścowi, z wykorzystaniem technologii ZVL i RZV lub innych platform. W USA aktualnie zarejestrowano 2 badania kliniczne oceniające bezpieczeństwo, tolerancję i immunogenność różnych szczepionek podjednostkowych (zawierających gE VZV) z adiuwantem (nr identyfikacyjny w rejestrze Clinical-Trials.gov: NCT03820414 i NCT04210752). Wyniki tych badań nie są jeszcze dostępne. Z kolei w Chinach zarejestrowano RCT z placebo w grupie kontrolnej, którego celem jest ocena bezpieczeństwa i skuteczności „żywej” szczepionki zawierającej atenuowany szczep VZV u zdrowych dorosłych w wieku ≥40 lat (nr identyfikacyjny w rejestrze ClinicalTrials.gov: NCT04334577), ale nie rozpoczęto jeszcze rekrutacji.
Najnowsze dane dotyczące bezpieczeństwa i imponującej skuteczności 2 szczepionek przeciwko COVID-19 opracowanych z wykorzystaniem mRNA i lipidów mogą się przyczynić do opracowania nowych szczepionek przeciwko innym chorobom zakaźnym z wykorzystaniem tej technologii, w tym przeciwko półpaścowi.258,259 W badaniu z udziałem naczelnych innych niż człowiek szczepionka mRNA wykazująca ekspresję gE VZV indukowała odpowiedź humoralną swoistą dla gE i związaną z limfocytami T CD4+ podobną do odpowiedzi indukowanej przez RZV i silniejszą po podaniu ZVL.260 Na wczesnym etapie opracowywania jest również inny preparat z adiuwantem zawierający jednoniciowy RNA pochodzący z wirusa paraliżu u świerszczy (CrPV).261 Trwają prace jeszcze nad kilkoma innymi szczepionkami przeciwko półpaścowi (p. tab. 2).
Potrzeby związane ze szczepionką przeciwko półpaścowi na świecie
Ludność świata starzeje się.262 Do 2050 roku 1 na 6 osób na całym świecie i 1 na 4 w Ameryce Północnej i Europie skończy 65 lat.263 Szacuje się, że w latach 2019–2050 we wszystkich regionach świata, z wyjątkiem Afryki Subsaharyjskiej, populacja osób starszych podwoi się.263
W ciągu całego swojego życia na półpasiec zachoruje 1/3 populacji dorosłych oraz połowa osób, które dożyją wieku 85 lat.15,58,65,66,264 Półpasiec rzadko prowadzi do zgonu, ale ma istotny niekorzystny wpływ na osoby starsze, powodując przewlekły ból neuropatyczny, pogorszenie funkcjonowania fizycznego i społecznego, stres emocjonalny, zmniejszoną produktywność i nieodwracalną utratę niezależności, a w systemach opieki zdrowotnej generuje koszty.89,265,266
Szacujemy, że przy braku szczepień przeciwko półpaścowi w ciągu następnej dekady na całym świecie wystąpi 278 mln zachorowań na półpasiec, w tym 10,5 mln u osób w wieku ≥85 lat, a u 20,7 mln osób w wieku ≥50 lat wystąpi PHN (oszacowano na podstawie prognoz populacyjnych267 i opublikowanych wskaźników zachorowalności na półpasiec i PHN15,268).
Szczepienie przeciwko półpaścowi osób starszych jest efektywne kosztowo,268,269 ale kraje o niskich i średnich dochodach mają wiele innych priorytetów w zakresie zdrowia publicznego. Biorąc jednak pod uwagę, że szczepienie dzieci przeciwko ospie wietrznej ostatecznie zmniejszyłoby zachorowalność na półpasiec wśród osób starszych, uwzględnienie go przez WHO w Strategicznym Planie Szczepień dla Regionu Afrykańskiego270 w efekcie zmniejszyłoby ludzkie i ekonomiczne koszty półpaśca. Dodatkowo z uwagi na starzenie się obecnej populacji osób, które przeszły pierwotne zakażeniem dzikim VZV, obciążenie związane z półpaścem wśród osób starszych ogromnie się zwiększy. W związku z tym potrzebna jest bezpieczna, skuteczna i niedroga szczepionka przeciwko półpaścowi.
W wyniku atenuacji szczepionkowy szczep Oka VZV nie jest zdolny do wywołania ospy wietrznej (pierwotnego zakażenia), ale podobnie jak dziki VZV przechodzi w stan latencji i może ulec reaktywacji, wywołując półpasiec.25,271-275 Zachorowalność na półpasiec wywołany przez vOka u zaszczepionych dzieci jest jednak znacznie mniejsza niż zachorowalność na półpasiec po przechorowaniu ospy wietrznej wywołanej dzikim VZV. Wydaje się więc, że atenuacja zmniejsza również zdolność szczepu szczepionkowego do reaktywacji.25,274,275
Szczepionki przeciwko półpaścowi, które nie zawierają VZV zdolnego do replikacji, takie jak RZV i inne (p. tab. 2), w przeciwieństwie do szczepionki zawierającej atenuowany vOka, są z definicji bezpieczne u pacjentów z niedoborem odporności, w tym u osób zamieszkujących kraje o niskich dochodach, gdzie endemicznie występują takie choroby, jak malaria, gruźlica i zakażenie HIV/AIDS.276-281 W związku z tym tego typu szczepionki idealnie nadawałyby się do profilaktyki ospy wietrznej i półpaśca. Jednak szczepionki „nieżywe” nie indukują latencji wirusa, więc nie dochodzi do okresowej reaktywacji syntezy antygenów VZV stymulujących endogennie VZV-CMI, co w konsekwencji może nie wywoływać długoterminowej odporności (p. rozdz. „Rola utajonego VZV w utrzymaniu odporności gospodarza na półpasiec”).
Szczepionki przeciwko gruźlicy zawierające szczep Bacillus Calmette-Guerin (BCG) stanowią platformę szczepionkową,282,283 która może odpowiadać na potrzeby w zakresie zdrowia publicznego w krajach o niskich dochodach na całym świecie. BCG posiada wiele zalet jako platforma dla szczepionek wysoce skojarzonych, idealnie odpowiadająca na potrzeby biedniejszych krajów. Genom BCG jest wystarczająco duży, aby pomieścić >20 różnych antygenów, dlatego stanowi platformę dla pojedynczej szczepionki przeciwko wielu różnym chorobom. Kraje o niskich i średnich dochodach mają już doświadczenie w produkcji i dystrybucji szczepionki BCG. Można ją łatwo i niedrogo wytwarzać w dużej ilości i pozbawić zdolności do replikacji, a przez to znacznie zwiększyć bezpieczeństwo, można też ją podawać samodzielnie za pomocą śródskórnego plastra z mikroigłami,284 bez potrzeby zapewnienia łańcucha chłodniczego, wykorzystując anamnestyczną odpowiedź immunologiczną u milionów mieszkańców biedniejszych krajów, którzy w przeszłości otrzymali już szczepienie BCG.
Materiały uzupełniające: Materiały uzupełniające są dostępne w internetowym wydaniu „The Journal of Infectious Diseases”.
Zawierają dane przekazane przez Autorów dla Czytelników.
Zamieszczone materiały nie są redagowane, a wyłączną
odpowiedzialność za ich treść ponoszą Autorzy. Pytania lub
informacje dotyczące błędów należy kierować do Autorów.
Podziękowanie: Niniejszy artykuł jest poświęcony pamięci Edgara
Hope-Simpsona, którego przełomowe obserwacje i prorocza hipoteza
na temat półpaśca stały się inspiracją i uzasadnieniem dla
opracowania „żywej” szczepionki przeciwko półpaścowi zawierającej
vOka, oraz Michiaki Takahashiego, który opracował vOka, dzięki
czemu praktycznie wyeliminowano zachorowania na ospę wietrzną i znacznie zmniejszono niekorzystny wpływ półpaśca na coraz
większą populację osób starszych należących do grupy ryzyka tej
choroby. Dziękujemy VA San Diego Healthcare System Research
Service i Veterans Medical Research Foundation w San Diego
za wsparcie administracyjne i inne wsparcie pozafinansowe, a także
Donnie Mussatto i Markowi Ashbaughowi za ich nieocenioną wiedzę i pomoc w przygotowaniu tego manuskryptu.
Wsparcie finansowe: R.H. i M.N.O. uzyskali częściowe wsparcie w ramach programu Cooperative Studies Program Veterans Affairs
(VA), James R. and Jesse V. Scott Fund for Gont Research oraz z prywatnych darowizn. J.I.C. uzyskał wsparcie finansowe w ramach
Intramural Research Program of the National Institute of Allergy and
Infectious Diseases.
Sponsorowanie suplementu: Suplement jest sponsorowany przez
Fundację Billa i Melindy Gatesów.
Potencjalny konflikt interesów: J.I.C. jest wymieniony jako
wynalazca we wniosku patentowym dotyczącym „żywej” szczepionki
przeciwko ospie wietrznej i ma umowę o współpracę badawczorozwojową z firmą GlaxoSmithKline nad szczepionką przeciwko
wirusowi Epsteina i Barr. M.N.O. był konsultantem firmy
GlaxoSmithKline i członkiem Komitetu ds. Monitorowania
Bezpieczeństwa Danych w RCT dotyczącym szczepionki Zostavax
finansowanym przez National Institutes of Health. Wszyscy autorzy
przesłali formularz ICMJE dotyczący ujawnienia potencjalnych
konfliktów interesów. Ujawniono konflikty, które redaktorzy uznali
za istotne dla treści niniejszego artykułu.
Wybrane piśmiennictwo:
Pełny wykaz piśmiennictwa jest dostępny w materiałach uzupełniających (p. academic.oup.com/jid/article/224/Supplement_4/S429/6378089#supplementary-data).15. Hope-Simpson R.E.: The nature of herpes zoster: a long-term study and a new hypothesis. Proc. R. Soc. Med., 1965; 58: 9–20
18. Oxman M.N.: Zoster vaccine: current status and future prospects. Clin. Infect. Dis., 2010; 51: 197–213
34. Oxman M.N.: Clinical manifestations of herpes zoster. (In:) Arvin A.M., Gershon A.A., (eds): Varicella-Zoster Virus: Virology and Clinical Management. Cambridge, UK, Cambridge University Press, 2000: 246–275
55. Harpaz R., Leung J.W.: The epidemiology of herpes zoster in the United States during the era of varicella and herpes zoster vaccines: changing patterns among older adults. Clin. Infect. Dis., 2019; 69: 341–344
90. Dooling K.L., Guo A., Patel M., et al.: Recommendations of the advisory committee on immunization practices for use of herpes zoster vaccines. MMWR, 2018; 67: 103–108
91. Oxman M.N., Levin M.J., Johnson G.R., et al.: A vaccine to prevent herpes zoster and postherpetic neuralgia in older adults. N. Engl. J. Med., 2005; 352: 2271–2284
112. Coplan P.M., Schmader K., Nikas A., et al.: Development of a measure of the burden of pain due to herpes zoster and postherpetic neuralgia for prevention trials: adaptation of the brief pain inventory. J. Pain, 2004; 5: 344–356
117. Schmader K.E., Levin M.J., Gnann J.W., et al.: Efficacy, safety, and tolerability of herpes zoster vaccine in persons aged 50–59 years. Clin. Infect. Dis., 2012; 54: 922–928
137. Lal H., Cunningham A.L., Godeaux O., et al.: Efficacy of an adjuvanted herpes zoster subunit vaccine in older adults. N. Engl. J. Med., 2015; 372: 2087–2096
138. Cunningham A.L., Lal H., Kovac M., et al.: Efficacy of the herpes zoster subunit vaccine in adults 70 years of age or older. N. Engl. J. Med., 2016; 375: 1019–1032
180. Berkowitz E.M., Moyle G., Stellbrink H.J., et al.: Safety and immunogenicity of an adjuvanted herpes zoster subunitcandidate vaccine in HIV-infected adults: a phase 1/2a randomized, placebo-controlled study. J. Infect. Dis., 2015; 211: 1279–1287
182. Dagnew A.F., Ilhan O., Lee W.S., et al.: Immunogenicity and safety of the adjuvanted recombinant zoster vaccine in adults with haematological malignancies: a phase 3, randomised, clinical trial and post-hoc efficacy analysis. Lancet Infect. Dis., 2019; 19: 988–1000
193. Benson C.A., Andersen J.W., Macatangay B.J.C., et al.: Safety and Immunogenicity of zoster vaccine live in human immunodeficiency virus-infected adults with CD4+ cell counts >200 cells/ml virologically suppressed on antire-troviral therapy. Clin. Infect. Dis., 2018; 67: 1712–1719
214. Willis E.D., Woodward M., Brown E., et al.: Herpes zoster vaccine live: a 10 year review of post-marketing safety experience. Vaccine, 2017; 35: 7231–7239
221. Hesse E.M., Shimabukuro T.T., Su J.R., et al.: Postlicensure safety surveillance of recombinant zoster vaccine (Shingrix) – United States, October 2017-June 2018. MMWR, 2019; 68: 91–94
Komentarz
prof. dr hab. n. med. Leszek Szenborn
Klinika Pediatrii i Chorób Infekcyjnych Uniwersytetu Medycznego
we Wrocławiu
W komentowanym artykule szczegółowo wyjaśniono biologię zakażenia wirusem ospy wietrznej i półpaśca (VZV) oraz wszystkie następstwa jego reaktywacji w postaci półpaśca. Dla polskiego Czytelnika artykuł jest zapowiedzią przełomu w profilaktyce półpaśca, który nastąpił po wprowadzeniu do stosowania szczepionki rekombinowanej, umożliwiającej immunizację w grupie najbardziej tego potrzebującej, czyli u pacjentów z niedoborami odporności. Drugim przełomem związanym ze szczepionką rekombinowaną jest znacznie większa skuteczność szczepienia w zapobieganiu zachorowaniom na półpasiec w ogóle oraz występowaniu neuralgii popółpaścowej, będącej najbardziej dotkliwym dla pacjentów powikłaniem i jednocześnie dużym obciążeniem systemu zdrowotnego. Szacuje się, że powikłanie to rozwija się ogółem u 9–15% chorych na półpasiec, jednak jego częstość gwałtownie zwiększa się wraz z wiekiem – neuralgia popółpaścowa dotyczy niemal każdego chorego >80. roku życia.1 Europejska Agencja Leków (EMA) zarejestrowała w krajach Unii Europejskiej (UE) 2 szczepionki przeciwko półpaścowi – w 2016 roku szczepionkę „żywą” (Zostavax), a w 2018 roku rekombinowaną (Shingrix).2-3 Preparaty te dotychczas były niedostępne w Polsce, co uniemożliwiało realizację profilaktyki półpaśca za pomocą szczepień. Szczepionkę „żywą” stosowano w krajach o wysokich dochodach, w których przynosiło to korzyści ekonomiczne. Cieszy mnie, że szczepionka rekombinowana będzie teraz dostępna również dla polskich pacjentów. W komentowanym artykule bardzo szczegółowo omówiono i porównano skuteczność kliniczną oraz profil bezpieczeństwa szczepionek. Warto zapamiętać, że chociaż ryzyko miejscowych i ogólnoustrojowych niepożądanych odczynów poszczepiennych (reaktywność) po podaniu nowej szczepionki rekombinowanej jest większe niż po podaniu szczepionki „żywej”, to zazwyczaj mają one łagodne lub umiarkowane nasilenie i rzadko upośledzają codzienną aktywność.
Jaka jest epidemiologia półpaśca w Europie i w Polsce?
Zapadalność na półpasiec jest podobna w poszczególnych krajach europejskich i wynosi około 2–4,6/1000/rok. Na podstawie badań przeprowadzonych w 7 krajach europejskich Pinchinat i wsp. oszacowali, że zapadalność na półpasiec wynosi około 3,4/1000/rok, co daje w UE około 1,7 mln zachorowań na półpasiec rocznie. W poszczególnych grupach wiekowych zapadalność na półpasiec wynosiła około: 1/1000/rok u dzieci, 2/1000/rok u dorosłych <40. roku życia i 4/1000/rok u dorosłych w wieku 40–50 lat. U osób w wieku >50 lat zapadalność stopniowo zwiększała się aż do około 10/1000/rok u osób w wieku 80 lat. We wszystkich badaniach półpasiec występował częściej u kobiet niż u mężczyzn.4 Choć badania te przeprowadzono w różnych latach, to ich wyniki były bardzo podobne. Odnosząc wyniki metaanalizy Pinchinat i wsp. do populacji Polski, można założyć, że rocznie na półpasiec choruje około 122 000 osób, z czego około 25 000–30 000 zachorowań dotyczy osób >75 lat. Z danych Narodowego Funduszu Zdrowia (NFZ) wynika, że w latach 2010–2013 liczba hospitalizacji z powodu półpaśca była stała i wynosiła około 1800 rocznie.5 Albrecht i wsp. przeanalizowali dane z województwa świętokrzyskiego i otrzymali podobne wyniki – średnia zapadalność na półpasiec wyniosła 3,4/1000/rok. Największa była w populacji osób w wieku ≥50 lat (6,1/1000) i w tej grupie wiekowej występowało również najwięcej powikłań. Z danych NFZ wynika, że w Polsce 52% hospitalizowanych stanowiły osoby z powikłaniami półpaśca (563 przypadków rocznie), a 19% – osoby z półpaścem rozsianym (200 przypadków rocznie).
Wpływ szczepień przeciwko ospie wietrznej na występowanie półpaśca
Rozpoczęcie powszechnych szczepień przeciwko ospie wietrznej w USA, które z czasem zmniejszają prawdopodobieństwo „odświeżenia odporności” w wyniku ekspozycji na dziki VZV (kontakt z osoba chorą na ospę wietrzną), dotychczas nie zwiększyło zapadalności na półpasiec u dorosłych, natomiast znacząco zmniejszyło zapadalność na półpasiec w zaszczepionej populacji oraz w populacji ich rówieśników. W okresie 12 lat realizacji programu powszechnych szczepień przeciwko ospie wietrznej w USA zapadalność na półpasiec w całej populacji dzieci objętej badaniem zmniejszyła się aż o 72%, a ten korzystny efekt obserwowano zarówno w grupie dzieci szczepionych, jak i nieszczepionych (choć w istotnie mniejszym stopniu). Od 4. roku życia zapadalność na półpasiec wśród dzieci szczepionych była mniejsza niż u nieszczepionych i z każdym kolejnym rokiem różnica ta była coraz większa.6 Bardzo ciekawe są przytoczone w artykule dowody, że endogenne stymulowanie odporności zapobiega półpaścowi u większości osób (p. ryc. 2).7 W przypadku dzieci znanym czynnikiem ryzyka wczesnego wystąpienia półpaśca, poza przypadkami immunosupresji spowodowanej chorobą lub leczeniem, jest przebycie pierwotnego zakażenia VZV w okresie płodowym (przeniesienie zakażenia drogą przezłożyskową od matki zakażonej w okresie ciąży) lub niemowlęcym.
Nerwoból związany z zachorowaniem na półpasiec
Chciałbym również przybliżyć Czytelnikowi ryzyko powikłań bólowych związanych z zachorowaniem na półpasiec. Ból jest dominującym objawem półpaśca w ostrej fazie choroby. Występuje u >90% chorych i zwykle utrzymuje się przez 30 dni. Jest on spowodowany uszkodzeniem komórek zwojów czuciowych i nerwów obwodowych przez replikujące się VZV oraz stanem zapalnym skóry. W przebiegu półpaśca występuje także ból prodromalny, także jako przeczulica, który poprzedza wystąpienie osutki na skórze (u ok. 75% pacjentów zwykle o 5 dni) i może być związany z uwalnianiem cytokin. Objawy bólowe charakteryzują się pieczeniem, kłuciem, swędzeniem, mrowieniem, drętwieniem, bólem przypominającym anginę, uczuciem ściskania i głębokim bólem. Wraz z wiekiem nasilenie bólu w przebiegu półpaśca się zwiększa, a czas jego utrzymywania się wydłuża.8
Jednak najbardziej dotkliwa dla pacjentów jest przewlekła neuralgia popółpaścowa (nerwoból popółpaścowy), która stanowi także duże obciążenie systemów zdrowotnych. Neuralgię popółpaścową rozpoznaje się, gdy ból w obrębie zajętego wcześniej dermatomu utrzymuje się przez >3 miesiące od wystąpienia objawów na skórze. Nerwoból popółpaścowy może się utrzymywać przez wiele lat.9 W raz z wiekiem częstość nerwobólu popółpaścowego się zwiększa, a czas jego utrzymywania się wydłuża.10 Wyniki badań sugerują, że nerwoból popółpaścowy występuje u 27% nieleczonych dorosłych chorych na półpasiec w wieku >55 lat, 47% w wieku >60 lat i aż 73% osób w wieku >70 lat. Odsetek pacjentów zgłaszających ból trwający ponad rok wynosił odpowiednio: 4, 22 i 48%. Ból w przebiegu neuralgii popółpaścowej ma charakter głównie neuropatyczny. Powoduje cierpienie i pogarsza jakość życia pacjenta, generuje duże koszty dla systemu ochrony zdrowia, często jest niedostatecznie kontrolowany ze względu na relatywnie małą skuteczność leczenia objawowego i bywa przyczyną podejmowania prób samobójczych.11
Objawy bólowe w okresie ostrym półpaśca oraz w przebiegu neuralgii popółpaścowej praktycznie nie dotyczą dzieci i młodzieży.
Inne następstwa zachorowania na półpasiec
Chciałbym również zwrócić uwagę Czytelników temat, którego nie poruszono w komentowanym artykule, czyli rzadkie, ale spektakularne postaci półpaśca, w których replikujące VZV uszkadzają również włókna motoryczne, co skutkuje występowaniem niedowładów oraz porażeń w obrębie zajętego dermatomu. Najczęściej rozpoznawany jest jednostronny obwodowy niedowład nerwu twarzowego, który razem z półpaścem usznym składają się na zespół Ramsaya Hunta.12 Zmiany na skórze małżowiny i błonie bębenkowej niekiedy są nieliczne i zwykle bardzo małe, przez co mogą pozostać niezauważone. Rzadziej rozpoznaje się skutki zajęcia innych ruchowych nerwów zaopatrywanych ze zwojów przykręgosłupowych.13
Na zakończenie chciałabym poruszyć problem z którym na pewno spotkają się lekarze realizujący szczepienia ochronne. Czy pacjenta, który przechorował półpasiec, można zaszczepić przeciwko półpaścowi preparatem rekombinowanym? Odpowiedź brzmi: tak, można. Półpasiec zwykle występuje jednorazowo, choć jego epizody mogą się też powtórzyć. Yawn i wsp. oszacowali, że ryzyko nawrotu półpaśca w ciągu średnio 7,3 roku wyniosło 6,2%, a w prawie połowie przypadków (45%) nawrót dotyczył innego dermatomu niż w pierwszym epizodzie.14 Zgodnie z ogólnymi zasadami szczepienie należy odroczyć do czasu ustąpienia wszystkich objawów ostrej choroby (nie należy uwzględniać bliznowacenia).15
Podsumowując, zachorowanie na półpasiec i jego powikłania stanowią istotne obciążenie dla pacjentów i systemów opieki zdrowotnej. Zatem korzyści ze szczepienia nowo dostępnym preparatem rekombinowanym mogą odnieść zarówno pacjenci, jak i zalecający je lekarze. Należy podkreślić, że korzyści ze szczepienia zdecydowanie przewyższają ryzyko związane z występowaniem typowych miejscowych i ogólnoustrojowych NOP, które zwykle mają łagodne lub umiarkowane nasilenie i utrzymują się do kilku dni.
Szczepienie przeciwko półpaścowi preparatem rekombinowanym zaleca się wszystkim dorosłym w wieku ≥50 lat oraz w wieku ≥18 lat z niedoborami odporności lub immunosupresją wynikającą z choroby lub stosowanej terapii. Szczepionkę można podawać razem z innymi szczepionkami (na tej samej wizycie). Pełny schemat szczepienia składa się z 2 dawek podawanych w odstępie 2 miesięcy. U osób z niedoborami odporności lub u których może wystąpić niedobór odporności związany z chorobą lub leczeniem, producent dopuszcza zastosowanie skróconego schematu szczepienia i podanie drugiej dawki 1–2 miesięcy po pierwszej dawce. Ze względu na podobne wskazania i grupy ryzyka szczepienie przeciwko półpaścowi warto proponować pacjentom dotąd nieszczepionym przeciwko pneumokokom i grypie oraz zgłaszającym się na szczepienie przypominające przeciwko krztuścowi, błonicy i tężcowi. Jedynym trwałym przeciwwskazaniem do podania rekombinowanej szczepionki przeciwko półpaścowi jest nadwrażliwość na jakikolwiek jej składnik lub po podaniu wcześniejszej dawki.16
Piśmiennictwo do komentarza:
1. American Society of Anesthesiologists Task Force on Chronic Pain Management, American Society of Regional Anesthesia and Pain Medicine: Practice guidelines for chronic pain management: an updated report by the American Society of Anesthesiologists Task Force on Chronic Pain Management and the American Society of Regional Anesthesia and Pain Medicine. Anesthesiology, 2010; 112: 810–8332. European Medicines Agency. Zostavax. www.ema.europa.eu/en/medicines/human/EPAR/zostavax (dostęp: 03.04.2023)
3. European Medicines Agency. Shingrix. www.ema.europa.eu/en/medicines/human/EPAR/shingrix (dostęp: 03.04.2023)
4. Pinchinat S., Cebrián-Cuenca A.M., Bricout H. i wsp.: Similar herpes zoster incidence across Europe: results from a systematic literature review. BMC Infect. Dis., 2013; 13: 170
5. Mastalerz-Migas A., Grodzicki T., Malec-Milewska M. i wsp. Półpasiec – objawy kliniczne, leczenie i profilaktyka. Terapia, 2015; 12 (332): 6–11
6. Weinmann S., Naleway A.L., Koppolu P. i wsp.: Incidence of herpes zoster among children: 2003–2014. Pediatrics, 2019; 144. pii: e20182917
7. Gaillat J., Gajdos V., Launay O. i wsp.: Does monastic life predispose to the risk of Saint Anthony’s fire (herpes zoster)? Clin. Infect. Dis., 2011; 53: 405–410
8. Weinberg J.M.: Herpes zoster: epidemiology, natural history, and common complications. J. Am. Acad. Dermatol., 2007; 57 (supl. 6): S130–135
9. Johnson R.W.: Zoster-associated pain: what is known, who is at risk and how can it be managed? Herpes, 2007; 14 (supl. 2): 30–34
10. Kost R.G., Straus S.E.: Postherpetic neuralgia–pathogenesis, treatment, and prevention. N. Engl. J. Med., 1996; 335 (1): 32–42
11. Johnson R.W., Bouhassira D., Kassianos G. i wsp.: The impact of herpes zoster and post-herpetic neuralgia on quality-of-life. BMC Med., 2010; 8 (1): 37
12. Nakajima H., Hara M., Morita A., Kameiet S.: Neurological complications of varicella-zoster virus infection. (W:) Thomasini R.L. (red.): Human herpesvirus infection – biological features, transmission, symptoms, diagnosis and treatment. InTechOpen, 2019. doi: 10.5772/intechopen.83036
13. Dworkin R.H., Johnson R.W., Breuer J. i wsp.: Recommendations for the management of herpes zoster. Clin. Infect. Dis., 2007; 44 (supl. 1): S1–26
14. Yawn B.P., Wollan P.C., Kurland M.J. i wsp.: Herpes zoster recurrences more frequent than previously reported. Mayo Clin. Proc., 2011; 86 (2): 88–93
15. Centers for Disease Control and Prevention: Shingrix Recommendations. www.cdc.gov/vaccines/vpd/shingles/hcp/shingrix/recommendations.html (31.03.2023)
16. Charakterystyka Produktu Leczniczego Shingrix. www.ema.europa.eu/en/documents/product-information/shingrix-epar-product-information_pl.pdf (03.04.2023)

















