Tłumaczyła lek. Iwona Rywczak
Od Redakcji: Przetłumaczono wybrane fragmenty artykułu. Czytelników zainteresowanych szczegółowymi informacjami odsyłamy do oryginału.
Skróty: PCR (polymerase chain reaction) – łańcuchowa reakcja polimerazy, PT – toksyna krztuścowa, ptxP (pertussis toxin promoter) – promotor toksyny krztuścowej, real-time PCR (real-time polymerase chain reaction) – łańcuchowa reakcja polimerazy w czasie rzeczywistym
Posiew i badanie PCR
Pobieranie materiału z nosowej części gardła na posiew i badanie PCR
Bordetella pertussis można wyizolować z wymazu lub aspiratu z nosowej części gardła. Wykazano, że u noworodków i niemowląt o 15% częściej B. pertussis wykrywano w aspiracie niż w wymazie. (…) Aspirat można również łatwo podzielić na mniejsze porcje w celu przeprowdzenia innych badań. U starszych dzieci, młodzieży i dorosłych zwykle wykonuje się wymaz, ponieważ w tych grupach wiekowych trudniej jest uzyskać aspirat. Prawidłowe pobranie materiału przedstawiono na filmie instruktażowym przygotowanym przez Nicole Guiso z Instytutu Pasteura w Paryżu (p. YouTube: „Prelevcoqueluche-desktop.m4v”).
B. pertussis rozmnaża się u człowieka głównie w nosowej części gardła, dlatego nie zaleca się posiewu i badań metodą łańcuchowej reakcji polimerazy (PCR) z wymazu z ustnej części gardła.
Postępowanie w rozpoznawaniu zakażeń B. pertussis przedstawiono w tabeli i na rycinie.
| Tabela. Główne metody laboratoryjne stosowane w rozpoznawaniu zakażenia B. pertussis | ||
|---|---|---|
| Metoda laboratoryjna | Zastosowanie | Próbka |
| posiew | podejrzenie krztuśca we wszystkich grupach wiekowych, jeżeli kaszel trwa <21 dni | wymaz lub aspirat z nosowej części gardła |
| PCR | podejrzenie krztuśca we wszystkich grupach wiekowych, jeżeli kaszel trwa <21 dni | optymalnie wymaz z nosowej części gardła, u osób niehospitalizowanych można zaakceptować wymaz z ustnej części gardła |
| badania serologiczne | podejrzenie krztuśca u starszych dzieci i dorosłych, jeżeli kaszel trwa >14 dnia | surowicab |
| a Niedawne szczepienie szczepionką zawierającą antygeny pałeczki krztuśca (w ciągu ostatniego roku lub wcześniej) może utrudnić interpretację wyniku badań serologicznych. b W Wielkiej Brytanii wykorzystuje się również próbki pobrane z jamy ustnej. PCR – łańcuchowa reakcja polimerazy | ||
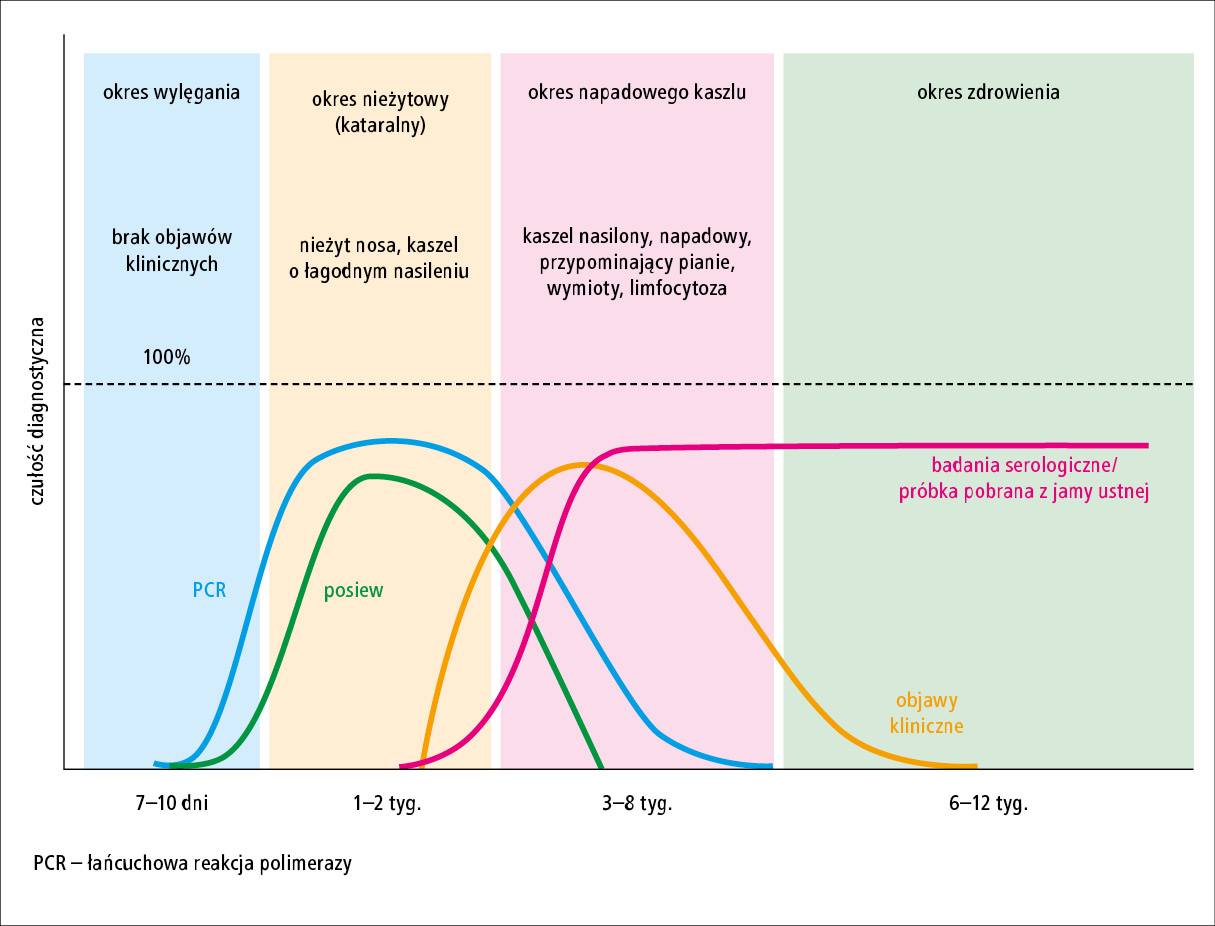
Ryc. 1. Wytyczne dotyczące rozpoznawania krztuśca w zależności od okresu choroby (opracowano na podstawie: Fry N.K. i wsp.: Bordetella pertussis and whooping cough [pertussis]: still a significant cause of infant morbidity and mortality, but vaccine-preventable. J. Med. Microbiol., 2021; 70 [10]: 001 442. doi: 10.1099/jmm.0.001442)
Transport próbek na posiew i do badań PCR
Wymaz lub aspirat z nosowej części gardła pobrany do identyfikacji B. pertussis lub innych bakterii z rodzaju Bordetellae (np. B. parapertussis) należy pilnie dostarczyć do laboratorium. Przed transportem materiał należy przechowywać w temperaturze pokojowej, aby zapobiec wyginięciu bakterii. Wymazy można umieścić na podłożu Regana-Lowe’a lub Amies, które zawierają węgiel drzewny, lub na uniwersalnym podłożu transportowym. Żywotność bakterii zmienia się po upływie >48 godzin, dlatego próbki materiału należy jak najszybciej przetransportować do laboratorium w temperaturze pokojowej. Do badań PCR można wykorzystać suche wymazówki. Zaleca się wymazówki nylonowe, dakronowe i ze sztucznego jedwabiu, nie powinno się natomiast stosować wymazówek bawełnianych i z alginianem wapnia, ponieważ mogą one hamować reakcję PCR. (…) W razie potrzeby materiał można transportować w torbach termicznych.
Posiew i przechowywanie
Bakterie B. pertussis są wrażliwe na działanie czynników środowiskowych, dlatego aspirat lub wymaz z nosowej części gardła na posiew należy dostarczyć do laboratorium w ciągu 4 godzin od pobrania, w temperaturze pokojowej. Czas transportu można wydłużyć maksymalnie do 48 godzin, jeśli materiał pobrano na odpowiednie podłoże transportowe (np. Regana-Lowe’a). Wykazano, że u dzieci, szczególnie u niemowląt, w porównaniu z dorosłymi, w wymazach z nosowej części gardła znajduje się bardzo dużo DNA pałeczki krztuśca, dlatego rozpoznawanie krztuśca na podstawie posiewu jest szczególnie użyteczne właśnie w tych grupach wiekowych. Dodatnie wyniki posiewów można zwykle uzyskać tylko w ciągu 2–3 tygodni od pojawienia się kaszlu.
Po dostarczeniu do laboratorium materiału pobranego z nosowej części gardła wysiewa się go na świeże podłoże Regana-Lowe’a lub Bordeta-Gengou z 15% krwią baranią lub końską pozbawioną fibrynogenu. Ponieważ bakterie B. pertussis długo rosną, należy stosować selektywne podłoża zawierające składniki hamujące wzrost innych drobnoustrojów. Podłoże Regana-Lowe’a oraz Bordeta-Gengou zawiera cefaleksynę (40 µg/ml).
B. pertussis jest bakterią tlenową. Płytki należy inkubować przez 7 dni w warunkach tlenowych, w temperaturze 35–36°C. Optymalnie wilgotność powietrza powinna wynosić 60% (aby zapobiec wyschnięciu płytki). Płytki należy codziennie kontrolować. Jeżeli po 7 dniach nie uzyska się żadnego wzrostu bakterii, można je zutylizować jako ujemne. Choć B. pertussis rośnie wolniej na podłożu Bordeta-Gengou, częstość izolacji bakterii po 7 dniach inkubacji jest podobna na obu podłożach. Główną zaletą podłoża Bordeta-Gengou jest możliwość uwidocznienia hemolizy. Kolonie B. pertussis i B. parapertussis na płytkach z podłożem Bordeta-Gengou lub Regana-Lowe’a typowo przyjmują postać małych, lśniących kropli podobnych do kropli rtęci. B. pertussis i B. parapertussis uwidocznią się jako typowe, małe, nieruchome ziarniakopałeczki Gram-ujemne. W celu potwierdzenia identyfikacji zaleca się wykonać swoisty test aglutynacji (B. pertussis/B. parapertussis) lub badanie PCR. Wykazano, że wiarygodną metodą jest również spektrometria mas MALDI-TOF MS (matrix assisted laser desorption ionization-time of flight mass spectrometry).
Materiał można przechowywać na podłożu zawierającym: (1) bulion tryptozowo-sojowy (TSB) i 10–20% glicerol lub (2) albuminę surowicy bydlęcej (BSA) – bufor SPG (sacharoza/fosforan/glutaminian).
Posiewy wykorzystuje się do oceny ewolucji drobnoustroju, wykrywania antygenów szczepionkowych oraz rozwoju oporności na antybiotyki. Więcej informacji na temat diagnostyki laboratoryjnej krztuśca można znaleźć w wytycznych WHO (p. 38. pozycja piśmiennictwa w oryginale artykułu – przyp. red.).
Badanie PCR
W postępowaniu diagnostycznym w kierunku krztuśca metodę PCR można wykorzystać tylko u osób, u których kaszel utrzymuje się od <4 tygodni (<28 dni), chociaż czułość badania jest odwrotnie proporcjonalna do czasu od początku objawów do pobrania próbki materiału. Zaleca się, aby materiał do badań pobrać jak najszybciej po wystąpieniu objawów choroby, optymalnie w ciągu <21 dni od zachorowania. Badanie PCR pozwala potwierdzić zakażenie różnymi gatunkami Bordetella. W diagnostyce opartej na badaniach PCR najważniejsze jest:
- prawidłowe pobranie wymazu lub aspiratu z nosowej części gardła
- właściwy wybór powielanego fragmentu DNA
- poprawna interpretacja wyników.
B. pertussis przyczepia się głównie do nabłonka rzęskowego dróg oddechowych, dlatego optymalnie materiał do badań należy pobierać z nosowej części gardła (a nie z nosa lub ustnej części gardła). Do badania można wykorzystać wymaz lub aspirat. Wymazówki powinny być wykonane ze sztucznego jedwabiu, dakronu lub nylonu, nie zaleca się natomiast stosować wymazówek bawełnianych lub z alginianem wapnia. Do transportu można wykorzystać podłoże Amies z węglem drzewnym lub podłoże Stuarta, a wymazówki można transportować w temperaturze otoczenia. Przed analizą PCR należy wyizolować DNA, korzystając z powszechnie dostępnych zestawów.
Gatunki Bordetella można wykrywać poprzez identyfikację różnych docelowych fragmentów genomu. Ponieważ mogą one być obecne w kilku gatunkach bakterii, wybór takiego fragmentu i interpretacja wyników ma bardzo duże znaczenie. Najczęściej jako sekwencje docelowe wykorzystuje się sekwencje insercyjne, przede wszystkim IS481 i IS1001. IS481 jest obecna w genomie B. pertussis, B. holmesii i niektórych izolatów B. bronchiseptica, a IS1001 jest obecna w genomie B. parapertussis i niektórych izolatów B. bronchiseptica. Sekwencje insercyjne występują w genomie w dużej liczbie kopii, co zwiększa czułość detekcji.
Niekiedy dodatni wynik dla IS481 jest interpretowany jako potwierdzenie zakażenia B. pertussis, a dodatni wynik dla IS1001 jako identyfikacja B. parapertussis. Jest to jednak błąd. W celu ostatecznego potwierdzenia zakażenia B. pertussis należy wykorzystać promotor toksyny krztuścowej (ptxP) jako sekwencję docelową, a w przypadku B. holmesii sekwencję IS1001-podobną. W celu osiągnięcia optymalnej czułości i swoistości mocno zaleca się kontrolę: izolacji DNA, wewnętrzną procesu amplifikacji oraz dodatnią i ujemną.
Badanie PCR ma szczególne znaczenie w rozpoznawaniu krztuśca u niemowląt i małych dzieci, ponieważ prawdopodobieństwo wykrycia choroby na wczesnym etapie jest u nich większe niż u dorosłych, którzy mają tendencję do „przeczekiwania” objawów zanim zgłoszą się do lekarza. Jeżeli kaszel utrzymuje się od ≥2–3 tygodni, zaleca się wykonać badania serologiczne (przeciwciała przeciwko toksynie krztuścowej [PT] w klasie IgG), a u chorych osób z kontaktu badanie PCR, ponieważ krztusiec jest wysoce zaraźliwy.
Ilościowe badanie PCR, w porównaniu z klasycznym jakościowym, jest szybsze, wyniki można monitorować online, nie jest konieczne wykrywanie produktów amplifikacji na żelu agarozowym. Aby uniknąć fałszywie dodatnich wyników spowodowanych dużą liczbą cykli PCR, ich maksymalna liczba zwykle wynosi 40. Szczegółowe zalecenia i protokoły postępowania opublikowało European Centre for Disease Prevention and Control (ECDC [2012]) oraz WHO (2014 [p. 38. i 42. pozycja piśmiennictwa w oryginale – przyp. red.]).
Obecnie stosuje się multipleksowe (panelowe) testy PCR, które oprócz pałeczki krztuśca wykrywają także inne drobnoustroje odpowiedzialne za infekcje dróg oddechowych. (…) Takie testy charakteryzują się mniejszą czułością w porównaniu z testami zaprojektowanymi wyłącznie do rozpoznawania krztuśca. Wykazano, że w porównaniu z testami swoistymi dla pałeczki krztuśca, dodatni wynik testów wykrywających wiele drobnoustrojów uzyskano u 56–67% chorych z objawami klinicznymi krztuśca. Wynika to głównie z faktu, że sekwencją docelową w takich testach panelowych jest ptxP występujący w postaci pojedynczej kopii w genomie bakterii. Testy panelowe wykazują zatem mniejszą czułość w potwierdzaniu zakażenia pałeczką krztuśca, jeżeli w próbce materiału jest mało DNA. O tych ograniczeniach należy pamiętać przy wprowadzaniu do diagnostyki laboratoryjnej nowych testów PCR wykrywających równocześnie wiele patogenów. Sekwencje insercyjne charakteryzują się dużą czułością, lecz mniejszą swoistością, a ptxP małą czułością i dużą swoistością. Optymalnie w celu potwierdzenia krztuśca za pomocą badań PCR zaleca się zastosowanie łączne sekwencji insercyjnych (IS481 i IS1001) i ptxP jako sekwencji docelowych.
Badania serologiczne
Pobieranie próbek krwi do badania przeciwciał przeciwko PT w klasie IgG
Zaleca się stosowanie probówek do surowicy bez dodatków. Jeżeli testy serologiczne posiadają odpowiednią walidację, można wykorzystać osocze heparynizowane lub pobrane do probówki z kwasem etylenodiaminotetraoctowym (ethylenediaminetetraacetic acid – EDTA). Surowicę lub osocze należy umieścić w temperaturze pokojowej i szybko odwirować, optymalnie w ciągu 4 godzin od pobrania krwi (maks. w ciągu 24 h). Jeżeli wykonanie testu zaplanowano na później, odwirowaną surowicę można przechowywać w chłodziarce (+2–8°C) maksymalnie przez 7 dni. Po tym czasie próbkę surowicy należy zamrozić (-20°C lub więcej).
Pobieranie materiału z jamy ustnej do badania przeciwciał przeciwko PT w klasie IgG
(…) Próbkę materiału uzyskuje się, pocierając wymazówkę wzdłuż linii dziąsła przez 1–2 minuty, którą następnie umieszcza się w probówce transportowej. W laboratorium wypłukuje się płyn z wymazówki i oznacza w nim przeciwciała przeciwko PT w klasie IgG. Oznaczenie przeciwciał przeciwko PT w treści uzyskanej z jamy ustnej jest wiarygodne. Badanie to wykorzystuje się w Anglii i Walii u pacjentów w wieku 2–17 lat do prowadzenia nadzoru epidemiologicznego oraz analizy ognisk epidemicznych w placówkach edukacyjnych. Poza tymi sytuacjami badania te raczej nie są stosowane.
Badania serologiczne – metody i zalecenia
Potwierdzenie krztuśca za pomocą badań serologicznych jest najbardziej prawdopodobne u osób, u których kaszel utrzymuje się od ≥2–3 tygodni. W tym celu należy oznaczyć przeciwciała przeciwko PT, którą produkuje wyłącznie B. pertussis. Nie są dostępne testy serologiczne pozwalające wykryć zakażenie B. parapertussis lub innymi gatunkami z rodzaju Bordetellae.
Badania serologiczne są przydatne głównie u dzieci w wieku ≥2 lat, młodzieży i dorosłych. U dzieci <2. roku życia krztusiec częściej podejrzewa się na wcześniejszym etapie choroby, kiedy metodą z wyboru jest badanie PCR lub posiew. Poza tym u młodszych dzieci istnieje większe prawdopodobieństwo niedawnego szczepienia przeciwko krztuścowi, które, zwiększając stężenie przeciwciał przeciwko PT, utrudnia interpretację wyniku.
Swoiste dla B. pertussis przeciwciała przeciwko PT można wykryć w teście ELISA lub testach panelowych.
Najważniejsze kryteria, jakie powinny spełniać badania serologiczne:
- jako antygen do opłaszczania płytek stosuje się wyłącznie natywną, oczyszczoną PT, niepozbawioną właściwości toksycznych
- wyniki podaje się w jednostkach międzynarodowych (IU/ml), wykorzystując międzynarodowy standard surowicy o określonym stężeniu przeciwciał klasy IgG przeciwko PT, taki jak WHO Standard Pertussis Antiserum 06/140 lub 06/142 (NIBSC, Potters Bar, Wielka Brytania)
- oznaczane są przeciwciała w klasie IgG przeciwko PT
- wartości standardów i próbek diagnostycznych wykazują zgodność liniową w szerokim zakresie rozcieńczeń. Można stosować mniejszą liczbę rozcieńczeń próbek.
(…) Zaleca się stosowanie zwalidowanych testów opracowanych w laboratoriach (in-house) lub zestawów komercyjnych spełniających powyższe kryteria. Nie zaleca się korzystać z zestawów z innymi antygenami niż PT, które podają wyniki w arbitralnie ustalonych jednostkach.
Kluczowa jest interpretacja uzyskanych wyników. Nie ustalono uniwersalnego punktu odcięcia (cut-off) dla wyniku dodatniego, ale te powszechnie stosowane są bardzo podobne. Ogólnie, wartość punktu odcięcia 100 lub 125 IU/ml wskazuje na niedawno przebytą infekcję (w ciągu roku), a wartość między 50/62,5 IU/ml a <100 IU/ml na infekcję w ciągu kilku ostatnich lat. Na podstawie danych z Danii, Holandii i Wielkiej Brytanii wykazano, że pojedynczy punkt odcięcia dla przeciwciał IgG przeciwko PT przy optymalnej czułości i swoistości może się mieścić w zakresie 60–75 IU/ml.
W praktyce klinicznej rozpoznanie zwykle ustala się na podstawie oznaczenia wykonanego z pojedynczej próbki surowicy. Jeżeli nie można potwierdzić rozpoznania, a jest to wskazane ze względu na obserwowane objawy kliniczne, po upływie 2–4 tygodni od pierwszego oznaczenia należy pobrać drugą próbkę surowicy. Wykazanie w drugiej próbce surowicy stężenia przeciwciał klasy IgG dla PT przekraczającego wartość cut-off, zwiększenia stężenia tych przeciwciał o 100% lub zmniejszenia o 50% w porównaniu z pierwszą próbką, potwierdza aktualne zakażenie pałeczką krztuśca.
Po szczepieniu przeciwko krztuścowi zwiększa się stężenie przeciwciał IgG przeciwko PT, dlatego przez ≥1 rok od podania szczepionki w diagnostyce krztuśca nie należy stosować badań serologicznych. ECDC i WHO opublikowały szczegółowe wytyczne i protokoły dotyczące diagnostyki serologicznej krztuśca (p. 38. i 42. pozycja piśmiennictwa w oryginale – przyp. red.).
Testy wykonywane w miejscu opieki nad chorym (point-of-care)
Na ogół testy point-of-care są bardziej przydatne w przypadku ognisk epidemicznych, ponieważ wynik uzyskuje się szybciej niż po zastosowaniu powszechnych testów PCR, co przekłada się na szybsze rozpoczęcie antybiotykoterapii u chorych lub zastosowanie profilaktyki antybiotykowej u osób z kontaktu. Mimo że takie testy są przydatne klinicznie, rzadko stosuje się je w procesie rozpoznawania krztuśca.
Ramka. Kryteria rozpoznania krztuśca i klasyfikacja przypadku na potrzeby nadzoru epidemiologicznegoa
Kryteria rozpoznania
- Kryteria kliniczne – każda osoba, u której kaszel utrzymuje się od ≥2 tygodni ORAZ która spełnia ≥1 z następujących kryteriów: (1) napady kaszlu, napady bezdechu podczas wdechu, wymioty po napadach kaszlu, (2) każda osoba, u której lekarz rozpoznał krztusiec, (3) każde niemowlę, u którego występują napady bezdechu.
- Kryteria laboratoryjne – konieczne spełnienie ≥1 z następujących warunków: (1) izolacja B. pertussis z materiału klinicznego, (2) wykrycie kwasu nukleinowego B. pertussis w materiale klinicznym, (3) wykazanie zwiększenia o 100% lub zmniejszenia o 50% stężenia swoistych przeciwciał w dwóch próbkach surowicy krwi pobranych w odstępie 3–5 tygodni, (4) wykazanie odpowiedniego stężenia swoistych przeciwciał w pojedynczej próbce surowicy krwi.
- Kryteria epidemiologiczne – powiązanie epidemiologiczne polegające na przeniesieniu z człowieka na człowieka (kontakt z chorym na krztusiec)
Klasyfikacja przypadku
- przypadek możliwy – każda osoba spełniająca kryteria kliniczne
- przypadek prawdopodobny – każda osoba spełniająca kryteria kliniczne i epidemiologiczne
- przypadek potwierdzony – każda osoba spełniająca kryteria kliniczne i laboratoryjne
a Opracowano na podstawie 3. pozycji piśmiennictwa.
Jedną z metod wykorzystywanych w testach point-of-care jest izotermiczna amplifikacja z użyciem starterów zapętlających (loop-mediated isothermal amplification – LAMP), która nie wymaga urządzeń niezbędnych do uzyskania odpowiednio wysokiej temperatury. (…) Na przestrzeni lat udoskonalono testy wykorzystujące metodę LAMP, zwiększając ich czułość i swoistość.
Inną opcją są testy z przepływem bocznym (lateral flow assays), wykrywające przeciwciała we krwi lub antygeny B. pertussis w materiale pobranym z nosowej części gardła. Wykazano, że testy oznaczające przeciwciała przeciwko PT charakteryzują się całkiem dobrą czułością i swoistością. (…) Wykorzystują one metodę chromatografii cieczowej, a ich wynik interpretuje się podobnie jak wynik szybkiego testu w kierunku SARS-CoV-2 (2 paski oznaczają wynik dodatni). Testy te wymagają jeszcze dopracowania i nie są dostępne na rynku.
(W oryginale 149 pozycji piśmiennictwa.)
Komentarz
dr hab. n. med. Katarzyna Piekarska,1
prof. dr hab. n. med. Waldemar Rastawicki,1
dr n. med. Katarzyna Zacharczuk,1 dr hab. n. med.
Iwona Paradowska-Stankiewicz, prof. NIZP-PZH2
1 Zakład Bakteriologii i Zwalczania Skażeń Biologicznych, Narodowy
Instytut Zdrowia Publicznego PZH – Państwowy Instytut Badawczy
2 Pracownia Epidemiologii Chorób Zwalczanych Drogą Szczepień,
Narodowy Instytut Zdrowia Publicznego PZH – Państwowy Instytut Badawczy
Krztusiec (koklusz) to ostre bakteryjne zakażenie dróg oddechowych wywołane Gram-ujemną pałeczką tlenową B. pertussis, wytwarzającą toksynę krztuścową. Źródłem zakażenia jest chory człowiek. Zakażenie najczęściej rozprzestrzenia się drogą kropelkową, przez wdychanie wydzieliny z dróg oddechowych chorego rozpylanej w powietrzu podczas kaszlu lub kichania. Krztusiec jest chorobą zakaźną, o charakterze nawracającym, bardzo zaraźliwą. Okres jej wylęgania wynosi 5–21 dni (zwykle 7–14 dni). Zakaźność jest największa w pierwszych 3 tygodniach choroby (w okresie nieżytowym i na początku okresu napadowego kaszlu), ale zdolność do zakażenia może się utrzymywać nawet przez 4–5 tygodni.1,2
Krztusiec stanowi potencjalne zagrożenie dla życia noworodków i niemowląt w pierwszych 6 miesiącach życia (do czasu ukończenia podstawowego szczepienia przeciwko krztuścowi). Dawniej krztusiec był postrzegany jako choroba wieku dziecięcego, jednak od kilku dekad częstość zachorowań na krztusiec zwiększa się również wśród nastolatków i dorosłych. W tych grupach wiekowych choroba może mieć łagodniejszy przebieg, nietypowy, dlatego może pozostać nierozpoznana. W przypadku nietypowego przebiegu choroby w diagnostyce różnicowej należy uwzględnić inne zakażenia bakteryjne, m.in. B. parapertussis, B. holmesii, B. bronchiseptica, Mycoplasma pneumoniae, Chlamydophila pneumoniae, oraz wirusowe (adenowirusy, RSV, wirus grypy i paragrypy).2
Zachorowania na krztusiec podlegają krajowemu i europejskiemu nadzorowi epidemiologicznemu (w Polsce istnieje obowiązek zgłoszenia zachorowania lub podejrzenia zachorowania do powiatowej stacji sanitarno-epidemiologicznej). Definicje przypadku przyjęte na potrzeby nadzoru epidemiologicznego przedstawiono w ramce.3 Według danych ECDC w 2018 roku w 30 krajach Unii Europejskiej/Europejskiego Obszaru Gospodarczego zgłoszono łącznie 35 627 przypadków krztuśca. Zachorowania najczęściej dotyczyły niemowląt w 1. roku życia (zapadalność 44,4/100<000 populacji), a w dalszej kolejności dzieci w wieku 10–14 lat.4 Epidemiologię zachorowań na krztusiec w Polsce przedstawiono na rycinie 2.5 Krztusiec wciąż pozostaje chorobą endemiczną w naszym kraju, dlatego prawidłowe rozpoznanie jest kluczowe dla oceny sytuacji epidemiologicznej tej choroby. Z danych z nadzoru epidemiologicznego wynika, że większości zgłoszonych przypadków rozpoznaje się na podstawie kryteriów laboratoryjnych (ok. 85%), a około 15% na podstawie objawów klinicznych. U większości pacjentów (ok. 98–99%) w ramach diagnostyki laboratoryjnej wykonano badanie serologiczne oceniające stężenie przeciwciał IgA i IgG przeciwko toksynie krztuścowej [anty-PT]), natomiast u pozostałych osób (1–2%) zlecono badanie metodą reakcji łańcuchowej polimerazy w czasie rzeczywistym (real-time PCR [ok. 0,7–1,7%]) oraz izolację pałeczek krztuśca (ok. 0,3%). Jednym z kluczowych elementów nadzoru epidemiologicznego jest weryfikacja danych, dlatego każdy zgłoszony przypadek jest analizowany m.in. pod kątem kompletności danych. Każdą wątpliwość oraz każdy brak danych pracownicy Zakładu Epidemiologii Chorób Zakaźnych i Nadzoru Narodowego Instytutu Zdrowia Publicznego PZH–Państwowego Instytutu Badawczego (NIZP PZH–PIB) wyjaśniają ze stacją sanitarno-epidemiologiczną. W niektórych przypadkach konieczny jest kontakt z lekarzem.
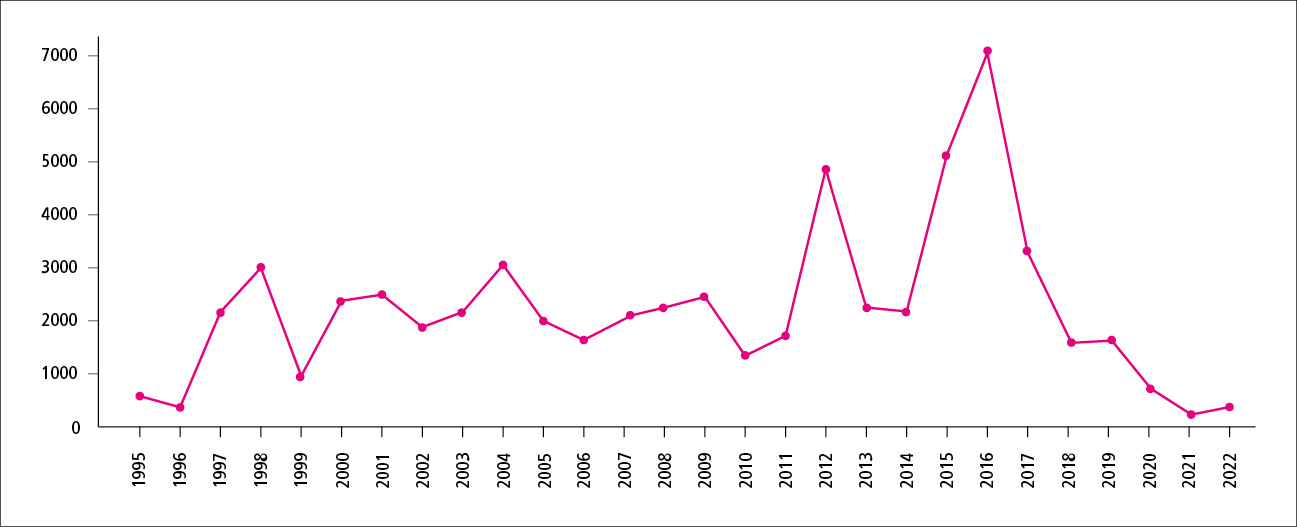
Ryc. 2. Liczba zachorowań na krztusiec w latach 1995–2022 w Polsce (przygotowano na podstawie 5. pozycji piśmiennictwa).
Diagnostyka laboratoryjna
W diagnostyce laboratoryjnej krztuśca zaleca się hodowlę oraz badania molekularne (real-time PCR) i serologiczne. Wybór właściwej metody postępowania zależy m.in. od czasu trwania choroby (p. ryc. 1) i wieku pacjenta.2,6
Wskazaniem do przeprowadzenia badań diagnostycznych, optymalnie przed rozpoczęciem antybiotykoterapii (antybiotyki mogą wpływać na czułość zastosowanych metod, zwłaszcza hodowli i real-time PCR), jest występowanie objawów sugerujących zakażenie pałeczkami krztuśca (kaszel o charakterze napadowym od >7 dni, nasilający się w nocy, który kończy się charakterystycznym zanoszeniem się).
Uzyskanie wiarygodnego wyniku zależy od pobrania odpowiedniego materiału do badań. Ponieważ pałeczki B. pertussis przylegają do nabłonka rzęskowego nosowej części gardła, optymalny do badań diagnostycznych jest wymaz z tylnej ściany nosowej części gardła lub aspirat wydzieliny z nosowej części gardła. Materiał do badań należy pobrać odpowiednią wymazówką zakończoną wacikiem wykonanym z dakronu, nylonu lub sztucznego jedwabiu. Nie należy stosować wymazówek bawełnianych (włókna bawełny zawierają kwasy tłuszczowe hamujące wzrost pałeczek krztuśca) oraz zawierających algininian wapnia (możliwa inhibicja reakcji PCR). Jeżeli pobranego materiału nie może szybko przekazać do laboratorium, wymazówkę należy umieścić w podłożu transportowym, zapewniając odpowiednie warunki transportu (w zależności od wskazań producenta podłoża transportowego 48–72 h w temp. pokojowej).2,6
Hodowla
B. pertussis to drobna Gram-ujemna pałeczka (o średnicy do 1 mm po 3 dniach hodowli), względnie tlenowa, wolno rosnąca, o dużych wymaganiach wzrostowych. Do inkubacji potrzebna jest duża wilgotność. Nawet w optymalnych warunków dodatni wynik hodowli uzyskuje się zaledwie u około 50% chorych na krztusiec. Hodowla ma największą czułość u niemowląt i małych dzieci, ponieważ w tych populacjach w nosowej części gardła zawartość pałeczek krztuśca jest większa niż u dorosłych. Hodowlę nadal uznaje się za „złoty” standard w diagnostyce krztuśca, a jej swoistość wynosi 100%.2,6 Aktualnie w Polsce niewiele laboratoriów diagnostycznych wykorzystuje hodowlę do wykrywania pałeczek krztuśca, natomiast powszechnie stosuje się testy serologiczne, a od kilku lat również, choć w nieco mniejszym zakresie, badania molekularne (Medyczne Laboratoria Diagnostyczne NIZP PZH–PIB wykonują wyłącznie badania molekularne).
Diagnostyka molekularna
Metoda real-time PCR charakteryzuje się większą czułością diagnostyczną i szybciej daje wyik. Czułość PCR wynosi 70–99% i jest największa w 3. tygodniu od wystąpienia objawów (napadowego kaszlu), po czym znacząco się zmniejsza.7 Real-time PCR można stosować jako metodę diagnostyczną do 5 tygodni od wystąpienia objawów krztuśca. W przypadku pałeczek krztuśca w materiale pobranym z górnych dróg oddechowych (wymaz z tylnej ściany nosowej części gardła lub aspirat wydzieliny z nosowej części gardła) poszukuje się obecności dwóch targetów genetycznych (fragmentów DNA) obecnych w genomie B. pertussis, tj. sekwencji insercyjnej – IS481 i promotora toksyny krztuścowej – ptxP. Dobór tych targetów ma wpływ na czułość zastosowanego testu.8,9 Tylko jednoczesne wykrycie IS481 i ptxP pozwala potwierdzić obecność pałeczek B. pertussis w materiale klinicznym.2,6,7 Uwaga: materiał do badania należy pobrać z właściwego miejsca, tj. z tylnej ściany nosowej części gardła, ponieważ ani nos, ani ustna część gardła nie są wyścielone nabłonkiem, do którego pałeczki krztuśca wykazują tropizm.
Diagnostyka serologiczna
Większość testów serologicznych przeznaczonych do rozpoznawania krztuśca przeprowadza się w surowicy krwi. Z tego powodu krew należy pobrać do probówki bez środków zapobiegających krzepnięciu (na tzw. skrzep). Jeśli stosowany test jest odpowiednio zwalidowany, moża użyć probówki z kwasem etylenodiaminotetraoctowym (EDTA).6,10
Metody serologiczne charakteryzują się największą czułością u osób chorych, z kaszlem utrzymującym się od ≥2 tygodni (w zależności od czasu trwania choroby wynosi ona 25–96%).6,10 Badanie serologiczne należy przeprowadzać za pomocą testów immunoenzymatycznych ELISA lub testów chemiluminescencyjnych, korzystając z zestawów komercyjnych lub odpowiednio zwalidowanych zestawów in-house. W diagnostyce serologicznej krztuśca powinno się poszukiwać swoistych przeciwciał klasy IgG (anty-PT) pałeczek B. pertussis. Z tego powodu w zestawach diagnostycznych jako swoisty antygen wykorzystuje się wyłącznie oczyszczoną PT. Stężenie swoistych przeciwciał anty-PT należy podawać w jednostkach międzynarodowych (IU/ml) wyliczonych z krzywej kalibracyjnej, wyznaczonej według wzorców WHO 06/140 lub WHO 06/142. Oznaczanie swoistych przeciwciał klasy IgA anty-PT jest mniej przydatne, ponieważ immunoglobuliny tej klasy są słabo produkowane u dzieci i dorosłych (badanie to charakteryzuje się małą czułością). Nie należy również oznaczać przeciwciał klasy IgM dla pałeczek B. pertussis.6,10-12
Nie ustalono dokładnie, jak należy interpretować wyniki badań serologicznych w kierunku krztuśca. Zazwyczaj przyjmuje się jednak, że wykrycie przeciwciał klasy IgG w stężeniu 100–125 IU/ml świadczy o aktualnym zakażeniu pałeczkami krztuśca, natomiast w stężeniu 50–100 IU/ml o zakażeniu w ciągu kilku ostatnich lat.10
W praktyce klinicznej najczęściej oznacza się stężenie swoistych przeciwciał klasy IgG anty-PT w pojedynczej próbce surowicy (dostępne są testy do oznaczania innych przeciwciał, ale nie zaleca się ich stosować). W przypadku uzyskania wyniku wątpliwego należy ponownie oznaczyć stężenie przeciwciał w drugiej próbce surowicy pobranej 2–4 tygodni po pobraniu pierwszej próbki. Wykazanie w drugiej próbce surowicy przeciwciał w stężeniu przekraczającym wartość cut-off, zwiększenia stężenia przeciwciał o 100% lub zmniejszenia stężenia o 50%, w porównaniu z pierwszą próbką, potwierdza aktualne zakażenie pałeczkami krztuśca.6,10
Piśmiennictwo do komentarza:
1. Wysocki J., Mrukowicz M., Mejza F.: Krztusiec (koklusz). www.mp.pl/interna/chapter/B16.II.18.3.1. (dostęp: 04.04.2023) 2. WHO: Manual for the diagnosis of whooping cough caused by Bordetella pertussis/Bordatella parapertussis. Update 2014. www.who.int/publications/i/item/laboratory-manual-for-the-diagnosis-of-whooping-cough-caused-by-bordetella-pertussis-bordetella-parapertussis.-update-2014 (dostęp: 04.04.2023)3. Definicje przypadków chorób zakaźnych na potrzeby nadzoru epidemiologicznego. wwwold.pzh.gov.pl/oldpage/epimeld/inne/Def_PL2_6b.pdf (dostęp: 04.04.2023)
4. European Centre for Disease Prevention and Control: Pertussis. (W:) ECDC. Annual epidemiological report for 2018. Stockholm, ECDC, 2020
5. Meldunki o zachorowaniach na choroby zakaźne, zakażeniach i zatruciach w Polsce. wwwold.pzh.gov.pl/oldpage/epimeld/index_p.html
6. Laboratory diagnosis and molecular surveillance of Bordetella pertussis. Recommendations from ECDC. ECDC Technical Report, 2022; doi: 10.2900/35054
7. He Q., Schmidt-Schläpfer G., Just M. i wsp.: Impact of polymerase chain reaction on clinical pertussis research: Finnish and Swiss experiences. J. Infect. Dis., 1996; 174: 1288–1295
8. Tatti K.M., Wu K.H., Tondella M.L. i wsp.: Development and evalua- tion of dual-target real-time polymerase chain reaction assays to detect Bordetella spp. Diagn. Microbiol. Infect. Dis., 2008; 61 (3): 264–272
9. CDC: Specimen Collection and Diagnostic Testing. www.cdc.gov/pertussis/clinical/diagnostic-testing/diagnosis-confirmation.html (dostęp: 04.04.2023)
10. Guiso N., Berbers G., Fry N.K. i wsp.: What to do and what not to do in serological diagnosis of pertussis: recommendations from EU reference laboratories. Eur. J. Clin. Microbiol. Infect. Dis., 2011; 30 (3): 307–312
11. Xing D., Markey K., Newland P. i wsp.: EUVAC.NET collaborative study: evaluation and standardisation of serology for diagnosis of pertussis. J. Immunol. Methods., 2011; 372 (1–2): 137–145
12. Markey K., Douglas-Bardsley A., Asokanathan C. i wsp.: Improvement in serological diagnosis of pertussis by external quality assessment. J. Med. Microbiol., 2019; 68 (5): 741–747
























