Tłumaczyła mgr Małgorzata Ściubisz
Komentarz prof. dr hab. n. med. Leszek Szenborn, Klinika Pediatrii i Chorób Infekcyjnych Uniwersytetu Medycznego we Wrocławiu
Skróty: CDC – Centers for Disease Control and Prevention, CRI (congenital rubella infection) – wrodzone zakażenie wirusem różyczki, CRS (congenital rubella syndrome) – zespół różyczki wrodzonej, WHO – Światowa Organizacja Zdrowia
Gudeloglu E., Akillioglu M., Bedir Demirdag T., Unal N.A., Tapisiz A.A., Tropical Doctor, 2022; 0 (0); doi:10.1177/00494755221134327; Copyright © 2022 by SAGE Publications. Reprinted by Permission of SAGE Publications.
Streszczenie
W krajach realizujących programy powszechnych szczepień przeciwko różyczce zachorowania na tę chorobę zdarzają się rzadko. Natomiast w krajach, które nie prowadzą programów powszechnych szczepień oraz w których je z jakichś powodów przerwano, nadal obserwuje się przypadki CRS. Autorzy niniejszego artykułu opisali przypadek dziecka z CRS o typowym przebiegu klinicznym, w tym z zaćmą wrodzoną, głuchotą typu odbiorczego i zmianami w obrębie kości. Za potwierdzenie CRS uznano obecność swoistych przeciwciał IgM przeciwko wirusowi różyczki u matki w I trymestrze ciąży oraz dodatni wynik badania serologicznego w kierunku różyczki u matki i noworodka.
Wprowadzenie
Zespół różyczki wrodzonej (CRS) przebiega z zaćmą, utratą słuchu, wadami serca i zaburzeniami ze strony ośrodkowego układu nerwowego.1,2 Ryzyko wad wrodzonych zasadniczo dotyczy tylko dzieci matek zakażonych wirusem różyczki w pierwszych 16 tygodniach ciąży.3
Opis przypadku
Noworodek płci męskiej urodzony siłami natury w 35. tygodniu ciąży w wyniku samoistnie rozpoczętego porodu (pierwsze dziecko pary niespokrewnionej). Matka w wieku 28 lat, pierworódka, chora na cukrzycę typu 1 i niedoczynność tarczycy. W okresie ciąży przyjmowała insulinę we wstrzyknięciach podskórnych, lewotyroksynę, witaminę D i żelazo. Wynik standardowego badania serologicznego w kierunku toksoplazmozy, różyczki i zakażenia wirusem opryszczki zwykłej (HSV), które wykonano w próbce krwi pobranej w 10. tygodniu ciąży, był ujemny. Inną metodą stwierdzono natomiast swoiste przeciwciała w klasie IgM i IgG przeciwko wirusowi różyczki, przy małym wskaźniku awidności przeciwciał. W kolejnym oznaczeniu wykazano 10-krotne zwiększenie stężenia swoistych przeciwciał IgG, przy jednoczesnym niewykrywalnym stężeniu przeciwciał IgM. W badaniu ultrasonograficznym (USG) płodu nie obserwowano nieprawidłowości.
Przedwczesne pęknięcie błon płodowych nastąpiło <18 godzin przed porodem. W 1. i 5. minucie po urodzeniu noworodek otrzymał odpowiednio 9 i 10 punktów w skali Apgar. Urodzeniowa masa ciała dziecka wynosiła 3500 g, długość ciała 49 cm (94. centyl), a obwód głowy 33 cm (77. centyl). W trakcie 3-dniowej hospitalizacji na oddziale intensywnej terapii noworodka w 11. dobie życia u chłopca przeprowadzono fototerapię z powodu hiperbilirubienemii.
Miesiąc później u niemowlęcia rozpoznano obustronną zaćmę i jaskrę. Obserwowano także umiarkowane powiększenie wątroby. Masa ciała zwiększyła się tylko do 4200 g (zmniejszenie do 30. centyla), a obwód głowy zmniejszył się do 31 cm.
W morfologii krwi stwierdzono neutropenię (1 × 109/l) i wrodzoną niedokrwistość (hematokryt 27,4%). Z kolei w audiometrii odpowiedzi wywołanych pnia mózgu wykazano utratę słuchu w prawym uchu, a w USG głowy – obustronne milimetrowe echogeniczne torbiele w okolicy bruzdy wzgórzowo-ogoniastej. Rezonans magnetyczny mózgowia potwierdził torbiele podwyściółkowe o średnicy 3 mm. W badaniu echokardiograficznym stwierdzono przerost przegrody międzykomorowej serca.
Wyniki badań serologicznych oraz metodą reakcji łańcuchowej polimerazy (PCR) w kierunku zakażenia niemowlęcia wirusem cytomegalii, parwowirusem, HSV, wirusem ospy wietrznej i półpaśca, wirusami zapalenia wątroby, HIV, kiły, odry oraz toksoplazmozy były ujemne. Nie stwierdzono również swoistych przeciwciał IgM przeciwko wirusowi różyczki, natomiast w dwóch oznaczeniach potwierdzono swoiste przeciwciała IgG.
Dyskusja
Przeszukano elektroniczną bazę publikacji medycznych PubMed za lata 1997–2019. Zidentyfikowano 20 opisów przypadków i serii przypadków CRS, które uznano za istotne (p. tab.), i przeanalizowano zgodnie z definicją przypadku zaproponowaną przez amerykańskie Centers for Disease Control and Prevention (CDC).4-23
| Tabela. Opisy przypadków i serii przypadków CRS opublikowane w piśmiennictwie w latach 1997–2019 | |||||||
|---|---|---|---|---|---|---|---|
| Autor, rok publikacji | Kraj | Wyniki badań laboratoryjnych pacjenta | Objawy kliniczne i wyniki badań obrazowych | Status szczepienia przeciwko różyczce matki | Klasyfikacja przypadku CRS (prawdopodobny lub potwierdzony) | Wiek dziecka lub grupa wiekowa | Zgon |
| Bypareddy i wsp., 20164 | Indie | nie wykonano | obustronna zaćma, barwnikowe zwyrodnienie siatkówki o charakterze ziaren pieprzu i soli, uszkodzenie słuchu typu odbiorczego, PDA | nieszczepiona | prawdopodobny | 10 lat | nie |
| Reddy i wsp., 20145 | Indie | nie wykonano | obustronna zaćma, opóźnienie rozwoju, PDA, głuchota | nieznany | prawdopodobny | 10 lat | nie |
| Singh i wsp., 20176 | Indie | dodatni wynik badania PCR | obustronna zaćma, ASD, PDA, małogłowie, powiększenie wątroby i śledziony | nieszczepiona | potwierdzony | noworodek | nie |
| Ionescu i wsp., 20167 | Rumunia | dodatni wynik badania serologicznego na obecność swoistych przeciwciał IgM | obustronna zaćma, ASD, VSD, zwężenie tętnicy płucnej, głuchota typu odbiorczego | nieznany | potwierdzony | 2 lata | nie |
| Mekonnen i wsp., 20178 | Etiopia | nie wykonano | obwodowe zwężenie tętnicy płucnej, PDA, zaćma, opóźnienie rozwoju | nieznany | prawdopodobny | 9 mies. | nie |
| Hussain i wsp., 20199 | Pakistan | dodatni wynik badania serologicznego na obecność swoistych przeciwciał IgM | PDA | nieszczepiona | potwierdzony | noworodek | nie |
| Lazar i wsp., 201510 | Rumunia | dodatni wynik badania PCR | ASD, PDA, obustronna zaćma | nieznany | potwierdzony | noworodek | tak |
| dodatni wynik badania PCR + dodatni wynik badania serologicznego na obecność swoistych przeciwciał IgM | zaćma, jaskra, głuchota, PDA, małogłowie, zmiany radiologiczne w kościach długich (radiolucent bone disease), żółtaczka, powiększenie śledziony | nieznany | potwierdzony | noworodek | tak | ||
| Chauhan i wsp., 201611 | Indie | nie wykonano | PDA, VSD, niedomykalność zastawki trójdzielnej, ubytek przegrody międzyprzedsionkowej, opóźnienie rozwoju, głuchota typu odbiorczego, małogłowie, barwnikowe zwyrodnienie siatkówki | nieznany | prawdopodobny | 7 lat | nie |
| Khurana i wsp., 201912 | Indie | dodatni wynik badania serologicznego na obecność swoistych przeciwciał IgM | obustronna zaćma, powiększenie wątroby i śledziony, małogłowie, ASD, PDA | nieznany | potwierdzony | noworodek | tak |
| Ahuja i wsp., 201513 | Indie | brak danych | VSD, ciężkie upośledzenie słuchu, opóźnienie rozwoju | nieznany | prawdopodobny | 4 lata | nie |
| Fang i wsp., 201314 | USA | dodatni wynik badania PCR + dodatni wynik badania serologicznego na obecność swoistych przeciwciał IgM | hipoplazja łuku poprzecznego aorty, PDA, powiększenie prawej komory serca, obustronna zaćma jądrowa, widoczne zmiany kostne, głuchota typu odbiorczego | nieszczepiona | potwierdzony | noworodek | nie |
| Ajij i wsp.,201415 | Indie | dodatni wynik badania serologicznego na obecność swoistych przeciwciał IgM | osutka skórna typu „muffinki z borówkami” (blueberry muffin), małogłowie, powiększenie wątroby i śledziony, sinicza wrodzona wada serca | nieszczepiona | potwierdzony | noworodek | nie |
| Pitts i wsp., 201416 | USA | dodatni wynik badania PCR + dodatni wynik badania serologicznego na obecność swoistych przeciwciał IgM | małogłowie, powiększenie wątroby i śledziony, hipoplazja łuku poprzecznego aorty, PDA | MMR | potwierdzony | niemowlę | nie |
| Ushida i wsp., 200317 | Japonia | dodatni wynik badania PCR + dodatni wynik badania serologicznego na obecność swoistych przeciwciał IgM | PDA, głuchota typu odbiorczego, obustronna zaćma | RV | potwierdzony | noworodek | nie |
| Ayadi i wsp., 201518 | Tunezja | dodatni wynik badania serologicznego na obecność swoistych przeciwciał IgM | żółtaczka, powiększenie śledziony, małogłowie, osutka skórna typu „muffinki z borówkami” (blueberry muffin) | nieznany | prawdopodobny | noworodek | tak |
| Hwang i wsp., 201019 | Tajwan | nie wykonano | PDA, hipoplazja łuku poprzecznego aorty, zwyrodnienie siatkówki, uszkodzenie słuchu, opóźnienie rozwoju | nieznany | prawdopodobny | noworodek | nie |
| Marchant i wsp., 201620 | Wielka Brytania | dodatni wynik badania PCR + dodatni wynik badania serologicznego na obecność swoistych przeciwciał IgM | obustronna zaćma | nieznany | potwierdzony | noworodek | nie |
| Ooi i wsp., 200521 | Malezja | dodatni wynik badania PCR + dodatni wynik badania serologicznego na obecność swoistych przeciwciał IgM | osutka skórna typu „muffinki z borówkami” (blueberry muffin), małogłowie, powiększenie wątroby i śledziony, PDA, uszkodzenie słuchu | nieznany | potwierdzony | noworodek | nie |
| Forrest i wsp., 200322 | Australia | dodatni wynik badania serologicznego na obecność swoistych przeciwciał IgM | obustronna głuchota typu odbiorczego | nieszczepiona | potwierdzony | noworodek | nie |
| Banerji i wsp., 200523 | Kanada | dodatni wynik badania serologicznego na obecność swoistych przeciwciał IgM i IgG wyizolowanie (hodowla) wirusa z moczu oraz z obu soczewek uzyskanych podczas chirurgicznego usunięcia zaćmy | małogłowie, obustronna zaćma | nieznany | potwierdzony | noworodek | nie |
| ASD – ubytek przegrody międzyprzedsionkowej, CRS – zespół różyczki wrodzonej, MMR – skojarzona szczepionka przeciwko odrze, śwince i różyczce, PCR – reakcja łańcuchowa polimerazy, PDA – przetrwały przewód tętniczy, RV – monowalentna szczepionka przeciwko różyczce, VSD – ubytek przegrody międzykomorowej | |||||||
CDC i Światowa Organizacja Zdrowia (WHO) inaczej definiują wrodzone zakażenie wirusem różyczki (CRI) i CRS.24,25 WHO opracowała kryteria kliniczne podejrzenia CRS i jego potwierdzonego przypadku, a także kryteria laboratoryjne potwierdzonego przypadku CRS lub CRI.25 Natomiast CDC klasyfikuje CRS jako przypadek prawdopodobny, podejrzany, potwierdzony lub tylko jako CRI.24
Następstwa kliniczne CRI mogą być różne – od samoistnego poronienia, wewnątrzmacicznego obumarcia płodu, do urodzenia dziecka z CRS. Największe ryzyko rozwoju CRS (90%) dotyczy dzieci matek zakażonych wirusem różyczki w I trymestrze ciąży.26,27 Wśród objawów CRS obserwuje się wiele różnych wad narządu wzroku, w tym jaskrę, zaćmę, zwyrodnienie barwnikowe siatkówki i małoocze. Inne cechy kliniczne to uszkodzenie słuchu typu odbiorczego, wewnątrzmaciczne ograniczenie wzrastania płodu i wady serca, takie jak zwężenie tętnicy płucnej i przetrwały przewód tętniczy. W późniejszym okresie po urodzeniu obserwuje się uogólnioną osutkę skórną typu „muffinki z borówkami” (ang. blueberry muffin [plamisto-grudkowa osutka koloru sinoczerwonego – przyp. red.]), zapalenie płuc, zmiany kostne, powiększenie wątroby i śledziony, opóźnienie rozwoju, zapalenie mózgu, autyzm, cukrzycę i zaburzenia czynności tarczycy.26,28
Potwierdzeniem rozpoznania jest większe stężenie swoistych przeciwciał IgG przeciwko wirusowi różyczki niż można oczekiwać w przypadku biernego transportu przeciwciał matczynych lub utrzymujące się dłużej, lub izolacja RNA wirusa różyczki z próbki pobranej od dziecka.29 Kryteria rozpoznawania CRS opracowane przez CDC odnoszą się wyłącznie do dziecka, natomiast kryteria WHO obejmują zarówno wyniki badań wykonanych u matki w czasie ciąży, jak i u dziecka po urodzeniu.25,26 Kryteria CDC koncentrują się wyłącznie na wynikach badań przeprowadzonych u dziecka, dlatego ich stosowanie wiąże się z ryzykiem przeoczenia niektórych zachorowań lub opóźnienia rozpoznania.
Wyniki przeprowadzonego przeglądu piśmiennictwa (p. tab.) sugerują, że w obrazie klinicznym CRS dominują wady serca i oczu, natomiast zmiany skórne obserwuje się rzadziej. We wszystkich potwierdzonych przypadkach CRS udokumentowano laboratoryjnie zakażenie wirusem różyczki, tzn. otrzymano dodatni wynik testu serologicznego w kierunku swoistych przeciwciał IgM lub dodatni wynik badania PCR. Opóźnienie rozwoju, które jest jednym z objawów klinicznych CRS, stwierdzono u 4 z 7 dzieci z prawdopodobnym CRS.
Celem niniejszego opisu przypadku jest zwrócenie uwagi na znaczenie szczepień ochronnych w eradykacji różyczki. Należy kontynuować rutynowe szczepienia przeciwko różyczce, koniecznie monitorując ich realizację. Nie dysponujemy leczeniem przyczynowym CRI, dlatego głównym celem musi być profilaktyka.
Piśmiennictwo:
1. Rubella vaccines: WHO position paper. Wkly Epidemiol. Rec., 2011; 86: 301–3162. Plotkin S.A.: Rubella eradication. Vaccine, 2001; 19: 3311–3319
3. Morgan-Capner P., Miller E., Vurdien J.E., et al.: Outcome of pregnancy after maternal reinfection with rubella. CDR (Lond. Engl. Rev.), 1991; 1: R57–R59
4. Bypareddy R., Chawla R., Azad S.V., et al.: Rubella cataract and retinopathy. BMJ, 2016; 2016: bcr2016216112
5. Reddy A.K., Renganathan S.N., Jayamohan A.E., et al.: Gregg syndrome aka embryopathia rubeolaris: CT illustration. BMJ Case Rep., 2014; 2014: bcr2014204204
6. Singh A., Narula S., Kareem H., et al.: An infant with congenital rubella syndrome in developing India. BMJ Case Rep., 2017; 2017: bcr2017221665
7. Ionescu C., Dascalescu D., Cristea M., et al.: Secondary congenital aphakia. Rom. J. Ophthalmol., 2016; 60: 37–39
8. Mekonnen D.: Clinically confirmed congenital Rubella syndrome: the role of echocardiography. Ethiop. J. Health Sci., 2017; 27: 197–202
9. Hussain A.S., Ali S.R., Mohammad N., et al.: Aniridia: a rare manifestation of congenital Rubella syndrome. J. Ayub. Med. Coll. Abbottabad., 2019; 31: 131–133
10. Lazar M., Perelygina L., Martines R., et al.: Immunolocalization and distribution of Rubella antigen in fatal congenital Rubella syndrome. EBioMedicine, 2015; 3: 86–92
11. Chauhan N., Sen M.S., Jhanda S., et al.: Psychiatric manifestations of congenital rubella syndrome: a case report and review of literature. J. Pediatr. Neurosci., 2016; 11: 137–139
12. Khurana S., Bansal A., Saini S.S., et al.: Severe pulmonary arteriopathy in a neonate with congenital Rubella syndrome and patent ductus arteriosus. Indian Pediatr., 2019; 56: 868–872
13. Ahuja R., Shigli A.L., Thakur G., et al.: Dental manifestations of congenital rubella syndrome. BMJ Case Rep., 2015; 2015: bcr2015209382
14. Fang J., Agrawal A., Gowtham S., et al.: Case report: congenital rubella syndrome: a rare but persistent concern in the United States. J. Perinatol., 2013; 33: 899–902
15. Ajij M., Nangia S., Dubey B.S.: Congenital rubella syndrome with blueberry muffin lesions and extensive metaphysitis. J. Clin. Diagn. Res., 2014; 8: PD03–PPD4
16. Pitts S.I., Wallace G.S., Montana B., et al.: Congenital rubella syndrome in child of woman without known risk factors, New Jersey, USA. Emerg. Infect. Dis., 2014; 20: 307–309
17. Ushida M., Katow S., Furukawa S.: Congenital rubella syndrome due to infection after maternal antibody conversion with vaccine. Jpn J. Infect. Dis., 2003; 56: 68–69
18. Ayadi I.D., Hamida E.B.: Intracranial epidural hematoma in a newborn with DIC secondary to congenital rubella. Pan. Afr. Med. J., 2015; 22: 63
19. Hwang S.J., Chen Y.S.: Congenital rubella syndrome with autistic disorder. J. Chin. Med. Assoc., 2010; 73: 104–107
20. Marchant E., Bishop L., Flaxman D., et al.: A case of congenital rubella syndrome and infection in South-East London in 2015: prevention, diagnosis, and the public health response. Br. J. Gen. Pract., 2016; 66: 635–636
21. Ooi H.L., Cheong S.M., Yogeswery S., et al.: Congenital rubella syndrome with positive serology and virus isolation. Med. J. Malaysia, 2006; 61: 248–250
22. Forrest J.M., Burgess M., Donovan T.: A resurgence of congenital rubella in Australia? Commun. Dis. Intell. Q Rep., 2003; 27: 533–536
23. Banerji A., Ford-Jones E.L., Kelly E., et al.: Congenital rubella syndrome despite maternal antibodies. CMAJ, 2005; 172: 1678–1679
24. Centers for Disease Control and Prevention: Rubella, congenital syndrome 2010 case definition. https://ndc.services.cdc.gov/case-definitions/rubella-congenital-syndrome-2010/
25. www.who.int/immunization/monitoring_surveillance/burden/vpd/WHO_SurveillanceVaccinePreventable_03_CRS_BW_R2.pdf?ua=1 (dostęp: 03.02.2022)
26. Reef S.E., Plotkin S.A.: Rubella. (In:) Remington J.S., Klein J.O., Wilson C.B., Nizet V., Maldonado Y.A. (eds): Infectious diseases of the fetus and newborn infant. 8th ed. Philadelphia, Elsevier, 2015: 894–932
27. WHO Vaccines and Diseases: Rubella, 2015. www.who.int/immunization/diseases/rubella/en/ (dostep: 29.07.2016)
28. Kimberlin D.W., Brady M.T., Jackson M.A., Long S.S. (eds): Rubella. American Academy of Pediatrics Red book: 2015 report of the committee on infectious diseases. 30th ed. Itasca, IL, American Academy of Pediatrics, 2015: 688–695
29. Rubella, congenital syndrome. 2007 case definition. www.cdc.gov/osels/ph_surveillance/nndss/casedef/rubellase2007.htm (dostęp: 31.08.2011)
Komentarz
prof. dr hab. n. med. Leszek Szenborn
Klinika Pediatrii i Chorób Infekcyjnych Uniwersytetu Medycznego
we Wrocławiu
Komentowany artykuł może stanowić dla Czytelników tzw. przypominajkę o konieczności zachowania gotowości do rozpoznawania wrodzonego zakażenia wirusem różyczki (CRI), mimo że w epoce powszechnych szczepień obserwuje się je rzadko. Niebezpieczeństwo związane z zakażeniem wirusem różyczki i znaczenie czynnego zapobiegania temu zakażeniu dotyczy przede wszystkim kobiet w ciąży. Wczesne rozpoznanie CRI u niemowlęcia nie zmienia zasadniczo rokowania, ponieważ nie dysponujemy leczeniem przyczynowym, ale kończy diagnostykę, potwierdzając przyczyny wykrytych zaburzeń. Jest także istotne ze względu na potencjalną zaraźliwość pacjenta dla otoczenia, szczególnie kobiet w wieku rozrodczym z personelu medycznego. W praktyce, w diagnostyce zakażeń wrodzonych zawsze trzeba uwzględnić etiologię różyczkową.
Chciałbym zwrócić uwagę na niejasno przedstawione wyniki badań serologicznych wykonanych u ciężarnej kobiety. W 10. tygodniu ciąży uzyskano ujemny wynik badania nie tylko w kierunku różyczki, a kolejne oznaczenie lub przeprowadzone inną metodą wskazywało na początek zakażenia wirusem różyczki, które ostatecznie potwierdzono serokonwersją (zwiększenie miana swoistych przeciwciał w klasie IgG) oraz zwiększeniem awidności przeciwciał. Dalszy opis wskazuje, że po porodzie nie zadbano o potwierdzenie lub wykluczenie zakażenia wirusem różyczki u noworodka, co było błędem. Przy urodzeniu, mimo 3-dniowego pobytu noworodka na oddziale intensywnej terapii, nie ujawniono objawów typowych dla zespołu różyczki wrodzonej (CRS), który ostatecznie rozpoznano dopiero miesiąc później. W opisie zaskakuje interpretacja niedostatecznego przyrostu masy ciała (700 g w ciągu miesiąca?) oraz zmniejszenie o 2 cm obwodu główki dziecka, co musiało wynikać z błędnego pomiaru albo jego fałszywego wyniku przy urodzeniu (np. z powodu obrzęku tkanek). Małogłowie jest bowiem typowym objawem CRS.
Przeprowadzono badania serologiczne lub PCR w kierunku 10 różnych zakażeń z grupy TORCH, ale akurat nie wykonano badania w kierunku RNA wirusa różyczki. Nie podano także, jaki materiał pobrano do badania PCR. Wirusa izoluje się zazwyczaj z ≥1 źródła, po czym w ciągu roku jego wydalanie stopniowo zanika. U dzieci z CRS wiremia oraz wydalanie wirusa do otoczenia z moczem i wydzieliną z górnych dróg oddechowych (nosowa część gardła) utrzymują się długotrwale. Niektórzy pacjenci wydalają wirusa nawet przez klika lat.1
Zaskakujące jest, że 28-letnia matka nie miała swoistych przeciwciał przeciwko CMV, HSV i VZV, a także po szczepieniach (np. przeciwko odrze), które nie przeniknęły przez łożysko. Dziecko urodziło się o czasie. Wskazuje to, że matka prawdopodobnie nie była szczepiona przeciwko odrze i różyczce.
U dziecka wykazano swoiste przeciwciała w klasie IgG przeciwko wirusowi różyczki, ale już nie w klasie IgM. Taki wynik jest możliwy, choć bardziej typowy dla CRI (zwykle w CRS przeciwciała w klasie IgM utrzymują się przez 1. rż.). U zakażonych wewnątrzmacicznie niemowląt bez klinicznych objawów CRS przeciwciała IgM zanikają szybciej, bo już po 1–2 miesiącach.2
W omówionym przypadku szczególną uwagę zwrócono na kryteria rozpoznania CRI, w tym CRS, podkreślając różnice między zaleceniami CDC i WHO. Jedną z nich jest orientacja na rozpoznanie u noworodka, niezależnie od wyników badań matki. Dotyczy to opisanego przypadku, w którym – oprócz zaburzeń typowych dla CRS – przebyte zakażenie wewnątrzmaciczne na wczesnym etapie ciąży potwierdziła jedynie serokonwersja u matki w okresie ciąży. Wykrycie przeciwciał tylko w klasie IgG u dziecka jest niewystarczające, chyba że stwierdzi się ich przedłużone utrzymywanie się we krwi, poza okres przyjęty dla utrzymywania się przeciwciał biernie przekazanych od matki (p. ryc. 1). Według polskich kryteriów, wzorowanych na zaleceniach WHO, opisane dziecko spełniało kliniczne i epidemiologiczne kryteria rozpoznania CRI (p. ramka 1 i 2).3
Ramka 1. Kryteria rozpoznania różyczki wrodzonej, w tym zespołu różyczki wrodzonej wg NIZP–PZHa
I Kryteria kliniczne
- wrodzone zakażenie wirusem różyczki – nie można zdefiniować kryteriów klinicznych
- zespół różyczki wrodzonej – każde niemowlę w wieku <1. rż. lub każde
dziecko martwo urodzone, u którego stwierdzono:
- ≥2 wady wrodzone z grupy A LUB
- 1 wadę wrodzoną z grupy A i 1 wadę wrodzoną z grupy B
– grupa A: zaćma, wrodzona jaskra, wrodzona wada serca, głuchota, zwyrodnienie barwnikowe siatkówki
– grupa B: plamica, powiększenie śledziony, małogłowie, opóźnienie rozwoju, zapalenie opon mózgowo-rdzeniowych i mózgu, zmiany radiologiczne w kościach długich, żółtaczka w ciągu 24 h po urodzeniu
- ≥2 wady wrodzone z grupy A LUB
II Kryteria laboratoryjne
- konieczne spełnienie ≥1 z następujących kryteriów:
- izolacja wirusa różyczki z materiału klinicznego
- wykrycie RNA wirusa różyczki
- stwierdzenie swoistych przeciwciał IgM przeciwko wirusowi różyczki
- utrzymywanie się swoistych przeciwciał IgG przeciwko różyczce w 6.–12. mż. (≥2 próbki z podobnym mianem swoistych przeciwciał IgG).
III Kryteria epidemiologiczne
Każde niemowlę lub każde dziecko martwo urodzone przez kobietę, u której
zakażenie wirusem różyczki w okresie ciąży potwierdzono laboratoryjnie (przeniesienie z człowieka na człowieka – zakażenie wertykalne).
a Opracowano na podstawie 3. pozycji piśmiennictwa.
Ramka 2. Klasyfikacja przypadku różyczki wrodzonej, w tym zespołu różyczki wrodzonej wg NIZP–PZHa
- Przypadek prawdopodobny: każde dziecko martwo urodzone lub
niemowlę, u którego nie wykonano testów LUB u którego uzyskano ujemne
wyniki testów, spełniające ≥1 z następujących kryteriów:
- powiązanie epidemiologiczne ORAZ ≥1 wada wrodzona z grupy A (p. ramka 1)
- spełnione kryteria kliniczne zespołu różyczki wrodzonej (p. ramka 1).
- Przypadek potwierdzony: każde dziecko martwo urodzone spełniające
kryteria laboratoryjne LUB każde niemowlę spełniające kryteria laboratoryjne
ORAZ ≥1 z następujących kryteriów:
- powiązanie epidemiologiczne (p. ramka 1)
- obecność ≥1 wady wrodzonej z grupy A (p. ramka 1).
a Opracowano na podstawie 3. pozycji piśmiennictwa
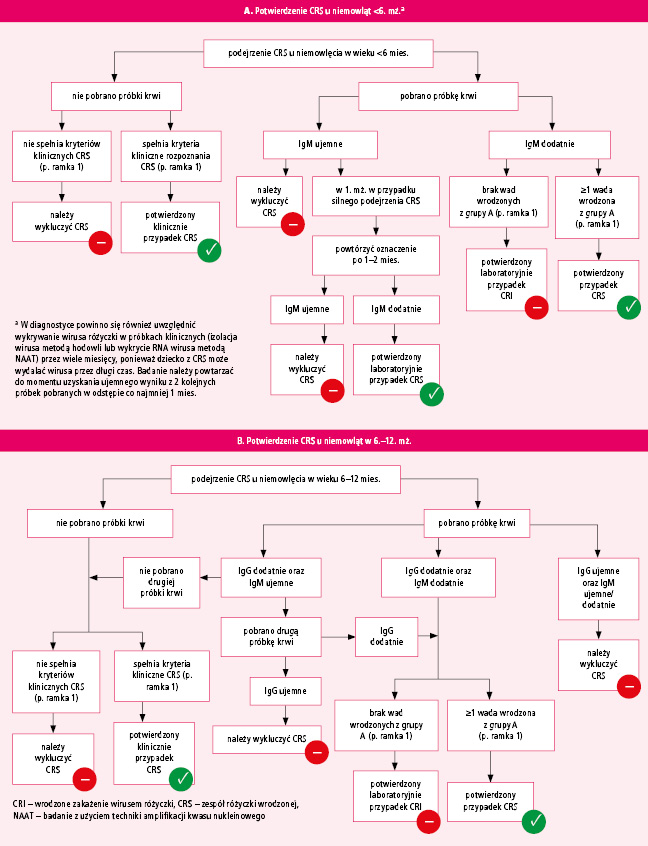 Ryc. Algorytm potwierdzenia CRS u (A) niemowląt w wieku <6 miesięcy i (B) niemowląt w wieku 6–12 miesięcy (na podstawie: World Health Organization: Congenital rubella syndrome: vaccine preventable diseases surveillance standards. www.who.int/publications/m/item/vaccine-preventable-diseases-surveillance-standards-crs [dostęp: 18.01.2023])
Ryc. Algorytm potwierdzenia CRS u (A) niemowląt w wieku <6 miesięcy i (B) niemowląt w wieku 6–12 miesięcy (na podstawie: World Health Organization: Congenital rubella syndrome: vaccine preventable diseases surveillance standards. www.who.int/publications/m/item/vaccine-preventable-diseases-surveillance-standards-crs [dostęp: 18.01.2023])
Powikłania w przebiegu CRI mogą występować także u dzieci zakażonych wewnątrzmacicznie i urodzonych jako zdrowe (śródmiąższowe zapalenie płuc, przewlekła biegunka, zaburzenia odporności). U niektórych pacjentów po latach stwierdza się postępujące zapalenie mózgu (progressive rubella encephalitis), różne zaburzenia autoimmunizacyjne, cukrzycę i zapalenie tarczycy. Patogeneza uszkodzeń płodu wywołanych zakażeniem wirusem różyczki nie została dotychczas jednoznacznie wyjaśniona. W badaniach cytopatologicznych zakażonych tkanek płodu stwierdza się ogniska martwicy, apoptozę oraz zahamowanie podziału ważnych w procesie organogenezy komórek. W hodowlach komórkowych obserwowano także inne objawy zakażenia komórek, w tym mitochondrialne oraz cytoarchitektury.4
Prawdopodobieństwo rozpoznania CRI w Polsce jest bardzo małe. Od 1999 roku Polska spełnia kryteria eliminacji CRS (<1 przypadek/100 000 żywo urodzonych dzieci). W latach 1999–2000 odnotowano po 1 przypadku CRS rocznie, w 2001 rozpoznano 2 przypadki, w 2002 roku – 3, w latach 2003–2006 nie stwierdzono zachorowań, a następnie w latach 2007–2009 po 1 przypadku rocznie. Większość (83%) matek 18 polskich dzieci z CRS rozpoznanym w latach 1997–2008 nie była szczepiona przeciwko różyczce.5 Wyjątkowy okazał się rok 2013, w którym odnotowano 2 potwierdzone przypadki CRS. Wtedy w Polsce zgłoszono wiele zachorowań na różyczkę (38 548 przypadków; zapadalność: 84,4/100 000), której etiologię potwierdza znamiennie większa zapadalność u nieszczepionych przeciwko różyczce młodych mężczyzn w wieku 15–19 lat (911,6/100 000).6 Od 2016 roku włącznie w Polsce nie zgłoszono żadnego przypadku CRI.
Rozpoznanie różyczki należy ustalać na podstawie objawów klinicznych oraz wyników badań laboratoryjnych. Czułość i swoistość rozpoznań różyczki w Polsce od wielu lat jest bardzo mała, co utrudnia ocenę rzeczywistej liczby zachorowań oraz interpretację podejrzeń zachorowań u osób szczepionych. W 2019 roku tylko 3 (1,05%) zgłoszone zachorowania zakwalifikowano jako przypadki potwierdzone w badaniu laboratoryjnym. Pozostałe 282 zachorowania (98,9%) zgłoszono wyłącznie na podstawie objawów klinicznych. Oprócz metod serologicznych najbardziej wiarygodną metodą diagnostyczną CRS i CRI jest badanie PCR w próbce moczu i wymazie z gardła. Badanie PCR można wykonać również w tkankach płodu pozyskanych w czasie badania prenatalnego.
Ze względu na to, że szczepienie przeciwko odrze, śwince i różyczce (MMR) przeprowadza się we wczesnym dzieciństwie, często poruszanym zagadnieniem w kontekście zapobiegania CRS jest trwałość ochrony poszczepiennej przed zakażeniem wirusem różyczki u kobiet w wieku reprodukcyjnym. Szczepionka jest bardzo skuteczna. Po podaniu 2 dawek MMR (szczep Wistar RA27/3) odpowiedź serologiczną przeciwko różyczce stwierdza się u 99–100% zaszczepionych. Mimo iż stężenie przeciwciał stopniowo się zmniejsza wraz z upływem czasu, to u osób zaszczepionych 2 dawkami MMR ochronne stężenie swoistych przeciwciał przeciwko różyczce po 22 i 21 latach stwierdzono odpowiednio u 91 i 100% badanych. Amerykański Advisory Committee on Immunization Practices (ACIP) i WHO uznają, że już 1 dawka szczepionki zawierającej wirus różyczki może zapewnić odporność na całe życie. Więcej szczegółowych informacji na temat odporności poszczepiennej Czytelnicy znajdą w artykule opublikowanym w 2019 roku na łamach „Medycyny Praktycznej – Szczepienia” (p. Skuteczność szczepienia przeciwko różyczce w zapobieganiu zachorowaniom i różyczce wrodzonej – przyp. red.).7
W 2019 roku w Polsce stan zaszczepienia 2 dawkami MMR dziewcząt w 15. roku życia. wynosił 98,3% (od 99,6% w woj. kujawsko-pomorskim do 97,6% w woj. pomorskim).8 Niestety konsekwencją obserwowanego od 2010 roku zjawiska odmawiania szczepień w Polsce będą epidemie wyrównawcze sprzyjające występowaniu CRI.9,10 Wiedza potrzebna do jego rozpoznania na pewno się przyda.
Piśmiennictwo do komentarza:
1. Scheie H.G., Schaffer D.B., Plotkin S.A., Kertesz E.D.: Congental rubella cataracts. Arch. Ophtalmol., 1967; 77: 440–4442. Cherry J.D.: Rubella virus. (W:) Feigin R.D., Cherry J.D. (red.): Textbook of pediatric infectious diseases. Philadelphia W.B., Saunders, 1998: 1955–1944
3. Narodowy Instytut Zdrowia Publicznego–Państwowy Zakład Higieny. Definicje przypadków chorób zakaźnych na potrzeby nadzoru epidemiologicznego. wwwold.pzh.gov.pl/oldpage/epimeld/inne/Def_PL2_6b.pdf (dostęp: 17.01.2023)
4. Lee J.Y., Bowden D.S.: Rubella virus replication and links to teratogenicity. Clin. Microbiol. Rev., 2000; 13: 571–587
5. Zimmerman L., Rogalska J., Wannemuehler K.A. i wsp.: Toward rubella elimination in Poland: need for supplemental immunization activities, enhanced surveillance, and further integration with measles elimination efforts. J. Infect. Dis., 2011; 204 (supl. 1): S389–S395
6. Korczyńska R.M., Paradowska-Stankiewicz I.: Rubella in Poland in 2013. Epidemiological Chronicle, 2015; 69: 213–218
7. Mańdziuk J., Kuchar E., Mrukowicz J.: Skuteczność szczepienia przeciwko różyczce w zapobieganiu zachorowaniom i różyczce wrodzonej. Czy potrzebna jest trzecia dawka? Med. Prakt. Szczep., 2019; 3: 33–38
8. Bogusz J., Augustynowicz E., Paradowska-Stankiewicz I.: Rubella in Poland in 2019. Epidemiological Chronicle, 2021; 75 (4): 588–596
9. Rachlin A., Danovaro-Holliday M.C., Murphy P. i wsp.: Routine vaccination coverage – Worldwide, 2021. MMWR, 2022; 71: 1396–1400
10. Rubella vaccination coverage. Poland. https://immunizationdata.who.int/pages/coverage/RCV.html?CODE=POL&YEAR= (dostęp: 17.01.2023)

















