Tłumaczył dr n. med. Dariusz Stencel
Komentarz dr n. med. Agnieszka Matkowska-Kocjan, lek. Bogna Franczak, Klinika Pediatrii i Chorób Infekcyjnych Uniwersytetu Medycznego
we Wrocławiu
Skróty: allo-HSCT (allogeneic HSCT) – allogeniczny HSCT, auto-HSCT (autologous HSCT) – autologiczny HSCT, GKS – glikokortykosteroidy, GvHD (graft-versus-host-disease) – choroba przeszczep przeciwko gospodarzowi, COVID-19 (coronavirus disease) – choroba spowodowana przez SARS-CoV-2, Hib – Haemophilus influenzae typu b, HSCT (haematopoietic stem cell transplant) – przeszczepienie macierzystych komórek krwiotwórczych, HPV – ludzki wirus brodawczaka, HPV-4 (4-valent human papillomavirus vaccine) – 4-walentna szczepionka przeciwko HPV, IChP – inwazyjna choroba pneumokokowa, IIV – inaktywowana szczepionka przeciwko grypie, LAIV (live attenuated influenza vaccine) – „żywa” szczepionka przeciwko grypie, MenB – meningokoki grupy B, MenACWY – meningokoki grupy A, C, W, Y, MMR (measles mumps rubella vaccine) – szczepionka przeciwko odrze, śwince i różyczce, PCV-13 (13-valent pneumococcal conjugate vaccine) – skoniugowana 13-walentna szczepionka przeciwko pneumokokom, POZ – podstawowa opieka zdrowotna, PPSV-23 (23-valent polysaccharide vaccine) – polisacharydowa 23-walentna szczepionka przeciwko pneumokokom, RZV (recombinant zoster vaccine) – rekombinowana szczepionka przeciwko półpaścowi, WZW – wirusowe zapalenie wątroby, VZV – wirus ospy wietrznej i półpaśca, ZVL (zoster vaccine live) – „żywa” szczepionka przeciwko półpaścowi
Translated from Journal of Infection 86 (1), Miller P., Patel S.R., Skinner R., et al., Joint consensus statement on the vaccination of adult and paediatric haematopoietic stem cell transplant recipients: Prepared on behalf of the British society of blood and marrow transplantation and cellular therapy (BSBMTCT), the Children’s cancer and Leukaemia Group (CCLG), and British Infection Association (BIA): 1–8. doi: 10.1016/j.jinf.2022.11.005. © 2022 The Author(s). Published by Elsevier Ltd on behalf of The British Infection Association. This is an open access article under the CC BY license (http://creativecommons.org/licenses/by/4.0/).
Streszczenie
U biorców HSCT występują niedobory odporności nabytej wobec chorób, którym można zapobiegać poprzez szczepienia. Zgodnie z krajowymi i międzynarodowymi wytycznymi biorców HSCT należy traktować jak osoby nigdy nieszczepione i proponować im realizację wszystkich szczepień od nowa. Celem niniejszego stanowiska jest podsumowanie aktualnych danych naukowych i wytycznych oraz zaproponowanie praktycznego i ustandaryzowanego programu rewakcynacji dzieci i dorosłych po HSCT w Wielkiej Brytanii, uwzględniającego dostępność poszczególnych preparatów oraz warunki ich rejestracji.
Wprowadzenie
W ciągu kilku tygodni po przeszczepieniu macierzystych komórek krwiotwórczych (HSCT) dochodzi do zmniejszenia stężenia swoistych przeciwciał przeciwko chorobom, którym można zapobiegać poprzez szczepienia.1-9 To zaburzenie immunologiczne może się utrzymywać przez wiele lat po przeszczepieniu zarówno autologicznym (auto-HSCT), jak i allogenicznym (allo-HSCT),10 a zakażenia występujące w tym okresie są częstą przyczyną zgonów.11 Biorcy HSCT są podatni na patogeny, przeciwko którym zostali zaszczepieni przed przeszczepieniem, a także narażeni na zwiększone ryzyko zachorowania i zgonu z powodu grypy, odry oraz zakażeń Streptococcus pneumoniae, Haemophilus influenzae typu b (Hib) i Bordetella pertussis.12-15 W związku z tym krajowe i międzynarodowe grupy robocze zalecają, aby biorców HSCT traktować jak osoby nigdy nieszczepione i proponować im realizację wszystkich szczepień od nowa (rewakcynację), zgodnie z programem szczepień przyjętym w kraju zamieszkania. Zalecenia dotyczące ponownego szczepienia biorców HSCT opublikowało kilka towarzystw naukowych, w tym Infectious Diseases Society of America (IDSA), American Society for Transplantation and Cellular Therapy (ASTCT) oraz European Society for Blood and Marrow Transplantation (EBMT).16-18 Temat ten podjęto także w publikacjach z konferencji European Conference on Infections in Leukaemia (ECIL) oraz Consensus Conference on Clinical Practice in GvHD (CCCPG).19,20 Children’s Cancer and Leukemia Group (CCLG) oraz Royal College of Paediatrics and Child Health opracowały zalecenia dotyczące szczepienia dzieci i młodzieży po HSCT.21,22 Mimo tych działań, w badaniach ankietowych przeprowadzonych w ciągu ostatnich 20 lat w ośrodkach przeszczepowych w Wielkiej Brytanii i Irlandii wykazano, że wyszczepialność w tej grupie dzieci była mała, a sposób realizacji szczepień znacznie różnił się między ośrodkami, m.in. w zakresie wyboru preparatów, momentu rozpoczęcia szczepień, wskazań do ich odraczania oraz zasad szczepienia pacjentów z chorobą przeszczep przeciwko gospodarzowi (GvHD) lub będących w trakcie terapii immunosupresyjnej.23-27 Przyczyną tych rozbieżności może być m.in. brak danych naukowych pozwalających sformułować szczegółowe wytyczne praktyki klinicznej, różnice w opublikowanych zaleceniach oraz wyzwania związane z wdrażaniem międzynarodowych zaleceń w praktyce w poszczególnych krajach.
W Wielkiej Brytanii obowiązuje jeden program rutynowych szczepień dzieci i dorosłych opracowany przez National Health Service (NHS), nie ma jednak aktualnego programu rewakcynacji dorosłych biorców HSCT, a ten przygotowany dla dzieci i młodzieży wymaga aktualizacji.21,22 Pandemia COVID-19 podkreśliła znaczenie strategii szczepień pacjentów z niedoborami odporności, w tym biorców HSCT, dlatego zebrane dowody naukowe oraz uzgodnione zalecenia brytyjskie dotyczące realizacji rutynowych szczepień i szczepień przeciwko COVID-19 są nadal aktualne.24
Celem niniejszego stanowiska jest podsumowanie aktualnych danych naukowych i wytycznych oraz zaproponowanie praktycznego i ustandaryzowanego programu rewakcynacji dorosłych i dzieci po HSCT w Wielkiej Brytanii, uwzględniającego dostępność poszczególnych preparatów oraz warunki ich rejestracji. Uznano, że zalecenie zespołu transplantacyjnego dotyczące rewakcynacji u biorców HSCT jest ważnym wskazaniem dla pacjentów,28 a przedstawione stanowisko wraz ze schematami szczepień powinno stanowić cenne narzędzie ułatwiające dyskusję i wspierać skuteczną realizację szczepień.
Zalecany program rewakcynacji w stopniu na jaki pozwalają dostępne dane naukowe dostosowano do programu rutynowych szczepień opracowanego przez NHS, aby móc realizować go w praktyce w Wielkiej Brytanii. Podano również nazwy handlowe szczepionek oraz ich skład, aby w razie braku dostępności którejś z nich móc podać inny preparat o takim samym składzie.
Rozpoczęcie rewakcynacji i wskazania do jej odraczania
Rozpoczęcie rewakcynacji
We wczesnym okresie po HSCT pacjenci są obciążeni większym ryzykiem zachorowania na choroby, którym można zapobiegać poprzez szczepienia, w tym inwazyjną chorobę pneumokokową (IChP) i grypę, oraz zgonu z ich powodu.13,29-31 W związku z tym bardzo ważne jest, aby realizację szczepień rozpocząć możliwie jak najszybciej. Niestety upośledzenie odporności, które zwiększa podatność na zakażenia we wczesnym lub niedługim okresie po HSCT, może też osłabiać odpowiedź immunologiczną na szczepionki. Wykazano, że im dłuższy jest odstęp czasu między HSCT a rozpoczęciem szczepień, tym odpowiedź immunologiczna na szczepionki jest lepsza.32-34 Dotychczas nie ustalono jednak optymalnego czasu rozpoczęcia szczepień po HSCT. Najwcześniejszej, bo już 3 miesiące po HSCT obserwuje się odpowiedź T-zależną na skoniugowane szczepionki polisacharydowe. Nie określono też biomarkerów wskazujących na możliwość uzyskania odpowiedzi na szczepionki, ani nie wykazano wyraźnego związku między liczbą limfocytów CD4+, CD8+ i CD19+ a odpowiedzią immunologiczną na różne szczepionki.35-39 Zgodnie z aktualnymi wytycznymi rewakcynację można rozpocząć 3–6 miesięcy po HSCT, bez rutynowej oceny markerów rekonstytucji układu odpornościowego. W praktyce wiele ośrodków wykonujących allo-HSCT w Wielkiej Brytanii rozpoczyna szczepienia rok po zabiegu.24,38,40,41 Prawie zawsze rewakcynację realizuje się w ramach podstawowej opieki zdrowotnej (POZ), a nie w ośrodkach przeszczepowych.24 Jednak częstotliwość wizyt kontrolnych w ośrodku przeszczepowym, a w niektórych przypadkach także hospitalizacji w ciągu pierwszych 3–6 miesięcy po zabiegu, stanowi istotną przeszkodę w realizacji szczepień w ramach POZ w niedługim czasie po HSCT.
Wskazania do odroczenia rewakcynacji
Zalecenia dotyczące odraczania rewakcynacji oraz podejmowane decyzje są w dużej mierze oparte na opiniach ekspertów, a nie na dowodach naukowych. Na przykład dane dotyczące wpływu GvHD na immunogenność szczepionek są niespójne.2,32,38,42-45 Pacjenci z GvHD lub będący w trakcie terapii immunosupresyjnej są obciążeni większym ryzykiem zakażeń, dlatego zgodnie z aktualnymi wytycznymi preferuje się raczej rozpoczęcie rewakcynacji niż jej odraczanie. Jednak w praktyce tylko nieliczne ośrodki przeszczepowe w Wielkiej Brytanii realizują szczepienia u pacjentów z przewlekłą GvHD.24 W obliczu braku spójnych danych naukowych nie można wydać wiążących zaleceń, jednak można uwzględnić następujące sugestie:
- Przy podejmowaniu decyzji o rozpoczęciu rewakcynacji lub odroczeniu szczepienia u pacjenta po HSCT, u którego doszło do nawrotu choroby, należy uwzględnić rokowanie i możliwość leczenia w przyszłości.
- Pacjenta, u którego przerwano realizację rewakcynacji z powodu nawrotu choroby i wykonania kolejnego auto- lub allo-HSCT, należy ponownie uznać za nigdy nieszczepionego i w odpowiednim czasie ponownie rozpocząć rewakcynację (a nie kontynuować przerwane schematy) po drugim HSCT.
- U biorców HSCT z przewlekłą GvHD o łagodnym przebiegu należy rozpocząć rewakcynację. U pacjentów z przewlekłą GvHD o umiarkowanym lub ciężkim przebiegu można rozważyć rozpoczęcie rewakcynacji, ale uwzględniając intensywność leczenia i przewidywany czas jego trwania.
- U biorców HSCT, którzy przyjmują glikortykosteroidy (GKS) w małej dawce (prednizolon w dawce <0,5 mg/kg mc. lub inny GKS w równoważnej dawce), należy rozpocząć rewakcynację. U pacjentów, którzy są w końcowym okresie stopniowego zmniejszania dawki leku immunosupresyjnego, można rozważyć odroczenie szczepienia na krótki czas do momentu zakończenia tego procesu.
- U biorców HSCT, którzy przyjmują GKS w dużej dawce (prednizolon w dawce >0,5 mg/kg mc. lub inny GKS w równoważnej dawce) lub poddani są terapii skojarzonej przez >6 miesięcy po HSCT, przy podejmowaniu decyzji o szczepieniu lub jego odroczeniu należy uwzględnić wskazania do leczenia, jego intensywność i przewidywany czas trwania.
- U pacjentów, u których rozważa się lub planuje wlew limfocytów dawcy (donor lymphocyte infusions – DLI), należy rozważyć odroczenie rutynowych szczepień do czasu jego zakończenia. Jeżeli z przyczyn epidemiologicznych ryzyko zakażenia danym patogenem jest duże, należy rozważyć priorytetowe podanie wybranych szczepionek (np. inaktywowanej szczepionki przeciwko grypie sezonowej [IIV] lub szczepionki przeciwko COVID-19).
Wybór szczepień i ustalenie harmonogramu
Szczepionki „nieżywe”
Wyniki badań z prospektywnym zbieraniem danych wskazują, że zdarzenia niepożądane po podaniu szczepionki przeciwko grypie sezonowej i pneumokokom występują z podobną częstością u biorców HSCT i w populacji ogólnej. Podobny jest również rodzaj tych zdarzeń oraz ich nasilenie.41,46-49 Nie ma też dowodów, aby szczepionki były czynnikiem wyzwalającym GvHD lub przyczyną jej zaostrzenia.35,41 Jednak w odniesieniu do szczepionek przeciwko COVID-19 w 1 badaniu z randomizacją (RCT) zaobserwowano, że GvHD nasiliła się po podaniu szczepionki mRNA BNT162b (Comirnaty firmy Pfizer) u 4,4% biorców allo-HSCT,50 a w drugim RCT u 4,5% pacjentów po podaniu pierwszej dawki szczepionki. W kolejnym RCT po szczepieniu preparatem mRNA BNT162b lub mRNA-1273 (Spikevax firmy Moderna) u 9,7% pacjentów rozpoznano przewlekłą GvHD, a u 3,5% pacjentów stwierdzono zaostrzenie już istniejącej choroby. Szczepienia z użyciem preparatów „nieżywych” zaleca się nawet pacjentom, u których HSCT wykonano z powodu choroby autoimmunizacyjnej, ponieważ nie ma danych sugerujących, że szczepionki te mogą być przyczyną wznowy choroby.51 Podsumowując, szczepionki „nieżywe” są bezpieczne u biorców HSCT. Pacjenci z tej grupy są narażeni na większe ryzyko zgonu z powodu COVID-19, a korzyści ze szczepienia przewyższają ryzyko z nim związane.52,53
Szczepienie przeciwko błonicy, tężcowi, krztuścowi, polio, Hib oraz WZW typu B
W Wielkiej Brytanii w ramach programu powszechnego podstawowe szczepienie dzieci przeciwko błonicy, tężcowi, krztuścowi, polio, Hib i wirusowemu zapaleniu wątroby (WZW) typu B realizowane jest z użyciem szczepionek wysoce skojarzonych typu „6 w 1” (DTPa-IPV-Hib-HBV; nazwa handlowa Infanrix hexa lub Vaxelis [preparat niedostępny w Polsce – przyp. red.]). Szczepienie obejmujące 3 dawki podawane w miesięcznych odstępach rozpoczyna się w 8. tygodniu życia. Z przyczyn praktycznych szczepionki te stosuje się także przy rewakcynacji biorców HSCT (p. dalej).
Szczepienie przeciwko błonicy, tężcowi i krztuścowi
Zgodnie z aktualnymi międzynarodowymi wytycznymi u biorców HSCT szczepienie przeciwko błonicy, tężcowi i krztuścowi można rozpocząć 6 miesięcy po zabiegu, a pełny schemat obejmuje podanie 3 dawek. Wykazano, że u biorców HSCT immunogenność 3-dawkowego schematu szczepienia przeciwko tężcowi jest większa niż 1-dawkowego,1 natomiast jest podobna w przypadku rozpoczęcia szczepienia 6 lub 18 miesięcy po HSCT.54 Szczepionki przeciwko krztuścowi o zmniejszonej dawce antygenów krztuśca (2,5–8 µg toksoidu krztuścowego [oznaczone małą literą „p”]) stosowane w ramach szczepienia podstawowego charakteryzują się mniejszą immunogennością.55,56 Podobnie u biorców HSCT odpowiedź na szczepionki ze zmniejszoną dawką toksoidu błoniczego (2 IU toksoidu błoniczego [oznaczone małą literą „d”]) wydaje się słabsza niż na szczepionki z dużą dawką (≥30 IU toksoidu błoniczego [oznaczone wielką literą „D”]). Zarówno szczepionka Infanrix hexa, jak i Vaxelis zawierają toksoid tężca, błonicy i krztuśca w dużej dawce (DTPa).
Szczepienie przeciwko polio
Zgodnie z aktualnymi wytycznymi szczepienie przeciwko polio z użyciem preparatu inaktywowanego (IPV) można rozpocząć 6 miesięcy po HSCT. Pełny schemat szczepienia podstawowego obejmuje podanie 3 dawek. Wykazano, że u biorców HSCT immunogenność 3-dawkowego schematu szczepienia z użyciem IPV jest większa niż 1-dawkowego,2-4 natomiast jest podobna w przypadku szczepienia 6 lub 18 miesięcy po HSCT.4
Szczepienie przeciwko Hib
Zgodnie z aktualnymi wytycznymi szczepienie przeciwko Hib z użyciem preparatu skoniugowanego można rozpocząć 6 miesięcy po HSCT. Pełny schemat szczepienia podstawowego obejmuje podanie 3 dawek. Wykazano, że schemat 3-dawkowy zrealizowany 3 lub 6 miesięcy po HSCT charakteryzuje się podobną immunogennością.57 W Wielkiej Brytanii w ramach rutynowych szczepień dzieci do uodpornienia przeciwko Hib stosuje się szczepionki wysoce skojarzone typu „6 w 1” (Infanrix hexa lub Vaxelis), a pełny schemat obejmuje 3 dawki szczepienia podstawowego podawane w odstępie miesiąca i 1 dawkę przypominającą w wieku 12 miesięcy (podawana na jednej wizycie ze skoniugowaną szczepionką przeciwko meningokokom grupy C).
Szczepienie przeciwko WZW typu B
Wytyczne dotyczące szczepienia przeciwko WZW typu B u biorców HSCT są zróżnicowane. Niektórzy eksperci zalecają szczepienie wszystkich biorców,16,58 a inni tylko biorców seroujemnych przed HSCT lub u których po HSCT odporność zmniejszyła się poniżej poziomu ochronnego.17,20 Wykazano, że 3-dawkowy schemat szczepienia przeciwko WZW typu B jest immunogenny u biorców allo-HSCT.59 W Wielkiej Brytanii w ramach rutynowych szczepień dzieci do uodpornienia przeciwko WZW typu B stosuje się szczepionki wysoce skojarzone typu „6 w 1”.
Dawki przypominające
Dostępnych jest niewiele danych dotyczących podawania dawek przypominających biorcom HSCT. W ramach programu rutynowych szczepień dzieci w Wielkiej Brytanii szczepienie przypominające przeciwko błonicy, tężcowi, krztuścowi i polio realizuje się po ukończeniu 3 lat i 4 miesięcy przy użyciu preparatu skojarzonego typu „4 w 1” (nazwa handlowa Repevax [w Polsce pod nazwą Adacel polio – przyp. red.] lub Boostrix-IPV), który zawiera pełną dawkę toksoidu błonicy i krztuśca (DTPa-IPV [w oryginalnym artykule wkradł się błąd – zgodnie z informacją na stronie internetowej brytyjskiej Medicines and Healthcare products Regulatory Agency szczepionki Repevax i Boostrix-IPV to preparaty zawierające antygeny błonicy i krztuśca w zmniejszonej dawce [Tdpa] – przyp. red.]). W ramach kolejnego szczepienia przypominającego, tym razem przeciwko błonicy, tężcowi i polio, w wieku 14 lat stosuje się preparat „3 w 1” o zmniejszonej dawce toksoidu błoniczego (Td-IPV; nazwa handlowa Revaxis [preparat niedostępny w Polsce – przyp. red.]). Z uwagi na brak danych dotyczących realizacji tych szczepień u biorców HSCT zaleca się przestrzeganie programu rutynowych szczepień.
Szczepienie przeciwko meningokokom
Zgodnie z aktualnymi międzynarodowymi wytycznymi biorcom HSCT zaleca się szczepienie przeciwko meningokokom, które można rozpocząć ≥6 miesięcy po zabiegu.20 Szczepienie należy realizować w schematach zgodnych z zaleceniami krajowymi, które są dostosowane do lokalnej epidemiologii zakażeń i dominujących grup meningokoków. Zgodnie z programem rutynowych szczepień w Wielkiej Brytanii niemowlęta otrzymują szczepienie przeciwko meningokokom grupy B (MenB) przy użyciu preparatu skoniugowanego (nazwa handlowa Bexsero) – 2 dawki podstawowe w wieku 8 i 16 tygodni oraz 1 dawkę przypominającą po ukończeniu 1. roku życia, a także szczepienie przeciwko meningokokom grupy A, C, W i Y (MenACWY) – 1 dawkę skoniugowanej szczepionki przeciwko meningokokom grupy C po ukończeniu 1. roku życia (preparat Menitorix) oraz 1 dawkę skoniugowanej szczepionki przeciwko meningokokom A, C, W i Y (preparat Nimenrix lub Menweo) w wieku 14 lat.
Obecnie nie ma danych dotyczących immunogenności szczepionek przeciwko MenB u biorców HSCT. Wykazano, że immunogenność 1 dawki skoniugowanej szczepionki przeciwko MenACWY u biorców HSCT jest mała, ale zwiększa się po podaniu drugiej dawki około 9 miesięcy po pierwszej.40,44,48,60 Zaleca się, aby u biorców HSCT postępować zgodnie z brytyjskim programem rutynowych szczepień przeciwko MenB. Natomiast w odniesieniu do szczepienia przeciwko MenACWY, z uwagi na małą immunogenność 1 dawki, zaleca się podanie 2 dawek szczepionki 8 i 18 miesięcy po HSCT (termin podania obu dawek wybrano ze względów praktycznych, aby pokrywał się z terminem podania innych szczepionek).
Szczepienie przeciwko pneumokokom
Zgodnie z aktualnymi wytycznymi 3–6 miesięcy po HSCT należy podać 3 dawki podstawowego szczepienia przeciwko pneumokokom z użyciem preparatu skoniugowanego (PCV). Po kolejnych 6 miesiącach należy podać 1 dawkę przypominającą PCV lub 23-walentnej szczepionki polisacharydowej (PPSV-23), w zależności od tego, czy u biorcy rozpoznano aktywną GvHD (w zaleceniach nie uwzględniono nowych skoniugowanych szczepionek, 15- i 20-walentnej, p. pkt. 5 komentarza - przyp. red.). Zgodnie z programem rutynowych szczepień dzieci w Wielkiej Brytanii niemowlęta otrzymują 1 dawkę skoniugowanej szczepionki 13-walentnej (PCV-13 [nazwa handlowa Prevenar-13]) w wieku 12 tygodni i kolejną (przypominającą) po ukończeniu 1. roku życia. U osób w wieku ≥65 lat stosuje się PPSV-23 (nazwa handlowa Pneumovax).
Szczepionki przeciw pneumokokom są najintensywniej badanymi szczepionka u biorców HSCT. GvHD jest czynnikiem ryzyka utraty odporności wobec pneumokoków, a pacjenci z GvHD słabo odpowiadają na PPSV-23.61 Wykazano, że u biorców HSCT odpowiedź immunologiczna po podaniu PCV jest większa niż po podaniu PPSV-23,62 a szczepienie z użyciem szczepionki 7-walentnej (PCV-7) 6–9 miesięcy po zabiegu w schemacie 3-dawkowy było bardziej immunogenne niż w schemacie 2-dawkowym.49 Natomiast immunogenność oceniana miesiąc po zakończeniu 3-dawkowego schematu szczepienia z użyciem PCV-7 zrealizowanego 3 lub 9 miesięcy po HSCT była podobna. Uczestnicy tego badania około 6 miesięcy po zakończeniu schematu podstawowego otrzymali również dawkę przypominającą PPSV-23. Prawie u połowy pacjentów, którzy nie odpowiedzieli na szczepienie podstawowe, odpowiedź immunologiczną uzyskano miesiąc po podaniu dawki przypominającej PPSV-23. Należy zauważyć, że trwałość odpowiedzi immunologicznej oceniana po upływie 24 miesięcy była mniejsza w grupie, w której szczepienie przeciwko pneumokokom rozpoczęto już 3 miesiące po HSCT.38 W kolejnym badaniu wykazano, że podanie PPSV-23 może rozszerzyć zakres ochrony o serotypy nieuwzględnione w PCV-7.43 W badaniu z użyciem PCV-13 stwierdzono, że czwarta dawka PCV (przypominająca) podana 6 miesięcy po szczepieniu pierwotnym może wzmocnić słabnącą odpowiedź immunologiczną, ale kosztem większej reaktywności.41
W świetle dowodów przemawiających za 3-dawkowym schematem podstawowym z użyciem PCV, a następnie podaniem dawki przypominającej, zaleca się modyfikację rutynowego schematu szczepienia stosowanego w Wielkiej Brytanii. Podanie dawki przypominającej 18 miesięcy po HSCT ustalono ze względów praktycznych, aby pokrywało się z terminem podania innych szczepionek.
Szczepienie przeciwko HPV
Zgodnie z aktualnymi wytycznymi szczepienie przeciwko ludzkiemu wirusowi brodawczaka (HPV) można rozpocząć 6–12 miesięcy po HSCT i należy je realizować zgodnie z krajowymi zaleceniami.20 Program rutynowych szczepień dzieci w Wielkiej Brytanii obejmuje podanie wszystkim dzieciom w wieku 12–13 lat 2 dawek 4-walentnej szczepionki przeciwko HPV (nazwa handlowa Gardasil) w odstępie 6–24 miesięcy. Szczepienie to można uzupełnić do 25. roku życia (w ramach programu powszechnego – przyp. red.). U pacjentów z upośledzoną odpornością zaleca się 3-dawkowy schemat szczepienia: pierwsze 2 dawki należy podać w odstępie miesiąca, a trzecią dawkę 4–6 miesięcy po pierwszej dawce.63
W Wielkiej Brytanii bardzo rzadko obserwuje się zakażenia HPV <14. roku życia. Choć rozpowszechnienie zakażenia HPV genotypami wysokiego ryzyka (16 i 18), które związane są etiologicznie z rozwojem raka szyjki macicy, jest największe u kobiet w wieku 20–24 lat i wynosi 40%, to pozostają one w grupie ryzyka nawet po ukończeniu 60 lat, kiedy rozpowszechnienie tego zakażenia wynosi 6%.64 U biorców HSCT, u których zabieg wykonano 20 lat temu, skumulowana zapadalność na zakażenie HPV narządów płciowych wynosi 40,1%, a u pacjentów z przewlekłą GvHD aż 67,1%.65 Przewlekła GvHD jest również czynnikiem ryzyka rozwoju nowotworów związanych etiologicznie z HPV.66 Wykazano, że 3 dawki HPV-4 były immunogenne u kobiet w wieku 18–49 lat po HSCT. Pacjentki szczepiono niezależnie od wcześniejszego zakażenia HPV i szczepienia przed zabiegiem, natomiast do badania nie kwalifikowano kobiet z aktywną postacią choroby związaną etiologicznie z HPV.67 U osób wcześniej zakażonych HPV szczepienie może zapewnić ochronę przed innymi genotypami wirusa.
Biorąc pod uwagę krajowe zalecenia dotyczące szczepienia pacjentów z upośledzoną odpornością i powyższe dane, zaleca się, aby wszystkim biorcom HSCT w wieku ≥12 lat proponować 3 dawki szczepionki przeciwko HPV. Z przyczyn praktycznych, aby ograniczyć liczbę wkłuć na jednej wizycie szczepiennej do 4, zaleca się rozpocząć szczepienia ≥6 miesięcy po zabiegu u dzieci oraz ≥18 miesięcy u dorosłych. U pacjentów, u których ryzyko zakażenia HPV w ciągu pierwszych 18 miesięcy po zabiegu jest szczególnie duże, można rozważyć wcześniejsze szczepienie.
Szczepienie przeciwko grypie
W Wielkiej Brytanii w ramach programu rutynowych szczepień osoby z grupy ryzyka mogą skorzystać z corocznego szczepienia przeciwko grypie sezonowej z użyciem IIV. Szczepionka „żywa” donosowa (LAIV) jest przeciwwskazana u pacjentów z upośledzoną odpornością, w związku z tym nie należy jej podawać biorcom HSCT, niezależnie od wieku.68
Wykazano, że u biorców HSCT w ciągu pierwszych 6 miesięcy po przeszczepieniu immunogenność IIV jest niewielka, a przez ≥12 miesięcy od zabiegu odpowiedź immunologiczna na szczepienie jest słabsza.32,34,37,69 Jednak z uwagi na sezonowe występowanie grypy opóźnienie podania IIV do ≥12 miesięcy po HSCT naraża pacjentów na zachorowanie na grypę i zgon z jej powodu. Największe ryzyko zakażenia wirusem grypy dotyczy pacjentów, u których przeszczepienie wykonano w sezonie zachorowań. Ryzyko grypowego zapalenia płuc jest największe w niedługim czasie po HSCT, a ryzyko zgonu w ciągu 30 dni od zachorowania sięga 28%.30,70 Ze względu na brak danych dotyczących alternatywnych strategii postępowania, zgodnie z aktualnymi wytycznymi biorcom auto- lub allo-HSCT zaleca się coroczne szczepienie przeciwko grypie z użyciem IIV. Szczepienie można rozpocząć ≥6 miesięcy po zabiegu.
Szczepienie przeciwko COVID-19
Biorcy HSCT należą do grupy dużego ryzyka zachorowania na COVID-19, dlatego szczepienie to należy wykonać u nich jak najszybciej po zabiegu. Pojawiają się dane dotyczące immunogenności szczepionek przeciwko COVID-19 u biorców HSCT, ale głównie dotyczą one szczepionki mRNA BNT162b2 (Comirnaty). Po podaniu 2 dawek szczepionki BNT162b2 serokonwersję obserwowano u 50–84,7% biorców allo-HSCT i 60–84% biorców auto-HSCT,50,71-74 choć wartości te były istotnie mniejsze niż w grupie kontrolnej obejmującej osoby zdrowe.50 Miano swoistych przeciwciał anty-SARS-CoV-2 u biorców auto- i allo-HSCT było podobne.75 W kilku innych badaniach wykazano, że szczepienie wykonane w ciągu pierwszych 12 miesięcy po HSCT charakteryzowało się mniejszą skutecznością, a biorcy przeszczepu powinni otrzymać szczepienie podstawowe w schemacie 3-dawkowym.50,72,73 Zgodnie z brytyjską „Green Book” biorców HSCT, których zaszczepiono przed zabiegiem, należy ponownie zaszczepić przeciwko COVID-19 po zabiegu, podając im 3 dawki szczepienia podstawowego i 1 dawkę (czwartą) przypominającą. Obecnie trwają intensywne badania nad ustaleniem optymalnej strategii szczepienia przeciwko COVID-19 po HSCT. Aktualne stanowiska dotyczące szczepienia przeciwko COVID-19 po HSCT są dostępne na stronie internetowej BSBMTCT (p. bsbmtct.org/bsbmtct-and-covid/). Szczepionka BNT162b2 (w postaci farmaceutycznej przeznaczonej dla dzieci) zarejestrowana jest do stosowania u dzieci w wieku 5–11 lat (aktualnie szczepionka ta jest zarejestrowana u dzieci w wieku od 6 mies. – przyp. red.).
Szczepienie przeciwko półpaścowi
Pacjenci po HSCT należą do grupy zwiększonego ryzyka zachorowania na półpasiec.59,60 W celu jego zmniejszenia pacjentom podaje się profilaktycznie leki przeciwwirusowe, ale nie określono, jak długo należy stosować taką profilaktykę, a u wielu pacjentów ryzyko reaktywacji wirusa ospy wietrznej i półpaśca (VZV) ponownie zwiększa się po odstawieniu leków. Aktualnie w Wielkiej Brytanii (oraz w Polsce – przyp. red.) dostępna jest rekombinowana szczepionka przeciwko półpaścowi (RZV [nazwa handlowa Shingrix]), która jako antygen zawiera glikoproteinę E VZV skoniugowaną z systemem adiuwantowym AS01B (p. także Szczepionki przeciwko półpaścowi – przyp. red.). Preparat zarejestrowano do stosowania u osób w wieku ≥18 lat. W RCT III fazy z udziałem biorców auto-HSCT w wieku ≥18 lat wykazano, że w okresie obserwacji wynoszącym 21 miesięcy 2 dawki RZV podane w odstępie 1–2 miesięcy już 50–70 dni po zabiegu przeszczepienia zmniejszały ryzyko zachorowania na półpasiec o 68,2%.76 Zalecenia dotyczące stosowania RZV przedstawione w brytyjskiej „Green Book” stanowią część krajowego programu szczepień dla dorosłych w wieku 70–79 lat. Ponieważ w ciągu pierwszych 2–3 lat po HSCT ryzyko zachorowania na półpasiec jest bardzo duże, a w ciągu pierwszych 2 lat po zabiegu stosowanie „żywej” szczepionki przeciwko ospie wietrznej jest przeciwwskazane (p. dalej rozdz. „Szczepionki żywe”), wszystkim dorosłym biorcom HSCT należy podać 2 dawki RZV w odstępie ≥2 miesięcy. Po 24 miesiącach od szczepienia należy oznaczyć stężenie przeciwciał anty-VZV i w razie wyniku ujemnego podać 2 dawki „żywej” szczepionki przeciwko ospie wietrznej (nazwa handlowa Varivax lub Varilrix), pod warunkiem że u pacjenta nie stwierdza się przeciwwskazań do stosowania preparatów „żywych”. Zalecenia dotyczące szczepienia dzieci i młodzieży po HSCT, dla których RZV nie jest zarejestrowana, oraz dorosłych, u których stwierdza się przeciwwskazania do podania RZV, przedstawiono w części dotyczącej szczepionek „żywych” (p. dalej).
Szczepionki „żywe”
Stosowanie szczepionek „żywych” jest przeciwwskazane u pacjentów z niektórymi pierwotnymi lub nabytymi niedoborami odporności, w tym przyjmujących leki immunosupresyjne. Stany te szczegółowo opisano w rozdziale 6. brytyjskiej „Green Book” (p. www.gov.uk/government/collections/immunisation-against-infectious-disease-thegreen-book).77 Zgodnie z aktualnymi wytycznymi u biorców HSCT szczepienie preparatami „żywymi” należy odroczyć do czasu aż będą spełniać określone kryteria. Opierając się na aktualnych wytycznych, łącznie z „Green Book”, zalecane minimalne kryteria dopuszczające podanie szczepionek „żywych” wymieniono poniżej.
Zalecenie 2. U pacjentów po HSCT, którzy spełniają powyższe kryteria, ale kontynuują leczenie z powodu choroby podstawowej, bezpieczeństwo podania szczepionki „żywej” należy ocenić na podstawie zaleceń „Green Book” i ChPL poszczególnych szczepionek.
Zalecenie 3. W rozdziale 11. brytyjskiej „Green Book” należy zaktualizować program szczepień, uwzględniając aktualne wytyczne dotyczące odstępów między szczepionkami „żywymi”.78
Szczepienie przeciwko odrze, śwince i różyczce
Zgodnie z aktualnymi wytycznymi zaleca się, aby u biorców HSCT seroujemnych wobec odry oraz spełniających kryteria podania szczepionek „żywych” szczepienie przeciwko odrze, śwince i różyczce (MMR) wykonać ≥24 miesiące po zabiegu. W naszej opinii ocena statusu serologicznego w kierunku odry u dzieci i młodzieży nie jest obowiązkowa, a brak dostępu do badań serologicznych nie powinien ograniczać szczepienia dorosłych. Zgodnie z programem rutynowych szczepień dzieci w Wielkiej Brytanii szczepienie MMR obejmuje podanie 1 dawki po ukończeniu 1. roku życia oraz dawki przypominającej po ukończeniu 3 lat i 4 miesięcy (z użyciem preparatu VaxPro lub Priorix). Utrata seropozytywności wobec odry, świnki i różyczki po przeprowadzeniu HSCT jest dobrze znanym zjawiskiem.7-9 Wykazano, że 2 dawki MMR podane w ciągu 12–24 miesięcy po HSCT w 6-miesiecznym odstępie były immunogenne.79-81
Zalecenie 1. Dorosłym biorcom auto- lub allo-HSCT seroujemnym w kierunku odry, u których: od zabiegu minęły ≥24 miesiące, nie rozpoznano czynnej GvHD, od ≥12 miesięcy nie stosuje się ogólnoustrojowej terapii immunosupresyjnej i nie stwierdza się innych przeciwwskazań do szczepienia preparatami „żywymi”, należy podać 2 dawki MMR w odstępie ≥6 miesięcy. Brak badań serologicznych nie powinien wykluczać szczepienia, o ile spełnione są pozostałe kryteria.
Zalecenie 2. Dzieciom i młodzieży po auto- lub allo- HSCT, u których: od zabiegu minęły ≥24 miesiące, nie rozpoznano czynnej GvHD, od ≥12 miesięcy nie stosuje się ogólnoustrojowej terapii immunosupresyjnej i nie stwierdza się innych przeciwwskazań do szczepienia preparatami „żywymi”, należy podać 2 dawki MMR w odstępie 6 miesięcy. W razie wybuchu ogniska zachorowań na odrę w danej społeczności należy rozważyć wcześniejsze szczepienie, tj. ≥18 miesięcy po HSCT, pod warunkiem że pacjent spełnia wszystkie inne kryteria podania szczepionki „żywej”.
Szczepienie przeciwko ospie wietrznej i półpaścowi
Szczepionki zawierające „żywy” atenuowany szczep VZV podaje się w celu: (1) zmniejszenia ryzyka pierwotnego zakażenia u pacjentów seroujemnych oraz (2) zmniejszenia ryzyka reaktywacji VZV (półpasiec) u wcześniej zakażonych pacjentów. W pierwszym przypadku stosuje się „żywą” szczepionkę przeciwko ospie wietrznej zawierającą mniejszą ilość wirusa (≥1350 PFU), a w drugim przypadku „żywą” szczepionkę przeciwko półpaścowi (ZVL) zawierającą znacznie więcej wirusa (19 400 PFU).
Szczepienia przeciwko ospie wietrznej nie uwzględniono w programie rutynowych szczepień u dzieci w Wielkiej Brytanii, ale zaleca się je nieuodpornionym pracownikom opieki zdrowotnej i osobom z bliskiego kontaktu pacjentów z niedoborami odporności. Z kolei ZVL uwzględniono w programie szczepień dla osób ≥70. roku życia. Nie zaleca się podawania ZVL pacjentom po HSCT niezależnie od tego, ile czasu minęło od zabiegu, ponieważ zawiera ona dużą ilość atenuowanego VZV i nie ma danych dotyczących bezpieczeństwa takiego postępowania. Zgodnie z aktualnymi wytycznymi u biorców HSCT seroujemnych wobec VZV i spełniających kryteria podania szczepionek „żywych” można rozważyć szczepienie przeciwko ospie wietrznej.
Dane dotyczące szczepienia przeciwko ospie wietrznej biorców HSCT są ograniczone. W kilku badaniach obserwacyjnych z retrospektywnym zbieraniem danych wykazano, że odsetek serokonwersji po szczepieniu przeciwko ospie wietrznej u dzieci i młodzieży wyjściowo seroujemnych, u których auto-HSCT lub allo-HSCT przeprowadzono >24 miesiące wcześniej, wyniósł 35–65%. Wykazano również, że po podaniu drugiej lub trzeciej dawki szczepionki serokonwersję stwierdza się nawet u 71% pacjentów, którzy nie odpowiedzieli na pierwszą dawkę.82,83 Podobnie duże odsetki serokonwersji wykazano w małym badaniu z prospektywnym zbieraniem danych przeprowadzonym u wyjściowo seroujemnych dzieci i nastolatków po HSCT.84 Natomiast stwierdzono, że immunogenność 2 dawek szczepionki przeciwko ospie wietrznej podanych w odstępie 8 tygodni dorosłym pacjentom serododatnim wobec VZV, u których auto-HSCT wykonano 6 miesięcy wcześniej, była niewielka. U uczestników tych badań rzadko obserwowano osutkę ospopodobną i nie odnotowano żadnych niepokojących sygnałów dotyczących bezpieczeństwa. Badanie serologiczne w kierunku VZV należy wykonać u wszystkich pacjentów (w tym dorosłych, którzy 6 mies. po HSCT otrzymali RZV), a w przypadku wyniku ujemnego należy podać 2 dawki szczepionki przeciwko ospie wietrznej, pod warunkiem że pacjent spełnienia wszystkie kryteria umożliwiające szczepienie preparatami „żywymi”.
Zalecenie 1. U dzieci i młodzieży seroujemnych wobec VZV, u których: auto- lub allo-HSCT przeprowadzono ≥24 miesiące wcześniej, nie rozpoznano czynnej GvHD, nie stosuje się ogólnoustrojowej terapii immunosupresyjnej od ≥12 miesięcy i potwierdzono wszystkie inne kryteria umożliwiające szczepienie preparatami „żywymi”, należy rozważyć podanie 2 dawek szczepionki przeciwko ospie wietrznej w odstępie 2 miesięcy.
Zalecenie 2. U wszystkich dorosłych biorców auto- i allo- HSCT (w tym tych, którzy otrzymali RZV) ≥24 miesiące po zabiegu należy wykonać badanie serologiczne w kierunku VZV. U pacjentów seroujemnych, bez aktywnej GvHD, którzy nie otrzymują ogólnoustrojowej terapii immunosupresyjnej od ≥12 miesięcy i spełniają wszystkie inne kryteria umożliwiające szczepienie preparatami „żywymi”, należy rozważyć podanie 2 dawek szczepionki przeciwko ospie wietrznej w odstępie 2 miesięcy.
Zalecenie 3. ZLV jest przeciwwskazana u biorców HSCT i nie należy jej stosować w tej grupie pacjentów.
Szczepienie przeciwko rotawirusom
Zgodnie z brytyjskim programem szczepień szczepionkę przeciwko rotawirusom (RV) podaje się niemowlętom w wieku 8 tygodni. Szczepienie przeciwko RV jest przeciwwskazane u biorców HSCT, ponieważ u pacjentów z upośledzoną odpornością może powodować ciężką biegunkę. Częstość tego zdarzenia niepożądanego jest mniejsza po okresie niemowlęcym, jednak wówczas zwiększa się ryzyko przejściowego wgłobienie jelita związanego ze szczepieniem przeciwko RV.85
Szczepionki podawane z indywidualnych wskazań
Szczepionka przeciwko gruźlicy
W Wielkiej Brytanii szczepionki przeciwko gruźlicy (BCG) nie podaje się w ramach powszechnych szczepień. Szczepienie to zaleca się tylko dzieciom i dorosłym z grup ryzyka, tj. narażonym na kontakt z osobą chorą na gruźlicę z powodu miejsca zamieszkania, kraju pochodzenia lub wykonywanej pracy. Dostępnych jest niewiele danych dotyczących bezpieczeństwa BCG u biorców HSCT. Zgodnie z aktualnymi międzynarodowymi wytycznymi BCG jest przeciwwskazana u biorców HSCT i nie należy jej stosować w tej grupie pacjentów.
Szczepienia przed podróżą
U biorców HSCT podróżujących do regionów występowania chorób endemicznych należy ocenić związane z tym ryzyko w specjalistycznym ośrodku medycyny podróży. Przy podejmowaniu decyzji o szczepieniu należy zwrócić uwagę na rodzaj preparatu („żywe”, „nieżywe”) i pamiętać, że generalnie szczepionki „żywe” są przeciwwskazane u biorców HSCT. Nie dysponujemy również danymi dotyczącymi bezpieczeństwa, immunogenności oraz skuteczności szczepionek przeciwko japońskiemu zapaleniu mózgu, wściekliźnie, durowi brzusznemu i cholerze w tej grupie pacjentów. W kilku badaniach nie stwierdzono zdarzeń niepożądanych po podaniu „żywej” szczepionki przeciwko żółtej gorączce niewielkiej grupie starannie wybranych biorców HSCT.86-88
Ocena odpowiedzi immunologicznej na szczepionki u biorców HSCT
W celu oceny odpowiedzi immunologicznej na szczepienie lub monitorowania jej trwałości można wykonać badania serologiczne. Aktualne wytyczne dotyczące oceny odpowiedzi immunologicznej na szczepionki u biorców HSCT są jednak zróżnicowane, ponieważ nie dysponujemy danymi naukowymi w tym obszarze. Zgodnie z wytycznymi IDSA zaleca się rutynową ocenę stężenia przeciwciał anty-HBs po szczepieniu przeciwko WZW typu B. Zgodnie z zaleceniami CCCPG sugeruje się, aby u pacjentów z przewlekłą GvHD rozważyć wykonanie badań serologicznych po szczepieniu podstawowym i przypominającym. Z kolei zgodnie z wytycznymi ASBMT zaleca się ocenę odpowiedzi immunologicznej na szczepionki przeciwko pneumokokom i WZW typu B, a także rutynowe długookresowe monitorowanie stężenia przeciwciał, oznaczając co 4–5 lat przeciwciała anty-HBs oraz przeciwko odrze, tężcowi, błonicy i polio. W wytycznych ECIL eksperci sugerują ocenę odpowiedzi immunologicznej na szczepionkę przeciwko pneumokokom po 2 latach od jej podania oraz długookresowe monitorowanie odpowiedzi immunologicznej na szczepionkę przeciwko Hib (co 5–10 lat) i DTP (co 3–5 lat). Żadna z powyższych grup ekspertów nie wydała zaleceń dotyczących oceny odpowiedzi immunologicznej po rewakcynacji.
Zalecenie 1. Nie zaleca się rutynowo oceniać odpowiedzi immunologicznej na szczepionki u biorców HSCT. Ocenę odpowiedzi immunologicznej można rozważyć u pacjentów z czynnikami ryzyka słabszej odpowiedzi, takimi jak przewlekła GvHD lub długotrwała terapia immunosupresyjna.
Zalecenie 2. Nie zaleca się długookresowego monitorowania odpowiedzi immunologicznej na szczepionki, a dawki przypominające DTP i szczepionki przeciwko polio należy podawać zgodnie z programem rutynowych szczepień obowiązującym w Wielkiej Brytanii.
Zalecenie 3. Ocenę odpowiedzi immunologicznej na szczepionkę w dowolnym czasie po szczepieniu można rozważyć w określonych sytuacjach klinicznych, takich jak zakażenie mimo szczepienia (tzw. zakażenie z przełamania odporności), zakażenia nawracające lub inne zakażenia związane z niedoborem odporności. Decyzję o ewentualnym podaniu dawek przypominających lub rewakcynacji należy podejmować w każdym przypadku indywidualnie, ponieważ nie dysponujemy danymi naukowymi uzasadniającymi takie postępowanie.
Szczepienie domowników i osób z bliskiego kontaktu
Dorosłych i dzieci mieszkujących z osobami po HSCT lub osoby mające bliski kontakt z biorcami HSCT należy szczepić zgodnie z programem rutynowych szczepień obowiązującym w Wielkiej Brytanii, pamiętając o poniższych zastrzeżeniach.
- Osoby mieszkające z biorcami HSCT lub mające bliski kontakt z biorcami HSCT należy co roku szczepić przeciwko grypie sezonowej. Osobom mającym bliski kontakt z biorcami HSCT, u których zabieg wykonano w ciągu ostatnich 2 miesięcy, lub u których rozpoznano przewlekła GvHD, nie należy podać LAIV, ponieważ istnieje teoretyczne ryzyko przeniesienia atenuowanego wirusa szczepionkowego.
- Pacjenci, u których HSCT wykonano w ciągu ostatnich 2 miesięcy lub u których rozpoznano przewlekłą GvHD, powinni przez 4 tygodnie unikać kontaktu z kałem niemowląt zaszczepionych przeciwko RV, ponieważ istnieje teoretyczne ryzyko przeniesienia atenuowanego wirusa szczepionkowego.
- Osobom mieszkującym z dorosłymi lub dziećmi po HSCT należy zaproponować szczepienie przeciwko COVID-19 zgodnie z aktualnymi krajowymi zaleceniami przedstawionymi w brytyjskiej „Green Book”.
Zapewnienie jakości i kontrola
Zgodnie ze standardami Wspólnego Komitetu Akredytacyjnego (JACIE) Europejskiego Towarzystwa Transplantacji Krwi i Szpiku (EBMT)89 w celu zapewnienia jakości wszystkie placówki medyczne powinny przestrzegać lokalnych Standardowych Procedur Operacyjnych (SOP) dotyczących szczepienia biorców HSCT i prowadzić rejestr szczepień. Po rozpoczęciu rewakcynacji lekarze POZ powinni otrzymać kopię harmonogramu rewakcynacji dzieci (p. Załącznik 1) lub dorosłych (p. Załącznik 2), aby mogli wybrać odpowiednią szczepionkę i czas jej podania (załączniki dostępne są w internetowej wersji artykułu pod adresem: www.journalofinfection.com/article/S0163-4453(22)00646–6/fulltext – przyp. red.). Pacjentów po HSCT należy zachęcać, aby zawsze mieli przy sobie dokumentację szczepień, którą lekarz będzie mógł uzupełnić po podaniu każdej szczepionki. W tym celu można wykorzystać schematy przedstawione w Załączniku 1 i 2 lub książeczkę szczepień dla pacjentów po HSCT opracowaną przez Anthony’ego Nolana (w polskich warunkach można wykorzystać wzór karty [wkładki] do dokumentawania szczepień u biorców HSCT zaproponowany przez dr n. med. A. Matkowską-Kocjan [p. Wytyczne dotyczące szczepień u pacjentów po przeszczepieniu komórek macierzystych szpiku. Zalecenia grupy roboczej European Conference on Infections in Leukemia (ECIL 7) a praktyka kliniczna] – przyp. red.).
Standardy kontroli realizacji szczepień u biorców HSCT
- Odsetek biorców HSCT, którzy rozpoczęli rutynową rewakcynację 6 miesięcy po zabiegu lub u których lekarz przeprowadzający HSCT podjął decyzję o odroczeniu rewakcynacji i ją udokumentował: cel 100%
- Odsetek biorców HSCT, którzy do 24 miesięcy po HSCT otrzymali wszystkie zalecane szczepionki „nieżywe” lub u których lekarz przeprowadzający HSCT podjął decyzję o odroczeniu rewakcynacji i ją udokumentował: cel 100%
- Odsetek biorców HSCT, którzy otrzymali szczepionkę „żywą”, mimo że nie spełniają wszystkich kryteriów pozwalających na jej podanie: cel 0%.
Udział poszczególnych autorów: P.M., S.P., R.S., F.D., A.R., P.H., J.S.,
T.d.S. uczestniczyli w spotkaniach związanych z opracowaniem
manuskryptu. P.M., S.P., R.S., F.D., A.R., A.K., P.H., K.O., J.S., T.d.S.
wnieśli znaczący wkład w opracowanie i przegląd wytycznych oraz
akceptację końcowego dokumentu. P.M., S.P., R.S., F.D., A.R.,
A.K., P.H., A.C., K.O., J.S., K.J., T.d.S. znacząco przyczynili się
do przeglądu i akceptacji ostatecznej wersji dokumentu.
Deklaracja konfliktu interesów: J.S. – honoraria za spotkania
edukacyjne od Jazz, Gilead, Janssen. Członkostwo w komitecie
doradczym firmy Medac oraz członkostwo w IDMC dotyczącym badań
klinicznych prowadzonych przez Kiadis Pharma. Pozostali autorzy
deklarują brak konfliktu interesów.
Materiały uzupełniające: Dodatkowe materiały do artykułu można
znaleźć w wersji elektronicznej (doi: 10.1016/j.jinf.2022.11.005).
Piśmiennictwo:
1. Ljungman P., Wiklund-Hammarsten M., Duraj V., et al.: Response to tetanus toxoid immunization after allogeneic bone marrow transplantation. J. Infect. Dis., 1990; 162: 496–5002. Ljungman P., Duraj V., Magnius L.: Response to immunization against polio after allogeneic marrow transplantation. Bone Marrow Transpl., 1991; 7: 89–93
3. Engelhard D., Handsher R., Naparstek E., et al.: Immune response to polio vaccination in bone marrow transplant recipients. Bone Marrow Transpl., 1991; 8: 295–300
4. Parkkali T., Stenvik M., Ruutu T., et al.: Randomized comparison of early and late vaccination with inactivated poliovirus vaccine after allogeneic BMT. Bone Marrow Transpl., 1997; 20: 663–668
5. Winston D.J., Ho W.G., Schiffman G., et al.: Pneumococcal vaccination of recipients of bone marrow transplants. Arch. Intern. Med., 1983; 143: 1735–1737
6. Giebink G.S., Warkentin P.I., Ramsay N.K., Kersey J.H.: Titers of antibody to pneumococci in allogeneic bone marrow transplant recipients before and after vaccination with pneumococcal vaccine. J. Infect. Dis., 1986; 154: 590–596
7. Ljungman P., Lewensohn-fuchs I., Hammarstrom V., et al.: Long-term immunity to measles, mumps, and rubella after allogeneic bone marrow transplantation. Blood, 1994; 84: 657–663
8. Pauksen K., Duraj V., Ljungman P., et al.: Immunity to and immunization against measles, rubella and mumps in patients after autologous bone marrow transplantation. Bone Marrow Transplant., 1992; 9: 427–432
9. Ljungman P., Fridell E., Lonnqvist B., et al.: Efficacy and safety of vaccination of marrow transplant recipients with a live attenuated measles, mumps, and rubella vaccine. J. Infect. Dis., 1989; 159: 610–615
10. Colton H., Greenfield D.M., Snowden J.A., et al.: Long-term survivors following autologous haematopoetic stem cell transplantation have significant defects in their humoral immunity against vaccine preventable diseases, years on from transplant. Vaccine, 2021; 39: 4778–4783
11. Styczyński J., Tridello G., Koster L., et al.: Death after hematopoietic stem cell transplantation: changes over calendar year time, infections and associated factors. Bone Marrow Transplant., 2020; 55: 126–136
12. Ljungman P., Camara R. de L., Perez-Bercoff L., et al.: Outcome of pandemic H1N1 infections in hematopoietic stem cell transplant recipients. Haematologica, 2011; 96: 1231–1235
13. Kumar D., Humar A., Plevneshi A., et al.: Invasive pneumococcal disease in adult hematopoietic stem cell transplant recipients: a decade of prospective population-based surveillance. Bone Marrow Transplant., 2008; 41: 743–747
14. Kochethu G., Clark F.J., Craddock C.F.: Pertussis: should we vaccinate post transplant? Bone Marrow Transplant., 2006; 37: 793–794
15. Lossos I.S., Breuer R., Or R., et al.: Bacterial pneumonia in recipients of bone marrow transplantation. Transplantation, 1995; 60: 672–678
16. Rubin L.G., Levin M.J., Ljungman P., et al.: 2013 IDSA clinical practice guideline for vaccination of the immunocompromised host. Clin. Infect. Dis., 2014; 58: 1–57
17. Tomblyn M., Chiller T., Einsele H., et al.: Guidelines for preventing infectious complications among hematopoietic cell transplantation recipients: a global perspective. Preface. Bone Marrow Transplant., 2009; 15: 1143–1238
18. Ljungman P., Cordonnier C., Einsele H., et al.: Vaccination of hematopoietic cell transplant recipients. Bone Marrow Transplant., 2009; 44: 521–526
19. Hilgendorf I., Wolff D., Meisel R.: Vaccination of allogeneic haematopoietic stem cell transplant recipients: report from the International consensus conference on clinical practice in chronic GVHD. Vaccine, 2011; 29: 2825–2833
20. Cordonnier C., Einarsdottir S., Cesaro S., et al.: Vaccination of haemopoietic stem cell transplant recipients: guidelines of the 2017 European conference on infections in Leukaemia (ECIL 7). Lancet Infect. Dis., 2019; 19: e200–e212
21. Patel S.R., Skinner R., Heath P.: Vaccinations for paediatric patients treated with standard-dose chemotherapy and haematopoietic stem cell transplantation (HSCT) recipients. 2020 https://www.cclg.org.uk/write/MediaUploads/
22. Royal College of Paediatrics and Child Health: Immunisation of the immunocompromised child. 2002 http://rcpch.adlibhosting.com/files/Immunisation%20of%20the%20Immunocompromised%20Child%C2%A02002-02.pdf
23. Gilleece M., Towlson K., Wilson M., et al.: Vaccination against Infection after Haematopoietic stem cell transplant: a survey of practice in the UK and Ireland. BBMT, 2007; 21: S614–S708
24. Miller P.D.E., de Silva T.I., Skinner R., et al.: Routine vaccination practice after adult and paediatric allogeneic haematopoietic stem cell transplant: a survey of UK NHS programmes. Bone Marrow Transplant., 2017; 52: 775–777
25. Dignan F.L., Hamblin A., Chong A., et al.: Survivorship care for allogeneic transplant patients in the UK NHS: changes centre practice, impact of health service policy and JACIE accreditation over 5 years. Bone Marrow Transplant., 2021; 56: 673–678
26. Bate J., Patel S.R., Chisholm J., Heath P.T.: CCLG) SCG of the CC and LG. Immunisation practices of paediatric oncology and shared care oncology consultants: a United Kingdom survey. Pediatr. Blood Cancer, 2010; 54: 941–946
27. Meiring J., Silva de T., Snowden J.A.: A study of adherence to a vaccination schedule following adult allogeneic haematopoietic stem cell transplants in UK. Bone Marrow Transplant., 2015: 203–204
28. Miller P.D.E., Forster A.S., de Silva T.I., et al.: Sociodemographic and psychological determinants of influenza vaccine intention among recipients of autologous and allogeneic haematopoietic stem cel transplant: a cross-sectional survey of UK transplant recipients using a modified health belief model. BMJ Open, 2018; 8: e021222
29. Hassan I.A., Chopra R., Swindell R., Mutton K.J.: Respiratory viral infections after bone marrow/peripheral stem-cell transplantation: the Christie hospital experience. Bone Marrow Transplant., 2003; 32: 73–77
30. Nichols W.G., Guthrie K.A., Corey L., Boeckh M.: Influenza infections after hematopoietic stem cell transplantation: risk factors, mortality, and the effect of antiviral therapy. Clin. Infect. Dis., 2004; 39: 1300–1306
31. Engelhard D., Cordonnier C., Shaw P.J., et al.: Early and late invasive pneumococcal infection following stem cell transplantation: a European bone marrow transplantation survey. Br. J. Haematol., 2002; 117: 444–450
32. Engelhard D., Nagler A., Hardan I., et al.: Antibody response to a two-dose regimen of influenza vaccine in allogeneic T cell-depleted and autologous BMT recipients. Bone Marrow Transplant., 1993; 11: 1–5
33. Natori Y., Humar A., Lipton J., et al.: A pilot randomized controlled trial of Adjuvanted vs Nonadjuvanted influenza vaccine in adult allogeneic hematopoietic stem cell transplant recipients. In: IDWeek. New Orleans, 2016
34. Karras N., Weeres M., Sessions W., et al.: A randomized trial of one versus two doses of influenza vaccine after allogeneic transplantation. Biol. Blood Marrow Transplant., 2013; 19: 109–116
35. Engelhard D., Zakay-Rones Z., Shapira M.Y., et al.: The humoral immune response of hematopoietic stem cell transplantation recipients to AS03-adjuvanted A/California/7/2009 (H1N1)v-like virus vaccine during the 2009 pandemic. Vaccine, 2011; 29: 1777–1782
36. Karras N., Weeres M., Sessions W., et al.: A randomized trial of one Vs. Two doses of influenza vaccine following allogeneic transplantation. Biol. Blood Marrow Transplant., 2013; 19: 109–116
37. Miller P.D.E., Silva de T., Leonard H., et al.: A comparison of viral microneutralization and haemagglutination inhibition assays as measures of seasonal inactivated influenza vaccine immunogenicity in the first year after reduced intensity conditioning, lymphocyte depleted allogeneic haematopoietic stem cell transplant. Vaccine, 2019; 37: 452–457
38. Cordonnier C., Labopin M., Chesnel V., et al.: Randomized study of early versus late immunization with pneumococcal conjugate vaccine after allogeneic stem cell transplantation. Clin. Infect. Dis., 2009; 48: 1392–1401
39. Boles E.E., Chiuzan C., Ragucci D., Hudspeth M.P.: Analysis of factors affecting immune recovery and initial response to tetanus after DTaP vaccination in pediatric allogeneic HSCT patients. Pediatr. Transplant., 2014; 18: 882–888
40. Parkkali T., Kayhty H., Ruutu T., et al.: A comparison of early and late vaccination with Haemophilus influenzae type b conjugate and pneumococcal polysaccharide vaccines after allogeneic BMT. Bone Marrow Transplant., 1996; 18: 961–967
41. Cordonnier C., Ljungman P., Juergens C., et al.: Immunogenicity, safety, and tolerability of 13-valent pneumococcal conjugate vaccine followed by 23-valent pneumococcal polysaccharide vaccine in recipients of allogeneic hematopoietic stem cell transplant aged =2 years: an open-label study. Clin. Infect. Dis., 2015; 61: 313–323
42. Parkkali T., Kayhty H., Hovi T., et al.: A randomized study on donor immunization with tetanus-diphtheria, Haemophilus influenzae type b and inactivated poliovirus vaccines to improve the recipient responses to the same vaccines after allogeneic bone marrow transplantation. Bone Marrow Transplant., 2007; 39: 179–188
43. Cordonnier C., Labopin M., Chesnel V., et al.: Immune response to the 23-valent polysaccharide pneumococcal vaccine after the 7-valent conjugate vaccine in allogeneic stem cell transplant recipients: results from the EBMT IDWP01 trial. Vaccine, 2010; 28: 2730–2734
44. Mahler M.B., Taur Y., Jean R., et al.: Safety and immunogenicity of the tetravelent protein-conjugated meningococcal vaccine (MCV4) in recipients of related and unrelated allogeneic stem cell transplantation (alloHSCT). Biol Blood Marrow Transplant., 2012; 18: 145–149
45. Barra A., Cordonnier C., Preziosi M.P., et al.: Immunogenicity of Haemophilus influenzae type b conjugate vaccine in allogeneic bone marrow recipients. J. Infect. Dis., 1992; 166: 1021–1028
46. Avetisyan G., Aschan J., Hassan M., Ljungman P.: Evaluation of immune responses to seasonal influenza vaccination in healthy volunteers and in patients after stem cell transplantation. Transplantation, 2008; 86: 257–263
47. Mohty B., Bel M., Vukicevic M., et al.: Graft-versus-host disease is the major determinant of humoral responses to the AS03-adjuvanted influenza A/09/H1N1 vaccine in allogeneic hematopoietic stem cell transplant recipients. Haematologica, 2011; 96: 896–904
48. Lavallade de H., Garland P., Sekine T., et al.: Repeated vaccination is required to optimize seroprotection against H1N1 in the immunocompromised host. Haematologica, 2011; 96: 307–314
49. Meisel R., Kuypers L., Dirksen U., et al.: Pneumococcal conjugate vaccine provides early protective antibody responses in children after related and unrelated allogeneic hematopoietic stem cell transplantation. Blood, 2007; 109: 2322–2326
50. Bergman P., Blennow O., Hansson L., et al.: Safety and efficacy of the mRNA BNT162b2 vaccine against SARS-CoV-2 in five groups of immunocompromised patients and healthy controls in a prospective open-label clinical trial. EBioMedicine, 2021; 74: 103 705
51. Sharrack B., Saccardi R., Alexander T., et al.: Autologous haematopoietic stem cell transplantation and other cellular therapy in multiple sclerosis and immune-mediated neurological diseases: updated guidelines and recommendations from the EBMT autoimmune diseases working party (ADWP) and the joint accreditation committee of EBMT and ISCT (JACIE). Bone Marrow Transplant., 2020; 55: 283–306
52. Malard F., Genthon A., Brissot E., et al.: COVID-19 outcomes in patients with hematologic disease. Bone Marrow Transplant., 2020; 55: 2180–2184
53. Kanellopoulos A., Ahmed M.Z., Kishore B., et al.: COVID-19 in bone marrow transplant recipients: reflecting on a single centre experience. Br. J. Haematol., 2020; 190: e67–e70
54. Parkkali T., Olander R.M., Ruutu T., et al.: A randomized comparison between early and late vaccination with tetanus toxoid vaccine after allogeneic BMT. Bone Marrow Transplant., 1997; 19: 933–938
55. Papadopoulos E.B., Young J.W., Kernan N.A., et al.: Use of the tetanus toxoid, reduced dose diphtheria and pertussis vaccine (Tdap) in allogeneic transplant (alloHCT) recipients. Blood, 2008; 112: 2214
56. Small T.N., Zelenetz A.D., Noy A., et al.: Pertussis immunity and response to tetanus-reduced diphtheria-reduced pertussis vaccine (Tdap) after autologous peripheral blood stem cell transplantation. Biol. Blood Marrow Transplant., 2009; 15: 1538–1542
57. Vance E., George S., Guinan E.C., et al.: Comparison of multiple immunization schedules for Haemophilus influenzae type b-conjugate and tetanus toxoid vaccines following bone marrow transplantation. Bone Marrow Transplant., 1998; 22: 735–741
58. Royal College of Physician of Ireland, Immunisation guidelines for Ireland 2013. http://www.hse.ie/eng/health/immunisation/hcpinfo/guidelines/
59. Jaffe D., Papadopoulos E.B., Young J.W., et al.: Immunogenicity of recombinant hepatitis B vaccine (rHBV) in recipients of unrelated or related allogeneic hematopoietic cell (HC) transplants. Blood, 2006; 108: 2470–2475
60. Cheng M.P., Pandit A., Antin J.H., et al.: Safety and immunogenicity of conjugate quadrivalent meningococcal vaccination after hematopoietic cell transplantation. Blood Adv., 2018; 2: 1272–1276
61. Hammarstrom V., Pauksen K., Azinge J., et al.: Pneumococcal immunity and response to immunization with pneumococcal vaccine in bone marrow transplant patients: the influence of graft versus host reaction. Support Care Cancer, 1993; 1: 195–199
62. Kumar D., Chen M.H., Welsh B., et al.: A randomized, double-blind trial of pneumococcal vaccination in adult allogeneic stem cell transplant donors and recipients. Clin. Infect. Dis., 2007; 45: 1576–1582
63. PublicHealth England, Green Book Human Papillomavirus chapter 18a, PublicHealth England. https://assets.publishing.service.gov.uk/government/uploads/system/uploads/attachment_data/file/1065283/HPV-greenbook-chapter-18a.pdf (accessed 8 May 2022)
64. Kitchener H.C., Almonte M., Wheeler P., et al.: HPV testing in routine cervical screening: cross sectional data from the ARTISTIC trial. Br. J. Cancer, 2006; 95: 56–61
65. Shanis D., Anandi P., Grant C., et al.: Risks factors and timing of genital human papillomavirus (HPV) infection in female stem cell transplant survivors: a longitudinal study. Bone Marrow Transplant., 2018; 53: 78–83
66. Savani B.N., Stratton P., Shenoy A., et al.: Increased risk of cervical dysplasia in long-term survivors of allogeneic stem cell transplantation – implications for screening and HPV vaccination. Biol. Blood Marrow Transplant., 2008; 14: 1072–1075
67. Stratton P., Battiwalla M., Tian X., et al.: Immune response following quadrivalent human papillomavirus vaccination in women after hematopoietic allogeneic stem cell transplant. Jama Oncol., 2020; 6: 696–705
68. Public Health England. Green Book Chapter 19 – Influenza. Public Health England; 2020 https://assets.publishing.service.gov.uk/government/uploads/system/uploads/attachment_data/file/931139/Green_book_chapter_19_influenza_V7_OCT_2020.pdf (accessed 11 Apr 2021)
69. Pauksen K., Linde A., Hammarstrom V., et al.: Granulocyte-macrophage colony-stimulating factor as immunomodulating factor together with influenza vaccination in stem cell transplant patients. Clin. Infect. Dis., 2000; 30: 342–348
70. Whimbey E., Elting L.S., Couch R.B., et al.: Influenza A virus infections among hospitalized adult bone marrow transplant recipients. Bone Marrow Transplant., 1994; 13: 437–440
71. Dhakal B., Abedin S.M., Fenske T.S., et al.: Response to SARS-CoV-2 vaccination in patients after hematopoietic cell transplantation and CAR-T cell therapy. Blood, 2021; 138: 1278–1281
72. Redjoul R., Bouter A.L., Beckerich F., et al.: Antibody response after second BNT162b2 dose in allogeneic HSCT recipients. Lancet Lond. Engl., 2021; 398: 298–299
73. Ram R., Hagin D., Kikozashvilli N., et al.: Safety and immunogenicity of the BNT162b2 mRNA COVID-19 vaccine in patients after allogeneic HCT or CD19-based CART therapy – a single-center prospective cohort study. Transplant. Cell Ther., 2021; 27: 788–794
74. Chiarucci M., Paolasini S., Isidori A., et al.: Immunological response against SARS-COV-2 after BNT162b2 vaccine administration is impaired in allogeneic but not in autologous stem cell transplant recipients. Front. Oncol., 2021; 11: 737 300
75. Maneikis K., Šablauskas K., Ringelevičiute U., et al.: Immunogenicity of the BNT162b2 COVID-19 mRNA vaccine and early clinical outcomes in patients with haematological malignancies in Lithuania: a national prospective cohort study. Lancet Haematol., 2021; 8 (8): e583–e592
76. Bastidas A., Serna J. de L., Idrissi M.E., et al.: Effect of recombinant zoster vaccine on incidence of herpes zoster after autologous stem cell transplantation: a randomized clinical trial. JAMA, 2019; 322: 123
77. Public Health England. Green Book Chapter 6 – Contraindications and Special Considerations. Public Health England; 2017 https://assets.publishing.service.gov.uk/government/uploads/system/uploads/attachment_data/file/655225/Greenbook_chapter_6.pdf (accessed 9 Apr 2021)
78. Public Health England, Green book – Chapter 11 – the UK immunisation schedule, Public Health England. https://assets.publishing.service.gov.uk/government/uploads/system/uploads/attachment_data/file/855727/Greenbook_chapter_11_UK_Immunisation_schedule.pdf (accessed 19 Jun 2021)
79. Olkinuora H., Käyhty H., Davidkin I., et al.: Immunity after (re)vaccination of paediatric patients following haematopoietic stem cell transplantation. Acta Paediatr., 2012; 101: e373–e377
80. Shah G.L., Shune L., Purtill D., et al.: Robust vaccine responses in adult and pediatric cord blood transplantation recipients treated for hematologic malignancies. Biol. Blood Marrow Transplant., 2015; 21: 2160–2166
81. Patel S.R., Ortin M., Cohen B.J., et al.: Revaccination with measles, tetanus, poliovirus, Haemophilus influenzae type B, meningococcus C, and pneumococcus vaccines in children after hematopoietic stem cel transplantation. Clin. Infect. Dis., 2007; 44: 625–634
82. Kussmaul S.C., Horn B.N., Dvorak C.C., et al.: Safety of the live, attenuated varicella vaccine in pediatric recipients of hematopoietic SCTs. Bone Marrow Transplant., 2010; 45: 1602–1606
83. Chou J., Kernan N.A., Prockop S., et al.: Safety and efficacy of the live attenuated varicella vaccine following T replete or T cel depleted related and unrelated haematopoietic cell transplantation. Biol. Blood Marrow Transplant., 2011; 17: 1708–1713
84. Sasadeusz J., Prince H.M., Schwarer A., et al.: Immunogenicity and safety of a two-dose live attenuated varicella vaccine given to adults following autologous hematopoietic stem cell transplantation. Transplant. Infect. Dis., 2014; 16: 1024–1031
85. Patel N.C., Hertel P.M., Estes M.K., et al.: Vaccine-acquired rotavirus in infants with severe combined immunodeficiency. New Engl. J. Med., 2010; 362: 314–319
86. de Fontbrune F.S., Arnaud C., Cheminant M., et al.: Immunogenicity and safety of yellow fever vaccine in allogeneic hematopoietic stem cell transplant recipients after withdrawal of immunosuppressive therapy. J. Infect. Dis., 2017; 217: 494–497
87. Yax J.A., Farnon E.C., Engleberg N.C.: Successful immunization of an allogeneic bone marrow transplant recipient with live, attenuated yellow fever vaccine. J. Travel. Med., 2009; 16: 365–367
88. Gowda R., Cartwright K., Bremner J.A.G., Green S.T.: Yellow fever vaccine: a successful vaccination of an immunocompromised patient. Eur. J. Haematol., 2004; 72: 299–301
89. Snowden J.A., Aljurf M., Hayden P., et al.: Quality Management and Accreditation in Haematopoietic Stem Cell Transplantation and Cellular Therapy: The JACIE Guide. Springer; 2021 https://www.ebmt.org/sites/default/files/2021–03/The-JACIE-Guide.pdf (accessed 6 May 2022)
Komentarz
dr n. med. Agnieszka Matkowska-Kocjan, lek. Bogna Franczak
Klinika Pediatrii i Chorób Infekcyjnych Uniwersytetu Medycznego we Wrocławiu
Przedstawione brytyjskie stanowisko dotyczące szczepienia pacjentów po przeszczepieniu macierzystych komórek krwiotwórczych (HSCT) jest w większości kontynuacją dotychczas obowiązujących wytycznych, m.in. Infectious Diseases Society of America (IDSA) z 2014 roku (p. Szczepienie pacjentów z niedoborem odporności – cz. II – przyp. red.) oraz grupy roboczej European Conference on Infections in Leukaemia (ECIL 7) z 2017 roku (p. Wytyczne dotyczące szczepień u pacjentów po przeszczepieniu komórek macierzystych szpiku. Zalecenia grupy roboczej European Conference on Infections in Leukemia (ECIL 7) a praktyka kliniczna – przyp. red.). Lekarze praktycy realizujący szczepienia w grupach ryzyka w Polsce w ostatnich latach posiłkowali się głównie zaleceniami ECIL 7. Stanowisko brytyjskie opracowano na podstawie obowiązującego w Wielkiej Brytanii programu szczepień ochronnych (PSO), uwzględniając dostępne preparaty szczepionkowe. Poniżej przedstawiam najważniejsze różnice w porównaniu z dotychczasowymi zaleceniami, z uwzględnieniem praktycznych aspektów realizacji szczepień u biorców HSCT w Polsce. Propozycję rozplanowania szczepień u pacjentów po HSCT zgodnie brytyjskim stanowiskiem przedstawiono na rycinie.
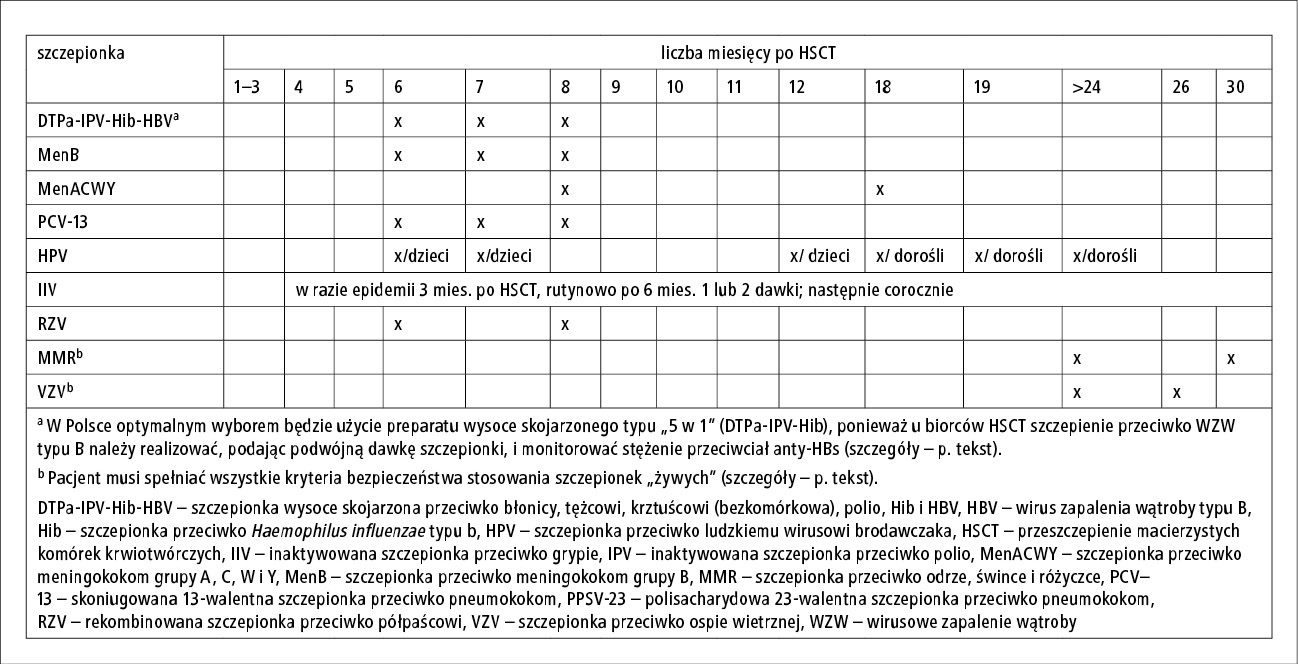
Ryc. Propozycja rozplanowania szczepień u pacjentów po HSCT zgodnie
ze wspólnym stanowiskiem Brytyjskiego Towarzystwa Transplantacji Krwi i Szpiku
oraz Terapii Komórkowej, Grupy ds. Nowotworów i Białaczki u Dzieci oraz Brytyjskiego Stowarzyszenia Zakażeń.
1. W brytyjskich wytycznych jednoznacznie zalecono stosowanie szczepionek wysoce skojarzonych typu „6 w 1” u wszystkich osób po HSCT, niezależnie od wieku. Choć w praktyce szczepionki wysoce skojarzone od dawna stosowano w tej grupie pacjentów w wielu krajach, m.in. w Niemczech i właśnie w Wielkiej Brytanii, to w żadnych dotychczas opublikowanych zaleceniach nie wskazano wprost, które preparaty należy stosować (zalecano jedynie, przeciwko jakim chorobom należy uodpornić pacjenta i w jakim czasie po HSCT przeprowadzić dane szczepienie). W związku z tym wielu lekarzy praktyków nie stosowało szczepionek wysoce skojarzonych typu „6 w 1” lub „5 w 1” u dorosłych, ponieważ są one zarejestrowane do stosowania u dzieci w wieku do 2–3 lat. Niestety aktualna sytuacja w Polsce bardzo utrudnia szczepienie pacjentów po HSCT. Na polskim rynku od dawna niedostępna jest skojarzona szczepionka przeciwko błonicy, tężcowi i krztuścowi typu DTPa zawierająca antygeny w dużej dawce i bezkomórkową komponentę krztuścową (szczepionki o zmniejszonej dawce antygenów typu „Tdpa” charakteryzują się małą u biorców HSCT), niedostępne są również monowalentne szczepionki przeciwko Haemophilus influenzae typu b (Hib [preparat Hiberix jest niedostępny na polskim rynku, z kolei szczepionka Act-Hib kupowana jest przez Ministerstwo Zdrowia od producenta do realizacji obowiązkowego szczepienia przeciwko Hib u dzieci i nie jest dostępna na rynku komercyjnym]). Zatem w celu optymalnej realizacji szczepień u biorców HSCT należy sięgnąć po preparaty wysoce skojarzone, które zawierają zarówno składową przeciwko Hib, jak i antygeny błonicy i krztuśca w dużej dawce. To jednoznaczne zalecenie brytyjskich ekspertów stanowi dla lekarzy praktyków kolejną „podstawę” do stosowania szczepionek wysoce skojarzonych u dorosłych po HSCT, mimo że w ChPL nie ma takiego zapisu (szczegółowe informacje dotyczące stosowania szczepionek off-label przedstawiono w rozdziale „Rola ChPL okiem prawnika”, w artykule „Koadministracja szczepionek” – przyp. red.). W takiej sytuacji pacjenta zawsze należy poinformować, że szczepionka jest stosowana poza wskazaniami rejestracyjnymi. W warunkach polskich optymalnym rozwiązaniem będzie szczepienie szczepionką wysoce skojarzoną typu „5 w 1”, ponieważ zawiera składową przeciwko Hib, ale nie zawiera składowej przeciwko WZW typu B (szczegóły – p. pkt 2).
2. Zgodnie z polskim PSO biorcom HSCT należy podać podwójną dawkę szczepionki przeciwko WZW typu B, a liczbę dawek ustalić w zależności od stężenia przeciwciał anty-HBs, które należy monitorować (pierwsze oznaczenie należy wykonać 4–6 tyg. po podaniu ostatniej dawki schematu podstawowego). Stężenie przeciwciał anty-HBs powinno wynosić ≥100 IU/l. Badanie kontrolne należy wykonywać co 6 miesięcy, a w przypadku zmniejszenia się stężenia przeciwciał do wartości <100 IU/l podać podwójną dawkę szczepionki.
3. Pewien niedosyt w brytyjskim stanowisku pozostawia rozdział dotyczący przeciwwskazań do rewakcynacji biorców HSCT. Autorzy odnoszą się jedynie do granicznych dawek glikokortykosteroidów (GKS), które stosuje się u pacjentów z przewlekłą chorobą przeszczep przeciwko gospodarzowi (GvHD). Wiadomo jednak, że pacjenci z tej grupy mogą przyjmować również inne leki immunosupresyjne, na przykład cyklosporynę A, mykofenolan mofetylu (w monoterapii lub w skojarzeniu z innymi lekami immunosupresyjnymi). Ten rozdział stanowiska należy interpretować razem z rozdziałem dotyczącym stosowania szczepionek „żywych”, w którym jednoznacznie wskazano, że pacjentom z przewlekłą GvHD absolutnie nie należy podawać preparatów „żywych”. W praktyce u wielu pacjentów między HSCT a rewakcynacją mija bardzo dużo czasu. W związku z tym, jeżeli na rozpoczęcie szczepień zgłosi się pacjent z przewlekłą GvHD, u którego HSCT wykonano 2,5 roku wcześniej, to nie można mu podać szczepionek „żywych”, choć biorąc po uwagę czas, jaki upłynął po zabiegu (>24 mies.), lekarz mógłby rozważyć takie rozwiązanie. W związku z tym pełny obraz bezpieczeństwa szczepienia pacjentów z przewlekłą GvHD dają dopiero oba te rozdziały. Wśród przeciwwskazań do rozpoczęcia szczepień po HSCT nie wymieniono również rytuksymabu, który także stosuje się u tych pacjentów. Szczepionki „żywe” można podawać dopiero ≥12 miesięcy po podaniu ostatniej dawki leku. Z kolei dawkę przypominającą szczepionki „nieżywej” zaleca się podać dopiero ≥6 miesięcy po podaniu ostatniej dawki leku, a w przypadku szczepienia podstawowego należy odczekać ≥12 miesięcy.
4. Interesujące są zalecenia dotyczące szczepienia przeciwko meningokokom biorców HSCT. Stanowisko brytyjskie podtrzymuje zalecenia ECIL dotyczące stosowania 2-dawkowego schematu szczepienia przeciwko meningokokom grupy A, C, W i Y, choć nie zaleca się takiego schematu u osób zdrowych (osobom >1. rż. podaje się 1 dawkę). Ciekawe jest również ujęcie szczepień przeciwko meningokokom grupy B. W dotychczas opublikowanych wytycznych szczepienie to zalecano w schemacie należnym dla wieku, natomiast w stanowisku brytyjskim schemat „niemowlęcy” 2+1 zalecono wszystkim biorcom HSCT niezależnie od wieku.
5. Zalecenia dotyczące szczepienia przeciwko pneumokokom nie różnią od dotychczas publikowanych. Natomiast w stanowisku nie uwzględniono 2 nowych szczepionek skoniugowanych – 15-walentnej (PCV-15) i 20-walentnej (PCV-20), choć obie zarejestrowane są również w Wielkiej Brytanii. Na posiedzeniu Advisory Committee on Immunization Practices (ACIP) w październiku 2022 roku zaproponowano aktualizację zaleceń w zakresie zasad szczepienia dorosłych biorców HSCT z użyciem PCV-20 (3 dawki w odstępie 4 tyg. + 1 dawka uzupełniająca ≥6 mies. po trzeciej dawce schematu pierwotnego [lub ≥12 mies. po zabiegu]) lub gdy jest niedostępna z użyciem PCV-15 i PPSV-23 (3 dawki PCV-15 w odstępie 4 tyg. + 1 dawka PPSV-23 ≥12. mies. po zabiegu, u pacjentów z przewlekłą GvHD zamiast dawki PPSV-23 można podać czwartą dawkę PCV-15 [zaproponowane schematy szczepienia biorców HSCT znalazły się w oficjalnych zaleceniach ACIP dotyczących szczepień dorosłych przeciwko pneumokokom opublikowanych 8 września 2023 roku – przyp. red.]).
6. W odniesieniu do szczepienia przeciwko HPV chciałabym zwrócić uwagę, że zgodnie z zaleceniami u osób z niedoborami odporności, niezależnie od wieku, szczepienie należy realizować w schemacie 3-dakowym. Zaproponowane przez brytyjskich ekspertów terminy szczepienia u dzieci i dorosłych wynikają ze względów praktycznych (p. artykuł). Ogólnie zaleca się, aby szczepienie przeciwko HPV rozpocząć 6–12 miesięcy po HSCT.
7. Cieszy mnie ujęcie zagadnienia dotyczącego szczepienia przeciwko półpaścowi u pacjentów po HSCT. Od niedawna w Polsce dostępna jest rekombinowana szczepionka przeciwko półpaścowi, którą można stosować u osób z niedoborami odporności, obciążonych zwiększonym ryzykiem zachorowania na półpasiec i jego ciężkiego przebiegu (p. także Szczepionki przeciwko półpaścowi – przyp. red.). Warto podkreślić, że skuteczność szczepionki rekombinowanej u biorców autologicznego HSCT potwierdzono w badaniu z randomizacją i w zapobieganiu zachorowaniom na półpasiec wyniosła ona 68,2%. Zmniejszała również niekorzystny wpływ półpaśca na jakość życia pacjentów. W grupach ryzyka półpaśca szczepionkę można stosować od 18 lat. Pełny schemat szczepienia obejmuje podanie 2 dawek w odstępie ≥2 miesięcy, przy czym warto pamiętać, że producent dopuszcza zastosowanie skróconego schematu szczepienia i podanie drugiej dawki ≥1 miesiąc po pierwszej u osób: z niedoborem odporności oraz u których może wystąpić immunosupresja związana z chorobą lub stosowaną terapią. Oznaczenie swoistych przeciwciał przeciwko VZV 2 lata po szczepieniu przeciwko półpaścowi, które proponują brytyjscy eksperci, w warunkach polskich może być trudne do wykonania, ponieważ badania tego nie uwzględniono w koszyku świadczeń gwarantowanych w ramach podstawowej opieki zdrowotnej (POZ). Takie oznaczenie można jednak wykonać w specjalistycznym ośrodku transplantacyjnym na zlecenie lekarza prowadzącego szczepienia u biorcy HSCT.
8. W stanowisku brytyjskim, podobnie jak w wytycznych IDSA, zalecono szczepienie przeciwko odrze dorosłym podatnym na zachorowanie (seroujemnym). Eksperci argumentują, że u dorosłych, którzy chorowali na odrę, swoiste przeciwciała utrzymują się przez wiele lat po HSCT. Proponują, aby przed kwalifikacją do szczepienia przeciwko odrze, śwince i różyczce (MMR) oznaczyć stężenie przeciwciał przeciwko wirusowi odry. Realizacja tego zalecenia w Polsce będzie trudna, ponieważ badanie to nie znajduje się w koszyku świadczeń gwarantowanych w ramach POZ. Dodatkowo MMR chroni przecież nie tylko przed odrą, ale również przed świnką i różyczką, a o oznaczaniu swoistych przeciwciał przeciwko tym dwóm ostatnim chorobom w stanowisku brytyjskim (oraz IDSA) nie wspomniano. Brytyjscy eksperci dopuszczają jednak podanie 2 dawek MMR bez oznaczania swoistych przeciwciał przeciwko odrze i takie rozwiązanie wydaje się optymalne. Należy pamiętać, że szczepionki „żywe” można podawać pacjentom po HSCT, którzy spełniają wszystkie następujące kryteria: od zabiegu minęło ≥24 miesięcy, nie rozpoznano aktywnej GvHD, pacjent nie otrzymuje ogólnoustrojowej terapii immunosupresyjnej od ≥12 miesięcy i wykluczono inne przeciwwskazania do podania szczepionek „żywych” (np. ciąża).
9. We wspomnianych powyżej zaleceniach ECIL 7 wskazano, aby z otoczenia pacjenta po HSCT odizolować osoby zaszczepione MMR lub VZV (jednocześnie nie precyzując, jak długo powinna trwać ta izolacja). Zalecenie to było kontrowersyjne, zwłaszcza w odniesieniu do podawania MMR. Autorzy innych publikacji jasno podkreślają, że izolacja pacjentów zaszczepionych MMR (u których po szczepieniu nie obserwuje się gorączki ani plamistej osutki) od pacjentów w immunosupresji (niezależnie od jej nasilenia) nie jest konieczna, podobnie jak izolacja pacjentów zaszczepionych przeciwko ospie wietrznej, u których po szczepieniu nie pojawiła się osutka. Wbrew pozorom jest to bardzo ważne dla rodzin pacjentów po HSCT ze względów organizacyjnym. Takie zalecenie może również opóźniać realizację szczepień przeciwko odrze oraz ospie wietrznej u zdrowych osób z otoczenia pacjentów po HSCT, generując zagrożenie epidemiologiczne. Cieszy mnie zatem, że eksperci brytyjscy zalecają szczepić osoby z otoczenia biorców HSCT zgodnie z programem rutynowych szczepień.
10. Na koniec chciałabym wspomnieć o proponowanej kontroli realizacji szczepień u biorców HSCT. Uważam, że takie postępowanie należy jak najszybciej wprowadzić również w Polsce. Eksperci brytyjscy postawili sobie za cel, aby 6 miesięcy po zabiegu HSCT rutynową rewakcynację rozpoczynało 100% pacjentów. Z mojego doświadczenia wynika, że w Polsce odsetek ten jest znacznie mniejszy – wielu pacjentów po HSCT nie tylko nie rozpoczyna rewakcynacji, ale nawet nie wie, że są takie zalecenia. Niestety ma to związek z problemem, na który zwracam uwagę od wielu lat, a mianowicie brakiem refundacji szczepień u pacjentów po HSCT, zwłaszcza dorosłych. Dorośli biorcy HSCT za niemal wszystkie zalecane szczepienia (z wyjątkiem grypy i COVID-19) muszą zapłacić sami. Bardzo łatwo policzyć, że jest to koszt kilku tysięcy złotych (!). Niedopuszczalne jest to, aby pacjent, który pomyślenie przeszedł HSCT, zmarł z powodu choroby, której można było zapobiec poprzez szczepienie, a którego nie wykonano z przyczyn finansowych. Uważam, że potrzebne jest pilne, systemowe rozwiązanie tego problemu.
Piśmiennictwo do komentarza:
1. Rubin L.G., Levin M.J., Ljungman P. i wsp.: Infectious Diseases Society of America. 2013 IDSA clinical practice guideline for vaccination of the immunocompromised host. Clin. Infect. Dis., 2014; 58 (3): 309–3182. Cordonnier C., Einarsdottir S., Cesaro S. i wsp.: Vaccination of haemopoietic stem cell transplant recipients: guidelines of the 2017 European Conference on Infections in Leukaemia (ECIL 7). Lancet Infect. Dis., 2019; 19: e200–e212
3. Komunikat Głównego Inspektora Sanitarnego z dnia 28 października 2022 r. w sprawie Programu Szczepień Ochronnych na rok 2023. Dz. U. MZ, poz. 113
4. Charakterystyka Produktu Leczniczego Infanrix Hexa, Infanrix-IPV+Hib, Hexacima, Pentaxim
5. Kobayashi M., Farrar J.L., Gierke R. i wsp.: Use of 15-valent pneumococcal conjugate vaccine and 20-valent pneumococcal conjugate vaccine among U.S. adults: updated recommendations of the Advisory Committee on Immunization Practices – United States, 2022. MMWR, 2022; 71 (4): 109–117
6. Kobayashi M.: Proposed updates to clinical guidance on pneumococcal vaccine useamong adults. www.cdc.gov/vaccines/acip/meetings/downloads/slides-2022-10-19-20/04-pneumococcal-kobayashi-508.pdf (dostęp: 05.04.2023)
7. Bastidas A., de la Serna J., El Idrissi M. i wsp.: Effect of recombinant zoster vaccine on incidence of herpes zoster after autologous stem cell transplantation: a randomized clinical trial. JAMA, 2019; 322: 123–1233
8. Charakterystyka Produktu Leczniczego Shingrix
9. CDC: HPV vaccine schedule and dosing. www.cdc.gov/hpv/hcp/schedules-recommendations.html (dostęp: 05.04.2023)
10. Meites E., Szilagyi P.G., Harrell W. i wsp.: Human papillomavirus vaccination for adults: updated recommendations of the Advisory Committee on Immunization Practices. MMWR, 2019; 68 (32): 698–702
11. Rubin L.G., Levin M.J., Ljungman P. i wsp.: IDSA clinical practice guideline for vaccination of the immunocompromised host. Clin. Infect. Dis., 2014; 58: 309–318
12. Tomblyn M., Chiller T., Einsele H. i wsp.: Guidelines for preventing infectious complications among hematopoietic cell transplantation recipients: a global perspective. Biol. Blood Marrow. Transplant., 2009; 15 (10):143–238
13. American Academy of Pediatrics: Immunization in special clinical circumstances. (W:) Kimberlin D.W., Brady M.T., Jackson M.A., Long S.S. (eds.): Red Book: 2018 Report of the Committee on Infectious Diseases. American Academy of Pediatrics, 2018

















