Czy szczepienie przeciwko COVID-19 preparatem wektorowym Vaxzevria (AstraZeneca) zwiększa ryzyko zdarzeń zakrzepowych?
Dostępne aktualnie dane naukowe wskazują, że istnieje prawdopodobny związek między szczepieniem preparatem Vaxzevria a występowaniem bardzo rzadkich, nietypowych zdarzeń zakrzepowych przebiegających z małopłytkowością (p. dalej), choć na razie nie potwierdzono jednoznacznie, że ma on charakter przyczynowy.1
W ramach rutynowego nadzoru nad bezpieczeństwem szczepień po wprowadzeniu preparatu Vaxzevria do powszechnego stosowania w UE, w kilku krajach zgłoszono przypadki takich zdarzeń zakrzepowych, które wystąpiły w związku czasowym ze szczepieniem tym preparatem. PRAC działający przy EMA sukcesywnie i dokładnie analizował wszystkie zgłoszone przypadki w poszczególnych krajach UE stosujących szczepionkę Vaxzevria (a także w Wielkiej Brytanii) oraz zaobserwowane w przedrejestracyjnych badaniach z randomizacją (RCT) oceniających skuteczność i bezpieczeństwo preparatu.2-5
W stanowisku opublikowanym 7 kwietnia 2021 roku PRAC wskazał,6 że zgłoszone w ramach rutynowego nadzoru nad NOP nietypowe zdarzenia zakrzepowe przebiegające z małopłytkowością (rzadziej również z krwawieniem) dotyczyły głównie naczyń mózgu (zakrzepica zatok żylnych mózgua [cerebral venous sinus thrombosis – CVST]), jamy brzusznej (zakrzepica żył trzewnychb [splanchnic veins thrombosis – SVT]) i tętnic. Do 22 marca 2021 roku po zaszczepieniu preparatem Vaxzevria około 25 milionów osób w krajach UE i Wielkiej Brytanii do bazy EudraVigilance zgłoszono 62 przypadki CVST i 24 przypadki SVT (w tym 18 zgonów). Na tej podstawie PRAC wyciągnął wniosek, że istnieje prawdopodobny związek między szczepieniem preparatem Vaxzevria a występowaniem takich rzadkich, nietypowych zdarzeń zakrzepowych i należy je uwzględnić jako rzadkie NOP tej szczepionki. Jednocześnie zaznaczył, że korzyści ze szczepienia preparatem Vaxzevria nadal przeważają nad potencjalnym ryzykiem z nim związanym, choć wielkość korzyści netto zmienia się zależnie od prawdopodobieństwa zakażenia SARS-CoV-2 (tzn. aktualnej zapadalności na COVID-19) oraz grupy wiekowej, a także innych czynników ryzyka (p. także Jak przekazywać informacje o potencjalnych korzyściach i zdarzeniach niepożądanych po szczepionce Vaxzevria (AstraZeneca) przeciwko COVID-19?).6,7
EMA wskazała, że jednym z możliwych patomechanizmów tych nietypowych zdarzeń zakrzepowych może być odpowiedź immunologiczna prowadząca do zaburzeń i objawów obserwowanych u niektórych pacjentów leczonych heparyną – tzw. małopłytkowości indukowanej heparyną (heparin induced thrombocytopenia – HIT).6,7 W piśmiennictwie angielskim tę szczególną postać zdarzeń zakrzepowych po szczepieniu określono jako vaccine-induced prothrombotic immune thrombocytopenia (indukowana szczepieniem prozakrzepowa małopłytkowość immunologiczna – VIPIT) lub – aktualnie częściej – jako vaccine-induced immune thrombotic thrombocytopenia (indukowana szczepieniem zakrzepowa małopłytkowość immunologiczna – VITT). Za proponowanym przez EMA patomechanizmem przemawiają również wyniki opublikowanych niedawno opisów serii przypadków VITT zgłoszonych w Niemczech i Austrii (we wszystkich próbkach surowicy pobranej od 28 pacjentów z podejrzeniem VITT po szczepieniu preparatem Vaxzevria wykryto przeciwciała przeciwko kompleksom heparyna– płytkowy czynnik 4 [PF4] i uzyskano dodatni wynik diagnostycznego testu czynnościowego, mimo że żaden pacjent nie otrzymał wcześniej heparyny),8 a także Wielkiej Brytanii (w 22 z 23 przypadków VITT stwierdzono anty-PF4).9 Większość zgłoszonych do tej pory przypadków dotyczyła kobiet w wieku <60 lat i wystąpiła w ciągu 14 dni po podaniu pierwszej dawki szczepionki (zakres do 24 dni).
EMA zaleciła, aby personel medyczny zwracał szczególną uwagę na objawy przedmiotowe i podmiotowe sugerujące epizod zakrzepowy lub małopłytkowość u osób zaszczepionych preparatem Vaxzevria, aby móc szybko wdrożyć odpowiednie i skuteczne leczenie.6,7 Osoby szczepione należy poinformować, aby natychmiast zgłosiły się do lekarza w przypadku wystąpienia takich objawów, jak:
- duszność
- ból w klatce piersiowej, uporczywy ból brzucha, silny i uporczywy ból głowy
- obrzęk kończyn dolnych
- niewyraźne widzenie
- podbiegnięcia krwawe lub wybroczyny pojawiające się kilka dni po szczepieniu i poza miejscem wstrzyknięcia.
Zgodnie z obowiązującą rutynową procedurą EMA zaktualizowała ChPL preparatu Vaxzevria i ulotkę dla pacjenta, dodając informację o zarejestrowanych przypadkach zdarzeń zakrzepowych.10
Podsumowując wyniki swojej analizy, PRAC jednoznacznie stwierdził, że – biorąc pod uwagę powszechne zagrożenie związane z pandemią COVID-19 (w tym duże ryzyko hospitalizacji, leczenia na oddziałach intensywnej terapii oraz zgonu), skuteczność szczepionki w zapobieganiu ciężkim zachorowaniom na COVID-19 oraz bardzo małą częstość VITT (wg najnowszych oszacowań 1 przypadek/ 100 000 dawek) – korzyści wynikające ze szczepienia preparatem Vaxzevria nadal przewyższają związane z nim potencjalne ryzyko we wszystkich grupach wiekowych.7
Po przeanalizowaniu danych z nadzoru we wszystkich krajach stosujących szczepionkę Vaxzevria po podaniu łącznie prawie 200 milionów dawek preparatu, takie samo stanowisko wydało WHO.11 EMA i WHO zapewniły, że nadal będą ściśle monitorować wszystkie przypadki zdarzeń zakrzepowo-zatorowych zgłoszone zarówno po podaniu preparatu Vaxzevria, jak i innych dostępnych szczepionek przeciwko COVID-19.6,7,11
W podobnym do EMA i WHO duchu wypowiedzieli się eksperci ds. hemostazy Polskiego Towarzystwa Hematologów i Transfuzjologów, ale dodatkowo – na podstawie dostępnych do 13 kwietnia 2021 roku zaleceń niemieckich, brytyjskich i kanadyjskich – zaproponowali modyfikację kwalifikacji do szczepienia preparatem Vaxzevria i postępowania w przypadku podejrzenia VITT (p. ramka), sugerując użycie innej szczepionki u osób z HIT lub zakrzepicą zatok żylnych mózgu w wywiadzie (pytanie o te zdarzenia zostało oficjalnie wprowadzone do nowej wersji kwestionariusza kwalifikacyjnego do szczepienia przeciwko COVID-19).12 Algorytm postępowania diagnostycznego zaproponowało natomiast British Society for Haematology (p. ryc. 1.).13

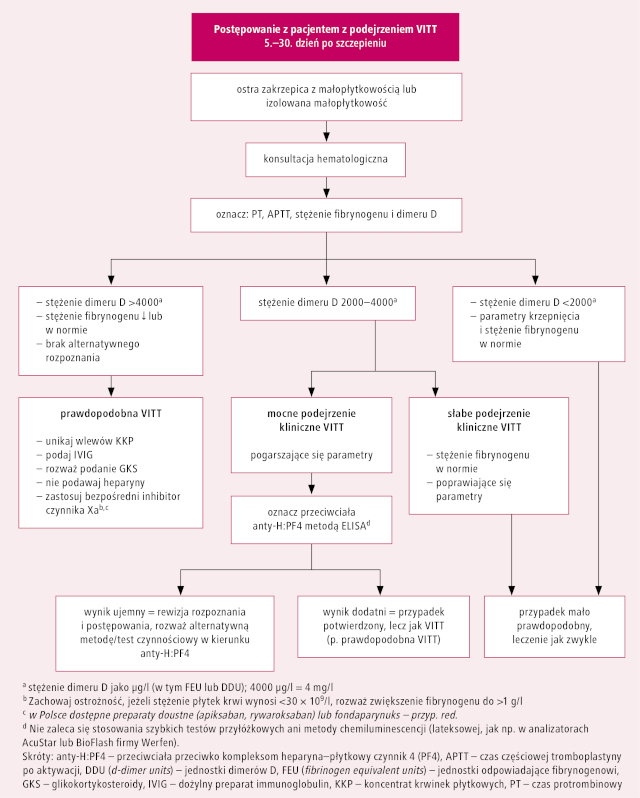
Ryc. 1. Postępowanie w przypadku podejrzenia indukowanej szczepieniem
zakrzepowej małopłytkowości immunologicznej (VITT)
wg wytycznych British Society for Haematology (na podstawie 13. pozycji
piśmiennictwa)
Ryzyko rzadkich, ciężkich zdarzeń niepożądanych po szczepieniu zawsze trzeba rozpatrywać w kontekście prawdopodobieństwa zakażenia SARS-CoV-2 i ryzyka związanego ze skutkami zachorowania na COVID-19 (p. także Jak przekazywać informacje o potencjalnych korzyściach i zdarzeniach niepożądanych po szczepionce Vaxzevria (AstraZeneca) przeciwko COVID-19?). Na podstawie brytyjskich danych klinicznych (zgony) i seroepidemiologicznych (zakażenie SARS-CoV-2) z pierwszej połowy 2020 roku (I fala pandemii) oszacowano, że w populacji dorosłych ryzyko zgonu z powodu COVID-19 wynosi 9/1000 zakażonych SARS-CoV-2 i zwiększa się wraz z wiekiem od 5/1000 w grupie wiekowej 45–64 lat, przez 31/1000 w grupie 65–74 lat, aż do 116/1000 wśród seniorów >74. roku życia.14 Według danych polskiego Ministerstwa Zdrowia z 26 marca br. – uwzględniając poprawkę, że w Polsce rzeczywista liczba zakażeń jest prawdopodobnie 4 razy większa niż oficjalna liczba – ryzyko zgonu w przebiegu COVID-19 w populacji ogólnej (tzn. z uwzględnieniem dzieci) wynosi ok. 6/1000 zakażonych SARS-CoV-2, a aktualnie do szpitali w ciężkim stanie trafiają coraz młodsi dorośli chorzy, także bez czynników ryzyka zdrowotnego (choroby przewlekłe).15 Ponieważ u dzieci zgony z powodu COVID-19 są niezwykle rzadkie, rzeczywista śmiertelność z powodu zakażenia SARS-CoV-2 u dorosłych w Polsce jest na pewno większa niż podano powyżej. Ryzyko hospitalizacji z powodu COVID-19 personelu medycznego mającego bezpośredni kontakt z pacjentami jest natomiast 3-krotnie większe niż w populacji ogólnej.16
a Ten termin jest wiernym tłumaczeniem akronimu angielskiego
CVST, ale właściwą nazwą jest zakrzepica
zatok opony twardej.
b Zakrzepica dotyczy żyły wrotnej i/lub jej dopływów (tj.
żyły śledzionowej i żył krezkowych) lub żył wątrobowych
(zespół Budda i Chiariego) będących w zasięgu
standardowego badania USG
Piśmiennictwo:
1. Cines D.B., Bussel J.B.: SARS-CoV-2 vaccine–induced immune thrombotic thrombocytopenia. N. Engl. J. Med., 2021. doi: 10.1056/NEJMe2106315 (dostęp: 21.04.2021)2. Supplement to: Voysey M., Clemens S.A.C., Madhi S.A. i wsp.: Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222) against SARS-CoV-2: an interim analysis of four randomised controlled trials in Brazil, South Africa, and the UK. Lancet, 2020; doi. org/10.1016/S0140-6736(20)32661–1
3. COVID-19 Vaccine AstraZeneca: PRAC preliminary view suggests no specific issue with batch used in Austria. www.ema.europa.eu/en/news/covid-19-vaccine-astrazeneca-prac-preliminary-view-suggests-no-specific-issue-batch-used-austria (dostęp: 13.04.2021)
4. COVID-19 Vaccine AstraZeneca: PRAC investigating cases of thromboembolic events – vaccine’s benefits currently still outweigh risks – update. www.ema.europa.eu/en/news/covid-19-vaccine-astrazeneca-prac-investigating-cases-thromboembolic-events-vaccines-benefits (dostęp: 13.04.2021)
5. COVID-19 Vaccine AstraZeneca: benefits still outweigh the risks despite possible link to rare blood clots with low blood platelets. www.ema.europa.eu/en/news/covid-19-vac-cine-astrazeneca-benefits-still-outweigh-risks-despite-possible-link-rare-bloodclots (dostęp: 13.04.2021)
6. AstraZeneca’s COVID-19 vaccine: EMA finds possible link to very rare cases of unusual blood clots with low blood platelets. www.ema.europa.eu/en/news/astrazenecas-covid-19-vaccine-ema-finds-possible-link-very-rare-cases-unusual-blood-clots-lowblood (dostęp: 13.04.2021)
7. AstraZeneca’s COVID-19 vaccine: benefits and risks in context. https://www.ema.europa.eu/en/news/astrazenecas-covid-19-vaccine-benefits-risks-context (dostęp: 26.04.2021)
8. Greinacher A., Thiele T., Warkentin T.E. i wsp.: Thrombotic thrombocytopenia after ChAdOx1 nCov-19 Vaccination. N. Engl. J. Med., 2021. doi: 10.1056/NEJMoa2104840
9. Scully M., Singh D., Lown R. i wsp.: Pathologic antibodies to platelet factor 4 after ChAdOx1 nCoV-19 vaccination. N. Engl. J. Med., 2021. doi: 10.1056/NEJMoa2105385
10. Charakterystyka Produktu Leczniczego Vaxzevria. www.ema.europa.eu/en/documents/product-information/vaxzevria-previously-covid-19-vaccine-astrazeneca-epar-product-information_pl.pdf (dostęp: 13.04.2021)
11. Interim statement of the COVID-19 subcommittee of the WHO Global Advisory Committee on Vaccine Safety on AstraZeneca COVID-19 vaccine. www.who.int/news/item/07-04-2021-interim-statement-of-the-covid-19-subcommittee-of-the-who-global-advisory-committee-on-vaccine-safety (dostęp: 13.04.2021)
12. Undas A., Podolak-Dawidziak M., Pruszczyk P. i wsp.: Uaktualnione stanowisko Sekcji ds. hemostazy Polskiego Towarzystwa Hematologów i Transfuzjologów w sprawie szczepionki przeciwko COVID-19 firmy AstraZeneca (13.04.2021 r.). www.mp.pl/zakrzepica/wytyczneartykuly/wytyczne/263793 (dostęp: 15.04.2021)
13. Guidance produced from the Expert Haematology Panel (EHP) focussed on Covid-19 Vaccine induced thrombosis and thrombocytopenia (VITT). Version 1.3. 07.04.2021. https://b-s-h.org.uk/media/19530/guidance-version-13-on-mngmt-of-thrombosis-with-thrombocytopenia-occurring-after-c-19-vaccine_20210407.pdf (dostęp: 13.04.2021)
14. COVID-19: The Green Book, chapter 14a. www.gov.uk/government/publications/covid-19-the-green-book-chapter-14a (dostęp: 26.03.2021)
15. COVID-19: zachorowania w Polsce – aktualne dane. www.mp.pl/pacjent/choroby-zakazne/koronawirus/koronawirus-warto-wiedziec/230267 (dostęp: 26.03.2021)
16. Shah A.S.V., Wood R., Gribben C. i wsp.: Risk of hospital admission with coronavirus disease 2019 in healthcare workers and their households: nationwide linkage cohort study. BMJ, 2020; 371: m3582; http://dx.doi.org/10.1136/bmj.m3582



























